INTRODUCCIÓN
Los avances exponenciales en las tecnologías para generar y procesar grandes conjuntos de datos biológicos, datos -ómicos, promueven un cambio de paradigma en la forma de abordar los problemas biológicos. Las tecnologías -ómicas están dirigidas principalmente a la detección universal de genes (genómica), ARNm (transcriptómica), proteínas (proteómica) y metabolitos (metabolómica) en una muestra biológica específica (Manzoni et al., 2016). Para procesar y analizar el enorme volumen de datos biológicos acumulados, es necesario el empleo de herramientas bioinformáticas que permitan manejar eficientemente la información obtenida por tecnologías de secuenciación de próxima generación (del inglés Next Generation Sequencing, NGS) (Aguilar-Bultet y Falquet, 2015).
En un proyecto de secuenciación de genoma, el ADN del organismo objetivo se divide en millones de piezas pequeñas y se lee en un equipo de secuenciación. Estas lecturas varían de 20 a 1000 pares de bases de nucleótidos (pb) en longitud, según el método de secuenciación utilizado. La secuenciación puede ser de lectura única (single-end) ó de lectura pareada (paired-end). Estas secuencias nucleotídicas se almacenan comúnmente junto con sus valores de calidad (Phred Quality Score ó Q) en un formato de texto plano conocido como fastq (Gladman, 2019). Se consideran secuencias de buena calidad aquellas que presentan un valor mayor o igual a 30, por lo que este parámetro se define como Q30.
Sin importar el tipo de tecnología aplicada para la generación de datos genómicos NGS, antes de utilizar las secuencias crudas se recomienda llevar a cabo una evaluación de calidad de cada grupo de datos. Es sumamente importante asegurarse que las lecturas se encuentran libres de adaptadores, secuencias contaminantes, artefactos de baja calidad o secuencias duplicadas, ya que de otra manera podrían interferir en los futuros análisis y procesos (Góngora-Castillo y Buell, 2013). Por lo general, la calidad de las lecturas se evalúa inicialmente mediante la observación de la distribución de bases a lo largo de la lectura, la distribución de calidad Phred, frecuencias de nucleótidos y complejidad de las lecturas (Bishop, 2014; Aguilar-Bultet y Falquet, 2015). Los resultados de esta evaluación pueden utilizarse a la hora de elegir las opciones de filtrado de las secuencias, o bien, verificar si por el contrario cumplen con los estándares de calidad (Andrews, 2010).
El filtrado de secuencias tiene como objetivo eliminar sólo las regiones de baja calidad en un procedimiento conocido como recorte. Este paso no es un proceso trivial y se aborda de diferentes maneras por diversos algoritmos, parámetros y herramientas (Cox et al., 2010; Martin, 2011; Bolger et al., 2014). El principio básico del recorte de lecturas es hacer una estimación de las tasas de error de lectura con el objeto de mantener la información de mayor calidad contenida en las lecturas, y así descartar aquellas de baja calidad o parte de las mismas (Del Fabbro, 2013; Bishop, 2014; Aguilar-Bultet y Falquet, 2015).
El filtrado de secuencias se ha adoptado ampliamente en los estudios más recientes de NGS (Schmieder y Edwards, 2011a). Sin embargo, a pesar de su popularidad, la información que se tiene al respecto sobre su aplicación, su efecto sobre los parámetros de calidad y de ensamblado, así como para la selección del software apropiado, continúa siendo escasa. Varios métodos se han descrito individualmente en la literatura (Cox et al., 2010; Smeds y Künstner, 2011; Schmieder y Edwards 2011b; Bolger et al., 2014; Chen et al., 2014 ) pero su utilidad se ha demostrado solo en casos particulares de ensamblados de genomas (Del Fabbro et al., 2013). La selección de un software de filtrado adecuado dependerá del tipo de información obtenida de la secuenciación, es decir, si la misma fue única o pareada. Existe una gran cantidad de software disponibles para el filtrado de lecturas, tales como Trimmomatic (Bolger et al., 2014), NGS QC Toolkit (Patel y Hain, 2012), PRINSEQ (Schmieder y Edwards 2011a) y CutAdapt (Martin, 2011).
Particularmente, en un ensamblado en el que la construcción de un genoma se realiza a partir de la unión de lecturas cortas en fragmentos más largos, conocidos como cóntigos, la utilización de lecturas filtradas adquiere suma importancia para la obtención de mejores resultados. El filtrado eliminará aquellas lecturas propensas a errores y proporcionará una mejor guía para configurar los parámetros de entrada apropiados para el ensamblador a utilizar (Bolger et al., 2014). En los últimos años, el número de software desarrollados para el ensamblado de secuencias cortas ha aumentado considerablemente. SPAdes (Bankevich et al., 2012) es un ensamblador de acceso libre basado en la construcción de grafos de Brujin (Medvedev et al., 2011). Este mide la relación que existe entre secuencias de nucleótidos de una longitud fija (k-mer) creada, y genera un grafo donde los nodos son los k-mers y las conexiones del grafo indican que los k-mers son adyacentes y se solapan (k-1 nucleótidos). El k-mer también puede verse afectado por la presencia de secuencias de baja calidad, lo que aumenta la probabilidad de errores en los ensamblados.
Un enfoque habitual para evaluar los ensamblados obtenidos se basa en el análisis del número de cóntigos mayores a 500 pb, la longitud del cóntigo más largo y el valor de N50. El valor N50 se define como la longitud del cóntigo más grande de todos los cóntigos, clasificados de menor a mayor, que representa el 50 % de la longitud del conjunto. Cuanto menor es el número de cóntigos y mayor es el valor del N50, se puede decir que el ensamblado es mejor.
En estudios previos, se aisló una cepa de Bacillus altitudinis codificada como 19RS3, de plantines de Ilex paraguariensis St. Hilaire 1822 (Aquifoliaceae), con propiedades de promoción del crecimiento vegetal (Laczeski et al., 2020). Con el fin de adquirir nuevos conocimientos que aporten a la comprensión de los mecanismos biológicos utilizados por esta bacteria, se secuenció su genoma completo.
En este contexto, se puso a prueba la hipótesis de que el filtrado de lecturas mejora los parámetros de calidad de los ensamblados generados para un genoma procariota, por lo que el objetivo de esta investigación fue evaluar el efecto del uso de lecturas pareadas crudas y lecturas pareadas filtradas, como archivos de partida, en el valor de k-mer, el número de cóntigos, la longitud del cóntigo más largo y el valor de N50 obtenidos en el ensamblado del genoma de la cepa de B. altitudinis 19RS3.
MATERIALES Y MÉTODOS
Datos genómicos
Los datos genómicos utilizados se obtuvieron como producto de la secuenciación del genoma completo de B. altitudinis 19RS3, una bacteria endófita recuperada de I. paraguariensis aislada en la provincia de Misiones, Argentina. Esta cepa fue seleccionada por presentar propiedades de promoción del crecimiento vegetal en ensayos realizados in vitro y en vivero con plantines orgánicos de Ilex paraguariensis (Laczeski et al., 2020). La misma se encuentra depositada bajo el número de acceso LBM250 en el cepario del Laboratorio de Biotecnología Molecular del Instituto de Biotecnología Misiones "Dra. María Ebe Reca" (InBioMis) perteneciente a la Facultad de Ciencias Exactas Químicas y Naturales de la Universidad Nacional de Misiones.
El ADN genómico se extrajo a partir del protocolo de Sambrook modificado (Sambrook, 2001; Cariaga Martinez y Zapata, 2007). La construcción de la librería TruSeq Nano DNA (350) y la secuenciación whole genome de novo paired-end se llevó a cabo por Macrogen (Seoul, Korea) con la tecnología Illumina HiSeq.
Análisis de calidad y filtrado de lecturas
Se realizó el análisis de calidad de las lecturas pareadas crudas obtenidas de la secuenciación y de las lecturas pareadas filtradas. Para ello se utilizó el software FastqC (Andrews, 2010) versión 0.11.9. Se evaluaron los principales parámetros de interés: cantidad de lecturas, longitud promedio de las lecturas, rango de longitud de las lecturas y porcentaje de bases nucleotídicas de guanina y citocina (GC). La calidad de cada grupo de lecturas se determinó a partir del análisis de los distintos módulos de FastqC (Del Fabbro et al., 2013; Rana et al., 2016; Rodriguez Hernáez, 2017).
De acuerdo con lo evaluado y con la finalidad de obtener lecturas de mejor calidad, se realizó el filtrado de éstas con el software Trimmomatic (Bolger et al., 2014) versión 0.39. Se seleccionaron las siguientes opciones: eliminación de adaptadores (ILLUMINACLIP:TrueSeq3-PE.fa:2:30:10), eliminación de las principales bases de baja calidad o N bases (LEADING:3), eliminación de las bases de baja calidad o N finales (TRAILING:3), escaneo de lecturas desde el extremo 5' con el método de "ventana deslizante" (SLIDINGWINDOW:4:15) y eliminación de lecturas con menos de 36 bases de largo (MINLEN: 36) (Del Fabbro et al., 2013; Rana et al., 2016; Rodriguez Hernáez, 2017).
Ensamblado del genoma
Se realizó el ensamblado del genoma de B. altitudinis 19RS3 con el software SPAdes (Bankevich et al., 2012) versión 3.12.0. Se evaluó la aplicación de valores de k-mer impares entre 55 a 87. Este software establece como requisito utilizar valores de k-mer impares y menores a 128. Como archivos de partida se utilizaron las lecturas pareadas crudas, y las lecturas pareadas obtenidas luego del filtrado con el software Trimmomatic.
Para la evaluación de los ensamblados se utilizó la herramienta Quality Assessment Tool for Genome Assemblies-QUAST (Gurevich et al., 2013) versión 4.0.
RESULTADOS
En la secuenciación del genoma de B. altitudinis 19RS3 se generó un total de 9 938 250 lecturas pareadas de 101 pb con una cobertura promedio de 266. El contenido GC fue 41,01 % y el valor de calidad Q30 fue 91,57 %.
Las lecturas crudas obtenidas presentaron valores altos de calidad según el análisis realizado con el software FastqC. La Fig. 1 presenta en la parte superior los parámetros básicos de calidad y en la parte inferior los gráficos de calidad por base para las secuencias sentido y anti-sentido. Estos gráficos representan cada una de las bases de una secuencia versus sus valores de calidad Q30. Dichos valores dividen el gráfico horizontalmente en una franja verde con valores de calidad altos (Q30 mayor o igual a 30), una franja amarilla con valores de calidad intermedios (Q30 menor a 30 y mayor a 20) y una franja roja con valores de calidad bajos (Q30 menor a 20). Las bases de las lecturas sentido-crudas mostraron una distribución completa sobre la franja verde. Sin embargo, las lecturas anti-sentido mostraron una distribución menos homogénea a medida que se aumenta la posición en pb de la secuencia.
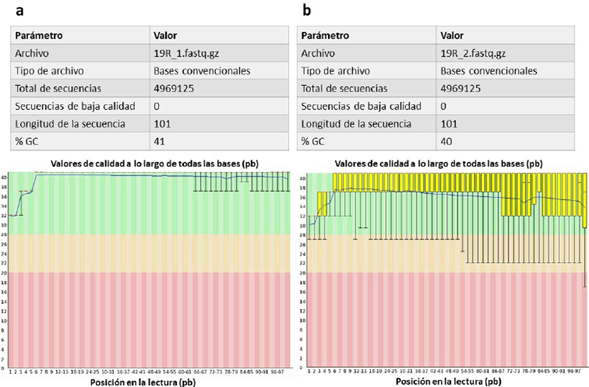
Figura 1 Análisis de calidad realizado por el software FastQC para las lecturas crudas del genoma de Bacillus altitudinis 19RS3 (Bacteria promotora del crecimiento vegetal aislada de Ilex paraguariensis St. Hil.). En la parte superior se presentan los parámetros básicos de calidad. En la parte inferior se observan los gráficos de calidad por base para las secuencias sentido (a) y anti-sentido (b). El eje X corresponde a la posición de cada base en una secuencia y el eje Y al valor de calidad Q30. Los colores representan la calidad según los valores de Q30, alta en verde (Q30 mayor o igual a 30), intermedia en amarillo (Q30 menor a 30 mayor a 20) y baja en rojo (Q30 menor a 20).
Luego del filtrado, y a pesar de que el número total de lecturas disminuyó, el 93,87 % del genoma secuenciado continuó representado. Debido al recorte se obtuvieron secuencias con un tamaño entre 36 y 101 pb. Las lecturas sentido-filtradas mantuvieron la misma calidad que las lecturas sentido-crudas en todas sus bases. Sin embargo, las lecturas anti-sentido filtradas mostraron una gran mejoría en la calidad de sus últimas bases con respecto a lo observado en las lecturas anti-sentido crudas. El porcentaje de GC no se vio afectado por el fi ltrado (Fig. 2).
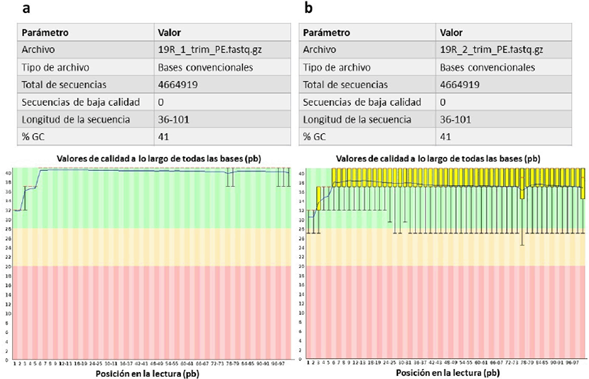
Figura 2 Análisis de calidad realizado por el software FastQC para las lecturas filtradas del genoma de Bacillus altitudinis 19RS3 (Bacteria promotora del crecimiento vegetal aislada de Ilex paraguariensis St. Hil.). En la parte superior se presentan los parámetros básicos de calidad. En la parte inferior se observan los gráficos de calidad por base para las secuencias sentido (a) y anti-sentido (b). El eje X corresponde a la posición de cada base en una secuencia y el eje Y al valor de calidad Q30. Los colores representan la calidad según los valores de Q30, alta en verde (Q30 mayor o igual a 30), intermedia en amarillo (Q30 menor a 30 mayor a 20) y baja en rojo (Q30 menor a 20).
A partir de la evaluación realizada con el software QUAST se obtuvieron dos tablas correspondientes a los ensamblados realizados a partir de las lecturas crudas (Tabla 1) y para los ensamblados realizados a partir de las lecturas filtradas (Tabla 2). En ambas tablas se resaltan en letra negrita los valores principales que se tuvieron en cuenta para realizar la comparación. Al utilizar valores crecientes de k-mer de 55 a 87, se logró disminuir el número de cóntigos y aumentar paralelamente el valor del N50. Si se observa el k-mer 79 en ambas tablas, valor con el cual se obtuvo el mejor ensamblado con las lecturas filtradas, se puede notar que existe una diferencia de cinco cóntigos, 157 763 pb en el valor de N50 y de 1464 pb en la longitud del cóntigo más largo, entre ambos ensamblados.
Tabla 1 Ensamblado del genoma de Bacillus altitudinis 19RS3 (Bacteria promotora del crecimiento vegetal aislada de Ilex paraguariensis St. Hil.). Resultados obtenidos de la evaluación por QUAST de los ensamblados realizados con SPAdes a partir de lecturas crudas.
| # cóntigos | Longitud del cóntigo más largo | Longitud total | GC (%) | N50 | |
|---|---|---|---|---|---|
| k-mer 55 | 28 | 778 854 | 3 783 072 | 41,16 | 553 021 |
| k-mer 61 | 26 | 830 193 | 3 783 478 | 41,16 | 774 385 |
| k-mer 65 | 23 | 932 555 | 3 781 549 | 41,16 | 774 285 |
| k-mer 67 | 20 | 932 563 | 3 781 839 | 41,16 | 774 289 |
| k-mer 69 | 20 | 932 571 | 3 781 909 | 41,16 | 774 293 |
| k-mer 71 | 20 | 932 579 | 3 782 087 | 41,16 | 774 405 |
| k-mer 73 | 21 | 932 719 | 3 783 779 | 41,16 | 774 409 |
| k-mer 75 | 22 | 932 805 | 3 784 068 | 41,17 | 774 143 |
| k-mer 77 | 22 | 932 986 | 3 785 125 | 41,17 | 774 147 |
| k-mer 79 | 21 | 933 937 | 3 785 553 | 41,17 | 774 151 |
| k-mer 81 | 18 | 964 807 | 3 786 254 | 41,17 | 928 480 |
| k-mer 83 | 20 | 964 870 | 3 788 948 | 41,17 | 894 982 |
| k-mer 85 | 20 | 964 876 | 3 789 114 | 41,18 | 894 986 |
| k-mer 87 | 20 | 964 882 | 3 788 415 | 41,17 | 894 990 |
QUAST: software utilizado para la evaluación de los ensamblados.
SPAdes: software utilizado para realizar los ensamblados.
K-mer: valor k utilizado para cada ensamblado realizado con el software SPAdes.
# cóntigos: número total de cóntigos de longitud ≥ 500 pb.
Longitud total: número total de bases en los cóntigos de longitud ≥ 500 pb.
GC (%): porcentaje de guanina y citosina.
N50: longitud del cóntigo más grande de todos los cóntigos clasificados de menor a mayor que representa el 50 % de la longitud del conjunto.
Las cifras destacadas en letra en negrita corresponden a los valores obtenidos para el mejor ensamblado generado con las lecturas crudas.
Tabla 2 Ensamblado del genoma de Bacillus altitudinis 19RS3 (bacteria promotora del crecimiento vegetal aislada de Ilex paraguariensis St. Hil.). Resultados obtenidos de la evaluación por QUAST de los ensamblados realizados con el software SPAdes a partir de lecturas filtradas con Trimmomatic.
| # cóntigos | Longitud del cóntigo más largo | Longitud total | GC (%) | N50 | |
|---|---|---|---|---|---|
| k-mer 55 | 28 | 778 854 | 3 782 731 | 41,16 | 553 021 |
| k-mer 61 | 24 | 830 193 | 3 781 196 | 41,16 | 774 421 |
| k-mer 65 | 21 | 964 992 | 3 781 853 | 41,16 | 927 810 |
| k-mer 67 | 18 | 964 996 | 3 783 031 | 41,16 | 927 814 |
| k-mer 69 | 19 | 964 386 | 3 783 999 | 41,16 | 927 818 |
| k-mer 71 | 18 | 964 394 | 3 782 835 | 41,16 | 927 786 |
| k-mer 73 | 18 | 964 402 | 3 785 025 | 41,16 | 928 507 |
| k-mer 75 | 19 | 964 492 | 3 784 944 | 41,16 | 928 507 |
| k-mer 77 | 17 | 966 288 | 3 787 201 | 41,17 | 929 616 |
| k-mer 79 | 16 | 966 271 | 3 788 682 | 41,18 | 931 914 |
| k-mer 81 | 17 | 964 864 | 3 789 487 | 41,18 | 932 026 |
| k-mer 83 | 17 | 964 870 | 3 789 762 | 41,18 | 932 030 |
| k-mer 85 | 19 | 964 876 | 3 790 302 | 41,18 | 930 818 |
| k-mer 87 | 20 | 964 882 | 3 791 338 | 41,18 | 894 990 |
QUAST: software utilizado para la evaluación de los ensamblados.
SPAdes: software utilizado para realizar los ensamblados.
Trimmomatic: software utilizado para el filtrado de las lecturas.
K-mer: valor k utilizado para cada ensamblado realizado con el software SPAdes.
# cóntigos: número total de cóntigos de longitud ≥ 500 pb.
Longitud total: número total de bases en los cóntigos de longitud ≥ 500 pb.
GC (%): porcentaje de guanina y citosina.
N50: longitud del cóntigo más grande de todos los cóntigos clasificados de menor a mayor que representa el 50 % de la longitud del conjunto.
Las cifras destacadas en letra en negrita corresponden a los valores obtenidos para el mejor ensamblado generado con las lecturas filtradas.
Si bien las diferencias entre resultados fueron notorias en todos los ensamblados, cabe destacar que el mejor ensamblado para B. altitudinis 19RS3 se obtuvo a partir de las lecturas filtradas con el valor de k-mer 79, con el que se generaron 16 cóntigos mayores a 500 pb con un N50 de 931 914 pb y el cóntigo más largo con una longitud de 1464 pb mayor al obtenido en el ensamblado realizado con las lecturas crudas (Tabla 2). Aunque se observaron valores mayores de N50 al utilizar un k-mer 83 en el ensamblado con lecturas filtradas, la diferencia entre ambos valores fue mínima. Es por esto que se decidió seleccionar como mejor ensamblado aquel que presentó un menor número de cóntigos.
DISCUSIÓN
Si bien el filtrado de secuencias es un paso esencial en el procesamiento de lecturas crudas, generalmente se omite en la bibliografía a la hora de realizar el ensamblado de un genoma. Esta falta de información y la consecuente ausencia de este proceso puede derivar en interpretaciones biológicas erróneas de los resultados obtenidos. La evaluación del efecto del filtrado de secuencias en los parámetros de calidad de los ensamblados obtenidos para B. altitudinis 19RS3 indicó que a medida que el valor de k-mer aumentó los ensamblados mostraron grandes mejoras en los demás parámetros evaluados, como el número de cóntigos y el valor de N50. Al utilizar las lecturas filtradas se obtuvo un mejor ensamblado con el valor de k-mer 79; sin embargo, al utilizar las lecturas crudas se observó un mejor ensamblado con el valor de k-mer 81. Este valor mayor para las lecturas crudas podría deberse a que como indicaron Del Fabbro et al. (2013), la inclusión de lecturas de baja calidad conduce a la generación de falsos k-mer (Zerbino y Birney, 2008), lo cual afecta la conectividad entre los nodos y tiene un impacto significativo en la longitud y el número final de cóntigos (Smeds y Künstner, 2011; Del Fabbro et al., 2013). A diferencia de los ensamblados que obtuvimos a partir de las lecturas filtradas, cuyo número de cóntigos disminuyó notablemente, Del Fabbro et al. (2013) generaron ensamblados más fragmentados con un mayor número de cóntigos a partir de las lecturas fi ltradas. Cabe destacar que su trabajo se realizó con genomas de mayor complejidad que el nuestro, factor que podría estar vinculado con una menor eficiencia del filtrado de las lecturas.
De manera similar al presente trabajo, los creadores del software Trimmomatic (Bolger et al., 2014) realizaron la evaluación de los ensamblados obtenidos a partir de lecturas crudas y filtradas. Como resultado, obtuvieron mejoras hasta de un 77 % y un 55 % en los valores de N50 y en la longitud del cóntigo más largo, respectivamente, a partir de las lecturas filtradas. Además, notaron que el ensamblado obtenido a partir de las lecturas crudas contenía una coincidencia perfecta de 34 pb con una secuencia de adaptador. Estos datos dan un mayor soporte a los resultados obtenidos por nuestro grupo y destacan la necesidad de trabajar con lecturas procesadas con el fin de asegurar la eliminación de secuencias de adaptadores que podrían incorporarse erróneamente en el ensamblado final.
Chen et al. (2014) también compararon los efectos del uso de lecturas crudas y filtradas para la generación de ensamblados. Al igual que en nuestro trabajo, sus resultados mostraron que en todos los casos el filtrado mejoró las puntuaciones de calidad de las lecturas. Coincidimos con Chen et al. (2014) al decir que Trimmomatic presenta una amplia variedad de opciones para la realización del filtrado de las lecturas y además recomendamos su uso por su fácil manejo y accesibilidad.
En concordancia con los resultados generados por Chen et al. (2014) y Bolger et al. (2014), los ensamblados obtenidos en nuestro trabajo para el genoma de B. altitudinis 19RS3 sustentan la necesidad del filtrado de las secuencias como paso previo a realizar el ensamblado de un genoma en estudio. Además, como lo mencionan Del Fabbro et al. (2013), consideramos que existe poca literatura disponible que trate sobre el manejo y procesamiento de lecturas cortas producidas durante un experimento NGS, y que la interpretación biológica de los datos puede verse influenciada por la falta de su aplicación.
CONCLUSIONES
Más allá del ensamblador que se seleccione, o de la estrategia k-mer que se utilice, en el presente trabajo remarcamos la importancia de realizar el procesamiento de datos genómicos a partir del filtrado y recorte de lecturas, con el fin de optimizar las etapas de análisis posteriores. Destacamos que este procedimiento, además de ser rápido y fácil de realizar, permite la obtención de ensamblados de mejor calidad para genomas bacterianos, con un mayor valor de k-mer, un menor número de cóntigos, una mayor longitud del cóntigo más largo y un mayor valor del N50, lo que asegura la generación de resultados fehacientes y representativos. Resaltamos, además, la utilidad del software Trimmomatic a la hora de realizar el procesamiento de secuencias pareadas y asegurar la eliminación de secuencias de baja calidad y adaptadores.















