INTRODUCCIÓN
El paraquat (1,1-dimetil-4,4-bipiridilo) es un herbicida que pertenece al grupo de los bipiridilos. Este compuesto controla un amplio número de hierbas postemergentes (Bromilow, 2004). El uso extensivo de este herbicida se asocia con su bajo costo en el mercado y su rápida acción en el control de hierbas y malezas, por lo que es uno de los compuestos más usados a nivel mundial, junto con el glifosato (Hernández y Hansen, 2011; Ortíz, 2013; Bajwa, 2014). Esto contribuye en gran medida a su inadecuado uso y manejo y, como consecuencia, a su elevada distribución en el ambiente, lo cual causa la contaminación del suelo y del agua (Gómez, 2005; García y Rodríguez, 2012; Camacho et al., 2017). En México se distribuyen cerca de 36 marcas comerciales que contienen porcentajes del ingrediente activo del paraquat, con un rango del 25 % hasta el 44,9 % (INECC, 2019). Sin embargo, son escasas las investigaciones sobre este tipo de compuestos en la actividad agropecuaria del país y particularmente del herbicida paraquat. Esto contrasta con la relevancia que el paraquat tiene por su alta toxicidad y los efectos que causa a la salud pública y al medio ambiente. Se considera que su comercialización se ha realizado desde hace 60 años (Bauer et al., 1995; Gagneten, 2002; Martínez et al., 2004; PANANP, 2011).
Existen argumentos contradictorios con respecto a la movilidad del paraquat en suelo. Algunos trabajos reportan que este herbicida es altamente persistente y se inactiva por completo al entrar en contacto con el suelo, en donde puede almacenarse (Saha, 2004). En otras investigaciones se ha indicado que este herbicida tiene una alta solubilidad en el agua, así como una alta afinidad con la materia orgánica, lo que contribuye a que este compuesto tenga una movilidad restringida en el suelo. Dicha movilidad del herbicida ocurre a través de las escorrentías de los ríos y su infiltración hacia los cuerpos acuáticos cercanos (Salazar, 2011; Salazar, 2013; Arellano et al., 2017; Veríssimo et al., 2018). Se afectan así otras actividades económicas que dependen de aguas superficiales de calidad, en las cuales no se ha utilizado este tipo de compuestos, tales como la acuacultura, en la que se cultivan diferentes especies de interés comercial. Además de los efectos de tipo ecológico derivados del uso extensivo de este herbicida, como la toxicidad subletal y la crónica, se puede presentar la mortalidad de especies no objetivo.
En distintas regiones del Estado de Veracruz se cuenta con granjas acuícolas (SAGARPA, 2008). Desde la década de los 70 se ha impulsado a esta actividad que representa una alternativa económica para muchas familias (Zetina et al., 2006), la cual ha contribuído al mejoramiento de su nivel de vida. Sin embargo, también trae consigo diversas problemáticas de tipo productivo, socioeconómico y ambiental, que la vuelven una actividad vulnerable a factores externos. De las especies cultivadas en la acuicultura se destacan la tilapia Oreochromis niloticus (Linnaeus, 1758), también conocida como mojarra, la cual genera los mayores volúmenes de producción (Avilés y Vásquez, 2006), y los langostinos como Macrobrachium olfersii (Wiegmann, 1836). Estos organismos representan un importante rol ecológico en los ciclos de energía y nutrientes de los hábitats acuáticos (García et al., 2013). A pesar de esto, en muchas ocasiones se carece de planes de manejo eficientes, lo que dificulta controlar los riesgos potenciales a los que se encuentran expuestos dichos organismos, como el vertimiento de aguas contaminadas dentro de los sistemas de producción. Aunque las especies antes mencionadas tienen importancia económica en México, no hay reportes publicados particularmente sobre evaluaciones de toxicidad aguda del Dasurquat® (con paraquat como ingrediente activo, manufacturado por la Distribuidora de Agroquímicos del Surestes de la republica S.A DE CV®, TABASCO, MÉXICO), ni para la tilapia O. niloticus, ni para los langostinos M. olfersii. Se sabe que el análisis toxicologico ha sido poco abordado para los herbicidas de uso en México, lo cual resalta la necesidad de conocer los efectos tóxicos de compuestos como el paraquat en sus formas comerciales, ya que son estas, y no el ingrediente activo por sí solo, las que están disponibles en el ambiente y que pueden afectar a otros organismos. El objetivo del presente trabajo fue determinar la concentración letal media (CL50) del herbicida Dasurquat® con bioensayos de toxicidad aguda en juveniles de tilapia O. niloticus y postlarvas de langostino de M. olfersii, dada la importancia de estas especies en la actividad acuícola. Particularmente con M. olfersii, este estudio es el primero que determina la toxicidad del paraquat en esta especie.
MATERIALES Y MÉTODOS
Diseño experimental
Para llevar a cabo el bioensayo de toxicidad aguda en organismos acuáticos se tomaron en cuenta los lineamientos que proporciona la Agencia de Protección Ambiental de Estados Unidos (US EPA) en su Guía Para Pruebas de Efectos Ecológicos OCSPP 850.1075 (EPA, 1996; 2016). Dicha guía tiene como propósito establecer los lineamientos para llevar a cabo pruebas toxicológicas agudas que involucren organismos acuáticos cuando son expuestos a concentraciones de un determinado compuesto. El diseño experimental comprendió tres etapas para cada especie: la primera correspondió a un periodo de aclimatación de los organismos, la segunda a un bioensayo preliminar exploratorio de concentraciones y la última al bioensayo definitivo.
Periodo de aclimatación
Se designó un área exclusiva del laboratorio de cuarentena y aclimatación del Instituto Tecnológico de Boca del Río, en la ciudad de Boca del Río, México, la cual se acondicionó a partir de junio 2 de 2019, con los requisitos ambientales necesarios para cada especie. Las condiciones que se mantuvieron similares para ambas especies fueron: la saturación de O2 disuelto del 85 %, ± 2,5 %; el pH del agua en 7,0 ± 0,5; la dureza < 180 mg L-1; y un fotoperiodo de 12 horas de luz y 12 horas de oscuridad. Solo en el caso de la temperatura, se mantuvieron condiciones mayores para O. niloticus con 28 °C, ± 1 °C, mientras que M. olfersii permaneció con una temperatura de 23 °C, ± 1 °C. Dichas condiciones se perseveraron desde 14 días previos al arribo de los organismos hasta la finalización del bioensayo definitivo, para declorar y estimular la maduración del agua en la que se mantuvieron los organismos. Para contener a los especímenes se colocaron 11 peceras de vidrio de 30 L de capacidad, cada una con agua potable apta para consumo humano previamente filtrada con un filtro mecánico y carbón activado. El suministro de aire constante mantuvo una concentración de O2.superior a 5 mg L-1.
Los lotes de organismos se adquirieron con un proveedor acuícola local para asegurar tener una talla similar e iguales condiciones de mantenimiento de los organimos previo a su aclimatación. Se contó con un lote de 1000 especímenes de tilapia O. niloticus con 22 días de eclosión del saco vitelino y un segundo lote de 1000 especimenes de langostino M. olfersii en estadio poslarval. Los lotes de cada especie se adquirieron en diferentes fechas para cada tipo de bioensayo, el preeliminar y el definitivo. Los individuos se distribuyeron en los acuarios de vidrio con el agua previamente madurada a una densidad aproximada de 50 a 70 organismos por acuario y se mantuvieron durante 14 días en periodo de aclimatación y de valoración del vigor del lote a través del registro de la mortalidad en ese periodo. Durante esta fase se midieron la talla y el peso promedio de una muestra de 20 organismos de cada especie (O. niloticus: peso promedio = 10 ± desviación estándar mg, longitud total promedio = 8,75 mm; M. olfersii: peso promedio = 5 mg, longitud total promedio = 5,72 mm). Durante el periodo de aclimatación y hasta 24 horas previas del inicio de los bioensayos, se suministró diariamente alimento comercial con 30 % de proteína. Cada tercer día se realizó la limpieza de las peceras mediante la técnica de sifón y se contabilizaron los organismos muertos, los cuales no rebasaron el 5 % de cada lote; de acuerdo con la guía OCSPP 850.1075 (EPA, 1996) este bajo porcentaje demuestra la vitalidad del lote para ser sometido al bioensayo.
Bioensayo preliminar
Se llevó a cabo un bioensayo estático preliminar con una duración de 96 horas para determinar el rango de concentraciones adecuadas para el bioensayo definitivo. El herbicida a evaluar (Dasurquat® con solución al 25 % de Paraquat) se adquirió en presentación líquida en una tienda local de productos agroquímicos. Se colocaron seis contenedores de polipropileno de 10 L de capacidad, cada uno con 4 L de agua acondicionada de acuerdo a las estipulaciones previamente señaladas y con concentraciones del herbicida de 10, 50, 100, 500 y 1000 μl L-1, más un control negativo. De forma aleatoria, se seleccionaron 60 organismos y se distribuyeron en grupos de diez ejemplares por contenedor. Esta distribución se realizó por separado en lotes para cada especie.
Análisis estadístico
La determinacón de la Concentracion Letal Media (CL50) consideró la mortalidad en los grupos experimentales a través de un análsis Probit realizado con el programa estadístico Minitab® Versión 18 (Minitab Inc, State College, Pennsylvania, EE. UU), con un intervalo de confianza del 95 %. Se definió el valor de CL50 como la concentración de la sustancia tóxica que es letal para el 50 % de los organismos de la prueba. Se realizó además un análisis de varianza para determinar la diferencia estadistica significativa (p < 0.05) a través de una prueba de las comparaciones múltiples de Tukey entre las réplicas con el software statistica (StatSoft, Inc. Tulsa, USA).
Bioensayo definitivo
A partir de los datos obtenidos con el análisis Probit del bioensayo preliminar (Russel, 1979, se determinó una serie geométrica de cinco concentraciones a evaluar (5, 10, 20, 40 y 80 μl L-1 para la tilapia y 0,1, 0,2, 0,5, 0,7 y 1 μl L-1 para el langostino) más un control negativo y dos repeticiones por cada tratamiento, con dos réplicas de igual estructura realizadas en fechas consecutivas. Se utilizaron 18 recipientes para las tres replicas del lote, con el siguiente diseño experimental: seis contederos para el grupo control, seis para la repetición uno y seis para la repetición dos. En total se emplearon 570 individuos de cada especie en los bioensayos definitivos. Cada ensayo se realizó de manera escalonada por lote y por especie debido a los requerimientos de mantenimiento y a las concentraciones usadas con cada taxón (Fig. 1). En los dos casos los bioensayos se realizaron de forma semi-estática, con recambios del 50 % de la solución dispuesta en los contenedores. Cada 24 horas se hicieron observaciones de los organismos y se midió la temperatura, el pH y la concentración de oxígeno disuelto (O2); se documentó el comportamiento anormal como nado errático, inmovilidad, apariencia y daños corporales como deshilachamiento de aletas, hemorragias en branquias, ojos saltones y otras características que no correspondieran a la especie; se cuantificó el número de organismos muertos y se calculó la mortalidad acumulada en porcentaje.
RESULTADOS
Bioensayo definitivo con tilapia O. niloticus
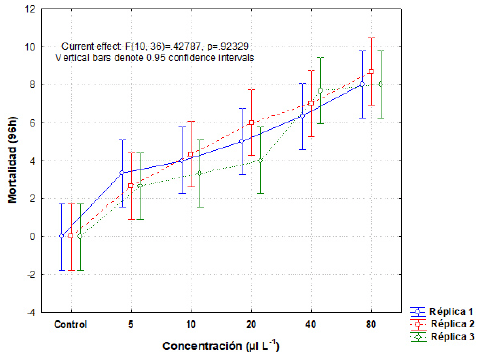
No se observó ningún cambio en la apariencia de los organismos. En el comportamiento se registró un movimiento mínimo y la pérdida del eje de natación (natación repentinamente boca arriba) en los organismos bajo las concentraciones de 40 y 80 μl L-1. En los individuos de las concentraciones más bajas se observó un nado normal. Solo en la concentración más alta (80 μl L-1) se registró una mortalidad del 100 % (Tabla 1). El análisis Probit reportó una CL50 de Dasurquat® en tilapia O. niloticus a 96 horas de 17,4 μl L-1, con un intervalo de confianza del 95 %, un límite inferior de 13,7 μl L-1 y un límite superior de 22,2 μl L-1 (Fig. 2). El valor del análisis de variaza para O. niloticus (p = 0,93) indicó que no existieron diferencias estadisticas significativas (p < 0,05) entre la mortalidad obtenida en las réplicas para cada concentración (Fig. 3). Por lo tanto, se puede decir que no existieron variaciones en las condiciones de manejo de los bioensayos ni en los resultados obtenidos entre los lotes utilizados en el diseño experimental.
Tabla 1 Mortalidad en bioensayos definitivos con tilapia O. niloticus expuesta a diferentes concentraciones de Dasurquat® (96 h)
| Concentración | Mortalidad (96h) | Máximo | Mínimo |
|---|---|---|---|
| 0 | 0 | 0 | 0 |
| 5 | 2.88 | 1 | 5 |
| 10 | 3.88 | 2 | 6 |
| 20 | 5.00 | 3 | 8 |
| 40 | 7.000 | 4 | 9 |
| 80 | 8.222 | 6 | 10 |
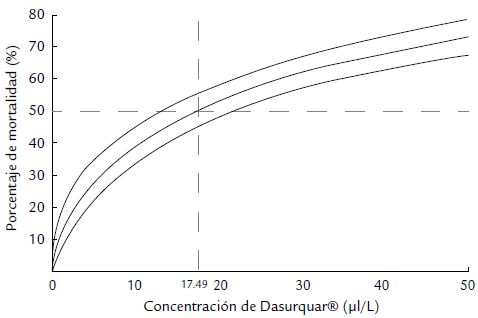
Figura 2 Concentración Letal Media (CL50) de Dasurquat® en tilapia O. niloticus a 96 horas con intervalos de confianza superior e inferior al 95 %.
Bioensayo definitivo con langostino M. olfersii
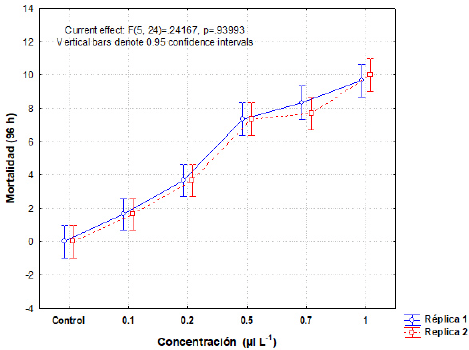
No se observó ningún cambio en la apariencia ni en el comportamiento de los organismos. Se contabilizaron 14 mudas de caparazón distribuidas en todos los contenedores, incluido el control negativo. La concentración más alta (1 μl L-1) fue la única que ocasionó una mortalidad del 1 00 % (Tabla 2). La CL50 de Dasurquat® en langostino M. olfersii a 96 horas fue de 0,31 μl L-1; con un intervalo de confianza al 95 %, el límite inferior fue de 0,26 μl L-1 y el límite superior de 0,35 μl L-1 (Fig. 4). El análisis de varianza para M. olfersii (p = 0.94) indicó que no existieron diferencias estadisticas significativas (p < 0,05) en la mortalidad obtenida entre las réplicas para cada concentración (Fig. 5). Tal como se registró para el bioensayo con O. niloticus, en el caso del lagostino tampoco existieron variaciones en las condiciones de manejo de los bioensayos.
Tabla 2 Mortalidad en bioensayos definitivos con langostino M. olfersii expuesto a diferentes concentraciones de Dasurquat® (96 h).
| Concentración | Mortalidad (96h) | Máximo | Mínimo |
|---|---|---|---|
| 0 | 0 | 0 | 0 |
| 0.1 | 1.5 | 1 | 2 |
| 0.2 | 3.5 | 2 | 5 |
| 0.5 | 7.25 | 6 | 8 |
| 0.7 | 8 | 6 | 9 |
| 1 | 9.75 | 9 | 10 |
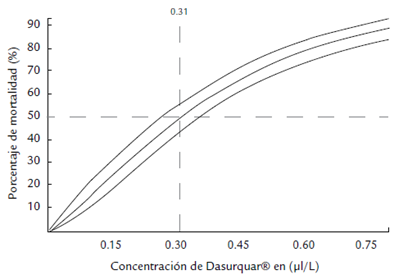
Figura 4 Concentración Letal Media (CL50) de Dasurquat® en langostino M. olfersii a 96 horas con intervalos de confianza superior e inferior al 95 %.
DISCUSIÓN
Eisler (1990) registró los siguientes datos de la CL50 de Paraquat en forma de catión (1,1-dimetil-4,4-bipiridilo) a 96 horas en invertebrados acuáticos: Procambarus clarkii = 1400 μl L-1, Gammarus fasciatus = 11 000 μl L-1, Pteronarcys californica > 100 000 μl L-1; y en peces: Brachydanio rerio entre 7500 y 48 500 μl L-1, Lepomis macrochirus = 13 000 μl L-1, Poecilia reticulata entre 15 y 22 000 μl L-1, Oncorhynchus mykiss entre 15 000 y 32 000 μl L-1, Salmo trutta = 25 000 μl L-1 e Ictalurus punctatus > 100 000 μl L-1.
En juveniles de peces de la especie Hemigrammus rhodostumus,Vargas (2010) halló una CL50 de 32,83 μl L-1 a 96 horas de exposición, pero utilizando la marca comercial Gramoxone® (27 % de ingrediente activo Paraquat). La CL50 determinada para O. niloticus (17,49 μL-1) se encuentra dentro del rango de concentraciones encontradas por otros autores en diferentes especies de peces, la cual va desde 7500 hasta 100 000 μL-1, independientemente de si se trata del ingrediente activo (catión Paraquat) o de una forma comercial. En contraste con el valor determinado en este estudio, Babatunde y Oladimeji (2014) registraron una CL50 de paraquat en O. niloticus de 12 250 μl L-1 (12,25 mg L-1). Estas diferencias pudieron estar asociadas con el uso de especímenes de mayor tamaño empleados por esos autores en su bioensayo, debido a que utilizaron peces con un rango de peso de 6,97 a 7,72 g (peso medio de 7,35 ± 0,53 g), mientras que los organismos usados en la presente investigación tuvieron un peso inferior a 1 g, de acuerdo con las especificaciones de la Guía OCSPP 850 1075 (EPA, 1996). Por lo tanto, parece existir una mayor resistencia a la exposición al herbicida paraquat en organismos de mayor talla, lo que incrementaría el valor de la CL50. Asimismo, Akinsorotan et al. (2019), empleando concentraciones mayores en sus bioensayos, encontraron un valor de CL50 de 40,7684 mg L-1 (40 768,4 μl L-1), el cual fue superior al obtenido en el presente trabajo.
La variabilidad en los valores de CL50 se han registrado para especies con diferente grado de complejidad. En mamíferos es de 110 mg Kg-1 (ratas) y en aves de 35 mg Kg-1, mientras que en peces la toxicidad aguda en la trucha arcoiris alcanza una CL50 de 19 mg L-1 (UNEP, 2012). En invertebrados acuáticos como los neonatos de Daphnia similis la CL50 es de 0,017 μg L -1 a < 24 h (Barbosa et al., 2014).
La CL50 encontrada para M. olfersii (0,31 μL-1) utilizando la forma comercial Dasurquat® fue menor al rango encontrado por otros autores para distintos invertebrados acuáticos (desde 1,4 ppm hasta 100 ppm) con el catión Paraquat. En contraste, Barbosa et al. (2014) indicaron que los juveniles M. amazonicum presentaron una CL50 de 5,0 μg L-1 después de 96 horas. Lo mencionado destaca la variabilidad de la respuesta de la toxicidad aguda, aún entre especies del mismo género, y permite destacar que el langostino M. olfersii tiene una mayor sensibilidad al herbicida al reportar una CL50 casi 56 veces más baja que la determinada para O. niloticus.
El riesgo toxicológico del herbicida Paraquat para actividades como la acuacultura es muy alto, tomando como referencia los valores de CL50 hallados. Bastaría con añadir 174,9 ml del herbicida Dasurquat en un tanque de cultivo de tilapia O. niloticus con capacidad de 10 000 L para poner en riesgo al 50 % de los organismos que ahí se cultiven, y tan solo 3,1 ml si el tanque contuviera langostinos de M. olfersii. Los valores mencionados resaltan la diferencia en la susceptibilidad de los organismos acuáticos, la que está asociada con las capacidades de resistencia de cada especie. Sin embargo, no existe suficiente información científica pública sobre el uso de herbicidas en cultivos agrícolas del Golfo de México. Solo Polanco-Rodríguez et al. (2019) reportan el uso de diez herbicidas de grupos químicos diferentesen en municipios de Yucatán (pero sin indicar las dosis de aplicación), entre los cuales se incluye al paraquat, clasificado como altamente tóxico (Categoria II).
La disponibilidad de herbicidas en aguas superficiales es un tema actual de estudio, a pesar de que el uso de estos compuestos no es reciente. En la acuacultura, el uso del agua superficial sin un tratamiento específico para eliminar este tipo de compuestos es común, y afecta la calidad los diferentes cultivos acuícolas, principalmente en los estadios juveniles y de poslarvas (Bautista-Covarrubias y Ruiz Velazco, 2011; Briones-Pérez et al., 2017). Veríssimo et al. (2018) describen la contaminación por paraquat en aguas de un arroyo rural en la región de montaña de Río de Janeiro en el sureste de Brasil e indican la posibilidad de migración de este contaminante, lo que lo hace disponible tanto para los organismos silvestres como para los cultivados.
Se requiere evaluar más detalladamente la sensibilidad al tóxico en diversas especies de organismos acuáticos. Los estudios realizados por Barbosa et al. (2014) establecieron que el langostino Macrobrachium amazonicum, el caracol Pomacea lineata y el cladócero Daphnia similis mostraron diferencias en su susceptibilidad en las pruebas toxicológicas de varios órdenes de magnitud, y que fueron más sensibles que los organismos de prueba correspondientes a grupos como los insectos acuáticos, los anfípodos y los cladóceros utilizados habitualmente en regiones templadas. Es necesario conocer el potencial toxicológico del herbicida para identificar las afectaciones en especies silvestres y cultivadas. Se ha reportado que el uso de herbicidas como el Glifosato genera efectos negativos en organismos de diversas especies no objetivo y provoca alteraciones en la estructura y la funcionalidad de los ecosistemas acuáticos y dulceacuícolas (Di Fiori et al., 2012). El uso de estos plaguicidas, su transporte y su lixiviación hacia el ambiente provocan riesgos para la biota acuática y la salud pública. Hay registros que indican efectos patológicos por la exposición a estos compuestos (Villaamil-Lepori et al. 2013).
El efecto de los herbicidas en la acuicultura se ha asociado con cambios y daños histopatológicos de diversa índole. En el caso de la tilapia ocurre la proliferación de células filamentosas y la hiperplasia celular en las branquias, la vacuolización de hepatocitos y la picnosis nuclear en hígado y en riñón, así como alteraciones de los parámetros enzimáticos. En esta investigación el principal indicador fue el comportamiento que mostraron los especímenes de O. niloticus, que se expresó en un nado errático e invertido. De manera similar, Babatunde y Oladimeji (2014), en bioensayos con exposición a paraquat de O. niloticus a concentraciones de 9600 μl L-1 (9,6 mg L-1) hasta 15 200 μl L-1 (15,20 mg L-1), observaron en los especímenes expuestos cambios físicos y de comportamiento, tales como hemorragia en la cabeza y las aletas pectorales y pélvicas, salida a la superficie del agua con la liberación de burbujas de la boca, pérdida de equilibrio, natación agitada y ojos inyectados en sangre. Akinsorotan et al. (2019) también registraron en O. niloticus respuestas adversas de comportamiento que incluyeron inquietud, natación errática y pérdida de equilibrio, así como decoloración y muerte súbita en los peces expuestos. Los efectos variaron con respecto a las concentraciones del contaminante y se detectó que la mortalidad de los especímenes se incrementó con el aumento en la concentración. Así, queda claro que el daño en las especies silvestres y cultivadas causado por los diferentes herbicidas depende de la concentración del compuesto al que se exponen. Para el presente caso, es necesario controlar el uso de herbicidas a base de paraquat cerca de los ecosistemas acuáticos, a fin de reducir el riesgo para los sectores productivos que dependen de estas actividades.
CONCLUSIONES
El resultado obtenido de una CL50 de 17,49 μl L-1 en la tilapia O. niloticus fue menor que para algunas especies de mayor complejidad como los mamíferos, pero similar para otras especies de peces. Los valores hallados demuestran la alta toxicidad de este compuesto para los organismos acuáticos y su potencial riesgo ambiental si se hace un manejo inadecuado. La ficha técnica de uso del Dasurquat® pide utilizar una concentración del compuesto no mayor a 1 L de producto por cada 100 L de agua, es decir una concentración de 10 ml L-1. Esta concentración representa alrededor de 570 veces más de la CL50 encontrada para la tilapia O. niloticus. Se tienen que considerar todos los factores involucrados en el uso y manejo de este tipo de herbicidas desde una perspectiva integral, lo que incluye a los usuarios de estos agroquímicos, los aspectos productivos de sus cultivos y las condiciones socioeconómicas, así como su impacto negativo en el ambiente y en la salud pública. Los datos obtenidos en este bioensayo en condiciones controladas brindan un marco de referencia para continuar con la investigación del efecto toxicológico de este herbicida.