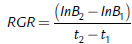INTRODUCCIÓN
Los factores abióticos a menudo dirigen los efectos en cascada hacia abajo ("top-down") y hacia arriba ("bottom-up") en las redes tróficas (Hoekman, 2010). Por ejemplo, la disponibilidad de luz puede interactuar para influenciar las tasas de crecimiento vegetal, los compuestos secundarios, el contenido de nutrimentos y la palatabilidad de las hojas para los herbívoros (Price et al., 1989). Una de las principales fuentes de luz en las selvas tropicales son los claros, definidos por Petr Kalm como "los árboles viejos que mueren continuamente y son exitosamente reemplazados por una nueva generación" (Goodale et al., 2014). Estos claros son complejos y presentan un sistema dinámico en el que existe heterogeneidad de luz dentro y entre ellos (Marthews et al., 2008). De igual manera, la interacción de las plantas con diversos organismos (herbívoros insectos, patógenos y mamíferos) puede influenciar la calidad de vida de las mismas (Ballina-Gómez et al., 2008). Sin embargo, las plantas han desarrollado una serie de estrategias para disminuir (resistencia) o sobrellevar (tolerancia) el impacto de los herbívoros (Stowe et al., 2000). Salgado-Duarte y Gianoli (2012) mencionan que las especies de plantas que se encuentran en entornos de sotobosque son más propensas a ser consumidas por herbívoros en comparación con las plantas establecidas en claros. Así, las diferencias en la disponibilidad de los recursos resulta ser uno de los mecanismos que mejor explican los niveles de herbivoría (Pieterse et al., 2012).
También, las diferencias en los grados de herbivoría entre las especies se relacionan con el hábito de crecimiento vegetal (Martínez-Pachón et al., 2010). De acuerdo con esto, en las plantas existe una competencia en la asignación de recursos, en la que no es posible invertir de manera simultánea recursos para el crecimiento y para la producción de defensas, a pesar de que estas últimas son una manera efectiva de evitar a los herbívoros. Estos compromisos asumen que el impacto negativo en el crecimiento podría ser el resultado de la disminución de la fotosíntesis, lo cual reduciría la cantidad global de las reservas de energía y provocaría un desvío de recursos del crecimiento hacia la defensa (Huot et al., 2014). Estas respuestas de asignación de biomasa dependen muchas veces de factores externos, ya que afectan la inversión asignada a cada estructura vegetal, como lo son las hojas, las raíces y los tallos (Villar et al., 2008). Por ejemplo, el estrés por sequía puede provocar un incremento de la proporción de raíz (RWR) para captar mayor cantidad de agua disponible en el suelo y reducir la biomasa foliar para restringir la pérdida de agua a través del área transpirable de las hojas (Poorter et al. , 2012). Además, hay otros mecanismos como son el cierre de los estomas (Quero et al., 2011) y producir hojas con un área foliar específica (SLA) menor (Poorter y Nagel, 2000). La combinación de estas respuestas puede provocar la reducción de la tasa de crecimiento relativo (RGR) bajo condiciones de sequía (Quero et al., 2008). Temme et al. (2019) mencionan que la planta modifica la proporción de biomasa hacia estructuras aéreas si la ganancia de carbono se ve negativamente afectada por bajos niveles de luz o CO2 en hojas. En cambio, si la ganancia se encuentra afectada por una baja disponibilidad de agua o nutrimentos en el suelo, el destino principal de los asimilados será la raíz.
En el presente estudio se evaluaron los efectos de la herbivoría y la apertura de claros en el crecimiento total de plántulas y la defensa foliar de Brosimum alicastrum en una selva mediana subcaducifolia. Para ello, se plantearon los siguientes objetivos: 1) evaluar la tasas de crecimiento relativo en biomasa; 2) determinar la contribución de los componentes morfológicos y fisiológicos en el crecimiento total, así como la variación en la asignación de biomasa hacia hojas, tallos y raíces; 3) evaluar el papel de la herbivoría y la apertura de claros sobre la inducción de las defensas químicas (fenoles totales foliares) y físicas (dureza foliar), así como un posible compromiso con el crecimiento total.
MATERIALES Y MÉTODOS
Sitio de estudio y especie de estudio
El estudio se realizó en una selva mediana subcaducifolia perteneciente al rancho "Colokche'akal" (20°01'36.8"N 89°10'13.4"W, 112 m altitud) localizado al sur del estado de Yucatán en el municipio de Tekax. El lugar cuenta con más de 2000 ha y una parte es utilizada para la ganadería; no obstante, la mayoría presenta vegetación conservada. El clima corresponde al cálido subhúmedo (Aw0") con poca oscilación térmica (Zamora-Crescencio et al., 2008), la precipitación y temperatura media anual son de 800 mm (máxima 1200 mm) y 24 °C, respectivamente (Challenger y Soberón, 2008). Esta región se caracteriza por tener una marcada estacionalidad en tres temporadas: secas (febrero-mayo), lluvias (junio-septiembre/noviembre) y frentes fríos o "nortes" (octubre-enero). Los suelos predominantes en la zona de estudio son litosoles réndzicos, los cuales se derivan de rocas calcáreas, de color pardo oscuro, de textura arcillosa enriquecida con aporte de materia orgánica (Zamora-Crescencio et al., 2008). El ramón (B. alicastrum) es una especie perennifolia de sotobosque, de lento crecimiento y de larga vida, que puede llegar a alcanzar una altura de 45 m y un diámetro a la altura del pecho (DAP) de hasta 1,5 m. Tiene una distribución que va desde el sur de México hasta Colombia, Perú, Venezuela y en las Islas del Caribe (de la Cruz y Dirzo, 1987).
Diseño experimental
Se empleó un diseño anidado, en el cual los sitios (claro y sotobosque, n = 3 cada uno) anidaron a los tratamientos de herbivoría (control, herbivoría simulada y natural).
El tratamiento de herbivoría simulada se estableció como un control negativo que sirviera para diferenciar el efecto producido difrectamente por un herbivoro y no un daño simulado. Dentro de la selva mediana se seleccionaron seis sitios: tres claros de selva de ~25 m2 y tres sitios de sotobosque (los claros se originaron de forma natural debido a la caída de los árboles, en algunos y para tener un diseño balanceado, fue necesario limpiar los claros de ramas que dificultaban el acceso para completar el número de sitios). En cada uno de ellos se realizaron 30 pocetas de ~20 cm de profundidad y posteriormente se sembraron 30 plántulas de 30 días de edad (n por tratamiento = 10, n total = 180 plántulas). En el tratamiento control no se removieron las hojas, en el tratamiento de herbivoría simulada se removieron todas las hojas, excepto la más nueva y en el natural se dejaron intactas las plantas pero expuestas a los herbívoros locales. Para el tratamiento control y de herbivoría simulada se excluyeron las plántulas con una malla para evitar en lo posible el contacto con cualquier herbívoro. Cada plántula se sembró en envases de plástico con agujeros para dejar libre la transferencia de nutrimentos y agua y para facilitar la obtención de raíces al final del experimento. El estudio tuvo una duración de seis meses, iniciando en agosto de 2014 y finalizando en enero de 2015.
Al inicio y al final del estudio se obtuvieron medidas de diez plántulas de cada tratamiento: altura, diámetro basal y número de hojas, así como la biomasa seca de las hojas, el tallo y la raíz mediante secado a 55 °C durante 48 horas o hasta alcanzar un peso constante. Para todos los sitios se registró la apertura del dosel, la temperatura y la humedad relativa, a las 12:00 h del día y al inicio del experimento (agosto de 2014). Los sitios de claro presentaron una apertura del dosel de 31,7 ± 0,81 % con una temperatura de 34,8 ± 0,77 °C y una humedad relativa de 65 ± 0,55 %. Los sitios de sotobosque tuvieron una apertura del dosel de 18,1 ± 0,65 % con una temperatura de 32,1 ± 0,18 °C y una humedad relativa de 70,2 ± 1,07 %. La apertura del dosel se determinó mediante fotografías hemisféricas con una cámara digital (Nikon CoolPix) con un lente hemisférico especial (Nikon Fisheye Converted FC-E8) montado con un adaptador especial (Step Down Ring Adapter UR-E4). Se tomaron tres fotografías por cada sitio, todas a 1 m de altura; previo al registro de las fotografías se aseguró que la cámara mantuviera una posición horizontal y con dirección norte. Todas las fotografías se tomaron en días nublados y se analizaron con el software analizador de imágenes Gap Light Analyzer GLA, Version 2 (Gap Light Analizer, 1999). La temperatura y la humedad relativa se registraron con un termohigrómetro digital (Amprobe THWD-3).
Análisis de crecimiento
Con las medidas iniciales y finales se calcularon las tasas de crecimiento relativo en biomasa (RGRB, mg g-1 día-1), en área foliar (RGRAF), en altura (RGRAlt), en diámetro (RGRD) y la tasa de producción foliar (TPF). También se calcularon los componentes morfológicos y fisiológicos de la RGRB, como la razón del área foliar (LAR, cm2 g-1), la tasa de asimilación neta (NAR, g cm-2 día-1) y el área foliar específica (SLA, cm2 g-1). Adicionalmente, con las mismas medidas se calculó la asignación de biomasa de toda la planta usando la proporción de la biomasa foliar (LWR, g g-1), del tallo (SWR, g g-1) y de la raíz (RWR, g g-1); todos los cálculos se realizaron según Hunt (1978). Para facilitar el uso de la terminología del crecimiento vegetal, todos los índices se usan por sus siglas en inglés.
La fórmula de la tasa de crecimiento relativo es:
Dónde: B1= biomasa inicial, B2= biomasa final, t1= tiempo inicial, t2= tiempo final, ln= logaritmo natural.
Análisis de área foliar y herbivoría
En cada muestreo se tomaron fotografías a las hojas de las plantas con una cámara digital semi-profesional (Nikon, Modelo: D3100). En el primer muestreo se fotografiaron todas las hojas de las plantas y en el final sólo se fotografiaron las hojas nuevas. Las fotografías se tomaron a una distancia de 20 cm de la hoja. Para fijar la hoja expandida y obtener medidas precisas se utilizó una tabla pequeña de papel cascarón (de 20 cm largo x 10 cm ancho). En la tabla se instaló una regla para medir la longitud de la hoja y establecer una longitud de referencia para el cálculo del área foliar con el programa image J (Image J, 1997).
Cuantificación de los fenoles y la dureza foliar
La producción de fenoles foliares se cuantificó con el método Folin-Ciocalteu (Makkar, 2003). Se obtuvieron las tres hojas más nuevas de cuatro plántulas por tratamiento (n por sitio = 12, n total = 72 plántulas). Se secaron las hojas a una temperatura no mayor a 55 °C para evitar la inactivación de los fenoles. Se molieron todas las muestras hasta convertirlas en pequeños fragmentos de aproximadamente 0,5 mm y obtener 200 mg. Posteriormente, cada muestra se transfirió a un matraz y se le añadió 10 ml de metanol al 50 %. El matraz se suspendió en un baño ultrasónico de agua durante 20 min. Después, el contenido del matraz se transfirió a tubos de centrifuga y se centrifugó por diez min a 3000 g a 4 °C. Posteriormente, se obtuvieron alícuotas con el extracto vegetal (0,25 ml) en tubos de ensayo, se aforó el volumen a 0,5 ml con agua destilada y se añadió 0,25 ml del reactivo Folin-Ciocalteu y la misma cantidad de Na2CO3. Se registró la absorbancia a 725 nm en un espectrofotómetro (Reyleigh, Modelo: UV-2601). Se calculó la cantidad de fenoles totales como equivalentes del ácido tánico de la curva de calibración.
Para analizar la dureza foliar se colectaron al final del estudio las dos hojas más nuevas de dos plantas por tratamiento (n por sitio = 12 hojas, n total = 72 hojas). Para analizar este parámetro se utilizó un penetrómetro foliar (Pocket Penetrometer) (Dirzo, 1987), con el cual se midió la presión necesaria ejercida para penetrar la hoja en g cm-2 de acuerdo al método descrito por Feeny (1970).
Análisis de datos
Para analizar los efectos de la herbivoría y la apertura de claros sobre el crecimiento, los componentes morfológicos y fisiológicos y la asignación de biomasa, se realizaron análisis de varianza anidados, en el cual el factor sitio anidó a los tratamientos de herbivoría. Posterior a ello, se realizaron análisis de Tukey para identificar diferencias entre pares de tratamientos. Además, para evaluar los porcentajes de herbivoría entre sitios se realizó la prueba de Mann-Whitney.
Para examinar el efecto de la herbivoría y de la apertura de claros en la dependencia de la producción de defensas vegetales (fenoles foliares y dureza foliar) y sobre el crecimiento en biomasa, se realizaron modelos de regresión de separación de pendientes. En estos modelos los sitios de estudio (claro y sotobosque) se consideraron como variables dummy (categóricas) y la producción de fenoles y la dureza foliar se consideraron como variables dependientes de la variable RGRB (variable independiente). Las pruebas de T examinaron la hipótesis nula β = 0, donde el estadístico F analiza las diferencias entre las pendientes de las líneas de regresión de los sitios de estudio (Ho: β 1 = β 2=). Todos los análisis se realizaron con Statistica 8 para Windows (Statistica, 2008).
RESULTADOS
Crecimiento de plántulas
Al inicio del experimento las plántulas presentaron una biomasa promedio (media ± error estándar) de 1,5 ± 0,08 g. Al final de los tratamientos la biomasa quedó de la siguiente manera: en claros con la herbivoría control 3,8 ± 0,34 g, con la herbivoría natural 4,64 ± 0,29 g y con la simulada 2,07 ± 0,11 g; en sotobosque con la herbivoría control 1,81 ± 0,18 g, con la natural 1,74 ± 0,07 g y con la simulada 1,07 ± 0,04 g.
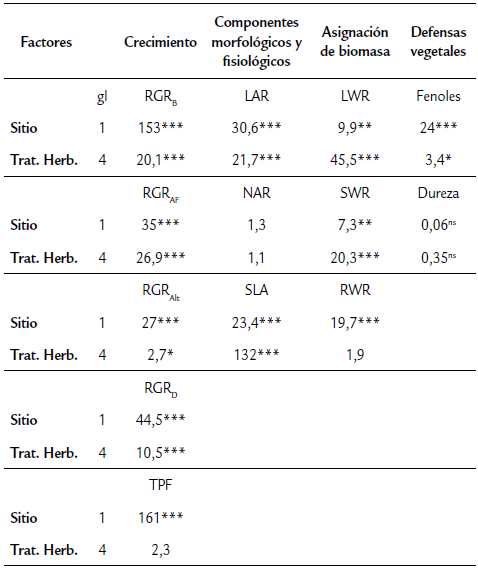
Se observaron efectos significativos de los sitios y los tratamientos de herbivoría en casi todas las variables de crecimiento, excepto en la tasa de producción foliar, que sólo presentó diferencias significativas entre sitios pero no entre tratamientos de herbivoría (Tabla 1).
Tabla 1 Efecto de la apertura de claros (sitios) y de la herbivoría sobre el crecimiento, los componentes morfológicos y fisiológicos, la asignación de biomasa y las defensas vegetales. Se muestran los valores de F y su significancia estadística (ns= no significativo; p < 0.05*; p < 0.005**; p < 0.0001***).
La RGRB fue mayor en las plántulas de los sitios de claros (0,003 ± 0,0002 g g-1 día-1) que en las de sotobosque (-0,00015 ± 0,0001 g g-1 día-1) y alrededor de cuatro veces mayor en las de los tratamientos control y de herbivoría natural de ambos sitios, en comparación con las de los tratamientos con herbivoría simulada (Fig. 1a; Tabla 1).
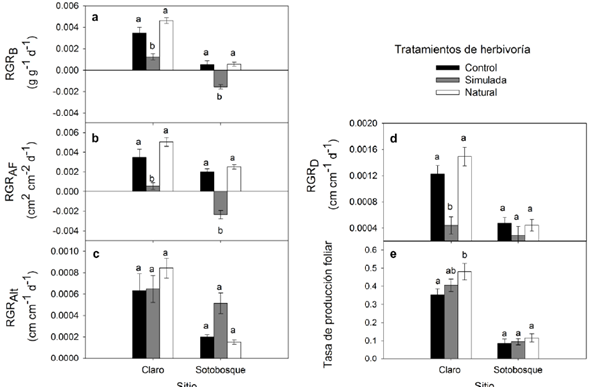
Figura 1 Efecto de la apertura de claros y la herbivoría sobre el crecimiento en términos de la tasa de crecimiento relativo en biomasa (RGRB) (a), el área foliar (RGRAF) (b), la altura (RGRAlt) (c), el diámetro (RGRD) (d) y la tasa de producción foliar (e). Letras diferentes indican diferencias significativas (Tukey < 0,05).
La RGRAF mostró el mismo patrón que la RGRB: mayor crecimiento bajo claros que en sotobosque (0,003 ± 0,0004 y 0,0007 ± 0,0003 cm2 cm-2 día-1, respectivamente) (Fig. 1b; Tabla 1). En tanto, la RGRAlt solo difirió entre sitios pero no entre tratamientos de herbivoría. Las plántulas lograron mayores alturas bajo claros que en sotobosque (0,0007 ± 0,00007 y 0,0002 ± 0,00003 cm2 cm-2 día-1, respectivamente) (Fig. 1c).
Las RGRD fueron mayores también en plántulas creciendo en claros que en sotobosque (0,001 ± 0,00009 y 0,0004 ± 0,00006 cm cm-1 día-1, respectivamente). Sin embargo, los tratamientos de herbivoría solo difirieron en altura bajo los claros, siendo tres veces más altas en el tratamiento control y de herbivoría natural que en los de la herbivoría simulada (Fig. 1d).
En la tasa de producción foliar (TPF) las diferencias fueron muy claras entre sitios, las plántulas de los claros produjeron muchas más hojas que las de sotobosque (0,41 ± 0,02 y 0,098 ± 0,012, respectivamente). En tanto, los tratamientos de herbivoría sólo difirieron en claros y con una magnitud menor (Tabla 1). En este sentido, el tratamiento de herbivoría natural presentó una TPF mayor que en el control (Fig. 1e).
Componentes morfológicos y fisiológicos
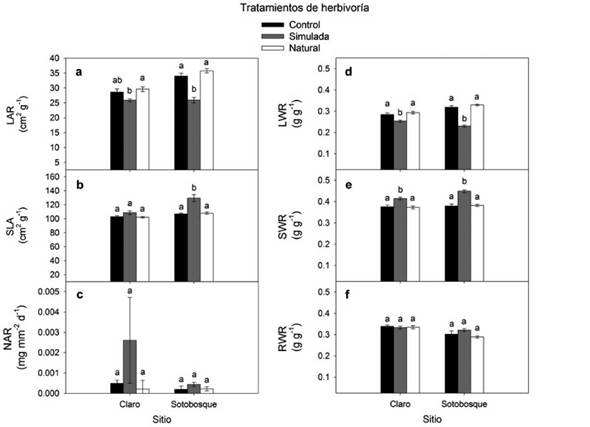
Los componentes morfológicos LAR y SLA presentaron diferencias significativas entre sitios y entre los tratamientos de herbivoría (Tabla 1). Para el LAR en sitios de claros, los valores mayores se obtuvieron en el tratamiento de herbivoría natural y el más bajo en el simulado; el control produjo valores intermedios. El mismo componente LAR pero en sotobosque, resultó significativamente menor con la herbivoría simulada en comparación con en el control y con la herbivoría natural (Fig. 2a). Para el SLA en sitios de claro, no se presentó ninguna variación entre tratamientos de herbivoría. No obstante, en sotobosque sí hubo diferencias significativas entre la herbivoría simulada, que fue mayor con respecto al control y a la natural (Fig. 2b). Por su parte, el componente NAR no presentó ninguna diferencia significativa entre sitios de claro y sotobosque, ni entre tratamientos de herbivoría (Fig. 2c).
Asignación de biomasa
Los tres componentes de asignación de biomasa (hoja-LWR, tallo-SWR y raíz-RWR) presentaron diferencias significativas entre sitios, aunque LWR y SWR sólo entre los tratamientos de herbivoría (Tabla 1). La asignación a biomasa foliar (LWR), tanto en claros como sotobosque, fue mayor en los tratamientos de herbivoría de control y natural; la simulada produjo una asignación de biomasa menor, pero en sotobosque las diferencias fueron más amplias (Fig. 2d). En forma opuesta, la asignación hacia tallos (SWR) fue más alta en el tratamiento de herbivoría simulada en comparación con el control y la herbivoría natural (Fig. 2e). La asignación de biomasa hacia las raíces (RWR) fue similar entre los tratamientos de herbivoría, pero mayor en los sitios de claros que en sotobosque (Fig. 2f).
Herbivoría y defensas foliares
En general, la herbivoría promedio por hoja no superó más allá del 0,3 %. No obstante, en claros se registraron porcentajes de daño significativamente mayores (Prueba de Mann-Whitney; U = 98, p = 0,04) (Fig. 3). Así mismo, se encontró que un 97 % de las hojas muestreadas presentaron daño por insectos herbívoros.
En el caso de las defensas foliares, sólo los fenoles mostraron variación significativa, tanto entre sitios como entre tratamientos de herbivoría, cuantificándose mayores niveles en el sotobosque y en el tratamiento de herbivoría de control (Tabla 1; Fig. 3).
Figura 3 Efecto de la apertura de claros sobre los porcentajes de herbivoría en plántulas de B. alicastrum. Letras diferentes indican diferencias significativas (Tukey < 0,05). La ausencia de letras indican que no hubo diferencia significativa entre los tratamientos de herbivoría en ningún sitio (claro y sotobosque).
Compromiso entre crecimiento y defensas vegetales
La interacción de los coeficientes de los sitios x RGRB no fueron significativos ni en los fenoles foliares ni en la dureza foliar. De forma interesante, se observaron patrones disimilares de las relaciones crecimiento vs. fenoles totales foliares, ya que bajo los claros de la selva se registró una relación positiva (parámetro: 7,2 ± 13,4) pero, en forma opuesta, en el sotobosque esta relación tuvo una tendencia negativa (parámetro: -3,3 ± 27) (Fig. 4).
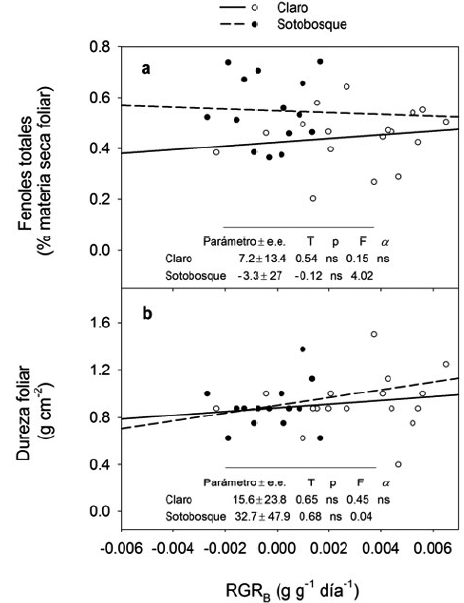
Figura 4 Efecto de la tasa de crecimiento relativo en biomasa sobre la producción de fenoles totales (% materia seca foliar) (a) y la dureza foliar (b) bajo sitios de claros (círculos blancos) y sotobosque (círculos negros). Se indican los valores de los modelos de regresión de la separación de pendientes para los fenoles foliares totales y la dureza foliar, en los que los sitios de estudio (claros y sotobosques) se consideraron como variables dummy (categóricas). Las pruebas de T examinaron la hipótesis nula β = 0, donde el estadístico F analiza las diferencias entre las pendientes de las líneas de regresión de los sitios de estudio (Ho: β1 = β2=). ns = estadísticamente no significativo.
DISCUSIÓN
En general el crecimiento fue mayor en las plántulas bajo los claros. Ello puntualiza el papel preponderante de la disponibilidad de luz producto de la apertura de claros para el crecimiento vegetal y la supervivencia (Iriarte-Vivar y Chazdon, 2005; Sterck et al., 2013; Valladares et al., 2016). Los bajos porcentajes de luz en el sotobosque (~ 2 %) limitan el desempeño de las plántulas que los habitan, mientras que en los claros se pueden encontrar niveles de luz de hasta un 30 % que benefician mayormente los estadios jóvenes de las plantas (Blundell y Peart, 2001). Adicional al efecto positivo de la luz sobre el crecimiento, su escasez también puede comprometer la capacidad de las plántulas de resistir herbívoros y patógenos (Beckage y Clark, 2005).
Se observaron tres tipos de crecimiento compensatorio a través de las variables de crecimiento. De forma interesante, estas variables sólo fueron compensatorias y sobrecompensatorias con la herbivoría natural, en tanto que con la simulada las respuestas fueron subcompensatorias. A nivel global (medido con la RGRB de las plántulas) B. alicastrum demostró su capacidad de hacer frente a los efectos adversos de la herbivoría (visto desde su crecimiento compensatorio). Otras respuestas similares de crecimiento se han encontrado previamente con la misma especie en otra selva subhúmeda con niveles de luz en sotobosque de alrededor del 2,5 % (Ballina-Gómez et al., 2008) y también en condiciones experimentales con niveles de luz del 1 al 65 % (Ballina-Gómez et al., 2010). Las respuestas sobrecompensatorias se observaron en la producción de hojas cuando la disponibilidad de luz fue mayor (en claros), lo que es consistente con la hipótesis de la compensación continua (Maschinski y Whitham, 1989). La evidencia empírica apoya esta hipótesis, aunque con ciertas observaciones (Dahlgren y Lehtilá, 2015). También hay otros estudios que mencionan que no siempre se presentará este incremento continuo con la adición de recursos (Pirk y Farji-Brener, 2013). De esta manera, sería recomendable que futuros estudios se enfoquen en el papel de la disponibilidad de recursos desde una perspectiva global, es decir, abarquen simultáneamente, además de la luz, otros recursos como el agua, los nutrimentos y las micorrizas.
Los componentes morfológicos relacionados con la estructura foliar (LAR y SLA) tuvieron mayores valores en las plántulas de sotobosque que en las de claros, mientras que el fisiológico (NAR) tendió a ser mayor en claros aunque sin diferencias significativas. Estos resultados con respecto a LAR y SLA, difieren de los reportados por Ballina-Gómez et al. (2010) para la misma especie vegetal y en condiciones experimentales. Estos autores no encontraron evidencia de variación por la disponibilidad de luz, pero sí para el caso de la NAR, la cual fue similar entre claros y sotobosque. No obstante, las diferencias de los componentes morfológicos y fisiológicos están dadas no únicamente en el gradiente de recursos sino también a nivel interespecífico (Adler et al., 2013). En este sentido, otros estudios con diferentes especies han encontrado valores del SLA mayores en sitios con alta disponibilidad de luz, lo cual se explica por una mayor demanda de luz (Rego y Possamai, 2006). Sin embargo, experimentos adicionales reportan justamente resultados totalmente opuestos; en ellos el área foliar fue mucho mayor en los sitios con menor disponibilidad de luz (Piña y Arboleda, 2010). Valladares et al. (2004) mencionan que generalmente las plantas que toleran la sombra, como el caso de B. alicastrum, suelen incrementar su área fotosintética como un mecanismo adaptativo con lo cual logran la máxima captación de la luz incidente (Moraes Neto et al., 2000).
Por otro lado, una parte de los resultados aquí encontrados sugieren también un equilibrio funcional en la asignación de biomasa, debido a que la mayor cantidad de biomasa dirigida hacia las hojas y tallos se produjo en el sotobosque, donde la disponibilidad de luz fue limitada. Por otra parte, bajo claros las plantas asignaron mayor biomasa hacia las raíces, lo que apunta hacia una alta limitación por factores como el agua y los nutrimentos. Por lo tanto, podría esperarse que estas plántulas expandan su sistema radicular en busca de éstos recursos (Poorter et al., 2012). Ello es de esperarse dado que la asignación de biomasa controla la capacidad de las plantas para utilizar los recursos, tales como carbono, agua y nutrimentos. Adicionalmente, los patrones de asignación de biomasa de las plantas son altamente sensibles a las variaciones de los factores climáticos (Poorter y Nagel, 2000).
En este estudio se encontró que las plántulas que crecen en el sotobosque de la selva fueron las que produjeron mayor cantidad de fenoles totales foliares, aunque de forma sorpresiva esto ocurrió sólo en aquellas plantas excluidas de la herbivoría (tratamiento control), lo que sugiere una defensa constitutiva más que inductiva por parte de B. alicastrum (Bixenmann et al., 2016). Esto se sustenta en el hecho de que la especie es capaz de producir defensas químicas desde etapas tempranas de su ontogenia sin necesidad de sufrir algún evento de herbivoría (Ballina-Gómez et al., 2008). Asimismo, las especies de lento crecimiento que crecen en el sotobosque producen una alta cantidad de fenoles debido a que en términos de asignación de energía les resulta más fácil que suplir el tejido perdido (Giertych et al., 2015). Adicionalmente, es posible que este resultado haya estado influenciado por las respuestas de crecimiento, ya que precisamente en el sotobosque fue donde crecieron menos las plántulas. Además, aunque no se encontró evidencia contundente, sí se registró un patrón negativo (compromiso) entre la tasa de crecimiento relativo (RGRB) y los fenoles (Lind et al., 2013). Esta ausencia de un claro compromiso (crecimiento y defensa) sugiere que los costos metabólicos de la defensa no siempre detectan compromisos con el crecimiento (Koricheva, 2002). Una razón es que si una planta es capaz de compensar para lograr un incremento en asignacion, ya sea para el crecimiento o la defensa reduciendo la asignacion a un tercer proceso, ningún compromiso crecimiento - defensa podría observarse, a pesar de los cambios significativos que pudieran verse en el fenotipo de la planta (Züst y Agrawal 2017). Los bajos porcentajes de herbivoría registrados en el sotobosque quizá hayan tenido un papel en estas respuestas. En esta última instancia, otros estudios también han registrado en otras selvas tropicales mayores porcentajes de herbivoría en sitios con alta disponibilidad de luz (Norghauer y Newbery, 2014). Una debilidad del presente estudio es que se registró la herbivoría sólo en la época de sequía. En este sentido, Gutiérrez-Granados (2000) menciona que la herbivoría en las selvas con estacionalidad marcada es el resultado de la pérdida de hojas y de algunos factores orográficos. En la época de sequía las plantas pierden el follaje, es decir, el recurso alimenticio de los diferentes herbívoros desaparece, con lo cual pierden una fuente potencial de alimento, lo que resulta en una disminución de sus poblaciones (Gutiérrez-Granados, 2000). Por otra parte, en forma notable la dureza foliar no presentó variación en ningún caso, ello a pesar de que se ha registrado una íntima relación negativa con el SLA (Westoby et al., 2000). Este es un indicador de mayor palatabilidad para los insectos herbívoros por la menor dureza y la mejor calidad nutricional (Lloyd et al., 2010), el cual fue significativamente mayor en las plántulas de sotobosque.
CONCLUSIONES
Se observaron respuestas compensatorias en todas las variables de crecimiento cuando la herbivoría fue natural; fueron subcompensatorias en RGRB, RGRAF y RGRD con la herbivoría simulada; y fueron sobrecompensatorias en la tasa de producción foliar con la herbivoría natural y sólo bajo claros de selva. Además, los componentes morfológicos como LAR y SLA fueron mayores bajo claros, y el fisiológico NAR más alto en plántulas de sotobosque. La asignación de biomasa fue en mayor proporción hacia hojas y tallos en sotobosque y más alta hacia raíces bajo claros. La herbivoría se encontró en mayores porcentajes bajo claros pero la producción de fenoles foliares se incrementó en el sotobosque. Finalmente, no se encontró una relación (compromiso) entre la producción de defensas con el crecimiento, tan solo una tendencia negativa con la producción de fenoles foliares y en condiciones limitantes de recursos, como ocurre en el sotobosque.