INTRODUCCIÓN
Los residuos derivados de la perforación petrolera son una fuente importante de contaminación de los ecosistemas marinos. Entre los años 2010 y 2016 se registró un poco más de 3200 plataformas de perforación petrolera en el mundo, que según distintas estimaciones de residuos de perforación por pozo (Gettleson, 1980; Bechmann et al., 2006; Jagwani etal., 2011) pudieron dejar entre 640 000 y 320 000 000 de toneladas de residuos y escombros de perforación en el mar. Los residuos de perforación se encuentran compuestos por Lodos de Perforación Petrolera (LPPs) (Pabortsava et al., 2011), a los cuales se les atribuye principalmente los agentes contaminantes y tóxicos (Gettleson, 1980). Los LPPs son una mezcla compleja de sustancias incorporadas en una matriz líquida usada principalmente para enfriar y lubricar la broca de perforación (Ruiz, 2012), remover los escombros del fondo del pozo de perforación, contrarrestar las presiones opuestas y laterales dentro del pozo, evitar escapes de gas y petróleo, prevenir el colapso de las paredes internas del pozo y permitir el proceso de instalación del casco protector (Jagwani et al., 2011). Los lodos de perforación base agua (WBM, por su sigla en inglés Water-based drilling muds) son los más usados por su menor costo de producción, menor impacto ambiental, mayor desarrollo, tecnificación y variedades en la formulación (Caenn et al., 2011). Los WBM presentan un aspecto físico líquido, coloidal, viscoso, de color variable entre grises a pardos. Los primeros WBM que se usaban en las plataformas de perforación petrolera tenían en su formulación más de 60 compuestos, sustancias y materiales de derivación biológica (Gettleson, 1980) que se clasificaban en cuatro fases: Líquida, coloidal, química e inerte (Ruiz, 2012). Los compuestos principales de los WBM son una mezcla compleja de solventes, arcillas, fosfatos, compuestos a base de lignina y surfactantes (Gettleson, 1980), dejando los compuestos de ligninas ferrocromo-sulfatadas trazas de cromo contaminante en los ambientes marinos (Okaiyeto et al., 2016; Ulmer et al., 1983).
El estudio toxicológico de los LPPs se ha enfocado en la medición de dosis y concentraciones letales (LD50, LC50), el análisis de impacto ambiental a nivel ecosistémico y poblacional, la cuantificación de cambios en la estructura de las comunidades bacterianas, y la evaluación de alteraciones fisiológicas en algunos modelos animales (Geehan et al., 2006; Bravo, 2007; Pabortsava et al., 2011; Bakke et al., 2013; Purser, 2015). Se ha demostrado que los LPPs tienen potencial tóxico en los ecosistemas marinos rápidamente después de su aplicación (Geehan et al., 2006; Bravo, 2007; Pabortsava et al., 2011; Bakke et al., 2013; Purser, 2015).
Específicamente, uno de los componentes más abundantes de los LPPs, las arcillas de barita, fueron hallados en los tejidos de coral ubicados a 10 Km de las plataformas de perforación, evidenciando una bioacumulación de Bario en el exoesqueleto (Lepland y Mortensen, 2007). En siete especies de corales formadores de arrecife: M. annularis, A. agaricites, D. stokesii, A. cervicornis, P. divaricata, P. furcata, y P. asteroides, se reportaron efectos adversos a concentraciones de 3,16 % a 100 % del sobrenadante y la fase de suspensión particulada de una mezcla 1:1 de lodo con agua marina filtrada, a un tiempo de exposición de hasta 96 h, los cuales incluyeron la retracción e inflamación de pólipos, incremento en secreción de moco, desintegración de tejidos y muerte de la colonia (Thompson Jr et al., 1980). En otro caso, el coral de aguas profundas L. pertrusa mostró efectos adversos similares, como la retracción de pólipos e incremento en la secreción de moco, además de la muerte de pólipos en un 2,2 % de los casos observados después de 84 días de exposición a una concentración de 2,5 mg WBM por 100 ml disolución (Larsson et al., 2013).
En este trabajo se registraron los cambios morfológicos en exposición hiperaguda a lodos de perforación petrolera base agua (WBM) en el cnidario Hydractinia symbiologicarpus a partir de registro fotográfico. Este es un cnidario colonial sésil perteneciente a la Clase Hydrozoa, que vive sobre las conchas donde habitan los cangrejos ermitaños de la especie Pagurus longicarpus (Frank et al., 2001). Presenta un plan corporal simple compuesto de tres tejidos principales pólipos, mata estolonal y cavidad gastrovascular (Frank et al., 2001), siendo frecuentemente utilizado como modelo cnidario de investigación en ecología, biología del desarrollo, inmunología comparativa y genética molecular (Frank et al., 2001). Esta especie presenta un gran potencial como modelo biológico para evaluación toxicológica de agentes contaminantes debido a su plan corporal simple con una única cavidad gastrovascular, tipo de vida sésil y colonial, lo que facilita el contacto de xenobióticos con el organismo e incrementa la absorción de estos.
MATERIALES Y MÉTODOS
Cultivo y cuidados de H. symbiolongicarpus
El cultivo de H. symbiolongicarpus del Instituto de genética de la Universidad Nacional de Colombia se originó de una colecta en Woods Hole, Massachusetts (USA), entre los años 2009 y 2010. Fragmentos de 0,5-2 cm2 de colonias que crecían en las conchas ocupadas por los cangrejos ermitaños se explantaron a láminas de vidrios numeradas y se mantuvieron en su lugar con bandas elásticas para facilitar su adhesión natural a las láminas. Las bandas elásticas fueron posteriormente retiradas después de que las colonias se adhirieron a la lámina. Las láminas con el tejido se mantuvieron en cajas portaláminas de acrílico inmersas en acuarios de 10 a 35 litros con agua marina artificial (Agua Marina Artificial: AMA; Salinidad: ~1,023 g/L, pH: ~8,30, Temperatura: 18-22 °C, Sal: Instant Ocean Sea Salt http://www.instantocean.com). El AMA en los tanques se mantuvo recirculando con bombas de 150-300 Lt/h de poder. Los animales fueron alimentados ad libitum con nauplios de Artemia salina de 48 h post-eclosión tres veces por semana. Para los experimentos de exposición se usaron animales silvestres de H. symbiolongicarpus con los códigos de identificación HWB87 (dos réplicas), HWB29 (cuatro réplicas), HWB35 (cuatro réplicas) y HWB39 (cuatro réplicas).
Preparación de disoluciones de prueba de WBM para exposición
Se realizaron mezclas de AMA y LPPs tipo WBM 9:1 (Sil et al., 2012), el cual tenía la siguiente formulación para un volumen total de 350 mL: 0,22 % Goma de Xanthan (Producto: Duovis), 0,63 % Celulosa polianiónica (Producto: POLIPAC UL), 0,83 % Copolimero de ácido acrílico (Producto: IDCAP), 1,75 % inhibidor de poliaminas (Producto: Kla-Stop), 2,33 % DRILLZONE, 9,79 % NaCl, 12,63 % Barita, 89,28 % agua marina. La mezcla se dejó reposar por una hora hasta que se formaron la fase líquida (FL), la fase de suspensión particulada (FSP) y la fase solida (FS). Tanto la FL y FSP fueron decantadas y usadas como solución de prueba. A partir de la FL y FSP se realizaron ensayos de exposición en H. symbiolongicarpus al 100 % de concentración v/v y 50 % de concentración de v/v con AMA. El pH fue equilibrado con soluciones de NaOH y HCl a concentraciones de 1 M, 0,1 M y 0,01 M hasta llegar al pH de los acuarios (8,15 - 8,40).
Experimentos de exposición
Se realizaron dos experimentos de exposición a LPP, empleando como solución de prueba la FL y FSP obtenida de la mezcla de AMA con LPP en H. symbiolongicarpus, para identificar efectos adversos a nivel macroscópicos durante y después de la exposición. El primer experimento empleó el 100 % de concentración de la solución de prueba y dos horas de exposición continuas para observar los efectos adversos durante la fase de exposición. En el segundo experimento se empleó el 50 % de concentración de la solución de prueba con una mezcla adicional 1:1 AMA y LPP y 90 min de exposición continua, para la observación de los efectos adversos en la fase de recuperación luego de la exposición a los LPPs. La disminución en el tiempo de exposición y concentración se realizó para garantizar la supervivencia de las colonias durante todo el experimento, ya que la fase de recuperación se estableció hasta 72h después de la exposición. Para el primer experimento fueron empleadas dos réplicas de la colonia HWB87 (Tratamiento y Control). En el segundo experimento se decidió ampliar la cantidad de individuos y replicas para garantizar la estabilidad del fenotipo descrito. En total se utilizaron 12 réplicas de tres individuos diferentes HWB29, HWB35 y HWB39, cuatro por cada uno. Dos réplicas de cada individuo se utilizaron en el tratamiento y las otras dos réplicas de cada individuo fueron utilizadas para el control.
En ambos ensayos se determinaron cambios morfológicos y morfométricos a partir de imágenes tomadas antes del inicio del experimento, durante el tiempo de exposición cada 10 a 15 min y después de la exposición únicamente en el segundo experimento a las 24 h, 48 h y 72 h con un estereomicroscopio Carl Zeiss® Stemi 2000C acoplado a una cámara AxioCam® Erc 5s. Las imágenes fueron procesadas con el programa Adobe® PhotoShop™ CS3, para las mediciones morfométricas de área de la colonia, diámetro de los pólipos, longitud de los tentáculos (Fig. 1) y cuantificación de número de pólipos por colonia. El diámetro de los pólipos se midió en cinco pólipos por imagen seleccionados de forma aleatoria, mientras que la longitud de los tentáculos se midió sobre diez tentáculos de cinco pólipos diferentes por colonia, con la condición de que los tentáculos se encontraran en posición perpendicular al eje del pólipo o posición paralela a la mata estolonal para poderlo medir desde la base hasta el punto más distal (Fig. 1). Cada fotografía fue escalada de pixeles (Pixeles por pulgada, ppi) a distancias métricas (mm) usando papel milimetrado en el fondo, para prevenir errores en el cálculo y mejorar la normalización de las comparaciones estadísticas.
Análisis estadísticos
A los conjuntos de datos se les realizaron pruebas de normalidad y homocedasticidad para determinar el tipo de pruebas estadísticas a utilizar. Se realizaron comparaciones pareadas de medias entre el control y tratamiento mediante pruebas T-Student y pruebas de Fisher en los casos en que se cumplía con los supuestos de normalidad y homocedasticidad (Pruebas Lillie Fors y Bartlett), de lo contrario se aplicaron pruebas de U-Mann Whitney y rangos de Wilcoxon cuando los grupos no presentaban normalidad, para determinar la significancia estadística entre los grupos de comparación.
Los datos morfométricos fueron graficados en el programa R versión 3.0.1 (Ripley, 2001) con el paquete gráfico Beanplot (Kampstra, 2008), el cual gráfica la distribución de los datos con suavizado Gaussiano y SJ-dpi, mostrando las líneas de promedio general y por grupos.
RESULTADOS
Cambios morfológicos y morfométricos durante la exposición a WBM
Diferencias altamente significativas y efectos adversos fueron evidenciadas en la exposición hiperaguda a WBM en colonias de H. symbiolongicarpus (Fig. 2). El registro fotográfico evidenció un aumento en la circunferencia y rigidez de los pólipos, retracción de los tentáculos con respecto al estado inicial, inmediatamente después del contacto de las colonias a WBM, como se observa en la imagen (Fig. 2a). Esas condiciones se mantuvieron durante todo el tiempo de exposición que abarco un total de 2 horas y en ningún momento los pólipos de las colonias expuestas cambiaron de posición o forma a la registrada previo a la exposición. Una vez identificado este efecto de hinchazón de los pólipos y retracción de los tentáculos, se midió el diámetro de los pólipos y la longitud de los tentáculos antes y durante el tiempo de exposición para determinar si los cambios eran estadísticamente significativos (Fig. 2b).

Figura 2 Resultados morfológicos y morfométricos a la exposición hiperaguda de WBM en colonias de H. symbiolongicarpus. (a) Imágenes de colonia control (Imagen superior, flechas de color negro) y colonia expuesta (Imagen inferior, flechas de color gris) a los 30 min de exposición a 100 % de FSP de WBM. Las flechas permiten enfocar los cambios en los pólipos seleccionados, notando una clara diferencia morfológica entre las condiciones de tratamiento. (b) Comparación de valores morfométricos para longitud de tentáculos (Gráfica superior, n = 160) y diámetro de pólipos (Gráfica inferior, n = 80) antes de la exposición (Pre-Exposition) y durante la exposición (Exposition). Las distribuciones de datos de color negro corresponden al control, mientras que las distribuciones de color gris corresponden al tratamiento. Las líneas punteadas muestran la media general de todos los datos; mientras la línea sólida en cada gráfica de distribución corresponde a la media grupal. Para ambas mediciones fue posible determinar diferencias altamente significativas cuando las colonias estaban expuestas a WBM, utilizando pruebas de significancia T-Student, Fisher, U-Mann Whitney y rangos de Wilcoxon (Significativo * p < 0,05, muy significativo ** p < 0,01 y altamente significativo *** p < 0,001).
Los resultados de comparación de medias para ambas mediciones morfométricas fueron altamente significativos (Longitud de tentáculos p= 3,51 e-14; diámetro de pólipos p = 1,89 e-18) y se pudo constatar con el posicionamiento de la media del grupo tratamiento con respecto al control y la media de mismo grupo antes de iniciar la exposición (Fig. 2b). En el tiempo 0 (pre-exposición), los valores de medias para el control y tratamiento en la longitud de los tentáculos y diámetro de pólipos estuvieron cercanos a los 0,2 mm (200 pm). En contraste durante el tiempo de exposición, las colonias expuestas mostraron un incremento hasta de 0,3 mm (300 pm, 1,5 veces mayor al estado inicial) para el diámetro del pólipo y una disminución cercana a los 0,05 mm (50 pm, una reducción del 75 % con respecto al estado inicial) en la longitud de los tentáculos para las medias respectivamente. Este primer conjunto de datos refleja que los lodos de perforación tipo WBM pueden generar efectos adversos inmediatos en altas concentraciones con afectación en tres aspectos fundamentales de las colonias de H. symbiolongicarpus que son hinchazón e inmovilidad de pólipos y retracción de tentáculos disminuyendo la supervivencia de las colonias expuestas.
Cambios morfológicos y morfométricos post-exposición a WBM
El segundo experimento se realizó con colonias más pequeñas, menor tiempo de exposición y la mitad de la concentración usada durante el primer experimento para observar si existen efectos adversos post-exposición (o fase de recuperación) en las colonias hasta las 72 h después del contacto con WBM. Los resultados mostraron diferencias significativas a las 72 h post-exposición en las medidas relacionadas con la biomasa de las colonias (Fig. 3). El primer efecto adverso apreciable en las colonias fue una reducción en el área total de la mata estolonal cuando se compararon las colonias control con las colonias expuestas. La colonia control llegó a perder un 12 % de área (de 28 mm2 a 25,1 mm2) al término del experimento (72 h), mientras en la colonia tratada la reducción fue de 40 % (de 24,9 mm2 a 14,8 mm2) al término del experimento (Fig. 3a). El conteo de pólipos por colonia mostro una disminución significativa en las colonias expuestas. En las imágenes mostradas, la colonia control tenía inicialmente (0 min) 22 pólipos, los cuales aún eran visibles y viables 19 al finalizar el experimento (72 h), teniendo sólo una de pérdida tres pólipos (14 %). En contraste, la colonia expuesta presentó una disminución de pólipos del 50 % (18 pólipos iniciales a los 0 min, nueve pólipos sobrevivientes a las 72 h postexposición), siendo mucho mayor la pérdida de pólipos con respecto al control (Fig. 3a).
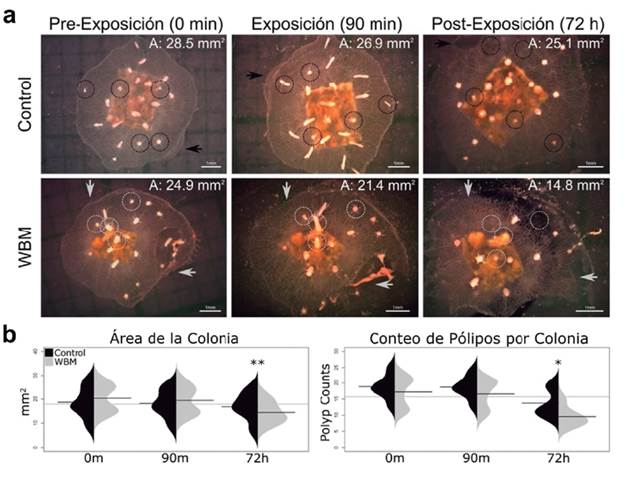
Figura 3 Resultados morfológicos y morfométricos a después de la exposición hiperaguda de WBM en colonias de H. symbiolongicarpus. (a) Imágenes de colonia expuesta (Imágenes inferiores, flechas y círculos de color gris) y colonia control (Imágenes superiores, flechas y círculos de color negro) a los 0 min, 90 min (tiempo máx. exposición a WBM) y 72 h (Tiempo máx. de recuperación después de los 90 min de exposición a WBM) a 50 % de FSP de WBM. Las flechas permiten ubicar el posicionamiento de la colonia en el campo fotográfico, mientras los círculos punteados indican el seguimiento de los pólipos a lo largo del tiempo. La exposición a WBM genera una disrupción en los tejidos (mata estolonal y disminución en la cantidad de pólipos), haciendo que se pierda las condiciones iniciales de salud en la colonia. (b) Comparación de valores morfométricos para área de la colonia (Gráfica izquierda) y cantidad de pólipos por colonia (Gráfica derecha) antes de la exposición (0 min), durante la exposición (90 min) y después de la exposición (72 h). Se emplearon pruebas de significancia T-Student, Fisher, U-Mann Whitney y Rangos de Wilcoxon, con un n = 12. (Significativo * p < 0,05, muy significativo ** p < 0,01 y altamente significativo *** p < 0,001).
Al comparar las medias para los valores morfométricos de todas las colonias empleadas (n = 6 control, n = 6 tratamiento) del área de la colonia y cantidad de pólipos por colonia, la primera medida mostró diferencias muy significativas (p < 0,01) a las 72 h post-exposición, mientras la segunda medida mostró diferencias significativas (p < 0,05) a las 72 h post-exposición (Fig. 3b). Las áreas de las colonias tenían una media inicial cercana a los 20 mm2, la cual se mantuvo hasta el final del tiempo de exposición sin mayores cambios (90 min). Al comparar con los valores de media al final del tiempo de recuperación 72 h (postexposición), la media de las colonias tratadas llego a estar cerca de los 10 mm2, mostrando cerca de un 50 % de reducción media de la mata estolonal, muy parecido a lo constatado en las imágenes (Fig. 3a). De igual manera ocurrió con la cantidad de pólipos por colonia (Fig. 3b), donde el valor de media inicial y al término del tiempo de exposición (0 y 90 min) estuvo alrededor de los 16 pólipos por colonia, mientras que al finalizar el tiempo de recuperación la cantidad media de pólipos sobrevivientes por colonia estuvo cercana a los ocho pólipos, siendo una reducción también cercana al 50 %. Estos análisis en el tiempo de recuperación (post-exposición) permiten generalizar que existe un efecto adverso a la exposición a WBM en las colonias de H. symbiolongicarpus, evidenciado en una pérdida de tejidos a nivel de pólipos y mata estolonal. Adicionalmente fue posible observar en el tiempo postexposición dos fenómenos, la presencia de pequeñas manchas rojas localizadas en el lugar donde anteriormente se encontraba un pólipo debido probablemente al proceso de degradación de este, y una deformación en los tentáculos en forma de "Z" y ligeramente retraídos (Fig. 4).
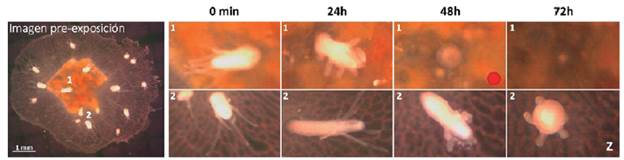
Figura 4 Observaciones adicionales morfológicas en pólipos individuales de colonia expuesta a WBM. (1) Pólipo que se va desintegrando pasadas las horas 48 h después de la exposición, donde se evidencia la presencia de una mancha roja (Izquierda superior del punto rojo). (2) Pólipo individual que refleja el cambio de la visualización elástica y suave de los tentáculos a las 24 h, hasta llegar a una retracción con formas rugosas similares a "Z" después de las 48 h y en 72 h. (Izq) Vista total de la colonia a 0 min antes de la exposición a WBM.
En conjunto, los resultados morfológicos y morfométricos establecen un patrón de efectos adversos "hiperagudos" durante el tiempo de exposición y agudos durante el tiempo de recuperación (72 h post-exposición). Los efectos adversos hiperagudos se resumen en retracción de los tentáculos, hinchazón de los pólipos y disminución de la movilidad sincrónica de la colonia evidenciada en la rigidez de los pólipos. Por su parte, los efectos adversos agudos en la fase de recuperación están generalizados hacia la pérdida de tejidos (pólipos y mata estolonal), deformación de los tentáculos y aparición de manchas rojas en los lugares donde se encontraban pólipos.
DISCUSIÓN
Diferentes cambios morfológicos y lesiones tisulares fueron descritas como efectos adversos a la exposición a la fase de suspensión particulada de WBM. Las alteraciones en las colonias fueron diferentes durante la fase de exposición y recuperación. Durante la fase de exposición, los efectos adversos fueron observados sobre los pólipos, mientras en la fase de recuperación los efectos adversos se observaron en la mata estolonal y pólipos, llevando en ambos casos a pérdida de biomasa.
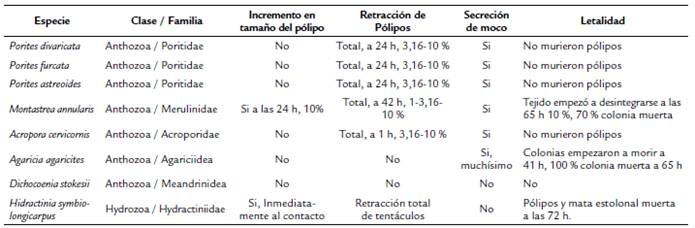
Experimentos de exposición realizados en otras especies de cnidarios, específicamente corales, reportaron efectos adversos similares a los registrados en H. symbiolongicarpus, tales como incremento en la circunferencia del pólipo, pérdida de tejido y muerte de colonias completas (Tabla 1) (Thompson Jr et al., 1980). Las especies M. annularis y A. agaricites mostraron un patrón fenotípico con muerte de tejido e incremento en la circunferencia del pólipo, este último sólo se registró en M. annularis, siendo un efecto adverso muy similar al observado en H. symbiolongicarpus (Tabla 1). La retracción de tejido fue una condición frecuente en las especies de cnidarios. En cinco especies fue posible ver una retracción total a una exposición del 3,16 % de concentración entre las 24 h y 48 h, mientras en A. cervicornis la retracción de los pólipos fue inmediata, similar a la retracción de tentáculos inmediata en H. symbiolongicarpus. Por otro lado, seis de los siete corales (Excepto D. stokesii) secretaron moco como parte de su respuesta fisiológica de estrés a la exposición por WBM, aunque este aspecto no fue observado en H. symbiolongicarpus.
Tabla 1 Cambios morfológicos reportados en siete especies de corales expuestas a WBMs en fase aguda hasta 96 h en concentraciones de 1 %, 3,16 % y 10 % (Thompson et al., 1980).
Experimentos de exposición de largo plazo (84 días) con el coral de aguas profundas Lophelia pertusa, evidenciaron patrones fenótipicos similares a los reportados en las especies de cnidarios mencionadas (Larsson et al., 2013). Con una exposición a 2,5 % mg/ml de WBM, la retracción de los pólipos fue del 80 %, la tasa de crecimiento disminuyó un 50 %, la secreción de moco incrementó en un 32 % y solo el 2,2 % de los pólipos murieron a los 84 días, causando efectos adversos crónicos parecidos a los observados en exposiciones agudas.
La evidencia y datos observados en las especies de cnidarios muestran que existe irritación tisular en exposición aguda y crónica a WBM. En otros invertebrados marinos como bivalvos fueron reportados afectaciones en órganos como gónadas y branquias, sistema digestivo en experimentos de larga duración con exposición continua a WBM (Cranford et al., 1999). En vieiras Placopecten magellanicus se observó un incremento del 20 % al 60 % de peso de tejido seco en las gónadas y un aumento exacerbado entre 200 % y 250 % del tejido seco del sistema digestivo después de 72 días de exposición (Cranford et al., 1999); en organismos de la especie Pecten maximus se observaron diferencias significativas y un incremento en el peso seco del sistema digestivo (no se reportaron valores exactos de peso), después de 21 días de exposición a WBM al 2 % de concentración (Bechmann et al., 2006). En los mejillones Mytilus edulis, el efecto adverso fue visualizado en branquias y células del sistema digestivo (Bechmann et al., 2006). Las células digestivas incrementaron su tasa de formación vacuolar, mientras en las branquias se observó una mayor cantidad de células mucosas (Bechmann et al., 2006). En organismos Vertebrados como los bacalaos Gadus morhua, los resultados microscópicos de las branquias mostraron varias anormalidades en el tejido epitelial de las larvas, como lo son engrosamiento de filamentos branquiales, malformaciones en los fi lamentos y presencia de aneurismas branquiales en exposición crónica a barita y WBMs (Bechmann et al., 2006). Por otra parte, a trabajadores de las plataformas petroleras se les ha caracterizado los riesgos ocupacionales si se exponen a WBM, los cuales incluyen irritación e inflamación en la piel, dermatitis, irritación en las mucosas entre otros síntomas relacionados a la exposición aguda (Broni-Bediako y Amorin, 2010).
Las alteraciones reportadas por exposición a WBMs en varios organismos animales de grupos taxonómicos variados muestran una generalidad en afecciones sobre tejidos y órganos de contacto como lo son, inflamación, irritación y procesos de desintegración tisular en los casos más severos tanto en fases crónicas como agudas de exposición. Particularmente, los tejidos sobre los que se observan las alteraciones son de tipo endoteliales, como en el caso de los cnidarios que son organismos con una alta proporción de endotelios, el sistema digestivo de moluscos o las branquias en peces, sin dejar de lado la irritación en los tejidos de mucosas en humanos. También fue posible observar niveles de letalidad en organismos coloniales, donde la perdida de pólipos y por lo tanto de biomasa fue algo generalizado, en los casos donde la dosis de exposición a WBM fue alta, como los reportados en este documento.
CONCLUSIONES
Se establecieron efectos adversos por exposición hiperaguda de los lodos de perforación petrolera base agua (WBM) en H. symbiolongicarpus. Las observaciones morfológicas fueron constantes durante los experimentos y se caracterizaron por una retracción de los tentáculos y engrosamiento de los pólipos durante la fase de exposición, perdida de tejidos a nivel de la mata estolonal y reabsorción de los pólipos en la fase de recuperación, acompañado de una malformación de los tentáculos y aparición de masas o puntos rojos en la mata estolonal. Los resultados morfométricos fueron consistentes con las observaciones morfológicas y mostraron significancia estadística en las comparaciones con el control. Las distancias de longitud del tentáculo y diámetro del pólipo validaron las observaciones morfológicas de retracción de los tentáculos y engrosamiento del pólipo, además la medición de área total de la mata estolonal y conteo de pólipos por colonia también evidenciaron la pérdida de biomasa. Los efectos adversos fueron consistentes con las reportadas en diversos organismos expuestos a WBM (Bechmann et al., 2006; Edge et al., 2016; Thompson Jr et al., 1980), como lo son la retracción de tejidos, la irritación tisular y disminución de la biomasa. Adicionalmente, es importante destacar el potencial de H. symbiolongicarpus como modelo biológico para realizar pruebas de agentes contaminantes en ecosistemas marinos con efecto tóxico en los organismos, debido a su simplicidad en el plan corporal y cultivo bajo condiciones de laboratorio. Estas características permitieron mejorar los parámetros de exposición con mezclas completas de prueba de WBM, ampliar el área total de exposición en tejidos biológicos a WBM, los cuales son básicamente epitelios, facilitando mecanismos de absorción de los xenobióticos y mejorar las probabilidades de observación de efectos adversos.
















