INTRODUCCIÓN
Las plantas están permanentemente expuestas a microorganismos. En un entorno natural, los patógenos exitosos son la excepción, ya que la mayoría de las plantas son resistentes a la mayoría de las especies de patógenos. Esta resistencia puede explicarse mediante dos líneas principales. La primera de ellas incluye la presencia de barreras constitutivas o preformadas, tales como la presencia de cutícula, exudados, ceras, látex, tricomas, pared celular, péptidos antimicrobianos y metabolitos secundarios preformados (Heath, 2000; Ham et al., 2007). La segunda línea de protección comprende las respuestas inducibles, que dependen del reconocimiento del patógeno, el cual es mediado por dos grandes familias de receptores de plantas. Los PRRs (del inglés, Pattern Recogntion Receptors) reconocen moléculas conservadas presentes en patógenos potenciales, que reciben el nombre de P/MAMPs (del inglés Pathogen/Microbial Associated Molecular Patterns). Este reconocimiento activa una respuesta temprana y de baja intensidad, pero de amplio espectro, conocida como PTI (del inglés PAMPs Triggered Immunity) (Cook et al., 2015). Los PRRs son receptores extracelulares que poseen un dominio LRR (del inglés Leucine Rich Repeats) extracelular y un dominio quinasa intracelular (Peng et al., 2018). Estas proteínas se conocen como RLKs (del inglés Receptor Like Kinases). Otros PRRs tienen un dominio LysM extracelular y se denominan RLPs (del inglés Receptor Like Proteins). Los PAMPs son moléculas fundamentales para la viabilidad del patógeno, están ampliamente distribuidos, tienen bajos índices de evolución y están altamente conservados (Saijo et al., 2018). La PTI involucra la activación de cascadas de MAP quinasas, deposición de callosa, producción de isotiocianatos y glucosinolatos, camalexina, especies reactivas de oxígeno (ROS, del inglés Reactive Oxygen Species) y la inducción de la expresión de genes relacionados con la patogénesis (PR, del inglés Pathogenesis Related) (Peng et al., 2018). Durante la evolución, los microorganismos adaptados lograron evadir el reconocimiento o suprimir los mecanismos de defensa, permitiendo su multiplicación en especies particulares de plantas hospederas. Los patógenos adaptados dependen de proteínas efectoras, que conducen a la susceptibilidad activada por efectores (ETS, del inglés Effector Triggered Susceptibility) (Ma et al., 2018). El segundo grupo de receptores se conoce como proteínas de Resistencia (R), las cuales reconocen y activan la ETI (del inglés Effector Triggered Immunity). Las proteínas R reconocen de manera específica los efectores, que reciben en este caso el nombre de proteínas de Avirulencia (Avr) (Monteiro et al., 2018). La respuesta ETI se sobrelapa con las respuestas activadas por la PTI pero es más fuerte y en la mayoría de los casos se asocia con una HR (del inglés Hypersensitive Response) (Peng et al., 2018). La mejor situación para el control de enfermedades de las plantas es introducir en las variedades comerciales genes que confieran resistencia duradera y de amplio espectro, lo cual se puede conseguir utilizando genes implicados en la resistencia no-hospedero. La transferencia de este tipo de genes de una especie a otra se ha reportado con éxito en maíz (Zhao et al., 2005), avena (Lorang et al., 2012) solanáceas (Lacombe et al., 2010) y cítricos (Citrus sinensis) (Mendes et al., 2010). Sin embargo, el primer paso para lograr este objetivo es determinar si la resistencia no hospedero, está mediada por barreras constitutivas o por respuestas inducidas.
La yuca, Manihotesculenta Crantz, es el cuarto cultivo más importante después del arroz, el trigo y el maíz como fuente de calorías. Las raíces de yuca son consumidas por más de mil millones de personas en el mundo (FAO, 2013). El almidón de yuca no sólo es importante para el consumo humano, sino que también tiene un amplio espectro de usos en diferentes industrias, haciendo que la yuca sea importante no sólo para la seguridad alimentaria sino también para la economía de los países en desarrollo (Ziska et al., 2009). Diferentes plagas y enfermedades afectan la yuca (McCallum et al., 2017). La bacteriosis vascular de la yuca (CBB, del inglés Cassava Bacterial Blight) es la principal enfermedad bacteriana que compromete la producción de yuca. El agente causal es la bacteria gram-negativa Xanthomonas phaseoli pv. manihotis (Xpm) (López y Bernal, 2012), la cual previamente era denominada Xanthomonas axonopodis pv. manihotis (Constantin et al., 2016). Esta enfermedad inicia con el establecimiento del patógeno en las hojas de la planta durante la temporada de lluvias (Boher y Verdier, 1994). El patógeno pasa por una fase epífita en las partes aéreas de la planta para posteriormente penetrar a través de estomas y heridas e iniciar la fase de desarrollo intracelular en el mesófilo para luego colonizar el tejido vascular (López y Bernal, 2012). Aunque existen algunas variedades resistentes, los agricultores no las han adoptado debido a que, en algunos casos, sus rendimientos son bajos y no poseen óptimas cualidades culinarias (López y Bernal, 2012).Xpm es un patógeno muy diverso y, en consecuencia, es necesario desarrollar estrategias para incorporar diferentes fuentes de resistencia. La planta modelo Arabidopsis constituye un excelente recurso para identificar potenciales genes no-hospedero que podrían transferirse a la yuca. En este trabajo se caracterizó la respuesta no-hospedero de Arabidopsis a Xpm con el fin de identificar si esta depende de la presencia de barreras estructurales preformadas o si es producto de la activación de una respuesta de inmunidad.
MATERIALES Y MÉTODOS
Bacterias
Los diferentes aislamientos de Xpm fueron crecidos en medio YPGA (5 % de levadura, 5 % de peptona, 5 % de glucosa y 15% de agar) a partir de stocks a -80° C. Las bacterias se incubaron a 28 °C durante 48 h. Para cada cepa, se tomó una colonia aislada y se transfirió a medio cuatro semanas de edad por punción o por infiltración (Meyer et al., 2005). Las plantas se inocularon con Xpm531, Xpm318 y Xpm681. Como controles, se inocularon plantas con MgCl2. Las plantas se mantuvieron a alta humedad durante el experimento. Las hojas se colectaron dos y cuatro horas después de la infección (hpi), luego se sumergieron en solución DAB (3,3 - Diaminobenzidine Liquid Substrate System, Sigma®) durante ocho horas. La reacción se detuvo con agua destilada y se almacenó en etanol al 96 %. Este experimento se realizó por triplicado.
Crecimiento bacteriano en Arabidopsis
Las plantas Col-0 se inocularon con las cepas Xcc6185, Xcc8004, Xpm531, Xpm318, Xpm681 y control (10 mM de MgCl2). Se inocularon tres hojas por planta en tres repeticiones biológicas diferentes, con una suspensión bacteriana de OD600nm = 0 , 2 (1x1 05 CFU / mL). Las plantas se inocularon por punción (Meyer et al., 2005). Todo el tejido se recolectó a los 0, 1, 3, 5 días después de la inoculación (dpi) y se maceró en 100 μl de MgCl2 10 mM estéril. Una vez macerado, el volumen se ajustó a 1 ml con MgCl2. Se realizaron diluciones seriadas con la muestra homogeneizada (100 μl en 900 μl de MgCl2) y se sembraron 10 μl por triplicado para cada dilución en placas de Petri con medio YPGA. Las muestras se incubaron a 28 °C durante 48 horas y las colonias se contaron para aquellas diluciones en las que era posible reconocer de 1 a 30 colonias.
Análisis estadístico
El análisis estadístico se realizó utilizando el software R 3.1 para evaluar los datos de cuantificación bacteriana. Se realizó la prueba de Spearman y la normalidad de los datos fue corroborada por la prueba de Shapiro Wilk. Para determinar la relación entre los parámetros evaluados (bacterias y días después de la inoculación), se realizó la prueba de aditividad líquido YPG, se incubó a 28 °C y 250 rpm durante 18 h antes de la inoculación. El inóculo líquido se centrifugó a 6000 rpm durante 5 minutos y se resuspendió en MgCl2 10 mM. La suspensión bacteriana se calibró a OD600nm = 0,2, correspondiente a 1x105 CFU / mL. Se emplearon dos cepas de Xanthomonas campestris pv. campestris (Xcc): Xcc6185, la cual es virulenta en el ecotipo de Arabidopsis Col-0, y Xcc8004, la cual es avirulenta en el ecotipo Col-0 (Meyer et al., 2005). Tabla 1. Las bacterias se aislaron en medio YPGA y la preparación del inóculo se realizó como se describe para las cepas Xpm. Las cepas de Xpm seleccionadas hacen parte del banco de cepas de Xpm del laboratorio y representan la diversidad de Xpm del Caribe Colombiano (Trujillo et al., 2014)
Tabla 1 Respuesta de diferentes ecotipos de Arabidopsis después de la inoculación con diferentes cepas de Xpm. Las plantas de Arabidopsis de diferentes ecotipos se inocularon con diferentes cepas de Xpm. El número indicado representa las hojas que muestran una HR sobre el total de hojas inoculadas. (-) Indica que no hay HR.
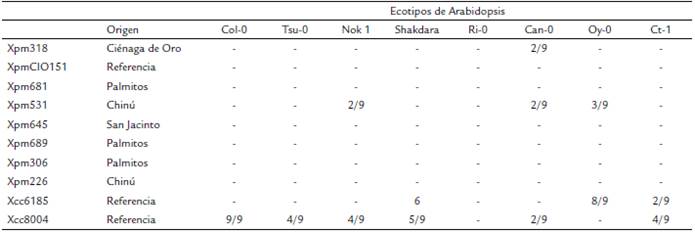
Las cepas de Xpm seleccionadas son representativas de la diversidad colombiana. Las cepas Xcc6185 y Xcc8004, en el el ecotipo Col-0 presentan una reacción de susceptibilidad y resistencia, respectivamente
Material vegetal e inoculación
Se emplearon ocho ecotipos diferentes de Arabidopsis thaliana: Columbia 0 (Col-0), Nok-1, Ct-1, Ri-0, Shakdara, Can-0, Oy-0 y Tsu-0. Las semillas se obtuvieron de la colección INRA - Versalles, Francia. Las plantas se cultivaron en una mezcla de turba y suelo con vermiculita en una proporción de 50:50. Las plantas se cultivaron en una cámara de crecimiento con un fotoperíodo de 12 h de luz / 12 h de oscuridad, a 26 °C día / 19 °C noche. Las plantas de cuatro a cinco semanas de edad fueron inoculadas con Xpm y Xcc por el método de punción (Meyer et al., 2005). Las plantas se mantuvieron a alta humedad mediante el uso de una cubierta de plástico durante 48 horas después de la infección. Después de la inoculación, se recolectaron tres hojas por planta y se emplearon tres plantas como unidad experimental.
Producción de ROS
Para evaluar la presencia de ROS en las hojas de Arabidopsis, se inocularon tres hojas de tres plantas de de Tukey y una prueba F para determinar la dependencia de los datos obtenidos de LogUFC en los parámetros de las bacterias y el día posterior a la inoculación. Se realizó un análisis de comparación de medias para evaluar la diferencia entre los datos obtenidos con diferentes bacterias y a diferentes tiempos post inoculación.
RESULTADOS
Arabidopsis no genera HR después de la inoculación con Xpm
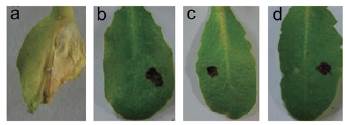
Con el fin de determinar la capacidad de Arabidopsis para inducir una HR después de la inoculación con Xpm, se inocularon ocho ecotipos diferentes de Arabidopsis con ocho cepas de Xpm por perforación de la vena principal de la hoja. Como control del experimento, se utilizaron las cepas Xcc6185 y Xcc8004, para las cuales el ecotipo Col-0 es susceptible y resistente, respectivamente (Xu et al., 2008). En todos los experimentos se observó el fenotipo esperado en el ecotipo Col-0 cuando las plantas se inocularon con Xcc6185 y Xcc8004 (Tabla 1). El ecotipo Ri-0 demostró ser resistente a Xcc6185, mientras que los ecotipos Tsu-0, Nok-1, Shakdara, Ct-1 fueron susceptibles a Xcc6185. Por otro lado, los ecotipos Tsu-0, Nok-1, Ri-0, Can-0 fueron resistentes a Xcc8004. Los ecotipos Shakdara y Oy-0 mostraron una HR contra Xcc8004. Con respecto a las inoculaciones con Xpm, ninguno de los ecotipos mostró una HR contra ninguna de las cepas evaluadas (Tabla 1; Fig. 1). Los ecotipos Nok-1, Can-0 y Oy-0 mostraron una respuesta de tipo HR cuando se inocularon con las cepas Xpm531 y Xpm318; sin embargo, esta respuesta no fue consistente en todos los experimentos, solo se observó en dos o tres hojas de un total de nueve evaluadas (Tabla 1).
Arabidopsis no produce ROS después de la inoculación con Xpm
Las plantas de Arabidopsis se inocularon por infiltración con las cepas Xpm531, Xpm318 y Xpm681. A las 2 hpi, se sumergieron en solución DAB y se evaluó la presencia de precipitado marrón en las hojas (Fig. 2). No se detectó producción de ROS después de la inoculación con Xpm. Este resultado planteó la posibilidad de que la no detección de ROS fuese producto del método de inoculación empleado. Para corroborarlo, las plantas se inocularon por punción, lo que genera una herida que conduce a la producción de ROS por sí misma. Cuando el experimento se realizó de esta manera, se observó una coloración marrón alrededor de los tres puntos de inoculación. Sin embargo, en presencia de Xpm, no se observó producción de ROS más allá del punto de inoculación (Fig. 2). Estos resultados sugieren que las plantas de Arabidopsis no generan ROS después de la inoculación con Xpm.
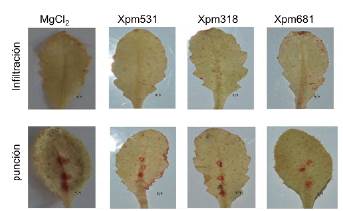
Figura 2 Evaluación de la producción de ROS en plantas de Arabidopsis ecotipo Col-0 después de la inoculación con diferentes cepas de Xpm. Se inocularon plantas de Arabidopsis (Col-0) mediante infiltración o punción con diferentes cepas de Xpm y se evaluó la producción de ROS mediante tinción con DAB. Se emplearon tres hojas por planta y tres plantas por cada experimento. Los números representan el número de hojas que presentaron el fenotipo observado en la figura.
Xpm no se multiplica en el tejido de Arabidopsis
Para determinar el crecimiento bacteriano de Xpm en Arabidopsis, las plantas se inocularon con las cepas Xpm531, Xpm318 y Xpm681, utilizando el método de punción. Del mismo modo, se realizó una inoculación con las bacterias Xcc6185 y Xcc8004. El tejido foliar se colectó a 0, 1, 3 y 5 dpi. Como se muestra en la Figura 3a, la cepa control Xcc6185 mostró un crecimiento constante con un pico a 5 dpi. En contraste, la cepa Xcc8004 mantuvo valores relativamente constantes presentando sólo un ligero aumento a 3 dpi y luego disminuyó a 5 dpi confirmando su avirulencia (Fig. 3b). La cepa Xpm531 mostró un pequeño aumento a 3 dpi, disminuyendo a 5 dpi (Fig. 3c). La cepa Xpm318 tuvo un bajo crecimiento a 3 dpi, seguido de una ligera disminución a 5 dpi (Fig. 3d). Finalmente, la cepa Xpm681 exhibió un comportamiento similar al de la cepa Xpm531, con un pequeño aumento a 3 dpi y una disminución a 5 dpi (Fig. 3e). En general, puede establecerse que, aunque para cada cepa de Xpm de manera individual se pueden observar pequeñas diferencias en el crecimiento a lo largo del tiempo estas no son estadísticamente significativas (Xpm631, p= 0,438, Xpm531, p= 0,348 y Xpm318, p= 0,214). Por otro lado, se confirmó que la cepa Xcc6185 se multiplica bien en el ecotipo Col-0, significativamente más que Xpm (diferencias estadísticamente significativas con un p valor = 0,011 a los 5 dpi). En conjunto, estos resultados permiten concluir que Xpm no puede multiplicarse en Arabidopsis y corroboran que esta planta es una especie no hospedera de Xpm.
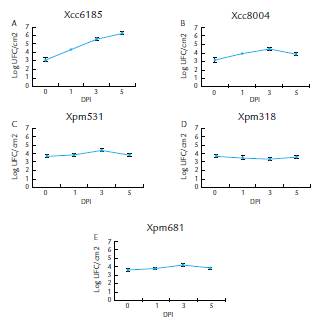
Figura 3 Cuantificación del crecimiento bacteriano de diferentes cepas de Xanthomonas en plantas de Arabidopsis ecotipo Col-0. Las plantas de Arabidopsis (Col-0) se inocularon con los controles (Xcc6185 y Xcc8004) y con las cepas Xpm531, Xpm318 y Xpm681 utilizando el método de inoculación por punción y el crecimiento bacteriano se evaluó a los 1, 3 y 5 dpi. Se emplearon tres plantas de Arabidopsis por cada cepa. Las barras de error representan la desviación estándar obtenida en la cuantificación del crecimiento a cada tiempo post-inoculación.
DISCUSION
La resistencia no-hospedero se define como aquella que presentan todas las variedades o ecotipos de una especie de planta a todas las variantes de un posible patógeno (Stam et al., 2014). Este tipo de resistencia puede explotarse como una importante fuente de resistencia. Sin embargo, es necesario primero comprender sus bases antes de ser empleada dentro de los programas de fitomejoramiento. El presente estudio tuvo como objetivo comprender las bases de la interacción no-hospedero entre Arabidopsis y Xpm. Hasta nuestro conocimiento este es el primer estudio enfocado a determinar el tipo de respuesta o interacción que se presenta durante la interacción entre Arabidopsis y Xpm. Las diferentes cepas de Xpm no pudieron crecer en plantas de Arabidopsis. Además, no se pudo observar la presencia de HR, ni la producción de ROS en plantas de Arabidopsis inoculadas con Xpm, lo que sugiere que las barreras preformadas constituyen un mecanismo clave en la resistencia no-hospedero de Arabidopsis a Xpm.
La resistencia no-hospedero puede darse ya sea por la presencia de barreras constitutivas o preformadas en la planta o por la activación de la PTI (Heath, 2000; Ellis et al., 2006). Aunque normalmente la PTI no es lo suficientemente fuerte como para inducir una HR, en algunos casos se ha asociado una HR o una respuesta similar a HR con la PTI o con la resistencia no-hospedero (Cook et al., 2015). En este trabajo, ninguno de los ecotipos de Arabidopsis mostró una respuesta HR a ninguna de las cepas de Xpm evaluadas; así como tampoco se observó crecimiento de Xpm en las plantas de Arabidopsis. La ausencia de HR sugiere que las plantas de Arabidopsis no están detectando Xpm. Sin embargo, no siempre que hay reconocimiento se da una HR (Mysore et al., 2004). Recientemente, se identificó un nuevo PRR que detecta un PAMP no caracterizado de Xanthomonas, el cual se ha denominado eMax (Jehle et al., 2013). Shakdara es un ecotipo de Arabidopsis que posee una mutación natural en eMax lo que hace que este ecotipo sea susceptible a Xanthomonas. Nuestros resultados muestran que Shakdara es resistente a diferentes cepas de Xpm. En un futuro será importante identificar el PAMP reconocido por eMax y establecer su presencia/ausencia en Xpm. Aunque en este trabajo no se observó una HR, no se excluyó la posibilidad de que otras respuestas de inmunidad pudieran activarse en Arabidopsis como consecuencia de la detección de Xpm. Una de estas respuestas implica la producción de ROS, los cuales se generan rápidamente una vez se ha detectado el patógeno (Bolwell et al., 1999). Sin embargo, en el presente estudio no se observó la producción de ROS en las hojas de Arabidopsis inoculadas con diferentes cepas de Xpm (Fig. 2). El empleo de otras metodologías más sofisticadas para la detección de ROS tales como ensayos empleando luminol pueden ser más sensitivos y cuantitativos (Albert y Fürst, 2017), lo cual valdría la pena explorar en futuros estudios para confirmar la no producción de ROS. Aún así, la ausencia de ROS observada en este trabajo respalda la premisa de que Xpm no supera las barreras preformadas en Arabidopsis y, en consecuencia, no se logra la inducción de las respuestas de inmunidad, como la producción de HR y ROS.
La ausencia de producción de HR y ROS en Arabidopsis, sustenta la hipótesis de que el mecanismo de resistencia no-hospedero de Arabidopsis a Xpm involucra barreras estructurales más que la inducción de una respuesta inmune. La resistencia no-hospedero de Arabidopsis a Xpm puede explicarse considerando diferentes aspectos. Primero, es posible que Xpm no encuentre en el tejido de Arabidopsis un nicho adecuado capaz de satisfacer sus requerimientos nutricionales y, por lo tanto, no pueda multiplicarse (Fig. 3). También es posible que Xpm no pueda superar algunas de las barreras físicas o estructurales presentes en Arabidopsis. Por otro lado, mientras que Xpm es un patógeno de una planta tropical, Arabidopsis es una especie nativa de zonas templadas, esto hace que bajo condiciones naturales sea poco probable que Xpm entre en contacto con Arabidopsis. Sin embargo, las bacterias Escherichia coli y Salmonella entérica, aunque no son patógenos de Arabidopsis y naturalmente sea poco probable que entren en contacto, si generan una activación de la PTI como consecuencia del reconocimiento de flagelina (Seo et al., 2012; García et al., 2014). Por esta razón podría ser posible que Arabidopsis también fuese capaz de activar una PTI frente a Xpm, lo cual no se evidenció en este trabajo.
CONCLUSIONES
La principal conclusión que se desprende de este trabajo es que la resistencia no-hospedero que presenta Arabidopsis frente a Xpm no implica la generación de HR, ni la producción de ROS y en consecuencia el mecanismo más probable que explica esta resistencia sea por la presencia de barreras estructurales o fisiológicas preformadas presentes en las células de la planta lo que previenen la proliferación y virulencia de Xpm.