INTRODUCCIÓN
El aumento del comercio y la conectividad mundial han generado nuevos espacios para la introducción de especies (Barriga, 2015), lo cual ha ocasionado impactos negativos en diferentes sectores como la salud pública, la economía y el sector productivo. Estas especies exóticas invasoras (EEI) suelen ser agresivas si no se controlan, se extienden y dominan los ecosistemas, reducen la biodiversidad autóctona (Kofodziejek, 2019) y perturban las funciones de los ecosistemas (Carlton et al., 2019; Doherty-Bone et al., 2019). Dentro del sector productivo, los agroecosistemas, como otros sistemas ecológicos, requieren de una elevada biodiversidad para mantener sus funciones. Sin embargo, también tienden a simplificarse ecológicamente (monocultivos), lo que los hace más susceptibles a las invasiones de especies exóticas que los sistemas naturales. Es por ello que las EEI pueden contribuir a un aumento de los costos de producción y, en algunos casos, pueden causar un alto costo en la producción agrícola. Incluso han desencadenado embargos comerciales bajo las reglas de la Organización Mundial del Comercio y deprimido los valores de los productos básicos (Herrera et al., 2016). Gran parte de las plagas agrícolas existentes son EEI que se introdujeron en algún momento durante los últimos 100 años (Guzmán y Poma, 2015).
Los efectos de las EEI son exacerbados por las perturbaciones de los ecosistemas y por las actividades antropogénicas que provocan fragmentación y degradación de los hábitats (Raghubanshi y Tripathi, 2009), así como por el cambio climático (Verlinden et al., 2014). Otros impactos en la producción de los agroecosistemas pueden resultar de la hibridación entre especies nativas e invasoras (Chaves, 2018; Urquía et al., 2019), la disrupción de depredadores y parásitos nativos, la extinción global de especies nativas y los procesos cambiantes del ecosistema (Altieri et al., 2007).
Las amenazas de las EEI en la agricultura mundial varían de acuerdo al país, la región, las características específicas de los productos básicos agrícolas y los patrones de comercio. En general, los mayores productores agrícolas (China y Estados Unidos) podrían experimentar el mayor costo absoluto de nuevas invasiones de especies (Paini et al., 2016). Sin embargo, los países en desarrollo, en particular los países del África subsahariana, parecen ser los más vulnerables. Además, China y Estados Unidos representan las mayores fuentes potenciales de especies invasoras para el resto del mundo, fundamentalmente en la región de Latinoamérica, que depende en gran medida del comercio con estas potencias (Paini et al., 2016).
Entre los países latinoamericanos Ecuador se destaca por su producción agrícola que representa una de las fuentes principales en su economía. Productos como el plátano, el cacao, las flores y el café constituyen los artículos principales de exportación del país. La invasión constante y sin control de EEI en Ecuador (e.g. Mauchamp, 1997) representa un problema grave ya que deja en una situación precaria a diversas actividades agrícolas y ganaderas, y genera problemas en la economía y seguridad alimentaria. Es bien conocido el impacto negativo que han dejado las EEI en los cultivos de café y las pérdidas de producción de regiones cercanas en Colombia (Sánchez et al., 2012), además, el impacto que generan las EEI ha sido reconocido en el Convenio sobre Diversidad Biológica (Sarandón, 2010), del cual Ecuador es signatario; en este convenio se propone el control y monitoreo de las EEI que amenazan los ecosistemas y las especies nativas. Sin embargo, a pesar del interés existente en esta problemática actual de invasiones biológicas en el país, solo se han realizado investigaciones y se destinan recursos para eliminar, mitigar y prevenir las invasiones en las Islas Galápagos (e.g. Kaiser, 2001; Buddenhagen, 2006; Causton y Sevilla, 2007; Rivas-Torres et al., 2018; Cimadom et al., 2019). Probablemente, estas islas estén expuestas a nuevas interacciones entre distintos grupos taxonómicos colonizadores (Guzmán, 2013; Causton et al., 2015) por el alto número de especies introducidas (Toral-Granda et al., 2017).
Por otra parte, la región continental Ecuatoriana carece de información sobre los efectos de las EEI en la diversidad de los ecosistemas. La gran mayoría de los trabajos solo reportan la presencia de estas especies (e.g. Cárdenas-Calle et al., 2019), pero carecen de la información necesaria para la prevención y el control de las invasiones biológicas. Tomando en consideración la alta biodiversidad del país, la dependencia del sector agrícola para el impulso de la economía y las afectaciones ecológicas y agrícolas por la incidencia de EEI, el presente estudio tuvo como objetivo predecir las distribuciones geográficas potenciales de las especies exóticas en Ecuador continental para identificar los agroecosistemas con riesgo de ser invadidos. Este estudio está en concordancia con los lineamientos e intereses gubernamentales expuestos en la Agenda 2017 del Instituto Nacional de Biodiversidad (INABIO, 2017) y cumple con las metas y necesidades de investigación identificadas para Ecuador.
MATERIALES Y MÉTODOS
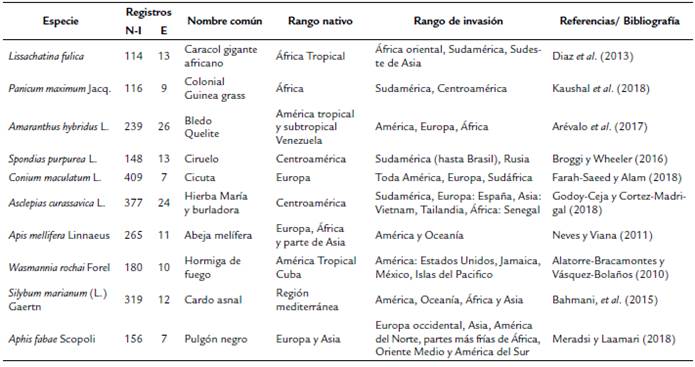
La investigación se realizó en Ecuador continental, situado en la costa noroccidental de América del Sur (01°30' N y 03°23,5' S; 75°12' W y 81°00' W). Se obtuvo una lista de las EEI presentes en el territorio mediante una revisión de la lista publicada en el Informe Final del proyecto "Digitalización de Datos de Especies Invasoras del Ecuador a Nivel Nacional y Regional" (Corporación Centro de Datos para la Conservación, Ecuador), el informe de Especies Exóticas Invasoras en Reservas de Biosfera de América Latina y el Caribe (Schüttler y Karez, 2008) y el Cuarto Informe para la Convención de Diversidad Biológica (MAE, 2010). Se buscó cada especie en las bases Global Biodiversity Information Facility (data.gbif.org) y TROPICOS (tropicos.org) para obtener registros (coordenadas geográficas) de la presencia de cada una de las especies en el rango nativo de su distribución y en las zonas de invasión en Ecuador y a nivel mundial (Tabla 1). De esta manera se obtuvo la mayor variabilidad de adaptación ambiental de las especies, para luego identificar los posibles sitios de invasión.
Tabla 1 Datos de las especies exóticas invasoras seleccionadas para la modelación del nicho ecológico en Ecuador continental. N-I: registros de presencia obtenidos en la región nativa e invadida a nivel mundial; E: registros de presencia en Ecuador.
Variables climáticas y de vegetación
Para la modelación del nicho climático de las EEI se usaron las 19 variables bioclimáticas disponibles en WorldClim 2.0 (Fick y Hijmans, 2017) y seis variables de vegetación y de contenido de agua en el suelo (DMP productividad de materia seca, FAPAR fracción de radiación fotosintéticamente activa absorbida, FCOVER fracción de vegetación verde, LAI índice del área foliar, NDVI índice de vegetación de diferencia normalizada, SWI índice de agua del suelo) obtenidas de Copernicus Global Land Service (Sánchez et al., 2015), con una resolución de 30 arc-segundos (~1 km2). Los valores de cada variable climática se extrajeron para cada localidad con presencia registrada de las especies en su región nativa y en las áreas que han sido invadidas a nivel mundial, con el uso de ArcGIS v10.1
Reducción de variables
Eliminar las variables predictoras altamente correlacionadas de los modelos de nicho ecológico puede aumentar el rendimiento del modelo (Cooper et al., 2016). Para este proceso de eliminación se utilizan varios métodos como los análisis de correlación, el Análisis de Componentes Principales (e.g. Dormann et al., 2013), combinación de métodos estadísticos (e.g. Ferrer-Sánchez et al., 2019) y el criterio de expertos (Fitzpatrick et al., 2013). Sin embargo, cuando se trabaja con numerosas especies invasoras, ecológicamente diferentes, resulta un desafío poder elegir correctamente las variables que mejor podrían representar sus distribuciones potenciales. Por ello, la reducción de variables en este caso, tuvo en cuenta los siguientes cuatro criterios: el primero consistió en modelar la distribución de las especies calibrando los modelos en la región nativa y de invasión mundial con todas las variables climáticas y transfiriéndolo a Ecuador. El segundo solo incluyó las variables de vegetación obtenidas del portal Copernicus Global Land Service. El tercero incluyó las variables (climáticas y de vegetación) de mayor aporte en los dos modelos anteriores. En este trabajo, el modelo se calibró únicamente con los registros de presencia de las especies en Ecuador y con las variables de mayor aporte a los primeros dos modelos. De esta forma se obtuvieron dos modelos, uno con datos obtenidos a nivel mundial (región nativa y de invasión) y el otro calibrado para Ecuador, que incluyeron las variables más significativas identificadas en los pasos previos.
De las variables que tuvieron mayor aporte al modelo obtenido por el tercer método (>50 % de forma individual o conjunta), se extrajeron sus valores en la región mundial y en Ecuador. Estos se compararon estadísticamente entre estas regiones con el uso de la prueba no paramétrica U de Mann Whitney.
Distribución geográfica potencial
Con las variables seleccionadas y los registros de presencia de cada especie, se calibraron los modelos mediante el algoritmo de máxima entropía (Maxent 3.4.1) (Phillips et al., 2018), el cual estima la idoneidad ambiental y la distribución potencial de las especies. Entre los algoritmos que usan solo datos de presencia, Maxent tiene muy buen rendimiento predictivo (Elith et al., 2011) y una gran solidez para tamaños de muestra pequeños (Wisz et al., 2008).
Se utilizaron los parámetros predeterminados de Maxent (autofeatures) incrementando a 5000 el número máximo de iteraciones en el algoritmo de optimización y se usó el 75 % de los registros de presencia como datos de calibración del modelo por especie y el 25 % como datos de validación (Peterson, 2003). Se utilizó una semilla aleatoria diferente para cada corrida del modelo, por lo que se realizó una partición aleatoria de los datos de calibración/validación y se utilizó un subconjunto aleatorio diferente de los datos de fondo en cada corrida.
Se obtuvieron dos modelos por cada especie. El primero fue calibrado en el área nativa y de invasión mundial y transferido a Ecuador, que se validó con registros nuevos e independientes de las especies en Ecuador. Un segundo modelo se calibró con los registros de presencia de las especies en Ecuador, para obtener su distribución geográfica potencial en esta región. La salida de MaxEnt se convirtió en un mapa binario que usó como línea de corte el minimun trainingpresence (Liu et al., 2013).
La contribución relativa de las variables a la predicción del modelo se analizó por el método Jackknife y por la estimación del porcentaje de contribución relativa de cada variable. Se consideró que las variables que más podrían contribuir al modelo serían las que al sumar su contribución, o de forma independiente, alcanzaran el 50 % de la contribución relativa (Peterson et al., 2003). La capacidad predictiva del modelo se evaluó con la curva ROC ("Receiver Operating Characteristic"). Como el AUC ("Area Under the Curve") es un indicador pobre de la precisión del modelo cuando no se utilizan datos de ausencia, se calculó además la modificación ROC parcial (Peterson et al., 2008) en el programa NicheToolBox (Osorio-Olvera et al., 2020) para evitar los problemas asociados a estas evaluaciones (Lobo et al., 2008). Se consideró un error de omisión del 5 % (Peterson et al., 2008).
Para evaluar el tipo de uso del suelo (agrícola, agropecuario, pecuario, áreas de conservación, forestal) y la extensión (km2) de los agroecosistemas que podrían ser afectados potencialmente por la invasión de las EEI, se usaron las cartas topográficas de uso del suelo a escala 1:50000 del Ministerio de Agricultura, Ganadería y Pesca de Ecuador (MAGAP). Se calcularon mapas de riqueza de EEI con la herramienta SDMToolBox de ArcGis 10.1. Esta herramienta permite sumar todos los mapas binarios de las especies evaluadas. De los mapas de uso de suelo se extrajeron los usos correspondientes a la agricultura y al agropecuario. A través de la superposición del mapa de riqueza de EEI con estos usos, se extrajeron las superficies de cada uso coincidentes parcial o totalmente con las zonas de presencia y de favorabilidad para la invasión potencial de un alto número de EEI. De esta manera se pudo evaluar la extensión de superficie (km2) que podría afectarse por la invasión potencial de EEI en diferentes agroecosistemas.
RESULTADOS
Los modelos de las diez EEI en la región nativa y de invasión mundial tuvieron un buen desempeño, con un promedio del AUC para los datos de calibración de 0.87 y 0.82 respectivamente (tabla 2). Aunque la distribución geográfica potencial de las especies sobrestimó el espacio geográfico con condiciones favorables para cada especie, el AUC parcial indicó un buen rendimiento de los modelos con un promedio AUCp = 1.56 ± 0.15 para los modelos transferidos a Ecuador y AUCp = 1.73 ± 0.11 para los modelos calibrados en Ecuador, significativo en todos los casos (p< 0,001) (Tabla 2).
Tabla 2 Rendimiento de los modelos de nicho ecológico para diez especies exóticas invasoras en Ecuador continental. AUCc: AUC para datos de calibración del modelo; AUCv: AUC para datos de validación del modelo.
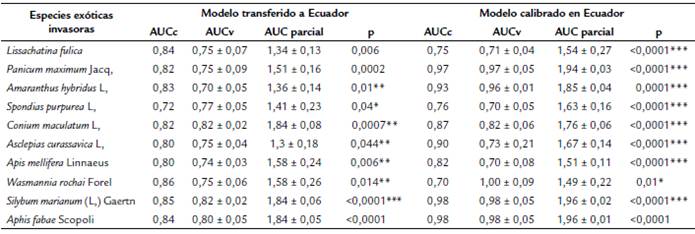
Los modelos calibrados con registros de presencia a nivel mundial indicaron que siete de las diez especies (Lissachatina fúlica, Panicum maximum Jacq., Amaranthus hybridus L., Spondias purpurea L., Asclepias curassavica L., Apis mellifera y Wasmannia rochai) encuentran condiciones ambientales favorables para la invasión potencial en >50 % del territorio de Ecuador continental (Fig. 1). Sin embargo, el modelo calibrado con registros de presencia en Ecuador indicó que las especies con mayor probabilidad de invasión potencial dadas las condiciones ambientales adecuadas serían L. fulica, S. purpurea L., W. rochai, A. mellifera y A. curassavica L. (Fig. 1). Analizando la coincidencia entre los resultados de ambos tipos de modelos se identificaron a estas últimas especies como las de mayor probabilidad de invasión potencial para la mayor parte del país.
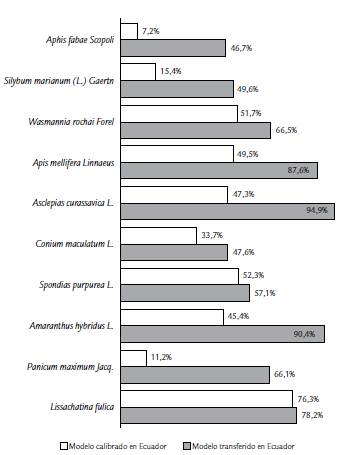
Figura 1 Extensión (km2) de la distribución geográfica potencial de diez especies exóticas invasoras en Ecuador continental. a) Resultados del modelo calibrado en el área nativa y de invasión mundial y transferido a Ecuador continental; b) resultados del modelo calibrado en Ecuador continental; (%) porcentaje que representa la extensión de las distribuciones respecto a la extensión de Ecuador continental (288 457 km2).
A través del análisis de superposición de mapas y tomando en cuenta la coincidencia de los modelos de las 10 EEI, de acuerdo al modelo calibrado en el área nativa y de invasión mundial, las regiones Costa (hacia el oeste) y Amazónica (hacia el este) se identificaron como los lugares con la mayor probabilidad de invasión de seis y siete especies respectivamente, considerando que son las áreas con las condiciones climáticas adecuadas para la coincidencia de las distribuciones geográficas potenciales (Fig. 2a). Sin embargo, a lo largo del pie de montaña se identificaron regiones donde coinciden los modelos de las diez EEI (Fig. 2a). Las provincias Esmeraldas, gran parte de Manabí, Guayas y Los Ríos en la región Costa, serían potencialmente las más afectadas. En la Amazonía, las provincias Sucumbíos, Orellana, Pastaza y Morona Santiago presentarían el mayor riesgo debido a la superficie con condiciones ambientales favorables para la invasión de múltiples especies. No obstante, numerosas provincias de Ecuador como Santo Domingo de los Tsáchilas y Pichincha, presentan elevado riesgo de invasión, pero en pequeñas áreas.
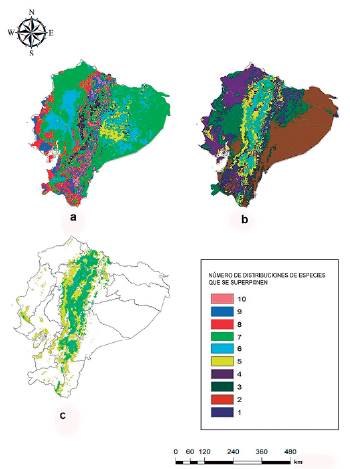
Figura 2 Traslape de las distribuciones geográficas potenciales de 10 especies exóticas invasoras en Ecuador continental. a) Distribuciones resultantes de los modelos calibrados en el área nativa y de invasión mundial, transferidos a Ecuador; b) distribuciones resultantes de los modelos calibrados en Ecuador continental; c) coincidencia entre ambos modelos de acuerdo con las áreas donde existe mayor superposición (>5) entre las distribuciones de las especies exóticas invasoras. Los colores indican el número de distribuciones de especies que se superponen en cada pixel.
En el caso del modelo calibrado en Ecuador continental, la suma de modelos que da la superposición de la distribución de las diez especies identificó a la región Sierra como el lugar con el mayor riesgo de invasión por cinco y seis especies (Fig. 2b), diferentes al modelo anterior. Las provincias Carchi, Imbabura, Pichincha, Cotopaxi, Bolívar, Tungurahua, Chimborazo, Cañar y Azuay presentaron el mayor riesgo de distribución potencial de las especies. Sin embargo, para ocho, nueve y diez especies no hubo coincidencias (Fig. 2b).
A partir del análisis de superposición del mapa de riesgo de invasión (riqueza de especies o coincidencia de las distribuciones potenciales de las especies) con el de cobertura agrícola de Ecuador continental, se identificó que la cobertura de suelo con probabilidad de ser afectada de acuerdo a los dos modelos sería la agropecuaria (Fig. 3). Esta cobertura presentó el mayor riesgo porque coincide con la distribución geográfica potencial de las diez especies. Para el modelo transferido a Ecuador se identificaron 39 662 km2 de cobertura agropecuaria que podrían ser afectados (Fig. 3a) y para el modelo calibrado en Ecuador continental se identificaron 8787 km2 (Fig. 3b). Ambos modelos coinciden en 14 966 km2 de superficie agropecuaria con riesgo de invasión por estas especies, principalmente hacia la región andina.
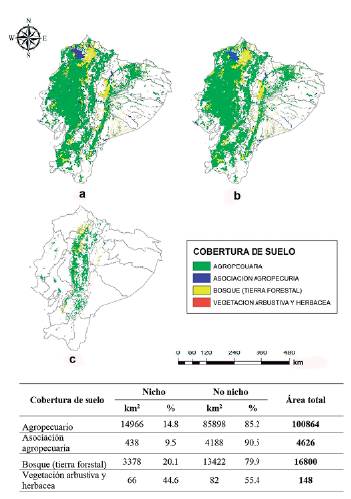
Figura 3 Distribución geográfica potencial de diez especies exóticas invasoras en la cobertura de suelo de Ecuador continental. a) Según el modelo transferido a Ecuador; b) según el modelo calibrado en Ecuador; c) según la coincidencia entre ambos modelos de acuerdo a las áreas donde existe mayor superposición (>5) entre las distribuciones de las especies exóticas invasoras.
Se identificó al sistema agropecuario como el agroecosistema más vulnerable a invasiones biológicas (Fig. 4). El sistema agropecuario mixto que integra los cultivos y la ganadería fue el más susceptible, con una superficie de riesgo de invasión de 17 347 km2 para el modelo transferido a Ecuador y el uso agrícola con 4107 km2 para el modelo calibrado en Ecuador. Ambos modelos coinciden en que 5562 km2 de uso agropecuario mixto podrían ser afectados potencialmente porque presentan condiciones adecuadas (Fig. 4), pero solo representan el 14 % de la extensión de este uso. El mayor porcentaje (34 %) de extensión con condiciones idóneas correspondió al uso agrícola-conservación y protección (Fig. 4).
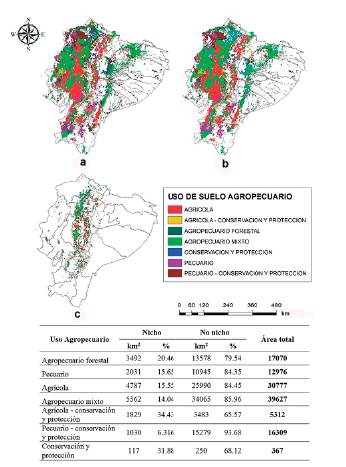
Figura 4 Distribución geográfica potencial de diez especies exóticas invasoras sobre el uso de suelo agropecuario en Ecuador continental. a) Según el modelo transferido a Ecuador; b) según el modelo calibrado en Ecuador; c) según la coincidencia entre ambos modelos de acuerdo con las áreas donde existe mayor superposición (>5) entre las distribuciones de las especies exóticas invasoras.
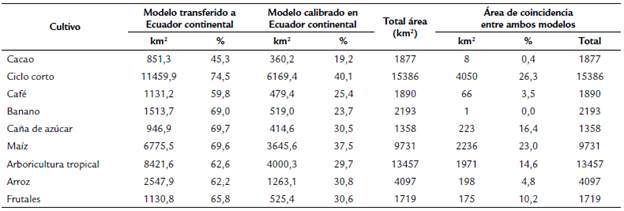
A través de la capa de descripción de actividades agrícolas se seleccionaron los cultivos más representativos, tomando como criterio principal el área de posible invasión y la importancia que representan estos cultivos para la economía del país. Para los dos modelos se identificaron los cultivos de ciclo corto como los que presentan más superficie (11 459,9 km2, 74,5 %; 6169,4 km2, 40,1% respectivamente) de tierra potencialmente favorable a invasión, ya que las condiciones climáticas son idóneas para que estas especies se distribuyan (Tabla 3). Los cultivos de banano, caña de azúcar y maíz también podrían sufrir afectaciones, dado que las condiciones favorables aparecen en el 69 a 69,7 % de su extensión (Tabla 3), para el modelo transferido a Ecuador continental.
DISCUSIÓN
Las especies Lissachatina fúlica, Conium maculatum L., Wasmannia rochai y Apis mellifera podrían invadir los agroecosistemas de Ecuador continental, estas especies probablemente no necesiten un control activo en la actualidad, pero deben monitorizarse utilizando herramientas ecológicas y socioeconómicas, y luego se les debe dar prioridad si comienzan a provocar impactos negativos. Lo anterior permitiria combatirlas desde su detección y no esperando a que se observen efectos negativos.
La especie L. fulica, habita en climas templados, zonas costeras, zonas agrícolas y bosques en general (Garcés-Restrepo et al., 2016), lo cual concuerda con lo observado en este estudio. Según los modelos existe una alta probabilidad de encontrar condiciones ambientales adecuadas en la región Costa, la cual presenta características similares a las halladas en los lugares donde se obtuvieron registros de presencia de esta especie en su área nativa y de invasión mundial y en algunas localidades de Ecuador. En este sitio las temperaturas van desde los 22 a los 28 °C y esta especie, de acuerdo a la temperatura media anual, se adecuaría mejor a temperaturas superiores a 25 °C. Además, existe una posibilidad de invasión potencial en las regiones Sierra y Amazonía de Ecuador, dado que las condiciones climáticas son favorables para la especie.
Lissachatina fulica se considera una plaga de alta prioridad en los programas de erradicación, ya que es transmisora de parásitos que pueden generar problemas neurológicos, respiratorios, hepáticos y estomacales en humanos. La enfermedad meningoencefalitis eosinofílica en humanos, causada por el helminto Angiostrongylus cantonensis, está asociada a la presencia de larvas infectantes del parásito en el caracol invasor (e.g. Hernández et al.,2020) y deja secuelas neurológicas en los pacientes. Además, este caracol afecta gravemente a los ecosistemas (Garcés-Restrepo et al., 2016), ya que compite con las especies autóctonas y destruye la vegetación al ser un herbívoro polífago que se alimenta tanto de los troncos como de los tallos, hojas, flores y frutos. Tiene una gran plasticidad fenotípica y logra desplazar, por su alta competitividad, al resto de los moluscos terrestres del ecosistema que invaden. A esta situación se suma que también puede actuar como un importante depredador de otros caracoles (Borrero et al., 2009) o puede contribuir de forma directa o indirecta a la extinción de diferentes especies de moluscos endémicos, como los de la familia Orthalicidae. Puede propagarse rápidamente e incurrir en daños sustanciales en un período corto si no hay una respuesta de gestión oportuna (Radosevich et al., 2007). Actualmente, es de alta prioridad su manejo en ecosistemas naturales para contrarrestar los efectos negativos que provoca.
Este caracol está incluido entre las 100 especies exóticas invasoras más dañinas del mundo (Lowe et al., 2004) y se identifica como una de las más nocivas de las regiones subtropicales y tropicales de Asia y el Pacífico (Yu et al., 2016). Por ello, es importante considerarla en programas de priorización para prevenir su posible invasión a las regiones amazónicas y costeras de Ecuador, donde podría provocar graves daños ecológicos y económicos, dadas las condiciones adecuadas de humedad y temperatura donde se desarrollan mejor las poblaciones de este molusco.
Conium maculatum L. se adapta a una gran variedad de climas y puede presentarse en bordes de caminos, ríos, cunetas, huertas abandonadas, en altitudes que llegan hasta los 1 400 msnm, por lo que su potencial de invasión, de acuerdo a estos resultados, se presentaría en la región Sierra. Asimismo, de acuerdo a otros estudios (e.g. Durán y Gómez, 2016), se ha reportado su presencia en plantaciones de trigo, maíz, cereales de grano fino y alfalfa en Argentina y otros países. Al ser una planta venenosa, la manipulación incorrecta por parte de los agricultores puede provocar problemas de irritación en la piel y en el caso de actividades ganaderas, el consumo por parte del ganado provocaría intoxicación (Durán y Gómez, 2016). Esto concuerda con nuestro análisis de agroecosistemas, donde los cultivos de ciclo corto como el maíz podrían ser afectados al encontrarse en ambientes con condiciones climáticas y de vegetación favorables para la invasión. Por ello, debe ser controlada y erradicada.
Wasmannia rochai habita en ambientes húmedos o secos y en zonas costeras. Algunos estudios la registran en plantaciones de cacao (Ulloa et al., 2012). En Ecuador continental, la invasión potencial de esta especie podría abarcar la región Costa, en provincias como Santo Domingo, Los Ríos y Esmeraldas, y en la región Amazónica. Además, los cultivos de ciclo corto podrían estar propensos a su invasión, así como el 60 % de los cultivos de cacao a nivel nacional (Ulloa et al., 2012).
Apis mellifera podría invadir áreas agropecuarias y cultivos agrícolas con condiciones ambientales favorables en la región Costa y Sierra. Esto podría afectar la producción de cultivos y los ingresos de muchos productores ya que A. mellifera es una especie muy agresiva y ahuyenta a otras especies polinizadoras más pequeñas, por lo que su presencia podría desestabilizar entornos naturales y agroforestales (Valladares, 2015) al disminuir la diversidad de polinizadores nativos. Es importante resaltar que su potencial de adaptarse a una gran variedad de climas y zonas donde exista suministro abundante de plantas con flores adecuadas (prados, áreas boscosas abiertas, jardines) incentiva a los productores de miel para distribuir esta abeja en muchas localidades donde naturalmente demoraría su ingreso o no podría llegar por factores limitantes de su expansión. Esto contribuye al éxito de colonización de la especie y a la rápida invasión de ecosistemas disímiles.
Las distribuciones potenciales de todas las especies analizadas comparten similitudes en cuanto a temperatura, precipitación, altitud e índices de vegetación. Sin embargo, hubo diferencias apreciables entre los resultados del modelo calibrado en la región nativa y de invasión mundial y el calibrado en Ecuador. Estas diferencias se pueden atribuir a la mayor variabilidad climática representada en las localidades de presencia obtenidas a nivel mundial, respecto a la menor cantidad de registros y menor variabilidad climática en el Ecuador. Por ello, y tratándose de especies invasoras, se considera que la mejor predicción se obtuvo a partir del modelo calibrado a nivel mundial.
Las variables más importantes para el rango nativo difieren de las identificadas en los modelos calibrados en Ecuador continental. Estas diferencias podrían atribuirse a que el nicho climático de las EEI no se ha conservado entre la región nativa y de invasión en Ecuador. Dicho aspecto tendría importantes implicaciones para la invasión, ya que las especies podrían tolerar nuevos climas y expandir su invasión más allá de las condiciones favorables conocidas en las regiones nativas (Halmy et al., 2019). Se conoce que para muchas EEI la similitud climática entre los rangos nativos y de invasión puede facilitar la invasión (Petitpierre et al., 2012; Obiakara y Fourcade, 2018). Esto se fundamenta en la teoría de "conservadurismo" del nicho, que indica que el nicho de una especie es constante en el espacio y el tiempo (Pearman et al., 2008) y predice que se requieren los climas que caracterizan el rango nativo de una especie para su expansión más allá del mismo (Bronneimann et al., 2012). Sin embargo, la expectativa del conservadurismo del nicho es compleja y los datos empíricos demuestran que pueden existir diferencias entre nichos climáticos nativos e invasores (e.g. restricción por factores bióticos como la depredación, la competencia y la limitación de dispersión, que resulta en la ocupación de una parte del nicho; Hutchinson, 1978). Cualquier alteración de estos factores bióticos puede producir un cambio en el nicho realizado (Tingley et al., 2014).
Varios estudios han documentado el conservadurismo de nicho de las poblaciones invasoras en relación con las poblaciones nativas (Peterson, 2011; Palaoro et al., 2013; Cunze et al., 2018). Sin embargo, crece la evidencia sobre cambios entre los nichos nativo e invadido (Tingley et al., 2014; Atwater et al., 2018) que repercute en la diseminación de las EEI dentro de los rangos de invasión, más allá de condiciones climáticas semejantes a las de su rango nativo, y que apoyan los resultados obtenidos en este estudio. Este tipo de análisis puede contribuir a la identificación de tendencias de poblaciones de EEI en sus rangos de invasión y de esta manera prevenir, mitigar y manejar las invasiones biológicas desarrollando estrategias formuladas bajo criterios científicos (Ørsted y Ørsted, 2019).
Se debe tener precaución con la interpretación de los modelos debido al grado de incertidumbre que puede ser intrínseco al método (Pearson et al., 2007). Pero de acuerdo con estos resultados, la recopilación de información realizada permitirá el desarrollo de estrategias preventivas en sitios que han sido identificados con un riesgo potencial de invasión por múltiples especies exóticas. Se podrían prevenir consecuencias negativas y muchas veces irreversibles en los agroecosistemas del país, si la información generada llega a las instituciones responsables de llevar acabo las estrategias preventivas, de mitigación y de control de las plagas y especies exóticas invasoras.
Aunque las especies invasoras se han mencionado como un problema en muchos estudios y documentos gubernamentales de Ecuador, han recibido poca atención en los planes de conservación y adaptación. Se espera que los resultados de esta investigación contribuyan a una estrategia nacional de gestión de EEI, al estar en completa concordancia con las prioridades de investigación identificadas recientemente en la meta 2, objetivo 2,5 de la Agenda Nacional de Investigación sobre la Biodiversidad (INABIO, 2017). Las actividades que se recomiendan a nivel mundial (Shrestha et al., 2019) y específicamente para Ecuador, según estos resultados, incluyen tres aspectos: 1) la producción y amplia difusión de materiales de educación comunitaria relacionados con la invasión biológica; 2) la cuantificación de los impactos de las especies a nivel nacional y de su costo económico en los medios de vida y en los agroecosistemas; y 3) un enfoque de manejo no limitado a las especies priorizadas por las comunidades agrícolas y dependientes de los bosques.
Una vez que se establecen las especies introducidas, su control o erradicación es difícil y probablemente muy costoso (Campbell et al., 2015). Las especies estudiadas ya se han establecido en Ecuador. En ausencia de control humano, se espera que estas especies continúen su propagación y aumento de las poblaciones, debido a la adaptabilidad, tolerancia ecológica y a la estrategia reproductiva exitosa que las caracteriza. Este potencial para una mayor expansión, junto con el estatus de plagas agrícolas en la mayoría de los casos, debe tenerse en cuenta al considerar el daño que pueden causar, particularmente en las extensas regiones agrícolas de Ecuador, donde se encuentran las principales producciones del país. Además, es importante destacar que ante los escenarios de cambio climático que se proyectan actualmente, estos efectos de las EEI pueden actuar sinérgicamente con el clima y exacerbar el problema para las producciones agrícolas. Esta situación afectaría adversamente la seguridad alimentaria y agravaría la desnutrición en América Latina, afectando a 5, 26 y 85 millones de personas en 2020, 2050 y 2080 respectivamente (Canales et al., 2006). De acuerdo con lo anterior, existe una necesidad urgente de iniciar un programa preventivo, de control y de erradicación de especies exóticas invasoras en Ecuador continental (e.g. Correoso, 2006), que funcione de manera eficiente y efectiva y que utilice un ejercicio de priorización para responder acertadamente al control de las especies más agresivas.
CONCLUSIONES
Tanto para el modelo calibrado en el área nativa y de invasión, como para el modelo calibrado de acuerdo a las condiciones climáticas de Ecuador continental, las especies cuya distribución geográfica potencial sobrepasa el 50 % de la extensión de Ecuador continental fueron Lissachatina fulica, Spondiaspurpurea L. y Wasmannia rochai. Las condiciones ambientales son apropiadas fundamentalmente en las provincias de la región Amazónica debido al bosque tropical lluvioso que le confiere una gran variedad de climas. Constituye así un área idónea para que muchas especies exóticas invasoras se puedan adaptar con relativa facilidad. Más del 50 % de la cobertura agropecuaria del país podría ser afectada por las especies Wasmannia rochai, Spondias purpurea L., Lissachatina fulica y Conium maculatum L. Estas especies mostraron una elevada probabilidad de invadir usos de suelo dedicados exclusivamente a labores agrícolas y agropecuario-mixtas, dentro de los cuales los cultivos agrícolas con mayor riesgo de afectación podrían ser los de ciclo corto como los cereales y otros cultivos para aprovechamiento textil como el algodón. Estos resultados deberán corroborarse en campo. Además, se debe poner más atención en los lugares donde aún no hay indicios de invasión para evitar futuros problemas ecológicos, económicos y sociales.