INTRODUCCIÓN
La osificación endocondral responsable de formar los huesos de los miembros y del esqueleto axial, utiliza al cartílago como elemento de anclaje que luego será reemplazado por tejido óseo (Mackie et al., 2011; Percival y Richtsmeier, 2013). El crecimiento del hueso endocondral progresa desde la proliferación, maduración e hipertrofia de los condrocitos, organizados en los centros de osificación, a la mineralización de la matriz cartilaginosa para formar un tejido óseo (García Hernández, 2007). El incremento de la densidad mineral ósea (DMO) en los huesos se asocia con la acreción de fosfato de calcio en forma de cristales de hidroxiapatita y depende de diversos factores intervinientes como genética, sexo, ejercicio, peso, y periodos fisiológicos del ciclo de vida, como particular e intensamente ha sido estudiado en los seres humanos (García Hernández, 2007). Por ello, a medida que progresa el proceso fisiológico de crecimiento y desarrollo óseo, los valores de DMO van aumentando debido a la mineralización de la matriz extracelular. Otro proceso fisiológico en el que se ven alterados los valores de DMO es el envejecimiento donde el recambio óseo resulta de un balance negativo con pérdida de masa ósea y consecuentemente disminución en la DMO. Si bien el tejido óseo es un tejido metabólicamente muy activo y dinámico, los valores de DMO en la adultez joven se mantienen en una placa homeostática, presentando valores estables. Estos valores también se ven alterados en ciertos procesos patológicos que puedan producir osteoporosis primaria o secundaria (Guyton, 2016).
La placa de cartílago metafisario se expande a través de la proliferación de condrocitos. La osificación de la matriz está precedida por la hipertrofia de los condrocitos en el eje medio prospectivo del hueso y por la deposición de un collar de hueso periosteal por los osteoblastos recientemente diferenciados que rodean el eje medio. Los vasos sanguíneos, osteoclastos, así como los precursores de la médula ósea y los osteoblastos, invaden el modelo desde el collar óseo y proceden a formar el centro primario de osificación. El centro primario se expande hacia los extremos del modelo de cartílago, a medida que los osteoclastos eliminan la matriz extracelular del cartílago y los osteoblastos depositan hueso en los restos de cartílago. Posteriormente se forma un centro de osificación secundario en cada extremo del modelo de cartílago, dejando una placa de crecimiento cartilaginoso entre los centros de osificación primaria y secundaria, así como los posibles cartílagos articulares permanentes en cada extremo del hueso (Kronenberg et al., 2003). La madurez esquelética se produce cuando el centro primario de osificación en expansión se encuentra con el centro secundario de osificación, lo que oblitera la placa de crecimiento (Ross y Pawlina, 2012; Berendsend y Olsen, 2015). La osificación endocondral comienza durante la vida fetal y continúa hasta el final del crecimiento en la adultez temprana (Ross y Pawlina, 2012; Berendsend y Olsen, 2015).
En el ser humano, son bien conocidos los procesos de crecimiento y desarrollo óseo, evidenciándose radiológicamente los núcleos de osificación primaria de los huesos largos entre los cinco y siete meses de vida, mientras que los núcleos de osificación secundaria se evidencian entre los siete meses y cinco años de vida, con gran variabilidad de aparición entre los distintos huesos y con variabilidad en torno al sexo, ya que este proceso ocurre generalmente antes en el sexo femenino. Desde los cinco a los 12 años los centros de osificación ya formados van creciendo, y, de los 12 a 20 años ocurre el periodo de fusión de las epífisis con las diáfisis de los huesos largos (Greenspan, 2007). En términos generales en los seres humanos entre los 18 y 20 años se alcanza la madurez ósea (Greenspan, 2007).
Al estudiar la biología del desarrollo de un mamífero, conocer el crecimiento y desarrollo de sus huesos largos se estudia un aspecto muy importante del desarrollo en general de esa especie. No es mucha la literatura que brinde información sobre los cambios que acontecen en el proceso de crecimiento y desarrollo de conejos y en particular de sus fémures (Thomsen et al., 1991; Lerner y Kuhn, 1997; Martiniaková et al., 2003). Numerosos experimentos de biología ósea y medicina regenerativa se han realizado utilizando como modelo experimental conejos, en particular en la línea NewZealand (CoNZ), previos a la implementación de protocolos en humanos, (Goy et al., 2012; Coletta et al., 2014; Cícero et al., 2017a; Coletta et al., 2017), lo que reafirma la necesidad de obtener información precisa al respecto. Dado que no existe información actualizada que describa en profundidad los estadios del desarrollo y crecimiento de CoNZ, el objetivo de nuestro estudio fue investigar al respecto, realizando análisis a niveles imagenológicos e histológicos.
MATERIALES Y MÉTODOS
Conejos hembras de la línea New Zealand (CoNZ), de dos semanas de edad, seleccionados aleatoriamente, se mantuvieron en jaulas individuales, con comida (Provife, Argentina), y bebida ad libitum, y se sacrificaron, a partir del primer mes posnatal, en tiempos mensualmente consecutivos: 1, 2, 3, 4, 5, y 6, obteniéndose post mortem 24 piezas femorales, cuatro por cada estadio de desarrollo, conformándose los grupos 1, 2, 3, 4, 5, 6, respectivamente. Todo el mantenimiento y sacrificio de los animales se realizaron acorde a proyecto acreditado en la facultad de Cs. Médicas, Universidad Nacional de Rosario, CUDI 5314/2018, resolución 6838/2019.
Obtención de las piezas femorales
Se realizó una ventana a modo de "libro abierto" en los planos superficiales del muslo, realizando una incisión longitudinal, en la cara medial del muslo, siguiendo la dirección del fémur. Luego se realizaron dos incisiones transversales a la primera incisión; la primera proximal a la unión coxofemoral y la segunda distal a la terminación de la articulación de la rodilla. Se prosiguió divulsionando el plano cutáneo-aponeurótico, hasta dejar al descubierto el plano muscular. Se continuó con la desarticulación de la rodilla, mediante la incisión de los ligamentos articulares, logrando así separar el muslo de la pierna. A posteriori se realizó una incisión profunda a nivel de la articulación coxofemoral, buscando cortar la capsula y los ligamentos coxofemorales, permitiendo la extracción del fémur y elementos musculares adheridos a él. Se divulsionó los laterales y se extrajo la totalidad del fémur con los elementos musculares de la región con sumo cuidado para no dañar la pieza ósea.
Las obtenciones de las piezas se realizaron entre los meses de julio y diciembre 2018.
Estudios radiológicos
Se tomaron radiografías de los fémures, mediante un equipo Dinar AF500 con revelado digital Carestream Directview. Como software de manejo de imágenes, se utilizó el programa de acceso libre: ImageJ 1.40 software (NIH, Maryland, USA) (Ryan, 1997; Schneider, 2012).
Determinación del ángulo de cuello femoral (af)
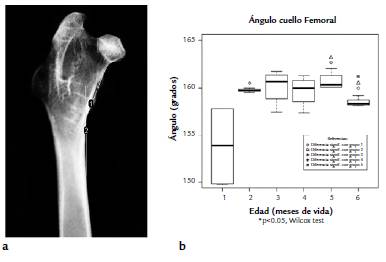
La determinación del ángulo del cuello femoral se realizó respecto al eje mayor óseo, mediante el trazado (ImageJ) de dos líneas guía, una paralela al eje mayor óseo y una segunda línea paralela al eje del cuello femoral (Fig. 1a). El valor de Af obtenido para cada pieza femoral se expresó en grados (°) entre ambas líneas guía.
Determinación de la longitud femoral (l)
La longitud femoral se midió en milímetros (mm), tras realizar con software (ImageJ) líneas limitantes perpendiculares en ambos extremos. La calibración fue realizada mediante la utilización de un patrón de calcio de longitud conocida (30 mm) (Thomsen et al., 1991; González Garamendi, 2009).
Determinación de la densidad mineral ósea (dmo)
La DMO, expresada en mg Ca/cm2, se realizó en distintas zonas, como sigue: 1) DMO total (DMOt), considerando el área total ósea (se toma como referencia toda la masa ósea del fémur); 2) DMO centro óseo (DMOco), determinado por la zona medial (centro morfométrico del hueso); y 3) DMO metáfisis femoral (DMOmf), comprende una zona de metáfisis femoral (considerando 6 mm2, a 1 mm por encima de unión del platillo de crecimiento metafisario). Para realizar las mencionadas determinaciones se utilizaron patrones de calcio de valores crecientes y conocidos: 0 mg Ca/cm2 (correspondiente al fondo de placa); 7,94 mg Ca/cm2; 18,72 mg Ca/cm2; 28,67 mg Ca/cm2; 40,73 mg Ca/cm2; 51,93 mg Ca/cm2. Mediante ImageJ se seleccionó un segmento que englobó a cada una de las áreas (sin incluir bordes óseos), y se asignó un valor que correspondió al promedio de intensidad de los pixeles en las áreas delimitadas (en imagen en blanco y negro la intensidad corresponde a un valor que ronda entre 0 -negro- y 256 -blanco-), este valor se ingresó en una tabla de Excel, para posteriores estudios estadísticos.
Mediante regresión lineal se compara el valor obtenido con el patrón de calcio de referencia. Para el análisis de datos se utilizó el software de acceso libre R de la R Foundation for Statistical Computing de Viena, Austria.
Estudios estadísticos
Para la comparación entre grupos se utilizó test de análisis multivariado no paramétrico de Wilcoxon, y corrección de Bonferroni. Los grupos se consideraron diferentes de forma significativa con un valor de p < 0,05.
Estudios histológicos
Se realizó un corte longitudinal de las piezas femorales, obteniendo así una muestra anterior y una posterior por cada fémur, teniendo en total cuatro muestras por animal estudiado. Se realizaron dos cortes sagitales y dos cortes transversales obteniéndose muestras menores a 3 cm de alto, 1 cm de ancho y 0,5 cm de espesor, de la región metafisiaria, que incluye tanto tejido óseo como cartilaginoso, del extremo distal del fémur.
Se colocaron las muestras en celdillas individuales, luego se descalcificaron en solución de ácido etilendiaminotetraacético (EDTA) al 10% pH 7, considerando distintos tiempos de descalcificación para las piezas en función de la etapa del desarrollo de cada una de ellas dada sus diferentes características. Las muestras se procesaron a posteirori acorde a procesos de deshidratación e inclusión en parafina convencionales (Beebe, 2000).
Se observó cartílago de crecimiento y tejido óseo cortical en áreas de 2 mm2, (2 mm de alto y 1 mm de ancho entre corticales diafisarias) observándose todas las zonas del cartílago de crecimiento. Las observaciones se realizaron con un microscopio óptico (Olympus, Japón) a 100 x, 200 x, 400 x y 1000 x de aumento. Se obtuvieron imágenes digitales con una cámara fotográfica adaptada (Olympus, Japón) y las mismas se analizaron con el software ImageJ 1.40 (Parfitt, 1987; Viguer, 1995), considerando las diferentes zonas histológicas acorde a lo previamente descripto en la literatura (Viguer, 1995; Mackie et al., 2008; Burdan, 2009; Villemure, 2009; Kierszenbaum, 2012a; Wongdee, 2012; Di Fiore, 2016).
RESULTADOS
Ángulo cuello femoral (af)
Se observaron diferencias significativas en las determinaciones de los ángulos de cuello femoral entre los grupos de dos meses (159,76) vs. un mes (153,85), (p < 0,05). El grupo del segundo mes no presenta diferencias significativas respecto al tercero, ni respecto a los grupos restantes. Nuestros resultados indican que las variaciones morfológicas ocurren durante le primer mes de vida, si bien existen leves tendencias de cambios posteriores, estos no revisten diferencias significativas en lo que respecta a la anatomía ósea. Los valores del ángulo del cuello femoral se observan en la figura (Fig. 1b).
Longitud femoral (L)
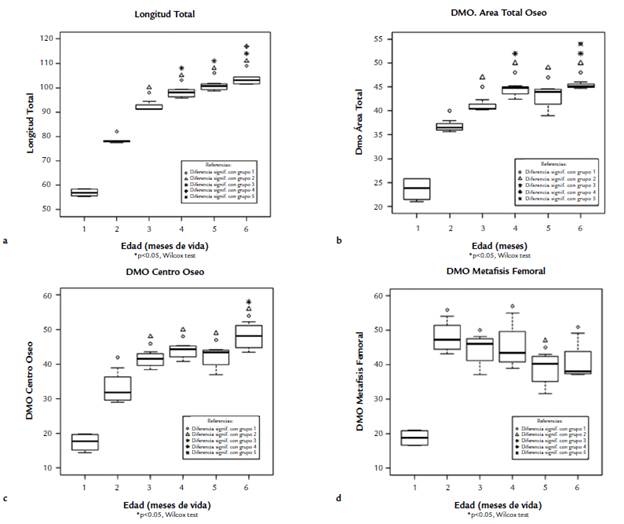
Se observaron diferencias significativas intergrupales de la longitud total de los fémures (L, mm) hasta los 4 meses postnatales (p < 0,01). Entre los grupos del cuarto (mediana: 98,03) y quinto mes (mediana: 100,65) no hubo diferencias significativas, si bien se encontró una diferencia entre el grupo del quinto mes (mediana: 100,65) respecto al sexto (mediana: 103,01). Los valores de L se observan en la figura (Fig. 2a).
Densidad mineral ósea (DMO)
Los resultados de las DMO se observan en las figuras (Fig. 2b-2d). Los valores de DMOt, mostraron incrementos significativos hasta el cuarto mes, y a partir de allí los cambios no fueron significativos (mediana grupo 4: 44,84; mediana grupo 5: 44,0; mediana grupo 6: 45,10). La DMOco incrementando mostró incrementos significativos hasta el tercer grupo, sin diferencias significativas entre el resto (mediana grupo 4: 44,33; mediana grupo 5: 43,38; mediana grupo 6: 48,17). La DMOmf mostró incrementos significativos del grupo 2 vs. grupo 1. Sin cambios significativos a partir de ese período (mediana grupo 3: 46,08; mediana grupo 4: 43,40; mediana grupo 5: 40,22; mediana grupo 6: 38,06).
Histología
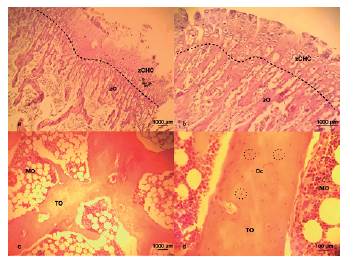
En los cortes histológicos del primer mes de desarrollo (Fig. 3a-3d) se observó cartílago metafisiario con características típicas del proceso de osificación endocontral. Se apreció una banda de zona de reserva con células progenitoras condroblásticas/condrocíticas (zR), de pequeño tamaño y escaso citoplasma formando agrupadas en grupos isógenos coronarios (GIC). Hacia proximal se evidenció una zona de proliferación (zP) muy abundante, también denominada cartílago seriado, con aumento de citoplasma y formando un gran número de grupos isógenos axiles (GIA). Las características de las zR y zP denotaron una gran actividad mitótica de células condrales. Luego se observaron condrocitos hipertrofiados formando la zona hipertrófica (zH) con un importante aumento del tamaño citoplasmático, seguidos de condrocitos hipertrofiados y calcificados formando así la zona de cartílago calcificado (zCC), en la cual se apreciaron las trabéculas directrices de osificación (TD). Se observó, contigua a la zCC, la zona de erosión (zE), donde se produce la progresión con la zona osteoide (zO). En los cortes de dos meses de desarrollo (Fig. 4a) se observaron las seis zonas de osificación endocondral, con una pequeña reducción de las zR, zP, zH, y aumento de la zO, mientras que las zCC y zE no se ven modificadas. En los cortes de tres meses de desarrollo (Fig. 4b-4d) se pudieron diferenciar también las seis zonas, con gran reducción de las zR, zP, zH, en especial zP, y aumento de zO. En particular se apreció una disminución de zR con extensa matriz extracelular, escasas células condrales y en la zP mayor tamaño de condrocitos con abundante citoplasma, denotando una menor tasa mitótica de la zR. En los cortes de 4 meses de desarrollo (Fig. 5a y 5b) no se logró diferenciar las zonas antes mencionadas, pero sí se observaron algunos remanentes de células condrales, pudiendo hallar una única zona de cartílago hipertrofiado y calcificado (zCHC). En los cortes de cinco y seis meses de desarrollo (Fig 5c y 5d, respectivamente) no se encontraron células o tejido cartilaginoso, sí se observó tejido osteoide (TO) con abundante matriz extracelular, donde se hallaron osteocitos (Oc) en sus lagunas osteocíticas. Alrededor del TO se observó médula ósea (MO) con abundante celularidad de pequeños citoplasmas.
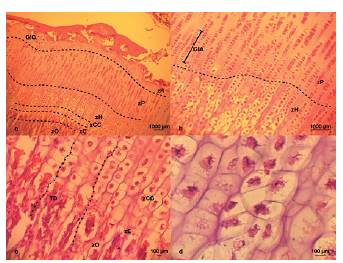
Figura 3: Histología metáfisis femoral de 1 mes. a) 1 mes, 100x. b) 1 mes, 200x. c) 1 mes, 400x. d) 1 mes, 1000x. GIC, grupos isógenos coronarios; zR, zona de reserva; zP, zona de proliferación; zH, zona hipertrófica; zCC, zona de cartílago calcificado; zE, zona de erosión; zO, zona osteoide; GIA, grupos isógenos axiles; TD, trabéculas directricez de osificación.
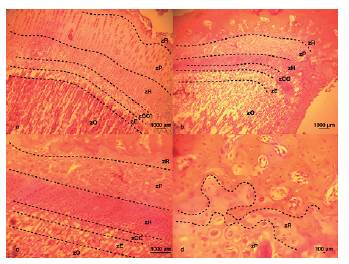
Figura 4: Histología metáfisis femoral de 2 y 3 meses. a) 2 meses, 100x. b) 3 meses, 100x. c) 3 meses, 200x. d) 3 meses, 400x. GIC, grupos isógenos coronarios; zR, zona de reserva; zP, zona de proliferación; zH, zona hipertrófica; zCC, zona de cartílago calcificado; zE, zona de erosión; zO, zona osteoide.
DISCUSIÓN
Últimamente el conejo ha sido seleccionado como un modelo experimental viable, previo a realizar experimentos en humanos (Manjeet et al., 2012). Previamente Thomsen et al. (1991). propusieron que el crecimiento longitudinal femoral a posteriori de los 100 días no revestía cambios importantes, sí bien sus estudios sólo fueron radiológicos. Nuestra propuesta coincide con los resultados de este autor, y además hemos profundizado en la caracterización de los procesos implicados.
Nuestros resultados discrepan de los presentados posteriormente por Lerner y Kuhn (1997), quienes concluyeron que la madurez esquelética se alcanzaba por completo entre la semana 24 y 28 de vida. Paralelamente, Martiniakova et al. (2005) propusieron que animales de seis meses podrían considerarse en etapa adulta para estudios óseos, pero nuestro trabajo realiza una caracterización de los fémures de los conejos en cada uno de los estadios mensuales hasta los seis meses, para poder fundamentar nuestra propuesta.
Masoud et al. (1986) y Heikel et al. (1999) afirmaron que la pubertad del modelo CoNZ se alcanzaría entre las diez y 12 semanas de vida, lo cual podría ser concordante con nuestros resultados respecto al tiempo para alcanzar la madurez ósea. No se ha encontrado hasta el momento evidencia alguna de cambios óseos al iniciarse la actividad reproductiva, la que se daría al aproximarse al 80 % del peso adulto entre las 20 y 23 semanas de edad, acorde a lo previamente informado por Aragón Hernández et al. (2010).
A partir de esta investigación proponemos que la madurez ósea se alcanza a partir del cuarto mes de vida, sin cambios relevantes posteriores. Las características del tejido en la región metafisaria se corresponden con tejido osteoide maduro ya en ese período, observándose ausencia total de componentes celulares y extracelulares condrales en la fisis de crecimiento (todavía inmadura), presentes en los períodos de desarrollo anteriores. No obstante, futuros estudios de estadíos tardíos etarios podrían quizás evidenciar un crecimiento longitudinal posterior. Esto se sustentaría con recientes descubrimientos realizados en roedores de que ciertos tipos celulares podrían promover algún tipo de crecimiento mínimo residual, especulándose que la diferenciación de ciertos condrocitos limítrofes ocurriría más efectivamente que la transdiferenciación de condrocitos hipertróficos en la generación de células mesenquimales (Mizuhashi et al., 2019). Hasta el momento no se ha estudiado en el modelo experimental conejo.
Nuestros estudios evidencian que durante el primer mes de vida se produce la mayor tasa de crecimiento óseo femoral. Durante el primer mes se observa a nivel histológico abundante crecimiento cartilaginoso, lo cual explica lo hallado tanto en la L como en DMO. Hacia el segundo y tercer mes, el tejido cartilaginoso disminuye de forma progresiva. En el cuarto mes sólo queda un remanente de cartílago sin gran capacidad de crecimiento longitudinal, lo que sería consistente con las determinaciones de L y DMOmf.
Martiniaková et al. (2003) describieron al tejido óseo compacto femoral en CoNZ en un grupo conformado por conejos de cinco a siete meses, observando en ellos un desarrollado y complejo sistema haversiano, con gran cantidad de osteonas de características maduras ya en el 5to mes de desarrollo. Pero en nuestro estudio hemos detallado los cambios en el período postnatal de los animales en estudio mes a mes. A partir de ello logramos afirmar que en un período de cuatro meses de desarrollo se puede indicar que el fémur de CoNZ presenta características de un tejido óseo maduro, generándose así la estabilización del crecimiento longitudinal femoral. A partir del quinto mes de desarrollo ya no observamos presencia de tejido condral.
Futuras investigaciones con mayor número de animales, considerando machos y hembras en los distintos estadíos, y realizando estudios de microtomografía computada, histomorfometría, expresión de diversas proteínas en los tejidos considerados, y diversos marcadores de procesos biológicos brindarán una mayor comprensión del modelo experimental conejo en su aplicación a proyectos relacionados con biología ósea. Paralelamente, a la luz de nuevos aportes brindados por la literatura que indicarían nuevos factores biomoleculares involucrados en procesos del desarrollo de diversos órganos y en particular del hueso, el estudio de la expresión de estos debería ser considerado en los futuros estadios (Roselló-Díez et al., 2015; Haraguchi et al., 2019).
Existen muchas controversias entre los resultados previamente reportados sobre la maduración de otros órganos en este modelo animal y sus procesos de crecimiento longitudinal, ya que el hueso es un órgano (Ferreti et al., 2008; Cointry el al., 2009), y por ello a partir de estos resultados se proponen nuevas hipótesis de trabajo en relación a la caracterización de los tipos celulares involucrados en los procesos de crecimiento longitudinal que en este modelo animal aún no han sido explorados (Mizuhashi et al., 2018).
CONCLUSIONES
El análisis integrado mediante los estudios radiológicos e histológicos son fundamentales para una correcta interpretación del proceso de osificación endocondral respecto al crecimiento y desarrollo femoral. Nuestras evidencias histológicas muestran al tercer mes una importante disminución de las zonas cartilaginosas de reserva, proliferación e hipertrofia, al cuarto mes solo un esbozo de estas zonas y a partir del quinto una ausencia total de las mismas, con presencia de hueso trabecular rodeado de medula ósea. Todo ello se traduciría densitrométricamente como la fusión por mineralización entre los puntos de osificación primario y secundario, lo que sustenta el plateau producido en la gráfica de L a partir del cuarto estadío de desarrollo.
Las mesetas observadas en las DMO estarían dadas por la osificación del cartílago de crecimiento de la metáfisis distal durante el primer mes de vida. Esto se fundamentaría según las evidencias histológicas obtenidas, en la que observamos la disminución de las zonas cartilaginosas no osificadas y aumento de las zonas cartilaginosas osificadas conjunto a la presencia de osteoblastos responsables del aumento progresivo de los valores de DMO, los cuales dependen de los componentes inorgánicos de la matriz extracelular. Si bien el tejido óseo es un tejido metabólicamente muy activo sometido a un proceso constante de aposición y resorción que intenta mantener los niveles de DMO en una placa homeostática, una vez alcanzada la madurez ósea no presenta modificaciones significativas durante la adultez joven, lo que se traduce en nuestro estudio como el plateau en los valores de DMO.
Si bien la forma anatómica del hueso ya se alcanza en el primer mes de vida, según se desprende de las variaciones del Af, este trabajo brinda evidencia concluyente de que los CoNZ alcanzan su madurez ósea completa a partir del cuarto mes de vida. Este trabajo aporta al conocimiento del desarrollo y crecimiento femoral de las conejas de la línea New Zealand.