INTRODUCCIÓN
Los machos y las hembras de muchas especies de lagartijas difieren en tamaño corporal y/o en otras características morfológicas como el largo de la cabeza, longitud axila-ingle y extremidades (Rivero Suárez et al., 2016; Kadry et al., 2017). Sin embargo, gran parte de lo que se conoce acerca de los patrones y causas del dimorfismo deriva de estudios enfocados en el dimorfismo sexual en tamaño corporal (DST) (Cox y Kahrl, 2015). Una desventaja de estudiar únicamente el DST es que con frecuencia no es claro si la selección opera sobre el tamaño del cuerpo o sobre una parte específica del mismo (Kaliontzopoulou et al., 2010; Scharfy Meiri, 2013). Por ejemplo, varias especies de lagartijas exhiben DST, donde las hembras son más grandes que los machos, y la explicación recurrente para este tipo de dimorfismo es que las hembras más grandes son favorecidas por la selección de fecundidad en virtud de que tienen más espacio para alojar descendientes (Olsson et al., 2002; Cox y Kahrl, 2015). No obstante, la selección de fecundidad debe actuar específicamente sobre el abdomen, que es la parte corporal que aloja a los descendientes, y puede ocurrir dimorfismo en este rasgo al margen de las diferencias sexuales en el tamaño de los organismos (Scharf y Meiri, 2013). Asimismo, la selección (natural o sexual) puede favorecer el dimorfismo en el tamaño de la cabeza y un estudio enfocado únicamente en el tamaño corporal pasa por alto este aspecto. De este modo, los estudios sobre dimorfismo que consideran tanto el tamaño corporal como regiones particulares del cuerpo deben proporcionar un panorama más detallado y preciso que los basados únicamente en el tamaño del cuerpo.
Como muchos fenómenos biológicos, el dimorfismo sexual puede explicarse mediante causas últimas (presiones selectivas persistentes) y próximas (V. gr., tasas de crecimiento), y los estudios integrativos que consideren ambas causas deben proporcionar una explicación más completa del mismo que los que se centren solo en alguna de ellas (Kuo et al., 2009). El enfoque más frecuentemente usado para examinar mecanismos próximos del dimorfismo en dimensiones de partes corporales consiste en examinar las relaciones de escala entre partes corporales, ya sea con respecto al tamaño corporal o entre partes corporales en sí (Rivero Suarez et al., 2016).
Los escíncidos de cola azul (Plestiodon Duméril y Bibron, 1839) exhiben una diversidad taxonómica, evolutiva y ecológica notable y han sido objetos de una diversidad de estudios biológicos, incluyendo dimorfismo sexual (Brandley et al., 2012). En las especies estadounidenses P. septentrionalis, P. inexpectatus y P. laticeps los machos son más grandes que las hembras, si bien P. fasciatus es monomórfica en este aspecto (Breckenridge, 1943; Vitt y Cooper, 1985; Vitt y Cooper, 1986). Asimismo, se ha encontrado DST, con machos más grandes que las hembras, en las especies asiáticas P. chinensis, P. quadrilineatus, P. elegans, P. latiscustatus y P. tamdaoensis (Lin y Ji, 2000; Huang, 1996; Du y Ji, 2001; Hikida et al., 2001; Yang et al., 2019). En todas las especies estadounidenses y asiáticas señaladas anteriormente los machos tienen cabezas más grandes que las hembras y en la mayoría de ellas se han registrado combates y encuentros agresivos entre los machos, lo que ha conducido a asumir que el dimorfismo sexual en el tamaño de la cabeza es consecuencia de la selección sexual (Vitt y Cooper, 1985; Vitt y Cooper, 1986; Huang, 1996; Du y Ji, 2001). Además, Davis (1968) encontró que los machos de P. laticeps, P. inexpectatus y P. fasciatus tienen extremidades delanteras más largas que las hembras, si bien no discutió las causas de este dimorfismo.
Cabe resaltar que aún se conoce muy poco acerca de la biología (incluyendo dimorfismo sexual) de las especies mexicanas de Plestiodon, las cuales, considerando a las especies aún no descritas formalmente, comprenden cerca de la mitad de las especies de Plestiodon reconocidas nivel mundial (~ 26 de 54: Brandley et al., 2012; Pavón-Vásquez et al., 2018). Ramírez-Bautista et al. (1996) y Ramírez-Bautista et al. (1998) encontraron DST con hembras más grandes que los machos en P. copei y P. lynxe, lo cual difiere de lo que se conoce de las especies norteamericanas y asiáticas, y sugiere que los patrones de dimorfismo sexual de algunas especies mexicanas pueden ser diferentes a las de sus congéneres asiáticos y norteamericanos. En este estudio describimos el dimorfismo sexual en tamaño corporal y en partes corporales (cabeza, cuello, tronco y extremidades) en una población de escíncidos de cola azul (Plestiodon sp) que habita al sur de la Sierra Madre Oriental. También, exploramos las relaciones de escala (alométricas) de las partes corporales examinadas y discutimos su papel en la manifestación del dimorfismo sexual en la forma del cuerpo.
MATERIALES Y MÉTODOS
Área de estudio
La población estudiada se ubica aproximadamente 2 Km al sureste del poblado de San Juan del Valle, municipio de Chilchotla, Puebla, México, al este de la Faja Volcánica Transmexicana (19°15'22''N, y 97°11'53"W), a una elevación de 2324 m. s. n. m. La vegetación dominante es bosque de pino encino. El clima del área es semifrío subhúmedo con lluvias en verano. El mes más frio es enero y tiene una temperatura media de 12,1 °C, y el más caliente es mayo con una media mensual de 16,5. La precipitación media anual es 1566,8 mm (Servició Meteorológico Nacional (México): https://smn.conagua.gob.mx/es/climatologia).
Especie bajo estudio
Previamente, la población de escíncidos de los alrededores de San Juan del Valle, Puebla, estaba asignada a la subespecie Plestiodon brevirostris brevirostris (Dixon et al., 1969), sin embargo, 42 años más tarde Feria-Ortiz et al. (2011) y Brandley et al. (2012) elevaron este taxón a nivel de especie (P. brevirostris). No obstante, en un trabajo más reciente, en el cual usaron datos moleculares, morfológicos y ambientales, Pavón-Vázquez et al. (2018), reevaluaron el estado taxonómico de esta especie y encontraron que realmente representaba cuatro especies distintas, dos distribuidas en el estado de Oaxaca, una el estado de Guerrero y otra (la que incluye a la población estudiada) en los estados de México, Tlaxcala y Puebla. Pavón-Vázquez et al. (2018) no describieron ni nombraron a estas especies. De este modo, la población estudiada pertenece a una especie recién descubierta, no descrita y aún sin un nombre formal. En este estudio nos referiremos a ella como Plestiodon sp.
Plestiodon sp es una lagartija de tamaño mediano. Los adultos miden entre 57 y 72 mm de longitud hocico cloaca (Chávez-López, 2012). Se trata de una especie de hábitos secretivos lo que hace difícil ver a los organismos en actividad. No obstante, la población de escíncidos de cola azul que habita en San Juan del Valle, Chilchotla, Puebla es abundante y es fácil encontrar organismos debajo de rocas pobremente cimentadas al suelo. Todos los organismos se recolectaron manualmente.
Obtención de datos
Las lagartijas usadas en este estudio se recolectaron en ocho viajes al área de estudio realizados de marzo de 2010 a febrero de 2011 (ver tabla 1 para tamaños muestrales). El trabajo de campo de cada viaje fue apoyado y avalado por la Carrera de Biología de la Facultad de Estudios Superiores Zaragoza, UNAM.
Tabla 1 Estadísticos descriptivos para el peso corporal (g) y seis rasgos morfométricos (mm) de hembras y machos adultos de Plestiodon sp. Las últimas tres columnas muestran los resultados de las pruebas de t de Student y post hoc de Bonferroni (ANMUCOVA). Abreviaciones: n = tamaño de muestra, LHC = Longitud hocico-cloaca, PCO = peso corporal, LCA = longitud de la cabeza, ACA = ancho de la cabeza, LTR = longitud del tronco, LCL = longitud del cuello; LFE = longitud del fémur.
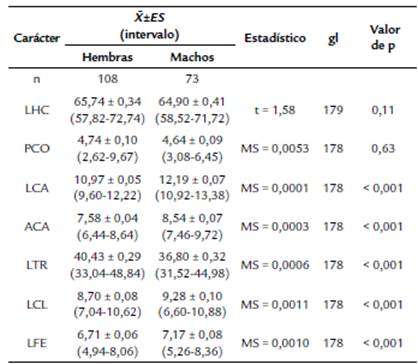
La evaluación del dimorfismo sexual se basó en 181 lagartijas adultas, 108 hembras y 73 machos. Se consideraron como adultos a todos los escíncidos con una LHC mayor a 57,0 mm, la cual es la talla del ejemplar más pequeño con folículos ováricos agrandados (Chávez-López, 2012). A cada ejemplar se les registró (Molina-Borja, 2003; Ji et al., 2006): (i) longitud hocico cloaca (LHC), de la punta del hocico a la parte posterior de la cloaca, (ii) ancho de la cabeza (ACA), registrada en la porción más ancha de la cabeza (inmediatamente posterior a la órbita ocular), (iii) longitud de la cabeza (LCA), de la punta del hocico a la parte posterior del tímpano, (iv) longitud del fémur (LFE), de la ingle a la rodilla (v) longitud del tronco (LTR), de la axila a la ingle, (vi) peso corporal (PCO).
Todas las medidas morfométricas se realizaron con un calibrador digital Vernier Trupper con precisión de 0.01 mm. El peso se registró mediante una balanza semianalítica Ohaus (± 0.01 g). Con el fin de disminuir errores en la toma de datos, todas las mediciones fueron realizadas por una misma persona. El 73 % de los ejemplares examinados se encontraban depositados en la colección herpetológica del museo de Zoología de la Facultad de Estudios Superiores Zaragoza, UNAM (Apéndice 1). Los restantes organismos examinados fueron medidos y liberados en el área de estudio.
Tratamiento estadístico de los datos
Previo a los análisis los valores de los rasgos registrados se transformaron a valores logarítmicos base 10. Todas las variables log-transformadas cumplieron con las suposiciones de homocedasticidad (prueba de Bartlett: p > 0,05) y normalidad (Lilliefrons: p > 0,05) que requieren las pruebas paramétricas utilizadas.
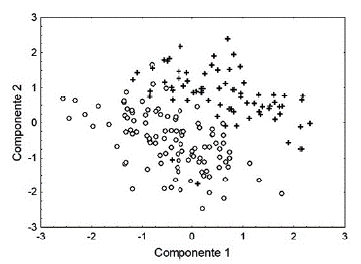
Se realizó una prueba de t de Student para evaluar diferencias sexuales en la LHC. Se realizó un análisis multivariado de covarianza (ANMUCOVA) para evaluar las diferencias sexuales en el PCO y las variables morfométricas relacionadas con partes corporales de los organismos (variables dependientes). Se utilizó como covariable al primer componente principal extraído mediante un análisis de componentes principales. El primer componente, el cual concentra la mayor parte de la variación de los datos y consiste en una combinación lineal de las medidas originales, puede considerase como un índice de tamaño corporal y usarse en otros análisis estadísticos si todos los factores de carga involucrados son positivos (Rao, 1996). Se utilizaron pruebas post hoc de Bonferroni para detectar diferencias sexuales significativas en las variables dependientes particulares (PCO, LCA, ACA, etc.). Con el fin de visualizar en qué medida los caracteres medidos separan a los sexos se construyó una gráfica dimensional con los primeros dos componentes principales. Además, se realizó un análisis discriminante para determinar el porcentaje de casos en los cuales los caracteres medidos clasificaron correctamente el sexo de los organismos.
Se utilizó la ecuación alométrica y = βxα para investigar las relaciones de escala de las variables relacionadas con partes corporales. No obstante, debido a que se utilizaron valores logarítmicos la ecuación utilizada fue ln(y) = ln(β) + aln(x). El escalamiento de las variables LCA, ACA y LFE y LCA se hizo con respecto a la LTR y el escalamiento de la LTR se hizo con respecto a la LCA. De este modo, la variable dependiente (y) fue cualquiera de las variables morfométricas (excepto la LHC) mientras que la variable independiente (x) fue o la LTR o la LCA. Las variables dependiente e independiente estuvieron sujetas a errores de medición y esto viola uno de los supuestos de método de regresión por mínimos cuadrados (Harper, 2014). Por lo tanto, se utilizó el método de regresión por ejes mayores reducidos o ejes mayores estandarizados (SMA por sus siglas en inglés) para estimar los parámetros de las ecuaciones alométricas correspondientes. Esto se hizo con la ayuda del paquete smatr v. 3.4-8 (Warton et al., 2018) de r (R Core Team, 2019). El comando utilizado (sma) proporciona, entre otras cosas, los parámetros del modelo SMA, los intervalos de confianza del 95 para la estimación de los mismos y los resultados de someter a prueba la hipótesis nula de que las pendientes alométricas de dos o más grupos de datos son iguales. Se consideró alometría positiva o negativa si los valores de α fueron mayores o menores de 1, respectivamente. Si bien se utilizaron valores logarítmicos, con el fin de facilitar la interpretación de las relaciones de escala, las gráficas resultantes se presentaron a escala natural (en mm). Sin contar estos análisis, los demás procedimientos estadísticos se realizaron en Statistica V8 (Stat Soft, 2007). En todos los análisis realizados se consideró un nivel de significancia de 0,05.
RESULTADOS
Dimorfismo sexual en tamaño y forma
Se examinaron en total 181 lagartijas adultas, 108 hembras y 73 machos. No se detectaron diferencias sexuales significativas en los valores promedio de la LHC y el peso corporal (Tabla 1). Una prueba de t en la cual se eliminaron a las hembras preñadas tampoco reveló diferencias sexuales en el peso corporal (t62 = 0,64; p = 0,52). El ANMUCOVA detectó diferencias sexuales significativas entre los grupos de variables analizados (Wilks = 0,24; F6173 = 90,47; p < 0,001). Los machos mostraron cabezas significativamente más largas y anchas que las hembras del mismo tamaño (Tabla 1). Asimismo, las longitudes del cuello y del fémur fueron relativamente mayores en machos que en hembras (Tabla 1). No obstante, las hembras tuvieron troncos significativamente más largos que los machos del mismo tamaño (Tabla 1).
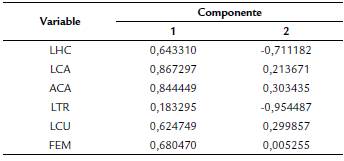
Los primeros dos componentes retuvieron el 73,50 % de la varianza total de los datos (CP1 = 46,10 y CP2 = 27,41). El ancho y el largo de la cabeza tuvieron mayor influencia en la variación del componente 1 mientras que la LTR fue la variable que influyo más en el componente 2 (Tabla 2). Los dos componentes separan notablemente a los sexos (Fig. 1). La función discriminante (lambda de Wilks = 0.23, p < 0,0001) fue D = 0,08PCO - 0,67LHC + 0,94LCA + 0,52ACA - 0,53LTR - 0,09 + 0,08LFE. El 95,4 % y el 94.5 % de los organismos fueron correctamente clasificados como hembras y machos, respectivamente.
Tabla 2 Factores de carga para los primeros dos componentes principales extraídos mediante el ACP realizado sobre las variables relacionados con el tamaño y la forma del cuerpo de Plestiodon sp. Las abreviaciones son como en la Tabla 1.
Alometria
Con excepción de la relación LCL-LTR, todas las demás relaciones de escala fueron estadísticamente significativas (Tabla 3, Fig. 2). Sin embargo, el efecto de las trayectorias alométricas en la forma del cuerpo y en el dimorfismo sexual difirió entre los caracteres. El patrón de crecimiento del LCA fue alométrico negativo en relación a la LTR en ambos sexos y las pendientes alométricas involucradas no fueron significativamente distintas (Tabla 3). Esto sugiere que si bien durante el crecimiento de los escíncidos adultos el alargamiento de la cabeza es lento en comparación con el tronco esto no afecta el dimorfismo sexual de los mismos.
Tabla 3 Trayectorias alométricas del largo de la cabeza (LCA), ancho de la cabeza (ACA), largo del cuello (LCL) y largo del fémur (LFE) escalados con la longitud del tronco (LTR), y de la LTR escalado con la LCA. r2 = coeficiente de determinación, pfl = probabilidad de la relación. Las últimas dos hileras muestran los resultados de las pruebas de igualdad de pendiente alométricas entre machos y hembras, lr = cociente de verosimilitud, p2 = probabilidad correspondiente.
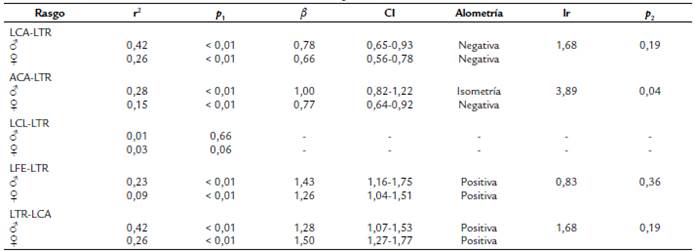
El patrón de crecimiento del ancho de la cabeza fue isométrico en los machos y alométrico negativo en las hembras y la diferencia sexual en las pendientes alométricas correspondientes fue estadísticamente significativa (Tabla 3). Esto es, en los machos el ancho relativo de la cabeza no cambia durante el crecimiento de los adultos, pero en las hembras si hay un cambio en las relaciones de escala de los caracteres involucrados. En consecuencia, el dimorfismo sexual en este carácter debe acentuarse durante el crecimiento de los adultos. En ambos sexos, la LFE y la LTR escalaron de modo alométrico positivo con la LTR y el LCA, respectivamente. Como en el caso del LCA, si bien durante el crecimiento posterior a la madurez hay un cambio en la escalación de estos caracteres no se espera que esto afecte el dimorfismo sexual de P. sp.
DISCUSIÓN
Dimorfismo sexual en tamaño corporal
En la mayoría de las especies de lagartijas los machos son más grandes que las hembras si bien también es común el patrón opuesto (Cox y Kahrl, 2015; Mori et al., 2017). Asimismo, muchas especies son monomórficas respecto al tamaño corporal. No obstante, su frecuencia es baja en comparación con la de especies con DST (Cox et al., 2007). Esto indica que el monomorfismo detectado en P. sp es poco común en lagartijas, incluyendo escíncidos, y esto se mantiene a nivel de familia (Cox y Kahrl, 2015) y dentro de algunos géneros (V. gr., Rivero Zuárez et al., 2016; Jiménez-Arcos et al., 2017). Esta tendencia también ocurre en Plestiodon. En la mayoría de las especies de escíncidos de cola azul estudiadas hasta la fecha un sexo es más grande que el otro (Breckenridge, 1943; Vitt y Cooper, 1985; Vitt y Coper, 1986; Huang, 1996; Du y Ji, 2001; Hikida et al., 2001; Yang et al., 2019) y hasta donde sabemos solo se conocen dos especies de Plestiodon monomórficas con respecto al tamaño corporal, P. fasciatus (Vitt y Cooper, 1986) y P. sp (el presente estudio).
Los principales mecanismos evolutivos que producen DST son la selección sexual y la selección de fecundidad (Cox y Kahrl, 2015). La selección sexual genera DST con machos más grandes que las hembras y opera a través del combate entre machos o la elección femenina. Por lo tanto, se espera que este tipo de dimorfismo predomine en especies donde los machos son agresivos o territoriales y poseen coloraciones corporales llamativas (Dubley et al., 2011). Por el contrario, cuando la selección de fecundidad opera, debe predominar el DST con hembras más grandes que los machos en especies poco agresivas que presentan una relación positiva entre el tamaño corporal y el número o calidad de sus descendientes (Brandt et al., 2016; Pincheira-Donoso y Hunt, 2017). En las especies de Plestiodon estadounidenses predomina el DST con machos más grandes que las hembras mientras que ninguna de las tres especies mexicanas estudiadas hasta la fecha, incluyendo P. sp, se encuentra este patrón. Esto es en parte explicable por diferencias sociales como las señaladas arriba. En varias especies no mexicanas los machos presentan coloraciones conspicuas en la cabeza y vientre y se han observado combates e interacciones agresivas entre ellos, particularmente en la época reproductiva (Vitt y Cooper, 1985; Vitt y Cooper, 1986; Huang, 1996). Por el contrario, no se han documentado interacciones agresivas en ninguna de las tres especies mexicanas de Plestiodon que no exhiben DST con machos más grandes que las hembras (P. copei:Ramírez-Bautista et al., 1996; P. lynxe: Ramírez- Bautista et al., 1998; P. sp: el presente estudio). Además, estos escíncidos realizan sus actividades entre la hierba, hojarasca o escombros que hay en el suelo donde hay poca oportunidad para exhibiciones sociales.
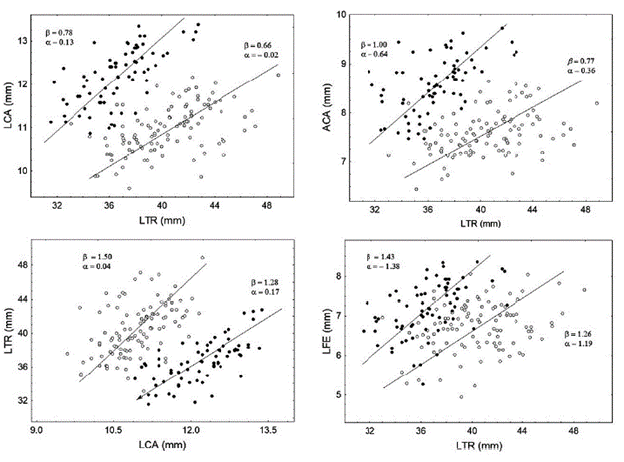
Figura 2 Relaciones de escala entre pares de variables morfométricas significativamente relacionadas de Plestiodon sp. Círculos cerrados = machos, círculos abiertos = hembras. LCA = ancho de la cabeza, ACA = ancho de la cabeza, LFE = longitud del fémur, LTR del tronco, α = ordenada al origen, β = pendiente alométrica.
Dimorfismo sexual en partes corporales
El dimorfismo sexual en el tamaño de la cabeza es ampliamente extendido en lagartijas y si bien se han publicado algunos casos en donde las hembras tienen cabezas más anchas que los machos (Trachylepis vittata:Rastegar-Pouyani y Fattahi, 2015; Trachylepis quinquetaeniata:Kadry et al., 2017) el patrón predominante es que ocurra lo opuesto (Zuffi et al., 2011; Luo et al., 2012; Ma et al., 2018). En particular dentro del género Plestiodon en todas las especies en donde se ha estudiado este rasgo los machos tienen cabezas más grandes que las hembras (P. laticeps:Vitt y Cooper 1985; P. fasciatus y P. inexpectatus: Vitt y Cooper 1986; P. egregius: P. elegans:Ji et al., 2006; P. quinquelineatus:Yang et al., 2019). Por lo tanto, el dimorfismo sexual en el tamaño de la cabeza de P. sp se ajusta al patrón encontrado dentro del género Plestiodon y en lagartijas en general.
En las especies en donde son frecuentes los combates y encuentros agresivos entre machos, incluyendo varias especies norteamericanas y asiáticas de Plestiodon, la explicación común del porqué los machos tienen cabezas más grandes que las hembras es que es una consecuencia de la selección intrasexual (Herrel et al., 1999; Borczyk et al., 2014). No es claro si este es el caso para los escíncidos de San Juan del Valle. Plestiodon sp es una especie recién descubierta y no se conoce casi nada acerca de su historia natural. Sin embargo, como se señaló anteriormente, la ausencia de coloraciones llamativas en los machos y tal vez de una menor agresividad entre los mismos sugiere que la selección sexual, si opera, no es tan intensa como en las especies no mexicanas. Por otro lado, factores tales como el conservadurismo genético, segregación alimenticia, comportamiento reproductivo y alometría también pueden explicar el dimorfismo sexual en el tamaño de la cabeza en lagartijas (Scharf y Meiri, 2013). Evidentemente es necesario conocer más acerca del ambiente social y ecológico de P. sp antes de precisar el significado del dimorfismo en el tamaño de la cabeza.
El dimorfismo sexual en la longitud del tronco también es común en lagartijas, incluyendo escíncidos, y en este caso generalmente son las hembras las que tienen troncos más largos que los machos (Olsson et al., 2002; Schwarzkopf, 2005; Ross et al., 2008; Dubey et al., 2011). Los escíncidos de San Juan del Valle se ajustan a esta tendencia. En las hembras una mayor longitud del tronco implica un mayor espacio para alojar descendientes. De este modo, se ha argumentado que la selección de fecundidad debe actuar específicamente sobre esta parte corporal y no sobre el tamaño del organismo (Scharf y Meiri, 2013). El dimorfismo sexual en la longitud del tronco, donde las hembras tienen troncos más largos que las hembras, en especies donde machos y hembras son de tamaño similar, como ocurre en P. sp, respalda esta aseveración (Schwarzkopf, 2005). Por otro lado, en especies con cuerpo alargado y extremidades reducidas, como ocurre en los escíncidos de San Juan del Valle, el tronco debe tener un papel importante en la locomoción y las diferencias sexuales en su longitud pueden implicar diferencias sexuales en la habilidad para desplazarse en sitios de difícil acceso (Schwarzkopf, 2005; Kaliontzopoulou et al., 2010). Sin embargo, es necesario realizar estudios sobre uso de hábitat y desempeño locomotor en P. sp con el fin de poder evaluar la relación entre dimorfismo sexual y desempeño locomotor.
La longitud del cuello es un rasgo escasamente considerado en los estudios de dimorfismo sexual. Olsson et al. (2002) encontraron que los machos tienen cuellos más largos que las hembras en el escíncido de la nieve Niveoscincus microlepidotus y argumentaron que un cuello más largo, en combinación con piernas más robustas, debe ser ventajoso en combates interespecíficos. Plestiodon sp exhibe un dimorfismo similar al del escíncido de la nieve. Sin embargo, no es claro si existen o no combates entre machos. Otra explicación es que este tipo de dimorfismo ocurre como una consecuencia del alargamiento del tronco de las hembras. En ejemplares del mismo tamaño un troco más largo debe estar asociado con un cuello más corto y viceversa.
Como ocurre en muchas especies de lagartijas (Ma et al., 2018), en los escíncidos de cola azul de San Juan del Valle los machos tienen extremidades traseras más largas y troncos más cortos que las hembras. Estos rasgos están relacionados con la locomoción. Extremidades largas y troncos cortos permiten zancadas más largas y por lo tanto intensifican la velocidad en superficies relativamente planas y abiertas (Olberding et al., 2016). En consecuencia, la explicación común para este tipo de dimorfismo es que los machos tienen estas características porque tienen mayor actividad que las hembras y pueden estar más sujetos a depredación (Iraeta etal., 2011). No es claro si esto puede aplicar a los escíncidos de cola azul de San Juan de Valle. Como muchas otras especies de Plestiodon, P. sp es una especie de hábitos "secretivos" que se desplaza a través matas de pasto corto u otros escombros que hay en el suelo. Por lo tanto, las implicaciones del dimorfismo en la longitud del tronco y extremidades en el desempeño locomotor deben ser diferentes al de lagartijas que se desplazan sobre superficies planas. Por ejemplo, un tronco más largo y extremidades más cortas deben mejorar la maniobrabilidad y el desplazamiento en ambientes de difícil acceso (Kaliontzopoulou et al., 2010). Por otro lado, como en el caso de la longitud del cuello, el dimorfismo en la longitud de las extremidades podría reflejar un efecto alométrico. En lagartijas, el alargamiento del cuerpo está asociado con un acortamiento de las extremidades y una reducción del diámetro corporal (Grizante et al., 2012). De este modo, las extremidades relativamente más cortas en las hembras podría ser consecuencia de un mayor alargamiento del tronco.
Alometria
Los neonatos de P. sp tiene una LCH promedio de 26,9 mm (Chávez-López, 2012) y el ejemplar más grande examinado en este estudio midió 72,74 mm de LHC. Esto sugiere que los escíncidos de San Juan del Valle pueden crecer alrededor 45,8 mm a lo largo de su vida. Si se considera que el ejemplar maduro más pequeño tuvo una LHC de 57,74 mm (Chávez-López, 2012), el crecimiento después de la madurez puede representar alrededor del 33,0 % del crecimiento total de un organismo. La alometría, por lo tanto, debe tener un papel importante en modificar la forma corporal de los adultos. En los escíncidos adultos de cola azul de San Juan del Valle, como en muchas especies de lagartijas (Kuo et al., 2009; Rivero Suárez et al., 2016; Ma et al., 2018), hay cambios en los tamaños relativos de la cabeza, tronco, cuello y extremidades. Sin embargo, excepto en el caso del ancho la cabeza estos cambios no afectan la expresión del dimorfismo en la forma del cuerpo. En este aspecto P. sp difiere de otras especies en donde las trayectorias alométricas de los caracteres examinados acentúan en dimorfismo sexual (Kuo et al., 2009; Aguilar-Moreno et al., 2010).
Se espera que los rasgos sexualmente seleccionados y cuya función sea exhibir el tamaño o la fuerza de un organismo ante su oponente muestren alometrías positivas (Lucas-Rodríguez y Eberhad, 2019). En concordancia con esta idea muchas especies de lagartijas en las cuales se ha considerado que el dimorfismo sexual en el tamaño de la cabeza es producido por la selección sexual el ancho y largo de cabeza de los machos muestran alometrías positivas (Molina-Borja, 2003; Aguilar-Moreno et al., 2010; Dashevsky et al., 2012; Rivero Zuárez et al., 2016). En P. sp el largo de la cabeza en ambos sexos y ancho de la cabeza en las hembras escalaron de modo alométrico negativo con respecto a la longitud del tronco. Esto es diferente de lo encontrado en otras especies en donde, de acuerdo con la hipótesis de Lucas-Rodríguez y Eberhad (2019), el dimorfismo en el tamaño de la cabeza es producido por selección sexual y el rasgo exhibe alometría positiva.
CONCLUSIONES
El monomorfismo en tamaño corporal y el patrón de variación sexual morfológica encontrado en los escíncidos de cola azul, el cual incluye cabezas y extremidades más grande en machos que en hembras y troncos más cortos en los primeros que en las segundas, es un patrón común en muchas especies sexualmente monomórficas de escíncidos. Sugiere que la selección (sexual y/o natural) actúa directa y diferencialmente sobre partes corporales ecológicamente relevantes al margen de su acción en el tamaño corporal. No obstante, la alometría también puede influir en la manifestación del dimorfismo en partes corporales, como la detectada en la longitud del cuello y extremidades traseras. Plestiodon sp es una especie recién descubierta. De este modo, excepto por los trabajos sistemáticos que permitieron establecer que es una especie nueva, el presente artículo representa el primer estudio sobre la biología de esta especie.