INTRODUCCIÓN
El uso de plantas con propósitos medicinales ha sido documentado en la India y China desde el año 2000 AC para el tratamiento de diversas enfermedades. Asimismo, se estima que más del 80 % de la población mundial sobre todo en países en desarrollo, usa la medicina tradicional a base de plantas para su salud, por lo que actualmente existe gran interés en promover y expandir su uso (WHO, 2013).
En México, el uso de plantas medicinales se remonta desde la época prehispánica; sin embargo, actualmente se desconoce el número de especies de plantas con este propósito, según Toledo en 1997 se tenía reportado alrededor de 5000 especies para tratar diversas enfermedades, y se tienen estudios de plantas medicinales en diversas localidades del país.
Para esto las autoridades de salud a través de la Farmacopea Herbolaria de los Estados Unidos Mexicanos (2013) realizan verificación sanitaria y control de calidad de los diversos medicamentos herbolarios, para que cumplan con la legislación sanitaria nacional. Debido a esto en México existe un gran interés por el estudio de plantas con propiedades medicinales, para el tratamiento de diversas enfermedades como respiratorias, digestivas (Alonso-Castro et al., 2017), de la piel, diabetes y cardiacas (García-Alvarado et al., 2001). Además, existen reportes de especies medicinales de uso tradicional en México que presentan actividad fungicida y antioxidante (Ruiz-Terán et al., 2008; García-Hernández et al., 2015).
Desafortunadamente existe un abuso en el consumo de plantas medicinales y muchas de ellas aún no están validadas por la legislación sanitaria del país, lo que podría representar un riesgo a la salud, debido a que la composición fitoquímica es muy variada y podrían presentar daños toxicológicos (Condorhuamán et al., 2017).
En este sentido, en algunos países se reporta que algunas plantas medicinales de uso tradicional presentan riesgos toxicológicos potenciales al hígado (Teschke y Eickhoff, 2015). En México, a pesar de la gran cantidad de plantas medicinales utilizadas, se tienen pocos reportes de especies con efectos tóxicos hepático como Scoparia dulcis L., Citrus aurantium L., Prunus persica L., Rosmarinus officinalis L., Equisetum hyemale L., Tilia mexicana Schltdl, Morus alba L., Mentha piperita L., y Larrea divaricata cav, otras que causan diarrea, náuseas y dolor de cabeza (Opuntia ficus indica L.mill.), también provocan reacciones alérgicas, palpitaciones, conjuntivitis, ataxia, taquicardia, mareos, somnolencia, pancreatitis, entre otros como Taraxacum officinale Koidz, Verbascum densiflorum L., Matricaria recutita L., Passiflora incarnate L., pero no se reporta la frecuencia de uso ni la dosis, sin embargo éstas y más especies son usados diariamente en la población mexicana (Rodríguez-Fragoso et al., 2008; Valdivia-Correa et al., 2016). Algunos de estos efectos no siempre son conocidos a corto o mediano plazo, por lo que es necesario realizar la búsqueda de evidencias farmacológicas, toxicológicas y sobre todo clínicas para su validación científica con el propósito de detectar posibles efectos tóxicos post administración que garantice su utilización de forma segura.
Por otra parte, Solanum ferrugineum Jacq. (familia de las solanáceas) es conocida en México como abrojo o berenjena, tiene amplia distribución y frecuentemente crece como arvense en áreas perturbadas de bosques de encinos y coníferas (Martínez et al., 2017), es una especie de uso medicinal, poco conocida y estudiada. El uso de esta especie no es muy extendido y solo se reporta en comunidades rurales de Nayarit y Michoacán, en donde las raíces, hojas y tallos se emplean para el dolor de huesos, padecimientos respiratorios e inflamación de la próstata (Hurtado et al., 2006; Gheno-Heredia et al., 2011).
El uso medicinal y farmacológico de varias especies del género Solanum se ha reportado previamente, tales como S. lanceolatum Cav., S. chrysotrichum Schltdl., S. rostratum Dunal, S. hindsianum Benth., S. nudum Dunal, S. lycocarpum A.St.-Hil., S. tuberosum L, S. pinnatisectum Dunal, S. ovalifolium Dunal, S. cernuum Vell., entre otras (Torres-Nagera et al., 2013; Lopes et al., 2014; Jiménez et al., 2017).
Este género muestra una gran variedad de metabolitos secundarios como licopeno, alcaloides esteroidales (solanidina, soladulcidina, solasodina, tomatidina), glicoalcaloides (solanocapsina, O-metilsolanocapsina, solamargina y solasonina), saponinas esteroidales, sesquiterpenos y polifenoles (Jimoh et al., 2010; Gaspar-Peralta et al., 2012; Mejia y Gómez, 2013; Medina-Medrano et al., 2016; Yuan et al., 2016; Al Sinani y Eltayeb, 2017). Así mismo se ha reportado variación en el contenido de polifenoles, flavonoides y actividad antioxidante en fruto de S. ferrugineum y de S. scabrum Mill. de diferentes procedencias (Jiménez-Aguilar y Grusak, 2015; Medina-Medrano et al., 2016).
Por otra parte, el efecto medicinal de las plantas se encuentra relacionado al tipo y contenido de metabolitos que producen, los cuales presentan una amplia gama de actividad biológica. Los compuestos fenólicos son los metabolitos secundarios más numerosos y complejos, con más de 8000 estructuras conocidas; a los ácidos fenólicos y flavonoides se les han atribuido propiedades antioxidantes ya que son capaces de eliminar radicales libres que están asociados a enfermedades crónicas como cardiovasculares, cáncer, diabetes y neurodegenerativas, y son considerados como agentes profilácticos y terapéuticos de estas enfermedades (Ratnam et al., 2006; Del Rio et al., 2013).
Debido a lo anterior, en el presente trabajo se pretende contribuir al conocimiento de S. ferrugineum debido a su alto contenido de compuestos bioactivos como polifenoles y su actividad antioxidante, además conocer si esta especie es inocua para ser utilizada como planta medicinal sin riesgo de intoxicación.
MATERIALES Y MÉTODOS
Material vegetal
Plantas completas sin flores ni frutos de S. ferrugineum se colectaron en tres localidades de Zapopan, Jalisco: 1- Las Agujas (LA) (20° 44' 40,7" N, 103° 30' 10,7" W a 1644 m. s. n. m.), 2- Parque el Nabo (PN) (20° 43' 39,9" N, 103° 34' 56,5" W a 1531 m. s. n. m.) y 3- Bosque la Primavera (BP) (20° 41' 48,5" N, 103° 34' 42,8" W a 1595 m. s. n. m.), durante el mes de mayo del 2018. Los ejemplares fueron identificados por la Dra. Ofelia Vargas Ponce del Laboratorio Nacional de Identificación y Caracterización Vegetal (LaniVeg) y los voucher de los epecímenes fueron depositados en el herbario "Luz María Villarreal de Puga" del Instituto de Botánica de la Universidad de Guadalajara (IBUG).
Obtención de los extractos.
Las hojas, tallos y planta completa de las localidades muestreadas, se deshidrataron por separado a 40 °C durante 48 h en una estufa de aire forzado y se molieron finamente, para obtener extractos de acuerdo con Atanassova et al. (2011). Se tomó 1 g de cada muestra por triplicado por separado y se mezcló con 10 mL de metanol al 80 % en un baño ultrasónico por 20 min, posteriormente se tomaron 2 mL para filtrarlos y centrifugarlos a 14 000 rpm durante 5 min.
Análisis de fenoles, flavonoides y proantocianidinas.
De cada triplicado se tomó 1 mL para mezclarlo con 9 mL de agua y un mL del reactivo Folin-Ciocalteu. Después de 5 min se le adicionaron 10 mL de una solución de carbonato de sodio (Na2CO3) al 7 % y al final se aforó a 25 mL con agua grado HPLC. Se incubaron en la oscuridad por 90 min a temperatura ambiente y se leyó la absorbancia a 750 nm en un espectrofotómetro JENWAY 6320D. Para calcular el contenido de fenoles, se utilizaron diferentes concentraciones de ácido gálico como estándar expresados en mg de equivalentes de ácido gálico (EAG)/g de muestra en peso seco (PS) (Atanassova et al., 2011).
Los flavonoides se analizaron con el método del cloruro de aluminio (AlCl3), para lo cual se tomó una alícuota por triplicado de 1 mL de cada extracto y se mezcló con 4 mL de agua HPLC y 0,3 mL de nitrito de sodio (NaNO2) al 5 %, después de cinco min se adicionaron 0,3 mL de AlCl3 al 10 %. Seis min después se adicionaron 2 mL de una solución de hidróxido de sodio (NaOH) al 1 M y se aforó a 10 mL con agua. Se mezclaron en un vórtex y se leyó la absorbancia a 510 nm en un espectrofotómetro JENWAY 6320D. Para el calculó del contenido de flavonoides se utilizaron diferentes concentraciones de (+) catequina como curva estándar y se reportó como mg de equivalentes de (+)-catequina (EC)/ g PS.
La determinación de las proantocianidinas se realizó con el método de El Arem et al. (2012). Para lo cual una alícuota de 50 μL de cada extracto o de la solución estándar ((+)-catequina) se mezcló con 1,5 mL de vainillina al 4 % (diluido con metanol) y 750 μL de HCl concentrado, posteriormente se incubaron a temperatura ambiente en la oscuridad por 20 min para leer la absorbancia a 500 nm en un espectrofotómetro VIS JENWAY 6320D. Los resultados fueron calculados como mg de equivalente de catequina (EC)/g de PS.
Capacidad antioxidante.
Se determinó con el método de DPPH (2,2-difenil-1-picrilhidrazilo) según la técnica de Shimamura et al. (2014), con ligeras modificaciones, para lo cual se preparó una solución con DPPH al 0,2 mM (en metanol), después de 2 h (de estabilización) los extractos y el control Hidroxitolueno Butilado (BHT 200 μg/mL) se diluyeron a diferentes concentraciones (0, 50, 100, 200, 300 y 500 μL/mL) los cuales se mezclaron con 1 mL del DPPH (al que se ajustó la absorbancia a 1,0 ± 0,5) y se reposaron en la oscuridad por 30 min, posteriormente se leyó la absorbancia contra un blanco (1,2 mL de metanol) a 517 nm en un espectrofotómetro UV-VIS (JENWAY 6320D). La actividad antioxidante se expresa como relación de inhibición (%), de acuerdo con la siguiente ecuación: Relación de inhibición (%) = [(A del control - A de la muestra) /A control] x 100, donde A es la absorbancia.
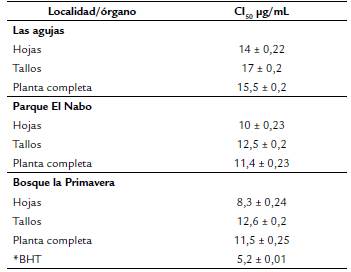
Una vez que se obtiene el porcentaje de la relación de inhibición de cada concentración se calculó la concentración inhibitoria media (CI50) (en μg/mL) que es la concentración de las muestras que producen una inhibición del 50 % comparado con el control positivo (DPPH) para lo cual se utiliza el programa GraphPad Prisma 8.
Toxicidad subcrónica.
El estudio se realizo de acuerdo con la Norma Oficial Mexicana (NOM- 062-ZOO 1999) como lo describen Ruiz y Sotelo (2001) y Monji et al., (2011). Se utilizaron ratones machos de la cepa BALB/c, recién destetados de 21 días de edad con pesos de 19,0 a 25,5 g, estos fueron alojados en jaulas de policarbonato bajo condiciones de bioterio (23 ± 2 °C, humedad del 60 % y ciclos de luz-oscuridad de 12 h, se les ofreció agua y alimento para roedor (2018S, HarlanTeklad) a libre acceso, con la autorización del comité de ética local (CINV.REC.203/14). Para el ensayo se utilizaron siete grupos de ocho ratones distribuidos al azar, después de cinco días de adaptación se les administró al inicio y a los 14 días de la prueba diferentes dosis de la harina de hojas de S. ferrugineum del BP (seleccionada por su mayor concentración de flavonoides y actividad antioxidante) mezcladas con carboximetilcelulosa al 0,2 % en solución fisiológica como vehículo: T0= control (solo se utilizó el vehículo), T1= 1 g de harina en 1 L de agua (dosis utilizada popularmente de forma medicinal), T2= 10 mg de harina, T3= 50 mg de harina, T4= 150 mg de harina, T5= 1500 mg de harina y T6= 15 000 mg de harina, todas las dosis fueron calculadas por kg de peso corporal (PC) del roedor. Se administró 0,8 mL de la suspensión /20 g de PC de los ratones en forma oral (con una cánula intragástrica).
Después de la administración, los animales fueron observados individualmente con especial atención durante las primeras 72 h y posteriormente tres veces por semana durante los 28 días que duró el ensayo. Se registró el peso al inicio del experimento y cada semana, así como datos de muerte y tiempo de ocurrencia de esta, signos y síntomas de toxicidad, además de cambios en la piel, en el sistema respiratorio, en la actividad somato motora y en la conducta. Se prestó atención especial a la presencia de temblores, convulsiones, salivación, diarrea, letargo, somnolencia y coma.
Análisis estadísticos
Los resultados fueron expresados como la media ± desviación estándar y se realizó un análisis de varianza de una sola vía para conocer si existen diferencias significativas en el contenido de polifenoles, flavonoides, proantocianidinas y actividad antioxidante en las muestras de las diferentes localidades, así como una prueba de medias de tukey a un nivel de confianza de 0,05 con el programa Minitab Statistical Software versión 19.2020.1.0.
RESULTADOS
Contenido de polifenoles, flavonoides y proantocianidinas.
En la tabla 1 se puede observar que las muestras del PN presentaron la mayor cantidad de polifenoles, en todas las partes de las plantas analizadas: hojas (22±0,04 mg EAG/g de muestra PS), tallos (5,6±0,01 mg EAG/g de muestra) y planta completa (14,3±0,16 mg EAG/g de muestra), mientras que en las muestras de LA se observaron los menores valores (15,3±0,7 mg EAG/g de muestra) en hojas 2,2±0,005 en tallos y 9,04±0,5 en planta completa, así como de flavonoides (7,8±0,3 en hojas, 1,3±0,1 tallos y 4,3±0,1 en planta completa).
Tabla 1. Contenido de polifenoles, flavonoides y prontocianidinas en hojas, tallos y planta completa de Solanum ferrugineum colectado en tres diferentes localidades. Cada valor representa la media ± desviación estándar (n=3).
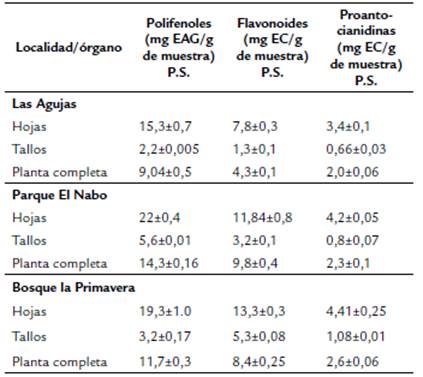
En cambio, se observó el mayor contenido de flavonoides en hojas y tallos con 13,3±0,3 y 5,3±0,08 mg EC/g de muestra, respectivamente en el BP, en comparación a las muestras de las otras dos localidades. Los valores de proantocianidinas en hojas, tallos y planta completa fueron mayores en las muestras de BP comparados con las de las otras dos localidades.
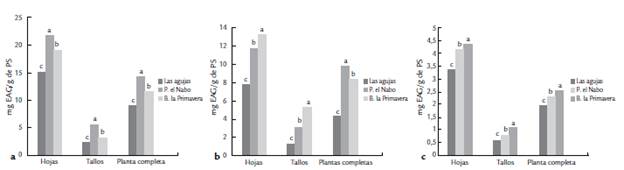
El análisis estadístico reveló diferencias significativas (p ≤ 0,05) en las hojas, tallos y planta completa en las tres localidades muestreadas, el contenido de polifenoles, resulto mayor en PN seguida de BP y por último en LA. En los flavonoides se observó un mayor contenido significativo (p ≤ 0,05) en hojas y tallos del BP, seguida de las muestras del PN, pero en planta completa en esta localidad fue la más alta, mientras que las tres muestras de LA presentaron los menores valores (p ≤ 0,05). Asimismo, las muestras del BP, revelaron el mayor contenido de proantocianidinas en hojas, tallos y planta completa (p < 0,05) y finalmente al igual que los polifenoles y flavonoides las muestras de LA mostraron los menores niveles de proantocianidinas (Fig. 1 a, b y c).
EAG = Equivalente a ácido gálico, EC = Equivalente a catequina, P.S. = Peso seco
Figura 1 Contenido de polifenoles (mg EAG/g de muestra) (a), flavonoides (mg EC/g de muestra) (b) y proantocianidinas (mg EC/g de muestra) (c) en peso seco de hojas, tallos y planta completa de Solanum ferrugineum de diferentes localidades. Los resultados son promedio de tres determinaciones. Las literales diferentes muestran diferencia significativa a un nivel de significancia = 0,05. EAG = Equivalente a ácido gálico, EC = Equivalente a catequina, PS= Peso Seco
Capacidad antioxidante
El cuadro 2 muestra los valores de la capacidad antioxidante expresado como CI50 que fueron similares entre ellos (p > 0,05). Las hojas tuvieron los menores valores con 8,3, 10 y 14 μg/rnL de CI50, en muestras de BP, PN y LA, respectivamente; mientras que los tallos presentaron contenidos mayores de entre 12,5 a 17 μg/mL. La capacidad antioxidante del Hidroxibutiltolueno (BHT) fue de 5,2 ± 0,01 de CI50.
Toxicidad subcrónica.
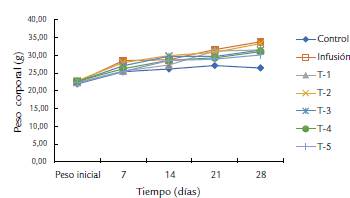
El peso corporal es un indicador importante para la valoración toxicológica, ya que está influido directamente por el consumo de alimento y agua. En la figura 2 se observa que el peso final en todos los tratamientos fue similar entre ellos, ligeramente mayor en el tratamiento de la infusión de la planta (1g/L de agua) y menor en el grupo control, sin haber diferencias significativas (p > 0,05). La administración oral de la harina de S. ferrugineum a las dosis evaluadas no causaron mortalidad en los 28 días del ensayo. Por lo que la DL50 en ratones de la cepa BALB/c es menor a 15 000 mg/ kg, lo que indica que su consumo es inocuo. Durante los primeros días del estudio solo se presentaron algunos signos como letargo, somnolencia y pilo erección moderadas en tres ratones de las dosis más altas (1500 y 15 000 mg/ kg PC). En general, los grupos tratados con la harina de Solanum ferrugineum no mostraron toxicidad por efecto de su administración (Tabla 3).
DISCUSIÓN
En México existe una considerable cantidad de especies medicinales de uso tradicional (cerca de 5000), similar a China e India con 4941 y 3000 (Ramawat y Goyal, 2008). Por lo que se hace necesaria la identificación de compuestos activos, así como conocer la toxicidad de estas plantas para tener un apropiado control de calidad. En este estudio se obtuvieron los valores más altos de polifenoles, flavonoides y taninos en las hojas de S. ferrugineum, las cuales son muy abundantes y crecen como malezas.
El contenido de polifenoles de hojas de S. ferrugineum (19,3 mg EAG/g de muestra) es superior al de plantas medicinales tradicionales de China como Angelica dahurica Benth. et Hook., Equisetum hiema L., Aster tataricus L.F., Centipeda minima (L.) A. Br. Et Ascher y Lepidium apetalum Willd (de 2,34 a 5,91mg EAG/g de muestra) (Song et al., 2010), de la India Hydrocotyle asiatica L., Portulaca oleracea L., Amaranthus viridis L. y Fagopyrum esculentum Moench con valores de 0,48 a 6,022 mg EAG/ g de muestra (Bordoloi et al., 2016), y de Corea como Citrus bergamia Risso, Mentha piperita L., Lavendula angustifolia Mill, Cymbopogon citratus (DC. ex Nees) Stapf., Thymus vulgaris L., Foeniculum vulgare Mill, Camellia sinensis L. y Chamaemelum nobilis L., cuyos valores oscilan entre 4.64 a 8.44 mg EAG/g de muestra (Yoo et al., 2008), así como a hierbas culinarias y especias Europeas Laurus nobilis L., Origanum vulgare L., Thymus vulgaris L., Cuminum cyminum L., Rosmarinus officinalis L. y Cinnamomum zeylanicum Ness con valores entre 1,12 a 5,82 mg EAG /g de muestra (Vallverdú-Queralt et al., 2014) y a otras hierbas selectas de Serbia (Mellilotus officinalis (L) Pall, Nepeta nuda L., Morus nigra L., Humulus lupulus L. y Hedera hélix L.) reportadas por Zugic et al. (2014), y de otras especies de Solanum como S. nigrum L. con 6.68 mg EAG/ g, aunque este valor fue expresado como ácido tánico (Jimoh et al., 2010) y en cultivares de S. melongena L. cuyos valores oscilan entre 0,614 a 1,38 g EAG/g (Okmen et al., 2009).
Sin embargo, los polifenoles de la especie estudiada son menores a otras especies medicinales de Morelos, México como Ziziphus amolle (Sessé & Moc.) M.C.Johnst., Annona squamosa L, Gliricidia sepium (Jacq.) Kunth ex Walp, Bursera grandifolia (Schltdl.) Engl., Comocladia engleriana Loesen y Licania arborea Seem con valores de 85 a 270 mg EAG/g de muestra (Ruiz-Terán et al., 2008), así como a otras especies medicinales de china como Ephedra sinica Seapf, Eriobotrya japonica (Thunb.) Lindl., y Dioscorea bulbifera L., con concentraciones de 27,7 a 59,43 mg/g de muestra (Song et al., 2010) y de Serbia Craetegus spp, Veronica officinalis L., Mentha pulegium L., Fragaria vesca L. y Hypericum perforatum L. con contenido de 23 a 61 mg EAG/g de muestra (Zugic et al., 2014) y a otras Solanum como, S. torvum (160,3 mg EAG/g de muestra) y Solanum ferrugineum (26,78 mg EAG /g de muestra) (Kusirisin et al., 2009; Medina-Medrano et al., 2016).
Tabla 3 Toxicidad subcrónica aguda (vía oral) de harina de Solanum ferrugineum a diferentes dosis (g de harina/Kg PC)
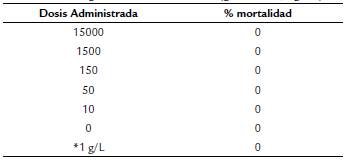
* Dosis utilizada en los remedios caseros como extracto acuoso PC = Peso Corporal
Los flavonoides presentan una alta actividad antioxidante debido a una combinación de sus propiedades quelantes de hierro y son secuestradores de radicales libres lo que evitan la formación de especies reactivas de oxígeno y radicales libres, además son antibacteriales, antivirales y analgésicos (Prakash y Gupta, 2014).
Los valores de flavonoides de hojas (13,3 mg EC/g de muestra) en la especie en estudio son superiores a los de hojas de plantas medicinales comerciales reportadas por Yoo et al. (2008); Zugic et al. (2014) y Atanassova et al. (2011), así como a algunas plantas medicinales de Macedonia como Astragalus glycyphyllos L. (1,61 mg EC/g), Galega officinalis L. (8,95 mg EC /g de muestra), Verbena officinalis L. (9,79 EC/g) y Digitalis lanata Ehrh. (Tusevski et al., 2014) y a los reportados en hojas de otras solanáceas como Physalis chenopodifolia Lam (1,48 m EC/g de muestra), Solanum scabrum (1,41 mg EC/g) y Solanum nigrum (0,73 mg EC/g de muestra) (valor expresado como quercetina) (Jimoh et al., 2010; Jiménez-Aguilar y Grusak, 2015; Barrientos Ramírez et al., 2019).
Las proantocianidinas también conocidas como taninos condensados son considerados como sustancias antinutritivas por disminuir la biodisponibilidad de proteínas y hierro, sin embargo, presentan efectos antioxidantes y se les han atribuido propiedades anticancerigenas, inmunomoduladoras, analgesicas, antiinflamatorias y antimutagenicas, entre otros (Dixon et al., 2005).
En nuestro estudio, las hojas de S. ferrugineum presentaron un contenido de proantocianidinas de hasta 4,42 mg EC/g de muestra, superiores a Solanum nigrum y S. melongena con concentraciones de 3,93 y 1,46 mg EC/g respectivamente (Jimoh et al., 2010; Rodriguez-Jimenez et al., 2018) y a hierbas medicinales de Serbia como Mellilotus officinalis y Veronica officinalis con valores de 1 y 2 m EC/g de muestra de muestra, y similares a Nepeta nuda, Morus nigra y Humus lupulus (contenidos de 4 a 4,5 mg EC/g de muestra), pero inferiores a Craetegus spp., Mentha pulegium, Fragaria vesca y Hypericum perforatum (9 a 25 mg/g) (Zugic et al., 2014), Leonotis leonorus (L.) R.BR. (Jimoh et al., 2010) y de S. torvum, con contenido de 65,91 mg EC /g de muestra reportados por Kusirisin et al. (2009).
Es bien conocido que la síntesis de fenoles se realiza en respuesta a condiciones bióticas y abióticas adversas como ataque de patógenos, herbívoros, radiación UV, temperaturas altas y bajas, metales pesados o deficiencia de agua y nutrientes, además los flavonoides se acumulan también de acuerdo al estado de desarrollo de la planta y a la disponibilidad de agua (Cetinkaya et al., 2017). Por lo que el menor contenido de fenoles de las muestras de LA pudo deberse a que éstas plantas crecen con poca disponibilidad de agua, debido a que las plantas de las otras dos localidades muestreadas crecen cerca de arroyos y canales de agua.
Por otra parte, existen antioxidantes que pueden ser naturales o sintéticos (hidroxitolueno butilado BHT y el hidroxianisol butilado BHA, entre otros), sin embargo, estos últimos pueden ser potencialmente cancerígenos o tóxicos (Botterweck et al., 2000). Por lo que en la actualidad se ha considerado remplazar los antioxidantes sintéticos por los de origen natural, y de éstos, los ácidos fenólicos, antocianinas y flavonoides muestran una alta actividad antioxidante (Jacobo-Velázquez y Cisneros-Zeballos, 2009).
En relación a esto, se han desarrollado diversos métodos rápidos y consistentes para determinar la actividad antioxidante. Cada método presenta ventajas y desventajas, pero los más comunes y confiables son el ABTS y DPPH, los cuales han sido modificados y mejorados en años recientes, además a mayor valor de IC50 con el método de DPPH indica menor capacidad antioxidante, como lo han reportado diversos autores (Atanassova et al., 2011; Zugic et al., 2014).
En este estudio los resultados de actividad antioxidante más bajo se encontró en el BHT con 5,2 μg/mL de CI50 seguido de las hojas de la planta analizada con 8,3-14 CI50, no hubo diferencia significativa (p> 0,05) entre las diferentes partes de la planta, ni entre localidades, aunque las hojas tuvieron el mayor contenido significativo de polifenoles totales, pudiera ser que no presentan polifenoles con alta actividad antioxidante (antocianinas, acidos fenólicos o ciertos flavonas), por lo que sería importante analizar estas muestras con técnicas de HPLC o utilizar otras técnicas de actividad antioxidante como FRAP, ORAC, ABTS, que son más especificas de acuerdo a los compuestos (Moon y Shibamoto, 2009).
Los resultados obtenidos son similares al reportado en otras especies medicinales como Melissa officinales L. con 10,87 Ug/mL de CI, Salvia officinalis L. con 12,64 μg/mL de CI50 y Mentha piperita L. con 10,23 μg/mL de CI50 (Atanassova et al., 2011), Fragaria vesca L. con 13,46 μg/mL de CI50 y Hypericum perforatum L. con 10,84 μg/mL de CI50 reportados por Zugic et al. (2014) y a otras de la India como Paederia scandens L. (8,3) y Amaranthus viridis L. (9,82), pero superior a Fagopyrum esculentum Moench (3,84 μg/mL de CI50) (Bordoloi et al., 2016), medicinales de Thai como Artemisia dubia Wall ex. DC (0,19), Azadirachta indeca A. Juss Var. siamensis valeton (1,2), Basella alba L. (0,7), Bidenspilosa L. (1,22 μg/mL de CI ), entre otras (Maisuthisakul, 2012), sin embargo, son inferiores a extractos de hoja de Moringa oleifera Lam. (19,12), de té verde (20,7 a 30,8) y semilla de uva (31,1 a 38 μg/mL) (Sreelatha y Padma, 2009; Shimamura et al., 2014).
A diferencia de los fármacos sintéticos, la información sobre el uso seguro de remedios herbales es muy limitado, existe muy poca información sobre la toxicidad a largo plazo de hierbas medicinales sin embargo, existen estudios de que algunos compuestos químicos o su sobredosis pueden causar riesgo de inducir hepatotoxicidad entre otros efectos adversos (Teschke y Eickhoff 2015). En la planta en estudio se observaron signos leves de toxicidad como letargo, somnolencia y pilo erección en las dosis más altas (1500 y 15 000 mg de harina/kg P.C.), dosis mucho más altas que las utilizadas en medicina tradicional de 1 g de harina/L de agua, estos signos también fueron observados en extractos acuosos, hidro-alcohólicos y etanólicos en ratones que se les administró hojas de Solanum chrysotrichum Schltdl. a dosis de 1000 mg de harina/kg de P.C., por vía oral, sin presentar toxicidad a 28 días (Aguilar-Santamaría et al., 2013), las dosis evaluadas de S. ferrugineum en los grupos tratados no mostraron toxicidad subcrónica vía oral durante 28 días, ni a la más alta concentración, por lo que se considera una DL50 mayor a 15 000 mg de harina/kg de P.C. en ratones, por lo que su consumo es considerada inocua.
CONCLUSIONES
En general consideramos que los resultados obtenidos de polifenoles, flavonoides, proantocianidinas y actividad antioxidante en S. ferrugineum indican un potencial farmacológicó sobre todo en las hojas; este estudio aporta evidencias toxicológicas de S. ferrugineum para su uso seguro, sin embargo, es importante realizar estudios más profundos en esta planta, como identificación de sus compuestos fenólicos individuales en las hojas.