INTRODUCCIÓN
El incremento de la resistencia química de vectores transmisores de enfermedades es un tema relevante en los sistemas de salud pública (Organización Mundial de la Salud, 2013; Cabezas et al., 2015). Enfocados en América Latina y El Caribe, las causas se relacionan a limitaciones operacionales en el cumplimiento de labores de monitoreo por control químico, con el propósito de evitar altas presiones de selección por insecticidas (órganoclorados, órganofosforados, carbamatos y piretroides) muy recurrentes en los últimos 80 años (Manjarres y Olivero, 2013; Huijben y Paaijmans, 2017). Tanto el Manejo Integrado de Vectores (MIV) como la Red Mundial de Resistencia de Insecticidas (WIN por sus siglas en inglés), coinciden en señalar el creciente desarrollo de resistencia de poblaciones del mosquito Aedes aegypti, causante de enfermedades de alta morbimortalidad mundial como el dengue, zika y chikungunya (Corbel et al., 2017; Thomas, 2018; Aponte et al., 2019). En este marco previo, urge la necesidad de minimizar el tamaño poblacional del vector al incorporar estrategias de innovación ecoamigables basados en el control biológico (Benelli et al., 2016; Ryan et al., 2019).
Los agentes biocontroladores (microbios, invertebrados o vertebrados acuáticos), accionan por selectividad al organismo meta para reducir las poblaciones acuáticas de mosquitos vectores (Saha et al., 2012; Dy et al., 2018; Freimoser et al., 2019). En A. aegypti las estrategias a escala microbiana se confinan básicamente a bacterias (Bacillus thuringiensis isrealensis (Bti), Lysinibacillus sphaericus) y hongos entomopatógenos (Beauveria bassiana, Metarhizium brunneum) (Boyce et al., 2013; Jaber et al., 2016; Alkhaibari et al., 2018). Sin embargo, los Actinomycetales ("actinomicetos"), con características duales de bacterias y hongos, han mostrado también ejercer función larvicida (Janaki, 2016; Balakrishnan et al., 2017). Las actinobacterias son reconocidas por elaborar el 75 % de principios activos totales descubiertos, de los cuales Streptomyces destaca por contribuir entre el 70-80 % de metabolitos secuendarios y ser el referente principal de actividades insecticidas (Kumari et al., 2016). No obstante, el enfoque actual recomienda ampliar la reserva de compuestos bioactivos con la búsqueda de otros actinomicetos a fin de evitar redescubrimientos y promover el hallazgo de nuevos antibióticos e insecticidas (Box et al., 1973; Hug et al., 2018). Es de entender, por lo tanto, que al priorizar el uso de cepas de Streptomyces en procesos controlados por biorreactores, se está desestimando la exploración de actinobacterias no Streptomyces tan igual o superior al efecto de interés no sólo por la adición de simples bacterias en cultivo, sino a la bioactividad de actinobacterias formadoras de biopelículas no cultivadas y desconocidas en sus mecanismos de control (Paulraj et al., 2016; Sekurova et al., 2019).
En general, las biopelículas constituyen complejas asociaciones microbianas que se desarrollan en ambientes antrópicos y en relaciones comunitarias muy especializadas de los ciclos biogeoquímicos (Ramey et al., 2004; Battin et al., 2016). El éxito ecofuncional con relación a las bacterias de vida libre, radica en el despliegue de propiedades emergentes mediante tres ventajosos atributos: (1) construcción de una autoproducida matriz de sustancias poliméricas extracelulares (EPSs) que facilita la colonización por superficies bióticas e inertes, (2) alta autoorganización y cohesividad estructural mono o multiespecíficas y (3) activación de procesos de adaptabilidad y alta resiliencia a ambientes hostiles reguladas por autoinductores (quorum sensing) (Kostakioti et al., 2013, Nozhevnikova et al., 2015; Flemming et al., 2016). No obstante los perjuicios patogénicos asociados a invasividad en instrumental médico-terapéutico y formación de placa dentaria (Subramanian et al., 2019), los beneficios antes citados se inclinan mayoritariamente en favorecer la exploración de actinobacterias nativas formadoras de biopelículas para continuo aprovechamiento en labores de remediación minera, tratamiento de acuíferos, aguas residuales, antibióticos y síntesis de metabolitos biocidas antivectoriales (Cunningham et al., 2003; Edwards y Kjellerup, 2013).
Miembros de las familias Pseudonocardiaceae y Corynebacteriaceae incluyen actinobacterias "raras" no Streptomyces capaz de formar biopelículas y compuestos bioactivos multipropósitos (Ventura et al., 2007; Tiwari y Gupta, 2014). Aunque el desconocimiento de metabolitos secundarios y bioactividades provienen de especies que crecen en ambientes extremos (ácidos, hidrotermales, hiperáridos), dicha tesis se contrapone con aquellas especies no extremófilas que también demuestran benéficas funciones biocontroladoras (Hall-Stoodley et al., 2004; Orhan y Orhan 2018). Por ejemplo, los estudios refieren la síntesis de antifúngicos poliénicos por miembros Pseudonocardiaceae frente a Escovopsis, a través de la asociación simbiótica de biopelículas en el integumento de la hormiga Atta (Ishak et al., 2011; Samuels et al., 2013). Del mismo modo, Saccharopolyspora y Saccharomonospora son claros modelos actinobacterianos que ejercen neurotoxicidad e ingesta larvicida selectiva por espinosinas en larvas de culícidos (Kirst, 2010; Karthik et al., 2011). De otro lado, en Corynebacteriaceae el limitado ejemplo larvicida sobre Aedes es el proveniente de aislados de Corynebacterium sp. (Nabar y Lokegaonkar, 2015). Este grupo opera preferentemente en forma de patógenas biopelículas en entornos intrahospitalarios, mientras otras especies, predisponen hábitos preferenciales de acercamiento de mosquitos al huésped al modificar compuestos orgánicos volátiles desprendidos de la piel, o son resistentes-tolerantes al cromo hexavalente (Coyle y Lipsky, 1990; Viti et al., 2003; Busula et al., 2017). De trascendencia en nuestros objetivos son las recientes características ecotróficas de ambas familias para biotransformar o englobar xenobióticos aromáticos derivados de dioxanos, tetrahidrofuranos y organoclorados (Chen et al., 2016; Ivshina et al., 2017) además de degradar polímeros recalcitrantes como celulosa o quitina de artrópodos (Shivlata y Satyanarayana, 2015; Inoue et al., 2016; Pang et al., 2020). La adherencia de biopelículas actinobacterianas que determinen cambios en estructuras quitínicas cuticulares de A. aegypti, sumado a la actividad insecticida previamente probada en bioensayos pilotos, son abordados en este estudio en demanda a la necesaria búsqueda de nuevos entomopatógenos bacterianos no Streptomyces.
El análisis bioprospectivo de biopelículas habitables en vectores inmaduros acuáticos, constituye la etapa inicial de nuestro estudio relativo a caracterización biológica del patógeno, aspectos que han sido pobremente investigados en organismos meta como A. aegypti (Vivekanandhan et al., 2018; Zothanpuia et al., 2018). En el entendido que la interacción actinobacteria y huésped díptero acuático se desarrolle en términos de disminuir el crecimiento poblacional de etapas inmaduras (Ettoumi et al., 2016; Zhang et al., 2019), postulamos que la relación patógeno-vector confiera favorables respuestas de mortalidad por biopelículas de actinobacterias no Streptomyces y aproximar en presuntivos modos de acción y patogenia. Por lo tanto, la investigación se desarrolló bajo los objetivos de caracterizar el crecimiento de biopelículas, cuantificar los niveles de mortalidad y virulencia sobre larvas y evaluar los efectos subletales en adultos de A. aegypti. La comprensión de los mecanismos básicos de biocontrol fomentará investigaciones direccionadas a diseñar procesos biotecnológicos que identifiquen rutas metabólicas de alta eficiencia en la síntesis de nuevos principios bioinsecticidas.
MATERIALES Y MÉTODOS
Colección de formas infectivas de actinobacterias
Se seleccionaron larvas de A. aegypti infectadas por estructuras análogas a micelios fúngicos. Las larvas infectadas se mantuvieron aisladas en un bioterio de corredor único, anexo al Laboratorio de Microscopía de la Universidad Nacional Agraria de la Selva, Tingo María, Perú. Se distinguieron dos tipos de infección de acuerdo con la distribución de los elementos infectivos en el cuerpo de la larva y al estadio al cual infectaba. En base a estos criterios, las larvas se separaron en recipientes estériles para el traslado al laboratorio.
Aislamiento y cultivo
Los procedimientos de aislamiento, cultivo y caracterización microbiana se efectuaron en el Laboratorio de Calidad Ambiental de la Facultad de Ciencias del Ambiente de la Universidad Nacional Santiago Antúnez de Mayolo, Huaraz, Perú. La extracción de las estructuras por escisión del tejido cuticular larvario se realizó en una cabina de flujo laminar horizontal, etiquetándolas por PsAITA y CoA2CA. Luego de lavar por tres minutos con hipoclorito de sodio al 1 % y agua salina isotónica estéril, se procedió a agitación y homogenización en sistema vórtex en modo continuo por cinco minutos. Posterior al calentamiento a 70 °C por 15 minutos, se tomó 1 mL del homogenizado y se inocularon alícuotas de 100 μL a partir de diluciones seriadas al décimo hasta 10-4. Por diseminación, se añadió cada alícuota en placas Petri con Agar Dextrosa Sabouraud Modificado Difco™ con cloranfenicol, medio de cultivo específico para hongos y Agar Nutritivo Merck para el crecimiento no selectivo de bacterias (Whitman et al., 2012). Se realizó luego una resiembra en Agar Almidón Caseína (AAC) suplementado con ácido nalidíxico (10 μg. mL-1), nistatina (50 μg. mL-1) y cicloheximida (10 g. mL-1) como medio no selectivo de actinobacterias (Küster y Williams, 1964; Ay et al., 2017; Parada et al., 2017). Los inóculos incubados a 26 °C entre 15 a 20 días respondieron adecuadamente a los medios. La selección de dos morfotipos entre cuatro se basó en la visualización de cepas con mayores respuestas competitivas por asimilación de nutrientes, rápida aparición del micelio y mayor cobertura superficial de crecimiento en el cultivo (Hibbing et al., 2010; Lloyd y Allen, 2015). Los cultivos se prepararon según las instrucciones del fabricante: autoclavado por diez minutos a una atmósfera de presión a 121 °C ajustado a pH 7,0 ± 0,2 para agar Sabouraud Modificado Difco ™ y autoclavado a 121°C por 20 minutos y pH 7,3 ± 0,2 para Agar Nutritivo Merck.
Caracterización de colonias y biopelículas
La determinación taxonómica de bacterias coloniales y en biopelículas se llevó a cabo por fotomicrografías, reacciones por tinción Gram y Ziehl-Neelsen, presencia o ausencia de micelio, tipología de elementos reproductivos e hifas, color de la colonia, forma del borde, aspecto y presencia de pigmentos difusibles (Whitman et al., 2012; León et al., 2016). Además, la biopelícula se caracterizó por su morfología, dimensiones, disposición y extensión corporal superficial en larvas y pupas.
Análisis de progresión de biopelículas
La medicion del crecimiento de biopelículas se realizó por captura de individuos visiblemente infectados por el micelio. El montaje en fresco de 30 individuos infectados limitó el uso de cubreobjetos para evitar el daño de la estructura micelar, previo al secuenciado de imágenes por microscopía de luz (Obert et al., 1990; Wilson et al., 2017). El secuenciado de imágenes permitió cuantificar diariamente el crecimiento por extensión superficial epicuticular de las biopelículas en cada estadio larval. Se realizó una captura fotográfica por reemplazo de individuos infectados lo que permitió ampliar la representatividad muestral (n=30) y promediar el crecimiento de la biopelícula por momento de evaluación (24, 48, 72 y 96 horas). La irregular distribución en el sustrato biótico y dispareja ganancia en masa de la biopelícula PsA1TA (patrón de agregado fractal), dificultó situar un punto preciso de continuidad de la medicion del crecimiento desde la interfase biopelícula-epicutícula. El crecimiento de la biopelícula, por lo tanto, se estimó indirectamente por cobertura superficial del órgano afectado expresado en porcentaje. En contraste, el crecimiento radialmente fijo de la biopelícula de CoA2CA en la estructura consistió en la medición desde un punto definido y central de la superficie de la estructura infectada, la cual se expresó en micras y complementariamente en porcentaje. El incremento diario radial de la biopelicula permitió continuar acertadamente la medición del crecimiento en los tiempos establecidos. El crecimiento de ambas biopelículas se visualizó con capturas fotográficas de un microscopio binocular BX50 Olympus®, Japan, equipado con cámara digital SC30 Olympus (3,3 mp), además del uso del método de calibración espacial de fotomicrografías a escala conocida del software de dominio público ImageJ 1.52a (NIH, USA) (Schneider et al., 2012). Se utilizó, también, un estereomicroscopio Olympus® SZX7.
Crianza de A. aegypti
El sistema de crianza larval procedió de un lote generacional F5 de adultos. La alimentación larvaria consistió en un balance nutricional en polvo para peces ornamentales, previamente esterilizado en estufa a 160 °C por dos horas. La crianza aséptica del vector en todas sus fases para el establecimiento del bioensayo se llevó a cabo conforme a protocolos estándar (Gerberg et al., 1994; Imam et al., 2014) en el Laboratorio de Microscopía de la Universidad Nacional Agraria de la Selva entre los meses de enero a abril de 2018.
Bioensayos larvicidas
Las unidades experimentales se constituyeron por vasos con solución de prueba e individuos larvales del I al IV estadio y pupas. Cada unidad integrada por 20 individuos se sometió por triplicado al estímulo microbiano, más el respectivo grupo control con agua potable declorinada. Se tomó como concentración única 3x108 UFC/mL de suspensión de actinobacterias en 199 mL de agua (200 mL de solución de prueba). La mortalidad se registró a intervalos de 24 horas hasta las 96 horas. Todos los grupos se mantuvieron bajo condiciones controladas de temperatura (26,0 ± 0,5 °C) y humedad relativa (75 a 80 %). La nula reacción ante la suave punción con estilete en el tórax de larvas y cefalotórax en pupas indicó la mortalidad de los individuos, la que fue corregida por la fórmula de Abbott cuando en el grupo control se situó entre 5 a 10 % (Abbott, 1925; World Health Organization, 2005):
Efectos subletales y saprotrofía
Los efectos subletales expresados en porcentaje se extendieron por tres días desde el término del bioensayo larvicida, en el que se incluían descripciones morfológicas de signos atípicos de locomoción, malformaciones en la preemergencia y emergencia de los individuos (WHO, 2005; Amarasekare y Shearer, 2013). La extensión de la respuesta infectiva posmortem de larvas, permitió determinar preliminarmente cual de los morfotipos es potencial saprófito degradador de quitina.
Análisis estadístico
Se empleó el ANOVA de un factor con medidas repetidas con diferencias significativas (p < 0,05) y no significativas (p > 0,05) entre la mortalidad larval y tiempos de exposición a las 24, 48, 72 y 96 horas (Hothorn, 2014). Los supuestos del ANOVA se comprobaron al verificar la normalidad con la prueba de Shapiro-Wilks (menor a 50 sujetos por unidad experimental) y esfericidad al emplear la prueba de Mauchly (p<0,05 existen diferencias estadísticamente significativas en la igualdad de varianzas y p> 0,05 no existen diferencias estadísticamente significativas en la igualdad de varianzas). Las comparaciones post-hoc se estimaron con la prueba Fisher LSD (p=0,05). Los Tiempos Letales medios±Desviación Estándar (TL50±DE) se calcularon por análisis Probit. Además, se estableció la prueba de bondad de ajuste Chi-cuadrado (X2) y valor de probabilidad p < 0,05, con diferencias significativas en el efecto infectivo de las cepas, o p > 0,05 con ninguna diferencia significativa en dicha acción, bajo un nivel de confianza del 95 %. Así también, se determinó el Coeficiente de Determinación (R2) como ajuste del modelo entre variables. Todo el análisis estadístico se procesó con el software libre R ver. 3.5.2 for Windows (R Project for Statistical Computing) (Crawley, 2015).
RESULTADOS
Morfología de colonias y biopelículas
El estudio abordó la identificación de patógenos a nivel de familia, caracterización de la morfología colonial y biopelículas de actinobacterias. Se seleccionaron dos morfotipos entre cuatro, en razón a la viabilidad de crecimiento en placas y rápido desarrollo micelial.
Los morfotipos emergieron dentro de las 36 horas, mientras los restantes superaron las 72 horas. Luego de diez días de desarrollo de los cultivos, se definieron dos morfotipos muy consistentes. El primero, rotulado PsA1TA, son formas Gram (+) no ácido alcohol resistente, con micelio aéreo y del sustrato constituyéndose a menudo por cadenas bacilares [Diam.: 0,9-1,2 μm (
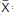 = 1,0 ±2,71), n = 50]. El micelio aéreo de color cremoso y del sustrato amarillo-claro, no produce pigmento difusible, esporangio o pseudoesporangio. En ocasiones los segmentos de las hifas del sustrato con ligero abultamiento, pero en conjunto, forman cadenas cortas con angulaciones en zig-zag (Fig. 1a). El micelio aéreo relativamente ramificado con extremos terminales en "Y", crece fragmentándose en formas abastonadas y cocoides no flageladas, forma brotes laterales y apicales (Fig. 1b-c) para luego alargarse y constituir nuevos segmentos. La colonia muestra elevación convexa, margen de entero a lobulado, borde liso-redondeado con aspecto pulverulento cerebriforme [(Diam.: 3,2-6,1 mm (
= 1,0 ±2,71), n = 50]. El micelio aéreo de color cremoso y del sustrato amarillo-claro, no produce pigmento difusible, esporangio o pseudoesporangio. En ocasiones los segmentos de las hifas del sustrato con ligero abultamiento, pero en conjunto, forman cadenas cortas con angulaciones en zig-zag (Fig. 1a). El micelio aéreo relativamente ramificado con extremos terminales en "Y", crece fragmentándose en formas abastonadas y cocoides no flageladas, forma brotes laterales y apicales (Fig. 1b-c) para luego alargarse y constituir nuevos segmentos. La colonia muestra elevación convexa, margen de entero a lobulado, borde liso-redondeado con aspecto pulverulento cerebriforme [(Diam.: 3,2-6,1 mm (
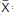 =4,8±1,1), n = 50] (Fig. 1d). Todas las características revelaron corresponder a representante Pseudonocardiaceae. Bajo estereofotografías, las biopelículas PsA1TA son blanquecinas, verrugosas, esferoidales [Diam.: 182,9-215,1 μm (X= 201,6±2,3), n = 25)] y elipsoidales [Diam. 479,3-522,8 μm (
=4,8±1,1), n = 50] (Fig. 1d). Todas las características revelaron corresponder a representante Pseudonocardiaceae. Bajo estereofotografías, las biopelículas PsA1TA son blanquecinas, verrugosas, esferoidales [Diam.: 182,9-215,1 μm (X= 201,6±2,3), n = 25)] y elipsoidales [Diam. 479,3-522,8 μm (
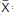 =504,1±5,5), n = 25) (Fig. 1e). La biopelicula destaca por su ordenamiento microlobular surcado (Fig. 1f, punta de flechas) de superficie relativamente envainada y lisa (Fig. 1g), en cuyo neblinoso lumen crecen dos tipos bacterianos no flagelados: bacilar [Long. 0,6-0,8 μm (X=0,7±0,9); diam. 0,3-0,4 μm (
=504,1±5,5), n = 25) (Fig. 1e). La biopelicula destaca por su ordenamiento microlobular surcado (Fig. 1f, punta de flechas) de superficie relativamente envainada y lisa (Fig. 1g), en cuyo neblinoso lumen crecen dos tipos bacterianos no flagelados: bacilar [Long. 0,6-0,8 μm (X=0,7±0,9); diam. 0,3-0,4 μm (
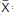 =0,37±1), n = 50] y cocoide [Diam.: 0,40,6 μm (X = 0,5), n = 50] (flecha negra y amarilla, Fig. 1h) densamente distribuidos en la matriz ininterrumpida.
=0,37±1), n = 50] y cocoide [Diam.: 0,40,6 μm (X = 0,5), n = 50] (flecha negra y amarilla, Fig. 1h) densamente distribuidos en la matriz ininterrumpida.
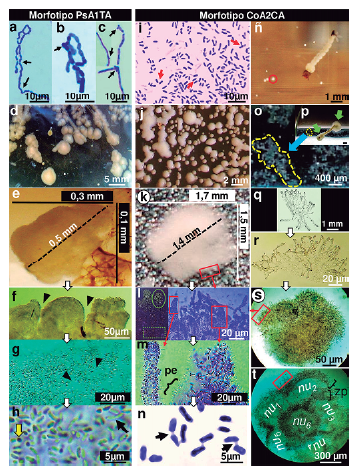
Figura 1 Caracterización de colonias bacterianas y biopelículas. Morfotipo PsA1TA (Fig. a-h): Las cadenas bacterianas forman angulaciones en zig-zag (a) y la organización de las hifas aéreas en cadenas bacilares crecen con abultamientos apicales o laterales (b y c) (flechas). En agar, la bacteria desarrolla a colonias pulverulentas de color blanco cremoso (d), mientras que la biopelícula infectiva muestra forma verrucoide (e). La ampliación secuencial de la biopelícula muestra superficies con bordes lobulados (f, punta de flechas) y ligeros halos de EPS en el lumen (g, punta de flechas), en el que albergan formas bacterianas bacilares y cocoides (h, flechas negra y amarilla). Morfotipo CoA2CA (Fig. i-t): Las células en cultivo se disponen en "V", "Y" y en paralelo (i, flechas). La colonia de superficie pulida exhibe un color blanco-rosáceo (j), cuya biopelícula emite un patrón morfológico algodonoso (k). La imagen en negativo (izquierda) con la imagen coloreada de azul (derecha) de la figura compuesta (l) contrasta la alta densidad bacteriana del estrato apical de las hifas superficiales de la biopelícula radial. A mayor escala, las hifas digitiformes proyectan conspicuos elementos filiforme similares a espinas (pe) (m) que rodean al conjunto bacteriano bacilar unido polo a polo por un tenue mucilago entre dos o tres integrantes bacterianos (n, flechas). CoA2CA induce la formación de bioaglomerados suspendidos (ñ, círculo rojo), adosados al sustrato de borosilicato (o, interlineado amarillo) e infectando el sustrato biótico del vector (p, flechas verdes). El morfotipo se organiza jerárquicamente en micelios dispersos (q), grumos (r) a gránulos esféricos (s) o arrosetados (t). La ampliación de las hifas radiales (l), refleja la similitud morfológica entre biopelículas infectivas sésiles (k) y gránulos esféricos flotantes (s), superficies resaltadas por subrecuadros rojos. zp: zona pilosa, nu: núcleo.
El segundo morfotipo asignado CoA2CA, son bacilos Gram (+) [Long.: 2,1-4,9 um (XX =3,6 ±0,31); diam.: 0,61,4 μm (
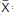 = 1,2 ±0,12), n = 50] rectos a ligeramente curvos y evidente pleomorfismo caracterizados por ser células individuales, en pares, paralelas, adjuntas en pequeños agregados y conectadas en el extremo polar por una delgada franja transparente que divergen en formas "V" e "Y" (Fig. 1i, flechas rojas). El morfotipo no es ácido alcohol resistente, no forma micelios, esporas, flagelos y gránulos policromáticos. La colonia es blanco-rosácea, redondeada, elevación convexa y borde entero, liso no pulverulento [Diam.: 1,8-5,5 mm (
= 1,2 ±0,12), n = 50] rectos a ligeramente curvos y evidente pleomorfismo caracterizados por ser células individuales, en pares, paralelas, adjuntas en pequeños agregados y conectadas en el extremo polar por una delgada franja transparente que divergen en formas "V" e "Y" (Fig. 1i, flechas rojas). El morfotipo no es ácido alcohol resistente, no forma micelios, esporas, flagelos y gránulos policromáticos. La colonia es blanco-rosácea, redondeada, elevación convexa y borde entero, liso no pulverulento [Diam.: 1,8-5,5 mm (
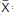 = 3,9±2,7), n = 50] (Fig. 1j) y ausente de pigmento difusible Las características pertenecerían a representante Corynebacteriaceae. Al estereoscopio la biopelícula CoA2CA es blanca, esferoidal y apariencia algodonosa [diam. 0,91,5 mm (
= 3,9±2,7), n = 50] (Fig. 1j) y ausente de pigmento difusible Las características pertenecerían a representante Corynebacteriaceae. Al estereoscopio la biopelícula CoA2CA es blanca, esferoidal y apariencia algodonosa [diam. 0,91,5 mm (
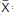 = 1,27±0,4), n = 25, Fig. 1k). Hifas entrecruzadas de diversos tamaños conforman el interior y exterior de la biopelícula. Desde un plano longitudinal, el estrato apical de las hifas superficiales exhibió densos agregados bacterianos, contrariamente al estrato inferior, con menor densidad y mayor interseparación celular (Fig. 1l, imagen izquierda). El interior de la biopelícula se estructuró de compactas y entretejidas capas de hifas, contrariamente a las laxas proyecciones superficiales filamentosas de las hifas (Fig. 1l, imagen derecha con tinción azul), ornamentadas de procesos espinosos filiformes (Fig. 1m). Al igual que su forma colonial, las bacterias no forman flagelos, son abastonadas [Long.: 2,5-4,4 Mm (
= 1,27±0,4), n = 25, Fig. 1k). Hifas entrecruzadas de diversos tamaños conforman el interior y exterior de la biopelícula. Desde un plano longitudinal, el estrato apical de las hifas superficiales exhibió densos agregados bacterianos, contrariamente al estrato inferior, con menor densidad y mayor interseparación celular (Fig. 1l, imagen izquierda). El interior de la biopelícula se estructuró de compactas y entretejidas capas de hifas, contrariamente a las laxas proyecciones superficiales filamentosas de las hifas (Fig. 1l, imagen derecha con tinción azul), ornamentadas de procesos espinosos filiformes (Fig. 1m). Al igual que su forma colonial, las bacterias no forman flagelos, son abastonadas [Long.: 2,5-4,4 Mm (
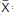 = 3,2 ±0,54); diam.: 0,81,2 Mm (
= 3,2 ±0,54); diam.: 0,81,2 Mm (
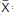 = 1,0±0,1), n = 50], con disposición individual, par o triple y ligeros quiebres angulares en "V" e "Y", polarmente adheridas por un mucílago semitransparente (Fig. 1n, flechas), que en conjunto se insertan en la matriz homogénea, traslúcida y no septada de las hifas envainadas.
= 1,0±0,1), n = 50], con disposición individual, par o triple y ligeros quiebres angulares en "V" e "Y", polarmente adheridas por un mucílago semitransparente (Fig. 1n, flechas), que en conjunto se insertan en la matriz homogénea, traslúcida y no septada de las hifas envainadas.
El morfotipo exhibió agregados microbianos flotantes y sésiles. Las formas flotantes se dispersan por la columna de agua (Fig. 1ñ, círculo rojo), mientras las sésiles, se adhieren a sustratos bióticos de larvas (Fig. 1p, flechas verdes) y abióticos de vidrio de borosilicato (Fig. 1o, interlineado amarillo). Las formas dispersivas adquieren complejos entramados de hifas y crecen similarmente al modelo no coagulativo de gránulos (Fig. 1q-1t). Las hifas incrementan en densidad al formar micelios filamentosos (Fig. 1q) y aglomerados (Fig. 1r), previos a la síntesis de gránulos esféricos (Fig. 1s) y arrosetados (Fig. 1t) de alta organización. La disposición central (o nuclear, nu) de los gránulos arrosetados es de apariencia polinuclear con hifas sin células, en tanto la periférica, similar a la zona pilosa (zp), corresponde a la superficie radial de alta densidad celular. Los gránulos esféricos flotantes (Fig. 1s) y biopelículas infectivas (Fig. 1k) denotan similitud estructural superficial al ser ampliadas por la Fig. 1l.
Dinámica infectiva de biopelículas y efecto posmortem
En esta etapa se determinó la dinámica de crecimiento infectivo de biopelículas y los efectos físicos inmediatos o mediatos de control en inmaduros. A diferencia de los estadios larvales I (L-I) y III (L-III), las etapas II (L-II) y IV (L-IV) se seleccionaron como modelos representativos de análisis por la mayor sensibilidad infectiva y marcados cambios morfológicos. Los exámenes microscópicos revelaron que las bacterias evolucionan a biopelículas según el tipo de revestimiento cuticular del órgano y estadio larval. La ausencia de conductos tróficos de soporte de los patógenos facilitó el directo anclaje epicuticular de microcolonias en etapas tempranas de la infección para impulsar la extensión superficial de biopelículas sobre el sustrato quitínico membranoso o esclereotizado del vector. En L-II, PsA1TA induce la acción infectiva de biopelículas en tórax y abdomen (Fig. 2a-2e) al experimentar las etapas de desarrollo (Fig. 2b) que incluyeron: adherencia de individuos microbianos al sustrato (1), formación de microcolonias (2), elongación (3) y maduración (4). En general, la colonización inicia al conformarse microagregados exactamente en la placa basal setal del abdomen que es el punto de emergencia de las cerdas laterales (Fig. 2c). Estados avanzados de la infección, las biopelículas originadas en la papila anal compenetran el segmento anal y cerdas caudales congregándose una integrada biopelícula biestratificada (Fig. 2d). La evolutiva formación de dos conspicuas biopelículas sobrepuestas, una esferoidal proximal (bpr) a la epicutícula y otras elipsoidal distal (bds) a la superficie cuticular, determinaron la grosera extensión lateral del tórax y abdomen de la larva (Fig. 2e). La expresión dual de biopelículas fue indetectable en la cutícula de pupas.
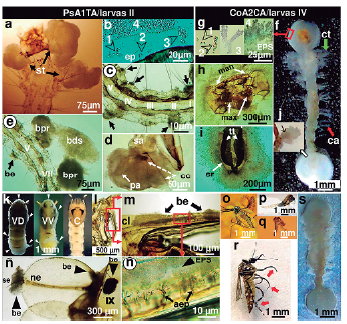
Figura 2 Crecimiento infectivo de biopelículas en A. aegypti. Panel PsA1TA/larvas II (Fig. a-e). Las flechas apuntan el afloramiento de biopelículas en segmentos torácicos (st) (a) y proliferan conforme la secuencia del ciclo de colonización: 1, adhesión monoestratificada de células en la epicutícula (ep); 2, microcolonias; 3, elongación; 4, maduración (b). Numerosas microcolonias emanan desde las placas basales de setas abdominales (c, fechas negras) hasta alcanzar prominentes biopelículas en el segmento anal (sa), papila anal (pa) y cerdas caudales (cc) (d). Estados avanzados de colonización del morfotipo incluye la formación de bicapa de biopelículas proximal (bpr), distal (bds) y las recientemente emergentes (be) a lo largo del abdomen (e). Panel CoA2CA/larvas IV (Fig. f-j). El morfotipo compenetra radialmente la zona cefálo-caudal y superficialmente el tórax y abdomen del vector (f), impulsado por el ciclo de crecimiento en cuatro etapas (1 a 4), tan igual como PsA1TA (g). Aquí, la biopelícula se acompaña de halos de EPS similarmente a como infecta las mandíbulas (man) y maxilares (max) (h), sifón respiratorio (sr) (i) y silla anal (j) donde se señala el punto de origen de la biopelícula (flecha negra). El panel entre las figuras k a ñ muestra la infectividad de CoA2CA en pupas, mientras que las figuras o ar, los efectos subletales en adultos. La biopelícula cubre homogéneamente la superficie de pupas al observarlas en vista dorsal (VD) y ventral (VV) cuando se compara con el control (C) (k). La extracción de la exuvia (l) se amplía para indicar que en el cefalotórax el clípeo alberga agregados emergentes de biopeliculas (be) (m), capaz de producir agrietamiento epicuticular (aep) (n) e invasividad entre la inserción de la seta (se) con la nervadura (ne) de la paleta natatoria, así como en zonas circundantes al IX segmento abdominal (ñ). La respuesta subletal produce individuos farados que emergen erróneamente al adherirse las alas (o), abdomen (p) y región cefálica (q) al interior de la exuvia y, cuando emergen totalmente, dificultan su equilibrio al formar tarsos curvos (r). La figura s, evidencia los restos larvarios profusamente cubiertos con biopelículas. tt: troncos traqueales, ct: cerdas torácicas, ca: cerdas abdominales.
CoA2CA envuelve con densos micelios radiales las regiones altamente esclerotizadas cefálica y anal en L-IV (Fig. 2f). No obstante, a escala microscópica, los elementos conjuntos de infección lo constituyen bacterias simples, microcolonias y biopelículas maduras acompañadas por halos blanquecinos de sustancias poliméricas extracelulares (EPSs) (Fig. 2g, 1-4), tan igual como en PsA1TA. La disposición radial reviste varios artejos esclerotizados de la cabeza que incluyen penachos bucales, mandíbulas, maxilas (Fig. 2h) y partes caudales como sifón respiratorio (Fig. 2i) y silla anal (2j), a diferencia del tórax y abdomen cuyo crecimiento es ligeramente delgado y superficial en sincronía con el aspecto vermiforme de la larva. Como mecanismo de reacción, ambos estadios expresaron arrítmicos y contráctiles movimientos pulsátiles que llevaron a las larvas a golpear la región cefálica contra la anal (material suplementario s1 y s2). En contraste al modo infectivo en larvas, la vista dorsal (VD) y ventral (VV) en pupas no evidenciaron crecimiento radial de COA2CA, sino tenue y homogeneamente superficial (Fig. 2k) comparado al control. Según el análisis morfológico de la exuvia (Fig. 2l), el crecimiento de microcolonias desde el clípeo (Fig. 2m) hasta rodear el cefalotórax reveló formar fisuraciones epicuticulares (Fig. 2n) acopladas a EPSs. La infección también remontó en la inserción de la nervadura con la seta de la paleta natatoria, IX segmento abdominal (Fig. 2ñ) con extensión a todo el cuerpo.
El efecto subletal de CoA2CA indujo en individuos no sensibles a la acción larvicida desarrollar a adultos farados, término empleado a adultos casi maduros, formados y ocultos en la exuvia de la pupa (Frantsevich et al., 2017). En ellos, las limitaciones físicas incluyeron la interrupción del despliegue de las alas e impedimento de salida del abdomen o tagma cefálico desde la exuvia (Fig. 2o-2q) (material suplementario s3). En algunos casos la completa emergencia a adultos se expresaba por el despliegue de tarsos curvos en todas las extremidades (Fig. 2r, flechas rojas). Además, el morfotipo prolongó su crecimiento a la etapa de degradación de los restos de larvas muertas mediante el recubrimiento (embalming) total del cadáver larvario similar a una "momificación micelar" (Fig. 2s). PsA1TA no produjo acción saprofítica.
Crecimiento de biopelículas dependiente de sustrato
El desarrollo de biopelículas se planteó en el supuesto de que la adherencia diferencial a la superficie del vector dependa del tipo de revestimiento epicuticular y promueva la detención del crecimiento larvario. Nuestros resultados determinaron que ambas biopelículas afectaron selectivamente el exoesqueleto rígido y blando con preponderancia a estadios específicos del vector. Los signos de degradación se evidenciaron no solo en artejos aislados (partes bucales, antena, cerdas y penachos), sino a extensiones de órganos (ojos compuestos, silla y papilas anales, sifón respiratorio) y regiones cefálica, torácica, abdominal y caudal. Al respecto, la Tabla 1 compara la evolución de biopelículas PsAITA en zonas con revestimientos no esclerotizados de larvas, con CoA2CA en estructuras no esclerotizadas de larvas y pupas.
Tabla 1 Evolución del crecimiento de biopelículas en estadios inmaduros de A. aegypti.
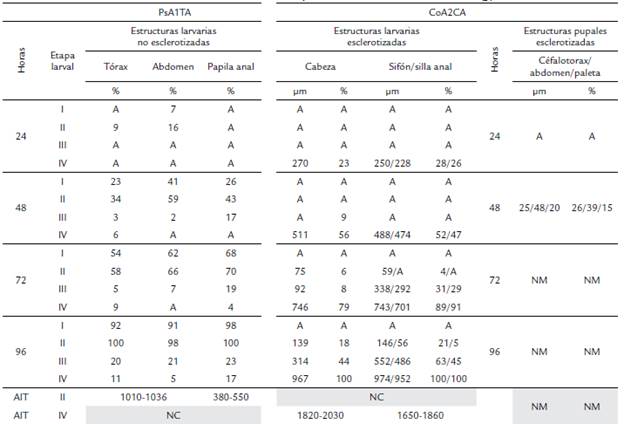
A: Ausencia de biopelícula, NM: No medible por emergencia a adulto, NC: No calculado, AIT: Amplitud infectiva total en 96 horas (μm)
PsAITA coloniza el abdomen de L-I y L-II (7 % y 16 %) desde las 24 horas. A excepción de microcolonias observadas en el abdomen, la extensión de biopelículas continuó marcadamente en tórax y papilas anales desde las 48 horas. En L-I, las biopelículas se acentúan prolíficamente (91-98 %) e impactan íntegramente en L-II (98-100 %) a las 96 horas. Por el contrario, L-III y L-IV no evidencian invasividad a las 24 horas, aunque ligeros indicios en el tórax (3 %), abdomen (2 %) y papilas anales (17 %) con formaciones aisladas de biopelículas que no sobrepasan el 24 %, aparecen entre 48 a 96 horas. L-IV es la etapa de menor proliferación del patógeno y mínimamente alcanzan el 11 % del tórax y 5 % del abdomen. La intensa multiplicación de estratos de biopelículas PsA1TA, llegaron a cuadriplicar el ancho del tórax (450 μm - 486 μm, n =10), abdomen (275 μm - 318 um n =10) y dimensión de papilas anales (22 um x 140 um n =10) de L-II. La amplitud total del ancho del tórax y abdomen más las biopelículas abarcó entre 1010 μm a 1036 μm de envergadura total infectiva, mientras que la integridad dimensional de la biopelícula que engloba las papilas anales comprendió entre 380 μm a 550 μm a las 96 horas.
CoA2CA es casi ausente en L-I, L-II y L-III, pero se forma en la región cefálica (cabeza y artejos) y caudal (sifón respiratorio y silla anal) de L-IV a partir de las 24 horas. La biopelícula crece en la cabeza 23 % (270 μm), sifón respiratorio 28 % (250 μm) y silla anal 26 % (228 μm). El crecimiento radial de la biopelícula es proporcional a la estructura que coloniza, por lo que se adjuntan para fines comparativos las dimensiones del órgano afectado. Así, en el sustrato esclerotizado de la cabeza de L-IV (895-929 μm de largo y 965-992 μm de ancho, n = 10), la biopelícula incrementa entre 23 % a 100 % desde 24 horas (270 μm) a 96 horas (967 μm), lo cual suma una envergadura diametral total de 1820 a 2030 μm (n = 10) equivalente al doble de la región cefálica. En el sifón respiratorio (867-923 μm de largo y 359-375 μm de ancho, n = 10) y silla anal (292-305 μm de largo y 247-263 μm de ancho, n = 10), la biopelícula alcanza a las 24 horas entre el 28 % (250 μm) y 26 % (228 μm), respectivamente, y aumenta a las 96 horas de tres a cuatro veces (974 μm en sifón y 952 μm en silla anal) el tamaño de los órganos al totalizar un diámetro infectivo entre 16501860 μm (n = 10). El incremento diario de la biopelicula se estimó entre 220 a 260 μm.dia-1 (n = 20), es decir, se duplica cada 24 horas con relación al órgano afectado.
Es de resaltar que la biopelícula también invade estructuras esclerotizadas de L-I y L-II, aunque es ausente dentro de las 48 horas. En L-II, los rangos de crecimiento mínimamente abarcaron entre 75 μm a 139 μm (6 % a 18 %) en la cabeza, en tanto fue ligeramente superior en estructuras de la región anal entre 59 μm a 146 μm (4 % a 21%), hasta el término del bioensayo (96 horas) y sin presentar profundas deformaciones corporales. El corto tiempo de duración de la conversión de pupa a adulto, medido entre 51 a 54 horas, solo permitió observar el crecimiento de diminutas microcolonias entre 20 μm a 48 μm (26 % del clípeo cefalotorácico, 39 % del abdomen y 15 % de paleta natatoria) hasta las 48 horas, procediendo luego a la emergencia a adultos.
Mortalidad larvicida y efecto subletal
El planteamiento por biocontrol de actinobacterias no Streptomyces formadoras de biopelículas, pretendió ser validado por la acción larvicida y efecto subletal en A. aegypti. En ese sentido, los hallazgos larvicidas reflejan dos reacciones específicas al vector: La respuesta orientada a fases tempranas de L-I y L-II ejercida por PsAITA y aquella susceptible a fases media y tardía de L-III y L-IV producida por CoA2CA, lo que condujo al análisis independiente de la mortalidad por morfotipo. En el bioensayo, la mortalidad no excedió el 3 % respecto al grupo control por lo que evitó corregirse con la fórmula de Abbott. El efecto larvicida por PsAITA empezó a las 24 horas con 15 % en L-IV, no obstante, a las 72 horas se estabiliza a 23 %. En contraste, L-II demostró tener mayor resistencia al estímulo microbiano con 5 % de mortalidad, pero despunta significativamente (p < 0,05) a 58 % frente a los demás estadios, los cuales no superaron el 40 % hasta las 96 horas (Fig. 3a). La acción deformadora de la biopelícula sobre L-II es muy evidente a las 72 horas con 30 % de mortalidad y coincide con los visibles signos de continua y agresiva tumefacción que distorsionan el tórax y abdomen al alcanzar cerca del 60 % a las 96 horas (panel fotográfico Larvas II, Fig. 3a). De otro lado, L-I y L-II mostraron ser menos sensibles a CoA2CA con 10 % y 5 % de mortalidad a las 24 horas, respectivamente, y sin mostrar diferencias significativas (p > 0,05) con relación a L-III y L-IV (15 % y 25 %). Desde ese momento, el estímulo microbiano confiere respuestas mortales relativamente escalonadas hasta las 72 horas, momento en que L-I y L-II muestran mortalidad significativamente diferente e inferior (45 % a 48 %, p < 0,05), respecto a L-III y L-IV (60 % a 63 %, p < 0,05). A las 96 horas, y en contra de lo morfológicamente esperado, las biopelículas no revelaron crecer en la región cefálica y caudal de L-I y L-II, por lo que, a pesar de carecerlas, la mortalidad se situó entre 59 %y55 %, sin mostrar diferencias significativas (p > 0,05). Sin embargo, la evidencia radial es clara en L-III y L-IV, que reaccionan negativamente al severo desarrollo de la biopelícula y, al igual que el morfotipo anterior, demostraría directa correspondencia con la progresiva mortalidad larval. Es decir que mientras los porcentajes de biocontrol se incrementan continuamente entre las 24 y 96 horas (10 % a 70 %, L-III y 15 % a 85 %, L-IV), dicho efecto podría correlacionarse positivamente con el paulatino desarrollo de las biopelículas (panel fotográfico Larvas IV, Fig. 3b).
Los individuos sobrevivientes a la acción larvicida son impedidos de emerger o emergen defectuosamente a adultos lo que evidenció respuestas subletales. El mecanismo de biocontrol sucede al adherirse determinadas regiones del cuerpo adulto al interior de la exuvia. Es decir que del 100 % de pupas sobrevivientes, el 65 % de individuos incluyó farados muertos por emergencia incompleta. De este total, 42 % mostró defecto en el despliegue total del ala derecha o izquierda, 33 % de separación errática de la región abdominal y 25 % por defecto de salida por adherencia de la región cefálica. Asimismo, el 32,2 % de individuos que emergen a adultos alados correspondió a aquellos estructuralmente íntegros y voladores, mientras que el 2,8 % fueron alados, pero morfológicamente limitados a formar tarsos curvos que impidieron el equilibrio corporal y desencadenó en muerte (Fig. 3c-3d).
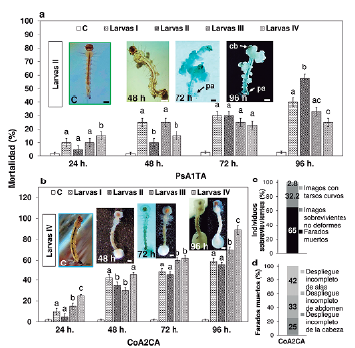
Figura 3 Comparación de la mortalidad larvicida y respuesta subletal efectuada por actinobacterias. Los gráficos en barras representan el porcentaje de mortalidad larvicida ejercida por PsA1TA (a) y CoA2CA (b) con fotomicrografías adjuntas que reflejan los cambios morfológicos en larvas II y IV hasta las 96 horas. Los porcentajes de mortalidad de individuos sobrevivientes al efecto larvicida son proclives a formar imagos con tarsos curvos, sobrevivientes voladores no deformes y farados muertos (c). Estos últimos, son agrupados por el tipo de anormalidad que impide su emergencia (d). En los gráficos a y b, las barras verticales indican el promedio y límites de confianza (X±LC, n= 60 individuos por grupo) al 95 %. Letras diferentes sobre las columnas representan diferencias significativas (p < 0,05) de la acción del patógeno por estadio larval, según la prueba de comparaciones múltiples de Fisher LSD. Barras de escala del panel fotográfico de larvas II: 100 μm y de larvas IV: 1 mm. cb: cabeza; pa: papila anal.
Virulencia
La virulencia asociada a actinobacterias tuvo como propósito inocular una cantidad conocida de patógenos y cuantificar el tiempo medio de efecto adverso al vector. De esta forma, demostramos que todas las etapas larvarias reaccionan a los morfotipos a diferentes niveles de tiempo. No obstante, priorizamos la interpretación de la virulencia a L-II y L-IV, por ser los estadios de referencia de mayor invasividad por biopelículas y susceptibilidad larvicida. La aplicación de 3x108 UFC/mL de inóculo bacteriano produjo diferentes tiempos de control calculados por TL50. A PsA1TA le tomará 3,4 (±0,5) días (81,6 horas) en controlar al 50 % de L-II, mientras que CoA2CA empleará 3,8 (±0,4) días (91,2 horas), sin evidentes diferencias estadísticamente significativas (p = 0,08). Es decir, ambos morfotipos pueden cuantificar la misma virulencia bacteriana, lo que implicaría en el uso indistinto de cualquier morfotipo para biocontrolar L-II. Aunque L-IV es la etapa de menor sensibilidad a PsA1TA capaz de prolongar el TL50 a 5,3 días (127,2 horas), CoA2CA mostró mayor severidad al emplear 2,5 días (60 horas) comparativamente la mitad del tiempo de virulencia de PsA1TA (p = 0,03). De manera semejante responde L-III con TL50 muy próximos a L-IV, establecidos entre 5,8 días (139,2 horas) en PsA1TA y 2,9 días (69,6 horas) en CoA2CA, con diferencias significativas (p = 0,02). La homogeneidad de las respuestas patógenas a todas las larvas fue respaldada por la relación-asociación de las variables (r2, 72 % a 94 %) que indican la efectiva letalidad bacteriana con alta confiabilidad y ajuste estadístico (X 2 , 1,3 a 8,2). Por lo tanto, los agentes infecciosos mostraron ser patógenos en distintos tiempos de control en dependencia al estado de desarrollo larval.
DISCUSIÓN
Este estudio caracterizó actinobacterias no Streptomyces formadoras de biopelículas y evaluó la acción insecticida y efectos subletales sobre A. aegypti. Las bacterias desarrollan voluminosas biopelículas verrugosas y radiales en la epicuticula de los organismos, atributos que confieren distintas dinámicas de desarrollo infectivo y malformaciones corporales en larvas y pupas. Los morfotipos Pseudonocardiaceae (PsAITA) y Corynebacteriaceae (CoA2CA) degradan la cutícula en función al tipo de recubrimiento cuticular del órgano del vector, lo que creó dependencia ante la disponibilidad de sustratos duros esclerotizados o blandos no escleretizados. Aunque la actividad es expresamente larvicida a favor del CoA2CA, el morfotipo induce regulación poblacional poslarval al limitar la emergencia total del adulto desde la exuvia pupal y postración permanente en adultos recién emergidos por formación de tarsos curvos, lo que revela alteraciones del exoesqueleto y respuestas subletales de control.
Si bien nuestras conjeturas sobre el agente causal infectivo partieron sobre la base de patologías fúngicas asociadas a Bauveria bassiana, Coelomomyces stegomyiae y Metarhizium anisopliae (Rueda et al., 2019), dichos supuestos fueron descartados por análisis comparativo dimensional de células en cultivos, elementos reproductivos de micelios e hifas, dinámica patogénica, entre otras características taxonómicas identificables a hongos (Samson et al., 1998; Watanabe, 2010). Por lo tanto, los morfotipos revelaron ser compatibles a actinobacterias Pseudonocardiaceae y Corynebacteriaceae (Harding et al., 2009; Whitman et al., 2012; Ranjani et al., 2016). En perspectiva, las bacterias cumplen las típicas etapas de formación de biopelículas que comprenden: adhesión al sustrato, formación de microcolonias, elongación y maduración acompañada de EPS (Vila y Rozental, 2016; Yadav y Sanyal, 2019), fases que desencadenaron la infectividad al vector y reproducción bacteriana. Además, la similitud de la morfología celular entre el cultivo colonial e integrantes de la biopelícula PsA1TA relativo a la presencia de elementos cocoides y bacilares en Pseudonocardiaceae (Sahin et al., 2014), sugieren la alta versatilidad por codificar el mismo fenotipo ante ambientes nutricionalmente distintos que abarquen sin mayor exigencia la captura de sustratos de origen no biótico (agar) y biótico (quitina). Del mismo modo aplicaría a la naturaleza pleomórfica y patógena de las bacterias Corynebacteriaceae (CoA2CA) (Takano et al., 2008; Tauch y Sandbote, 2014) similarmente observadas en cultivo y asociadas en forma de biopelículas.
Las actinobacterianas formadoras de biopeliculas infectivamente asociadas a etapas acuáticas de mosquitos, son un aporte inédito en el control larvicida muy poco estudiado en ambientes de agua dulce en donde los vectores proliferan. No obstante, la asociación es mayormente extendida en la regulación de la metamorfosis de organismos marinos (Rendueles y Ghigo, 2015) e hidrólisis de biopolímeros de bacterias colonizadoras de sustratos (Dang y Lovell, 2020). En nuestro estudio, el biocontrol puede ser explicado en parte por estos puntos de vista, pero principalmente en la interacción con el huésped por asociación epibiótica en términos de respuestas antagonistas (Wahl et al., 2012). La relación epibiótica favorecería en parte el modo de crecimiento de las bacterias estudiadas al evidenciar las fases alternantes sésil (infectiva) y planctónica (disipativa), estrategias que cooperan en la proliferación bacteriana y colonización de nuevos ambientes (Berlanga y Guerrero, 2016). De acuerdo con este modelo, CoA2CA adecuaría negativamente su asociación epibiótica en contra del vector, al abarcar jerarquías de organización de formas infectivas más completas y predominantes tales como micelios filamentosos, grumos y gránulos, similarmente a los propágulos producidos por Streptomyces (van der Aart et al., 2018; Veiter et al., 2018). En contraste, el ciclo de vida de PsA1TA reveló no incluir la estrategia disipativa vía planctónica, a pesar de que dichos propágulos suelen evidenciarse en los entomopatógenos Saccharopolispora y Amycolatopsis integrantes de la misma familia (Singh et al., 2013; Barka et al., 2015). Dado que CoA2CA es demandante por la fase disipativa, dicho mecanismo abarcó el adosamiento a matrices abióticas de vidrio de borosilicato con el desarrollo de películas adherentes y facilitación para la dispersión bacteriana a nuevos espacios potencialmente colonizables ante recambios de fuentes hídricas (Young, 2006; Preedy et al., 2014). Aunque los argumentos previos pueden teorizar acertadamente los orígenes ecofuncionales del biocontrol, también es congruente con explicar la formación de gránulos esferoidales y arrosetados de CoA2CA, que podrían asociarse con la expresión de antibióticos e insecticidas de interés en bioprocesos tecnológicos (Dhakal et al., 2017; van Dissel y van Wezel, 2018), en vista que el morfotipo mostró mayor actividad larvicida. En ese sentido, la liberación de metabolitos larvicidas sería factible de ocurrir, si asumimos que se produzcan en las hifas de grumos y gránulos tal cual se realiza en otros actinomicetos a escala biotecnológica (Singh et al., 2012). En resumen, la extensión de biopelículas sésiles al huésped habilitaría la directa regulación poblacional vectorial e, indirectamente, mediante la diseminación por propágulos, doble ruta de alto poder patógeno muy ventajosa en los propósitos de biocontrol. En ambos casos no se descartaría la emisión de compuestos bioactivos insecticidas.
Tabla 2 Virulencia de PsA1TA y CoA2CA en larvas de A. aegypti.
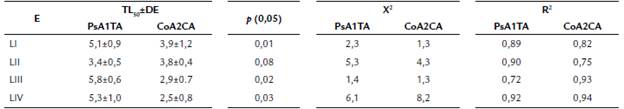
E: estadio, TL50: tiempo letal medio, DE: desviación estándar, X2: Chi-cuadrado, R2: Coeficiente de determinación. p: Valor de probabilidad (p < 0,05: existen diferencias significativas, p > 0,05: no existen diferencias significativas). La mortalidad incluye un total de 60 larvas por estadio (20 x 3 repeticiones) mas el grupo control.
La quitina es el principal polímero constitutivo del exoesqueleto y primera barrera de defensa ante patógenos en todas las etapas de desarrollo del mosquito (Kaya y Vega, 2012; Nation, 2016; Lopez et al., 2019). De acuerdo con nuestros hallazgos, dos enfoques podrían ser planteados a fin de aproximar actividades de biocontrol sobre la cutícula: La inhibición de la ecdisis y degradación cuticular. En el primer abordaje, ambos morfotipos demostraron detener la ecdisis en todas las etapas larvarias, a excepción de las pupas. En línea con la actividad larvicida, la interrupción de la dinámica estructural de la ecdisis sería el resultado de la relación patogenia-virulencia de PsA1TA (3,4 días/81,6 horas) y CoA2CA (2,5 días/60 horas). El mecanismo, muy vinculado a bacterias entomopatógenas, podría ser potenciado por la presencia de biopelículas infectivas y liberación de quitinasas (Costa-Orlandi et al., 2017; Oyeleye y Normi, 2018). Si bien ambos supuestos pueden sinergizar el control larvario global, lo evidente fue que, de todos los individuos expuestos, L-II y L-IV destacan por ser altamente sensibles y experimentar intensos cambios morfológicos y mortalidad. El segundo planteamiento estaría respaldado por la erosionabilidad y fragmentación cuticular que apuntarían a indicios degradativos del exoesqueleto. De las observaciones deducimos una relación de compatibilidad asociada a la consistencia del revestimiento epicuticular que confina a las bacterias a establecerse en sustratos de cutículas blandas (PsA1TA) y esclerotizadas (CoA2CA). La afinidad por nichos bióticos con grado variable de esclerotización de la quitina, ha sido bien estudiada en A. aegypti (Christophers, 1960; Sugumaran y Semensi, 1987) y se explicaría porque genéticamente la bacteria predispone la síntesis creciente de biopelículas en la medida que sean estimuladas por sustratos quitínicos adicionales y posibiliten la activación extra de complejos enzimáticos desmineralizadores y desproteinizadores del biopolímero (Killiny et al., 2010; Tamadoni y Barzkar, 2018). En consecuencia, se procede a la degradación enzimática de quitina no endurecida y quitina esclerotizada (Wu et al., 2013; Du et al., 2017) que revelaría proteólisis de sustratos quitínicos por PsA1TA y CoA2CA. Aunque las investigaciones vinculan a Streptomyces poseer la mayor diversidad de enzimas degradantes, en general, las actinobacterias se ubican entre los mejores descomponedores de quitina (Lacombe-Harvey et al., 2018), por lo que nuestro estudio contribuye a ampliar dicha acción a dos morfotipos raros no streptomicetos.
Los individuos sobrevivientes a la acción larvicida responden mediante dos mecanismos: Aquellos expuestos a PsA1TA que expresan pupas y adultos voladores sin daño y los sometidos a CoA2CA que avanzan a adultos farados (preemergentes) y alados no voladores con aberraciones físicas. Los signos por exposición a CoA2CA son coincidentes con los exteriorizados por inhibidores de síntesis de quitina (CSIs) (Farnesi et al., 2012; Salokhe et al., 2012) naturalmente producidos por Streptomyces, Micromonospora y Actinomadura (Sakuda et al.,1996; Mishra et al., 1998). Las limitaciones asociadas al plegamiento de la cabeza, alas o abdomen dentro de la exuvia se deben a reacciones morfológicas típicas del efecto de CSIs sintéticos (Awad y Mulla, 1984; Fontoura et al., 2012), mientras que los tarsos curvos en adultos alados, a la reducción de cecropina B esencial en la correcta formación cuticular del imago, tal como se ha demostrado en A. aegypti (Liu et al., 2017). Por lo tanto, la anulación de la ecdisis larvaria, incompleto despliegue de adultos y expresión de tarsos curvos en alados, sugerirían biocontrol de CoA2CA asociado a transmisión transestadial subletal (Alto y Lord, 2016; Brown et al., 2018) con implicancias en la estabilidad y rigidez del exoesqueleto.
De otro lado, los resultados revelaron que el crecimiento de CoA2CA se extendió a la etapa post mortem, en contraste al nulo desarrollo de PsA1TA. Dado que la degradación de la cutícula esclerotizada es más resistente respecto a la no esclerotizada (Leger et al., 1986; Andersen, 2012), es interesante observar, además, la inespecificidad del morfotipo por elegir sustratos quitínicos en procesos formativos o degradativos. Esto significa que CoA2CA puede degradar estructuras quitínicas de función protectora en el organismo o bajo disponibilidad ambiental como resto orgánico recalcitrante, independientemente del grado de esclerotización. Estas evidencias sugieren que CoA2CA ejerza función quimiotrófica y saprótrofa, capaz de conducirse por rutas quitinoclásticas degradativas diversas y en términos de poder cuantificarse la efectividad degradante de la quitina (Beier y Bertilsson, 2013). No obstante, detalles sobre el metabolismo quitinolítico y productos de degradación quedarían por ser dilucidados en favor del interés industrial farmacéutico, químico y biogeoquímico del C y N.
CONCLUSIONES
Dos actinobacterias formadoras de biopelículas Pseudonocardiaceae (PsA1TA) y Corynebactariaceae (CoA2CA) confieren actividad larvicida y subletal en adultos de A. aegypti. Las biopelículas crecen infectivamente en estructuras cuticulares esclerotizadas y no esclerotizadas que revelaron preferencias tróficas en la adquisión de sustrato. Mientras que PsA1TA construyó densas biopelículas en tórax y abdomen, CoA2CA desarrolló estructuras con disposicion radial en las regiones cefálica y anal. Ambos morfotipos ejercen mortalidad al inhibir el avance de las etapas larvarias. PsA1TA fue más mortal y virulento en L-II y CoA2CA lo fue en L-IV. CoA2CA induce respuesta subletal por despliegue defectuoso del adulto farado, en tanto los emergentes muestran desequilibrio por formación de tarsos curvos. A su vez, el crecimiento de CoA2CA se extiende al estado post mortem de larvas que sugieren ser saprótrofos, contrariamente a PsA1TA. Dado que las evidencias se derivaron a análisis morfológicos preliminares, los mecanismos exactos de biocontrol en A. aegypti deberían ser reconfirmados y elucidados bajo un diagnóstico molecular de los morfotipos, acompañados de alto detalle ultraestructural de la acción infectiva.
















