INTRODUCCIÓN
México ocupa el segundo lugar en producción y exportación de orégano en todo el mundo (Orona-Castillo et al., 2017). Destaca por tener un gran potencial económico y una importante demanda internacional, debido a sus usos en la industria farmacéutica, cosmética y alimentaria; posee propiedades antimicrobianas, citotóxicas, antioxidantes y antifúngicas (Aguilar-Murillo et al., 2013). En México, la producción de orégano rebasa las 80 toneladas anuales; sus ventajas y utilidades lo convierten en uno de los productos de mayor aprovechamiento mundial. En el noroeste de México, habita un pueblo amerindio denominado COMCAAC con un total de habitantes ~20 000 personas; tienen usos, costumbres, tradiciones y lengua propios; tienen autoridades tradicionales propias, que se eligen por voto, y se respeta su jerarquía a la par de las leyes civiles mexicanas; se autodenominan "Seris" (caminantes de dunas o arenales). Actualmente la comunidad se dedica a la agricultura, frecuentemente con técnicas avanzadas y con prácticas sustentables. En la actualidad y con base a los apoyos federales de la nación y en aras de producir subproductos de orégano (extracto para medicina tradicional, aceite esencial, especias, pan, etc.), y si bien ya utilizan líneas mejoradas, están demandando se les proponga un sistema de producción de orégano con el uso de biofertilizantes; lo anterior debido a las condiciones bajo las que producen (suelos con baja disponibilidad de materia orgánica (M.O.) <1% y pH arriba de 8); aunado a lo anterior, la salinidad se ha vuelto un intruso de suelos agrícolas (Borboa-Flores et al., 2016; Lastiri et al., 2017; Romero-Perdomo et al., 2017) y los costos de producción se ven incrementados, sobre todo al sustituir la baja disponibilidad de M.O. por altas aplicaciones de fertilizantes químicos y donde su uso indiscriminado ha agravado el problema local de la salinidad, el cual está presente en las regiones agrícolas de la zona árida de México.
Existe una especie de orégano, Lippia palmeri Watts que crece de manera natural en suelos costeros, adaptada a suelos pobres en materia orgánica y alta temperatura (García-Pérez et al., 2012). La aplicación de microorganismos benéficos presentes en el sistema radicular de las plantas, entre los que resaltarían aquellos tolerantes a la salinidad y que son denominadas halobacterias promotoras del crecimiento de plantas (HPCP) se plantea como una alternativa a la intrusión salina y que disminuiría las aplicaciones de fertilización sintética (Romero-Perdomo et al., 2017; Renganathan et al., 2018). Las HPCP tienen la capacidad de asociarse al sistema radicular, beneficiar a la planta y mitigar el efecto de la salinidad en el suelo; mejoran los rendimientos de los cultivos proveyéndoles de nutrimentos mediante la fijación de nitrógeno atmosférico, solubilización de fosfatos, asimismo influyen en la planta por su producción de fitohormonas, como las auxinas y gibelinas (AG3) (Puente y Bashan, 1993; Puente et al., 1999; Loredo-Osti et al., 2004). Entre los estudios con halobacterias y cultivos hortícolas y de interés forrajero figuran los de Rueda-Puente et al. (2009), Villegas-Espinoza et al. (2014), Borboa-Flores et al. (2016), Pathak y Kumar (2016), Mahanty et al. (2017), Jiménez-Gómez et al. (2018), Renganathan et al. (2018) y Söğüt y Çığ (2019), entre otros. Sin embargo, aquellos estudios dirigidos a plantas aromáticas y su asociación con bacterias benéficas como son las promotoras del crecimiento vegetal de tipo halotolerante, son nulos en la región noroeste de México. En el contexto de una agricultura sustentable, y a que las HPCP incrementan la productividad de la planta, es importante proponer biofertilizantes en una agricultura de alta intrusión salina y temperatura para el cultivo de orégano en el noroeste de México. Con base a lo anterior, el objetivo del presente trabajo consistió en aislar e identificar las HPCP termo-y halo-tolerantes, con actividad solubilizadora de fosfatos, productoras de ácidos orgánicos y sideróforos, además de su capacidad de fijar nitrógeno asociadas a la rizosfera de L. palmeri, en la zona árida del Noroeste de México.
MATERIALES Y MÉTODOS
Muestreo de raíces y suelo para aislamiento microbiano
El muestreo se realizó en la zona árida indígena de los COMCÁAC (indígenas Seris) a 140 km al oeste de la ciudad de Hermosillo, Sonora, México. Las coordenadas son 112° 07' 14.9" y 112° 07' 15.3" W y 28° 59'18.2" y 28° 59'18.4" N a 46 metros sobre el nivel del mar. Predominan suelos tipo franco-arenosos y arenosos, pobres en nitrógeno y materia orgánica, con clima seco árido-desértico (BWh) (según la clasificación climática de Köppen) con temperatura media anual de 20-22 °C y precipitación media de 123 mm.
Las muestras de raíz y suelo fueron colectadas a 10 cm de distancia del tronco de cinco plantas silvestres de L. palmeri en la etapa de floración y de tres años de edad aproximadamente. Se tomaron tres submuestras por cada planta (500 g de suelo y raíces) y a una profundidad de 20, 40 y 60 cm. Los arbustos fueron seleccionados por su robustez (1.80 ± 10 cm de ancho), altura (1,50 ± 10 cm) y color (verde opaco intenso). El material colectado se depositó en bolsas de plástico oscuras, se etiquetaron con sus correspondientes datos de colecta y se guardaron en un recipiente térmico con hielo que presentaba una temperatura entre los 4 ± 2 °C para su traslado al laboratorio.
Procesamiento de muestras de suelo rizosférico y raíces para el aislamiento de cepas fijadoras de N2
El aislamiento microbiano se llevó a cabo considerando las siguientes condiciones: temperatura de incubación (35 y 45 °C), medio de cultivo (Rennie y Ashby) y concentración de NaCl (0, 0,25, 0,50 y 0,75 M), con tres replicas. Considerando las cinco plantas, y las tres profundidades hace un total de 480.
En el laboratorio, suelo y raíces de cada muestra fueron separada; las raíces fueron seccionadas a 2 cm según Puente et al. (1999). Las raíces de cada planta fueron depositadas en dos medios de cultivo carentes de una fuente de nitrógeno; uno de ellos en medio líquido (medio de Rennie) (Rennie, 1981) en matraces de 500 mL y el otro en medio sólido (medio de Ashby) en cajas Petri según Vital López et al. (2015). Posteriormente, las cajas Petri con medio sólido se incubaron en una cámara climática por 43 h, sometiendo a dos temperaturas los medios de cultivo con raíces de cada planta a 35 y 45 °C. Por su parte, de los matraces con medio líquido y raíces, una vez transcurrida la incubación, se tomó una alícuota para ser diluida en agua estéril en una proporción 1:10 y de la quinta dilución se tomó 0.1 mL para sembrar por triplicado en medio libres de la fuente de nitrógeno: sólido Rennie (Rennie, 1981) y medio sólido Ashby (Vital López et al., 2015); ambos medios considerando concentraciones de NaCl (0, 0,25, 0,50 y 0,75 M).
Con relación al suelo colectado, se seleccionó el suelo adherido a las raíces (rizósfera); 4 gr de suelo rizosférico (SR) se obtuvieron de cada muestra y se depositaron en agua destilada estéril para su dilución (1:100 SR: agua por volumen). La solución resultante fue diluida en serie en una proporción 1:10 y de la quinta dilución se tomó 0,1 mL para sembrar por triplicado en dos medio líquidos libres de la fuente de nitrógeno: Rennie (Rennie, 1981) y Ashby (Vital López et al., 2015); ambos medios considerando concentraciones de NaCl (0,25, 0,50 y 0,75 M). Los medios de cultivo se incubaron por 120 horas a 30 y 45 °C, según Rueda-Puente et al. (2010). Con relación a los matraces con medio líquido y SR, una vez transcurrida la incubación, se tomó una alícuota para ser diluida en agua estéril en una proporción 1:10 y de la quinta dilución se tomó 0,1 mL para sembrar por triplicado en medio libre de la fuente de nitrógeno: sólido Rennie (Rennie, 1981) y medio sólido Ashby (Vital López et al., 2015); ambos medios considerando concentraciones de NaCl (0, 0,25, 0,50 y 0,75 M). Con base a lo anterior descrito, 96 unidades experimentales (cajas Petri) por cada planta selecta y muestreada fueron consideradas para SR y raíz, originando 486 en total para su análisis por las cinco plantas.
Muestreo y análisis químico de suelo
Durante la colecta de suelo y raíz de las plantas de orégano, se realizó un muestreo de transecto variable de 2 x 10 mts y con el apoyo de una pala, se tomaron tres sub muestras de suelo alrededor cada planta muestreada a una distancia de 10 cm del tronco de L. palmeri, se consideraron diferentes profundidades de 20, 40 y 60 cm hasta obtener la cantidad de 500 g de suelo para formar una muestra compuesta. Se realizó el análisis de suelo para identificar su clasificación, en ppm (mgkg suelo): N-NO3, P, Ca, Mg, Na, C.I.C. en mEq.100gm, % Cationes Intercambiables: Ca, Mg, Na y K con base a Aguilar-Murillo et al. (2013).
Selección y purificación de los microorganismos fijadores de N2
Con la finalidad de aislar y purificar las colonias desarrolladas, las bacterias presentes en los distintos cultivos sólidos y en las diferentes concentraciones de NaCl utilizadas, se manejó el medio sólido TSA (Trypticase Soy Agar) (Becton, Dickinson and Company) considerando la concentración salina a la que se desarrolló siguiendo las recomendaciones de Manovsky (1982) e incubándolas a 30 °C durante 24 h. Los aislados bacterianos fueron preservados y almacenados en 15 % de glicerol a -70 °C (Carrillo et al., 1998). Posteriormente se tomó una colonia de cada aislado y se le realizó un frotis para la tinción de Gram, apoyándose de portaobjetos y utilizando un kit para tinción (Hycel de México S.A. de C.V.), según Javor et al. (1984); las muestras bacterianas fueron observadas en un microscopio óptico (Olympus cx31). Posteriormente a cada uno de los aislados se le realizó una caracterización morfológica en donde se incluyeron datos de color, consistencia, apariencia, borde, elevación, tipo de crecimiento y forma de la colonia según Javor et al. (1984), Barrow y Feltham (1993) y MacFaddin (2000). Posteriormente, se realizó a cada cepa bacteriana una curva logarítmica de crecimiento; se cultivaron en TSA durante 24 h a 150 rpm a 30 °C tomando muestras cada 2 h, de acuerdo al siguiente procedimiento: 1 mL del cultivo se vertió en una celda para espectrofotómetro (FISHER SCIENTIFIC 415), tomando la lectura de absorbancia a una longitud de onda de 540 nm contra un control de medio nutritivo sin células bacterianas. La suspensión bacteriana se diluyó hasta obtener una absorbancia de 1,00 unidad, que corresponde a una concentración de 1 x 109 UFCmL (Rueda et al., 2009; 2010; 2011).
Evaluación de la fijación de Nitrógeno (FN), Solubilización de fosfatos inorgánico (SF) y Producción de sideróforos (PS) por las bacterias aisladas
Para cada actividad biológica evaluada, las cepas seleccionadas se reactivaron por separado en medio de cultivo en TSB (Tripticase Soy Broth) durante 24 h a 150 rpm en una incubadora (Infort HT) a 30 °C. Para realizar la prueba de FN, se preparó agar sólido "Rennie" (Rennie, 1981), para SF medio SRSM (Santoro et al., 2015), el cual contiene sales de fosfato de calcio, así como purpura de bromocresol como indicador de Ph y para la prueba de PS se preparó medio solido cromoazurol S (CAS) todos se colocaron en cajas Petri por triplicado. Las placas se dividieron en seis segmentos considerando uno para el control, posteriormente en cada segmento se agregaron 2μL de cultivo puro de las cepas previamente crecidas en TSB, se incubaron a 30 °C durante 48 h, tomando lectura de diámetros de crecimiento a las 21 y 48 h con un vernier milimétrico (Mitutoyo America Corporation).
Para la prueba de FN se consideró la cepa control Azospirillum brasilense (proporcionada por el Centro de Investigaciones Biológicas del Noroeste = CIBNOR=); Con base en las medidas de crecimiento obtenidas se clasificaron como actividad nula (-) cuando no se presentó crecimiento 0,0 mm, como actividad moderada (+) cuando se presentó crecimiento de 0-7 mm y como actividad alta (++) cuando el crecimiento superó los 7 mm. Con relación a la SF y PS, con la finalidad de observar alrededor de la(s) colonia(s) bacteriana(s) una degradación mineral que se manifiesta en forma de halo (índice de degradación =mm= y evidenciado por la clarificación del medio ocasionada por la solubilización de fosfatos y producción de sideróforos). De acuerdo a los resultados de crecimiento, se clasificó como actividad nula (-) cuando no se presentó crecimiento 0,0 mm; como actividad moderada (+) con crecimiento de 0-3 mm y como actividad alta (++) cuando el crecimiento superó los 3 mm. El control utilizado para SF y PS fue "Bacillus subitilis cepa 1118a" de la colección de microorganismos extremófilos del CIBNOR".
El diseño experimental para las actividades bacterianas de fijación de Nitrógeno, solubilización de fosfatos inorgánicos y producción de sideróforos, fue un diseño completamente al azar. Los valores obtenidos, fueron evaluados con estadística descriptiva, se obtuvo la media y desviación estándar. Los resultados fueron analizados con el paquete estadístico INFOSTAT versión 2017e.
Identificación de las halobacterias con capacidad de fijar N2, solubilización de fosfatos inorgánicos y producción de sideróforos
La caracterización molecular de las halobacterias se desarrolló partir de la secuenciación del ADN que codifica para el ARN ribosomal 16s (GENEWIZ). Las condiciones para la amplificación de la reacción en cadena de la polimerasa (PCR) utilizando los primers bacterianos universales se realizó como se reportó previamente (McCabe et al., 1999; Baker et al., 2003); una secuenciación de los amplicones del gen ARN ribosomal 16S (GENEWIZ, NJ,USA) Posteriormente, las secuencias nucleotídicas se analizaron mediante un alineamiento múltiple utilizando el programa Blast (https://blast.ncbi.nlm.nih.gov/Blast.cgi) para identificación de las especies bacterianas.
Evaluación de la germinación por efecto de Bacillus amyloliquefaciens
Con base en los resultados de las actividades biológicas realizadas a las cepas en estudio; se seleccionó a Bacillus amyloliquefaciens, debido a su capacidad halotolerante y por presentar actividad positiva a las tres pruebas biológicas de promoción de crecimiento (capacidad de crecer en concentraciones de NaCl (0, 0,25, 0,50 y 0,75 M), a 45 °C, fijar N2, solubilización de fosfatos inorgánicos y producción de sideróforos). Posteriormente las semillas de orégano fueron sometidas a pruebas de germinación siguiendo las reglas ISTA (2016); utilizando un diseño estadístico completamente al azar con tres tratamientos pre-germinativos (B. amyloliquefaciens + AG3 (100 ppm) + Control agua destilada) los cuales fueron sujetos a tres concentraciones de NaCl (0, 0,06, 0,12 M) y tres réplicas.
Las semillas fueron colectadas en el estero Santa Rosa de Bahía de Kino (coordenadas: 28° 59' 18.2" N y 112°10' 9.5" O), a 46 metros sobre el nivel del mar; se utilizaron 50 semillas (0,9 x 0,6 mm de diámetro en promedio) por tratamiento y sin daños mecánicos ni de insecto. Luego, las semillas se depositaron en recipientes con agua destilada por 60 min. (Rueda-Puente et al., 2009). Enseguida se desinfectaron en una solución de hipoclorito de sodio al 3 % durante tres minutos (Carrillo et al., 1998; Rueda-Puente et al., 2009). Bacillus amyloliquefaciens se reactivó utilizando el medio de cultivo en TSB; la concentración microbiana inoculada en semilla fue la de 1 x 109 UFC. mL y la inoculación en semilla fue con base a la técnica del vacío reportada por Carrillo et al. (1998). Las semillas con su tratamiento y por triplicado se colocaron en cajas Petri utilizando como sustrato papel filtro.
Las placas fueron colocadas en una germinadora bajo oscuridad continua, con temperatura y humedad relativa controlada de 28 ± 2 °C y 90 % respectivamente, por un período de 30 días. Cada una de las placas se irrigó con las diferentes concentraciones de NaCl de manera inicial con 5 mL y posteriormente para evitar evaporación se utilizó un atomizador, se cambió el papel filtro de cada caja Petri cada tercer día. Al segundo día se observaron las primeras semillas germinadas, realizándose conteos de plántulas germinadas cada dos días (ISTA, 2016). En esta prueba se consideraron tres variables: semillas germinadas (%), tasa de germinación y longitud radicular (Gulzar y Khan, 2001).
Para determinar el porcentaje de germinación, el valor germinativo y la tasa de velocidad de germinación se siguió la metodología empleada por Borboa-Flores et al. (2016). La tasa es la velocidad de germinación en tiempo; asimismo, fue evaluada la longitud de radicular apoyándose de un vernier.
Se utilizó un diseño estadístico completamente al azar; se realizaron análisis de varianza del porcentaje de germinación transformando previamente los valores porcentuales con arcoseno (Sokal y Rohfl, 1995). La diferencia mínima significativa entre las medias de los tratamientos, de las variables estudiadas (porcentaje de germinación), fueron evaluadas mediante la prueba de Rango Múltiple de Duncan al 0,05 %. Los datos fueron analizados utilizando el programa estadístico de cómputo SAS 9.1.
RESULTADOS
Con base en la metodología planteada, los resultados indican que el tipo de suelo donde se desarrolla de manera natural L. palmeri es un tipo franco arenoso (Arena: 62,14; Limo 22,77; Arcilla: 15,09); C.E. Milimmho ssc = 6,14; saturación= 31,5 g kg-1; Capacidad de campo = 12,63 g kg1; MO 0,088 g kg-1; N-NO3= 0,09 mg kg-1; P= 3,1 mg kg-1; Permeabilidad K (cmh) = de alta a excesiva 12,5; Cationes Intercambiables: Ca = 250 g kg-1; Na = 190 g kg-1),lo cual es indicativo de que el orégano presente en el estero de Santa Rosa es tolerante a la salinidad según la C.E. obtenida en los análisis y un bajo contenido de M.O. presente.
Con relación a los aislados bacterianos de raíz (R) y suelo rizosférico (SR), se observa en la Tabla 1 un total de 15 aislados bacterianos; diez fueron obtenidos de R (crecimiento a las 43 h de incubación) y cinco de SR (crecimiento a las 120 h de incubación). Cabe indicar que, de las 15 colonias obtenidas, el 26 % corresponde a aquellas obtenidas a 0 M de NaCl; 33 % a las desarrolladas a 0,25 M y 40 % a las que crecieron a 0,5 y 0,75 M de NaCl, lo cual señala la capacidad de estos microorganismos para tolerar los altos contenidos de NaCl y similares al presente en el agua de mar (0,5 M de NaCl = 32 grL) y presente en el Golfo de California, que con sus mareas logra irrigar a las plantas de orégano del estero Santa Rosa. No obstante, en la Tabla 1 se indica la temperatura de preferencia para cada aislado, se observa que aquellas colonias halotolerantes tienden a desarrollarse en la alta temperatura estudiada.
Con base en las características morfológicas de los 15 aislados obtenidos, cuatro resultaron ser bacterias Gram positivas y 11 Gram negativas (Tabla 1). los aislados 1F, 4F y 15F presentaron morfología de bacilo y Gram negativo pequeños y cortos, mientras que los aislados 2F, 3F, 5F, 6F, 10F, 12F y 13F, presentaron morfología de bacilo pequeño y largo Gram negativo; por su parte los aislados 10F y 11F mostraron bacilos Gram positivos pequeños largos. El aislado 8F presentó morfología de cocobacilo Gram negativo pequeño y corto. El aislado 9F resultó con morfología de diplobacilo Gram positivo pequeño y largo. Por último, el aislado 14F presentó morfología de estreptobacilo grande Gram positivo (Tabla 1).
Tabla 1 Características morfológicas de los aislamientos bacterianos en rizosfera de Lippia palmeri.
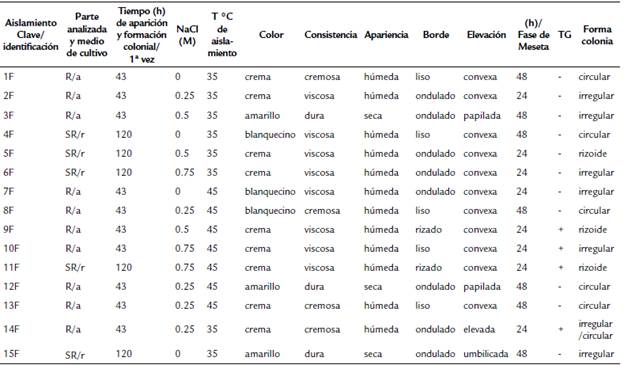
TG: Tinción de Gram; SR: suelo rizosférico; R: raíz; r: Rennie; a: Ashby; /FM: Tiempo transcurrido para alcanzar la fase de meseta en el crecimiento bacteriano.
De acuerdo con los resultados obtenidos en la tabla 2, el 46,6 % de los aislados mostró una actividad alta ++ (cuando el crecimiento superó los 7 mm), 6F, 9F,10F y 11F mostraron desarrollos significativos a las 48 h con mediciones arriba de los 8 mm (Fig. 1). El 64,4 % mostró una actividad moderada (+), con un crecimiento colonial que no superó los 6 mm (Fig. 1). En la solubilización de fosfatos (SF), la actividad alta fue en los aislados (12F,13F y 15F) (Tabla 2 y Fig. 1b), resultado que se puede apreciar con valores numéricos altos en comparación de los restantes aislados en la Figura 2a y 2b.
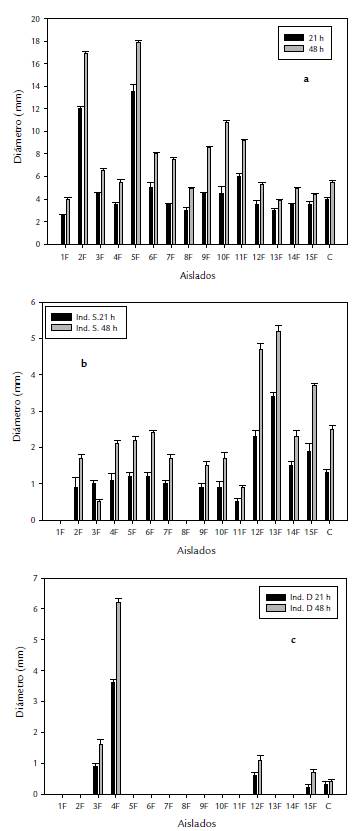
Figura 1 Colonias bacterianas aisladas de Orégano (L palmeri) sobre medio Rennie, para la prueba de fijación de nitrógeno. a) solubilización de fosfatos. b) y producción de sideróforos. c) mostrando promedios de diámetro de crecimiento radial colonial a las 21 y 48 h de incubación. Barras en columnas indican desviación estándar
Tabla 2 Actividad biológica asociadas a la promoción de crecimiento de halobacterias aisladas de raíz y suelo rizosférico de Lippia palmeri e identificación molecular mediante el gen 16Sr.
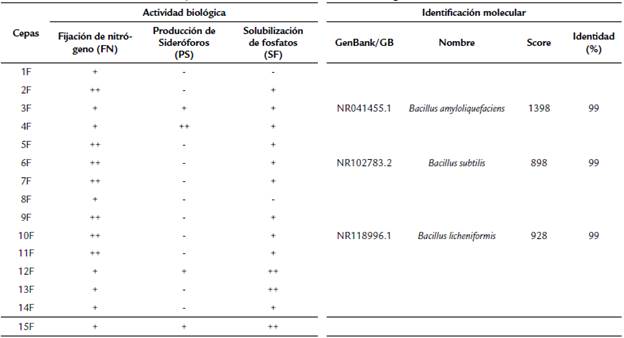
FN: Actividad nula (-) cuando no se presentó crecimiento colonial bacteriano; como actividad moderada (+) cuando se presentó crecimiento de 0-7 mm y como actividad alta (++) cuando el crecimiento superó los 7 mm. Técnica desarrollada por triplicado. SF y PS: Actividad nula (-) cuando no se presentó crecimiento; como actividad moderada (+) con crecimiento de 0-3 mm y como actividad alta (++) cuando el crecimiento superó los 3 mm.
Por su parte en la actividad biológica de Producción de sideróforos (PS), sólo se mostró actividad en cuatro aislados (Tabla 2), sobresaliendo el aislado con clave 4F, con valores significativos vs aislados activos (Fig. 1c). Cabe indicar que en las tres pruebas biológicas. Aquellos aislados con valores superiores indicados previamente, superaron a los controles utilizados para las pruebas (Azospirillum halopraeferens para FN y Bacillus subitillis 1118a). La caracterización mediante el gen 16S ribosomal arrojan que, de los microorganismos bacterianos aislados, y con base a las propiedades biológicas evaluadas, fueron selectos el 3F, 6f y 10F, correspondiendo a Bacillus amyloliquefaciens, Bacillus subtilis y Bacillus licheniformis, respectivamente (Tabla 2).
En la prueba de germinación, se pudo observar que la salinidad decremento los porcentajes de germinación (Tabla 3). No obstante, el porcentaje final de la germinación no fue favorecido por el AG3 y Bacillus amyloliquefaciens en salinidad inferiores a 0,06M de NaCl. Ésta variable fue influenciada positivamente por el inoculante bacteriano y AG3 en la más alta salinidad estudiada (0,12 M de NaCl). Este influjo fue reflejado positivamente en la Tasa de Germinación, apreciándose que la velocidad de la germinación aumenta por la halobacteria B. amyloliquefaciens, reflejándose principalmente en la germinación bajo condiciones de salinidad. Asimismo, el efecto favorable por el inoculante y el AG3, fueron positivamente con p < 0,05, en la longitud radicular, superando la halobacteria al control y al AG3 en un 100 y 70 %, respectivamente, a 0 M de NaCl, mientras que a 0,06 y 0,12 M, fue en un 35 y 60 % respectivamente.
Tabla 3 Efecto en la germinación (%), tasa de germinación y longitud radicular de Lipia palmeri por la inoculación por Bacillus amyloliquefaciens en semilla de orégano vs Acido giberélico, bajo condiciones de salinidad.
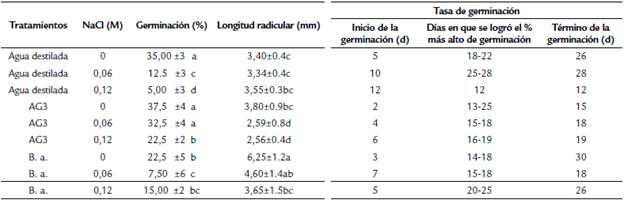
AG3: Ácido giberélico a 200 ppm.; B.a.: Bacillus amyloliquefaciens; d: días. Las medias con letras iguales en una columna para cada factor no son estadísticamente diferentes (Tukey, p < 0.05); ± desviación estándar.
DISCUSIÓN
Las zonas áridas adolecen de factores abióticos que agudizan una agricultura convencional. Las altas temperaturas, los bajos contenidos de materia orgánica aunado a una intrusión salina figuran son los principales causantes de una agricultura improductiva, y el noroeste de México no es omiso a estos factores. Para contrarrestar lo anterior, en una agricultura aledaña a los sistemas costeros, entre las alternativas se propone promover cultivos tolerantes a la salinidad como el orégano, que últimamente resulta atractivo principalmente para comunidades ubicados en el litoral costero, entre ellas la comunidad indígena COMCAAC en el estero Santa Rosa, Bahía de Kino, Sonora. Entre otras alternativas se encuentran los biofertilizantes, sobre todos aquellos que tengan la capacidad de tolerar la salinidad y altas temperaturas que prevalecen en el tipo de ambientes donde se produce orégano.
Los resultados obtenidos en el presente estudio, revelan la gran biodiversidad de microorganismos capaces de fijar N2 atmosférico, solubilizar fosfatos y producir sideróforos asociados a la raíz y suelo rizosférico de L. palmeri silvestre presente en el estero costero; microorganismos que deben tener la capacidad halotolerante pues habitan en suelos con características físico-químicas con concentraciones de sales y pH altos, en comparación de aquellos requeridos para el desarrollo de cultivos agrícolas. Los estudios con halobacterias promotoras del crecimiento de plantas van en aumento, debido a las múltiples bondades obtenidas, la capacidad de adaptación en medios desfavorables y la increíble respuesta de su metabolismo con la simbiosis de una amplia gama de vegetales. Bondades que favorecen al desarrollo de las plantas mediante la habilidad de reducir el nitrógeno atmosférico a amonio, a través de la síntesis de un complejo enzimático denominado nitrogenasa (Ahemad y Kibret, 2014; Rincon-Molina et al., 2020), resultado que fue corroborado en presente estudio con las técnicas de actividad biológica. De manera similar a la capacidad de desarrollarse en medios libres de la fuente de Nitrógeno, los resultados del estudio arrojaron que las cepas obtenidas pudieron solubilizar (acidificar) el medio SRS, tornándolo de color amarillo brillante, la cual se evalúa cualitativamente por observación visible y medición del halo de solubilización, halo que es producto de la acidificación del medio por los metabolitos secundarios (ácidos orgánicos) producidos por las colonias bacterianas (Schwyn y Neilands, 1987).
Los ácidos orgánicos, tienen entre otras funciones actuar como quelantes de los cationes de calcio (Ca+2) principalmente; sin embargo, también son relevantes para Fe, Al y Mg que acompañan la liberación de fosfatos a partir de compuestos fosfáticos insolubles (Goswami et al., 2014). Con relación a la prueba de secreción de sideróforos, se pudo observar que no se encontró actividad en más del 50 % de los aislados, sin embargo y con base a la Tabla 2, los cuatro microorganismos con actividad positiva mostraron moderada y alta actividad en esta prueba (4F). Actividades que rebasaron a los controles utilizados en el presente estudio y que muestran que aparentemente estas bacterias son capaces de liberar sustancias quelantes (sideróforos) que atraen el hierro hacia la rizósfera, donde puede ser absorbido por la planta (Radzki et al., 2013; Ahmed y Holmstrõm, 2014; Mancilla et al., 2017). Además, estos sideróforos son secretados por las bacterias favoreciendo la competitividad e inhibiendo el crecimiento de otros microorganismos, debido a su acción antibiótica que impide el crecimiento de patógenos limitando el hierro disponible para ellos (Shen et al., 2013).
Por otra parte, con relación al estudio de germinación bajo las condiciones evaluadas, se pudo observar que resultados similares se han obtenido para otras plantas (Puente et al., 1999; Corella y Ortega, 2013; Costerousse et al., 2018) y que, aunque los ensayos se hayan efectuado con otras plantas y otros microorganismos benéficos, algunos inhiben los efectos sobre la germinación (Hanslin y Eggen, 2005; González et al., 2017; Tahami et al., 2017). Sin embargo, otros estudios muestran efectos positivos con este tipo de microorganismo (Puente y Basham, 1993) que también coinciden con los resultados del presente estudio. Los efectos positivos de Bacillus amyloquefasciens observados en el presente estudio se deben aparentemente a la producción de sustancias promotoras de crecimiento según lo reportado en otros estudios (Mishra et al., 2017; Rajput et al., 2018; Khan et al., 2019; Kutlu et al., 2019; Ribeiro y Simoes, 2019).
CONCLUSIONES
El presente estudio, evidencia la presencia de microorganismos que se desarrollan en zonas áridas como halotolerantes y asociados a Lippia palmeri en los esteros de Santa Rosa de la Comunidad Indígena COMCAAC; 15 aislados presentaron la capacidad de crecer en medios de cultivo libre de una fuente de nitrógeno como un indicativo a la fijación de nitrógeno, además de tener actividad para solubilizar fosfatos y producir sideróforos. La identificación por el gen ribosomal 16S indican la presencia de Bacillus amyloliquefaciens, Bacillus subtilis subsp. subtilis y Bacillus licheniformis. La inoculación de Bacillus amyloliquefaciens, en la etapa de germinación como fase inicial, muestra resultados significativos con p < 0,05, en la longitud radicular en presencia de NaCl. Este es el primer informe de Bacillus amyloliquefaciens como una bacteria fijadora de nitrógeno asociada a Lippia palmeri. Estudios relacionados con la (co-inoculación) promoción vegetal deben ser considerados en posteriores estudios considerando a los microorganismos caracterizados en el presente estudio (Bacillus amyloliquefaciens, Bacillus subtilis and Bacillus licheniformis).















