INTRODUCCIÓN
La familia Cerambycidae es conocida como escarabajos longicornios debido a la longitud de sus antenas, que por lo general son más largas que el resto del cuerpo (Martínez, 2000). Esta familia está dividida en ocho subfamilias Parandrinae, Prioninae, Lepturinae, Spondylidinae, Necydalinae, Cerambycinae, Lamiinae y Dorcasominae, de las cuales las siete primeras se encuentran en el continente americano (Bezark, 2020). Ecológicamente este grupo de coleópteros es importante en el proceso de la circulación de los minerales hacia el suelo, ya que al igual que la mayoría de los escarabajos barrenadores de madera, propician las condiciones para la invasión de hongos que la descomponen (Martínez, 2000). Su alimentación es variada, desde troncos, ramas, frutos, semillas, raíces y tallos herbáceos (Noguera, 2014). Algunas especies perciben compuestos volátiles expedidos por fuentes maderables a través de estructuras presentes en las antenas llamadas sensilias (Álvarez et al., 2015).
La presencia de los cerambícidos está determinada por diversos factores, como la composición de las especies vegetales, la cubierta del dosel, la hojarasca y los árboles en descomposición (Noguera, 2014). La relación entre los factores ambientales y los cerambícidos permite catalogarlos como organismos bioindicadores, ya que su riqueza, abundancia y distribución pueden ser alterados debido al cambio de uso de suelo, tala y extracción de madera (Noguera et al., 2012; Noguera, 2014).
En México se encuentra el 4,46 % de la diversidad mundial de este grupo (Noguera, 2014; Wang, 2017), de las cuales el 48,58 % de las especies registradas para el país son endémicas (Noguera, 2014), valores que puede aumentar conforme los estudios de diversidad de cerambícidos se incrementen. Los estados que más aportan a la riqueza de cerambícidos en el país son Veracruz, Oaxaca, Jalisco y Chiapas (Noguera, 2014), con un evidente vacío en la información de este grupo para el estado de Tabasco, ya que son pocos los estudios de la entomofauna en la entidad. Por lo anterior, el objetivo del presente estudio fue estimar la diversidad y fluctuación anual de cerambícidos asociados al borde e interior de una selva tropical en el estado de Tabasco.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se realizó entre agosto de 2016 y julio de 2017 en la selva tropical de la Sierra el Madrigal (17°32'17" N y 92°55'08" O) en el municipio de Teapa, Tabasco, México. El sitio de estudio se caracteriza por presentar relictos de selva alta perennifolia, en el borde de este ecosistema se encuentran especies vegetales principalmente de las familias Rubiaceae, Solanaceae, Petiveriaceae, Cyperaceae, Urticaceae, Musaceae, Bixaceae, Malvaceae, Anacardiaceae, Fabaceae, Annonaceae, Bignoniaceae, Moraceae y Lauraceae. En el interior las familias mejor representadas son Boraginaceae, Solanaceae, Arecaceae, Euphorbiaceae, Piperaceae, Heliconiaceae, Moraceae, Malvaceae, Lauraceae, Meliaceae, Acanthaceae, Fabaceae y Burseraceae (Gerónimo-Torres et al., 2019).
Diseño de muestreo
Se seleccionaron tres puntos de muestreo en el borde de la selva y tres puntos en el interior, tanto los puntos del borde como los del interior estuvieron separados a 50 m de distancia y la separación del borde al interior fue de 200 m. La captura de los insectos se realizó con trampas de intercepción cebadas con alcohol etílico al 70 % y con trampas de luz ultravioleta. En cada punto de muestreo seleccionado se instalaron tres trampas de alcohol a tres diferentes alturas: 1,5, 6 y 12 m, con el objetivo de maximizar el esfuerzo de captura. La recolecta de los especímenes atraídos en cada una de las trampas se realizó quincenalmente por un año. En el caso de las trampas de luz ultravioleta, las capturas fueron realizadas una vez al mes en cada punto de muestreo por un año, a una altura de 1,5 m. Las trampas fueron instaladas a las 18:00 h y levantadas al día siguiente. Las muestras recolectadas fueron etiquetadas y conservadas en alcohol etílico al 70 % para su posterior determinación (Pérez-De la Cruz et al., 2009a; b).
Identificación de ejemplares
La determinación taxonómica de los insectos se realizó mediante el uso de claves taxonómicas, descripciones de especies (Toledo, 1997; Turnbow y Thomas, 2002; Verdugo, 2004; Toledo y Hovore, 2005; Maes et al., 2010a; b; c; d; e; Enríquez, 2012; Monné y Bezark, 2014) y comparaciones con material depositado en la Colección de Insectos de la Universidad de Tabasco (CIUT).
Análisis de datos
La diversidad de Cerambícidos presentes en el borde e interior de la selva se determinó con el índice de diversidad verdadera de orden 1 (1D), en la cual considera las especies más abundantes en la comunidad (Moreno et al., 2011) a través del programa EstimateS 9.1.0 (Colwell, 2013). La equitatividad de la comunidad se analizó con el índice de Pielou, la similitud con el índice de Sorensen y la completitud del muestreo a través de las curvas de acumulación de especies mediante el estimador no paramétrico Chao 1 (Moreno, 2001). Para comparar la distintividad taxonómica entre el borde e interior, se emplearon las métricas asociadas al análisis de jerarquías taxonómicas propuesta por Warwick y Clarke (1995), con los siguientes niveles taxonómicos; familia, subfamilia, tribu, género y especie; a través de los cuales se calculó: 1) el índice de diversidad taxonómica (∆), el cual mide la distancia taxonómica entre dos individuos elegidos al azar, 2) el índice de distintividad taxonómica (∆*), el cual mide la distancia taxonómica esperada entre dos individuos elegidos al azar, los cuales pertenecen siempre a especies diferentes; y 3) el índice de distintividad taxonómica promedio (A+), el cual estima el promedio de distancias taxonómicas entre especies. Finalmente, la abundancia de los insectos recolectados mensualmente se comparó gráficamente con la precipitación, temperatura y humedad promedio, datos obtenidos de la estación meteorológica del campo experimental Puyacatengo (17°31'38" N y 92°55'50" O).
RESULTADOS
Composición de la comunidad
Se recolectaron 295 especímenes de tres subfamilias, pertenecientes a 56 especies de 38 géneros; Lamiinae fue la subfamilia con mayor diversidad, con 40 especies distribuidas en 20 géneros, para Cerambycinae se recolectaron 14 especies de 12 géneros y para Parandrinae dos especies de un género. El género con mayor riqueza fue Leptostylus LeConte, 1852 con ocho especies, seguido de Urgleptes Dillon, 1956 con cinco. Se identificaron seis especies como nuevos registros para México y 29 para Tabasco (Tabla 1).
Tabla 1 Riqueza y abundancia de cerambícidos capturados en el borde e interior de una selva tropical del sureste de México. Nuevos registros de especies para el estado de Tabasco*. Nuevos registros para México**.
| Borde | Interior | Total | Borde | Interior | Total | ||
|---|---|---|---|---|---|---|---|
| Lamiinae | Lamiinae | ||||||
| Amniscites sp | 1 | 0 | 1 | Desmiphora cirrosa Erichson, 1847* | 2 | 0 | 2 |
| Anisopodus sp | 1 | 0 | 1 | Estola sp | 3 | 0 | 3 |
| Eutrypanus mucoreus (Bates, 1872) | 0 | 1 | 1 | Ptychodes politus Audinet-Serville, 1835* | 1 | 0 | 1 |
| Hyperplatysgriseomaculata Fisher, 1926** | 5 | 1 | 6 | Taeniotes scalatus (Gmelin, 1790)* | 0 | 2 | 2 |
| Lagocheirus araneiformis fulvescens Dillon, 1957* | 1 | 2 | 3 | Lochmaeocles batesi (Aurivillius, 1923)* | 4 | 1 | 5 |
| Lagocheirus binumeratus Thomson, 1861* | 1 | 0 | 1 | Oncideres rubra Franz, 1959* | 0 | 1 | 1 |
| Leptostylus gibbulosus Bates, 1874* | 50 | 8 | 58 | Sternycha paupera (Bates, 1885)* | 0 | 1 | 1 |
| Leptostylus hilaris Bates, 1872 | 15 | 1 | 16 | Tulcus lycimnius (Dillon & Dillon, 1945)* | 4 | 1 | 5 |
| Leptostylus laevicauda Bates, 1880** | 2 | 0 | 2 | Ataxia sp | 12 | 9 | 21 |
| Leptostylus sp1 | 1 | 0 | 1 | Esthlogena albisetosa Bates, 1880* | 1 | 1 | 2 |
| Leptostylus sp2 | 0 | 1 | 1 | Esthlogena sp | 6 | 6 | 12 |
| Leptostylus sp3 | 1 | 0 | 1 | Cerambycinae | |||
| Leptostylus sp4 | 1 | 0 | 1 | Chlorida cincta Guérin-Méneville, 1844* | 1 | 3 | 4 |
| Leptostylus x-griseus Bates, 1885** | 0 | 2 | 2 | Ayriclytus bolivianus Martins & Galileo, 2011** | 0 | 3 | 3 |
| Lepturginus obscurellus Gilmour, 1959* | 2 | 0 | 2 | Mecometopus aesopus (Chevrolat, 1860)* | 0 | 1 | 1 |
| Atrypanius leucopygus (Bates, 1872) * | 0 | 6 | 6 | Mecometopus sp | 0 | 1 | 1 |
| Atrypanius haldemani (LeConte, 1952)* | 5 | 2 | 7 | Neoclytus cacicus (Chevrolat, 1860)* | 0 | 1 | 1 |
| Urgleptes ozophagus Chemsak & Feller, 1988** | 1 | 2 | 3 | Placosternus crinicornis (Chevrolat, 1860)* | 1 | 0 | 1 |
| Urgleptes sinuosus Gilmour, 1960* | 0 | 1 | 1 | Placosternus guttatus (Chevrolat, 1860)* | 2 | 8 | 10 |
| Urgleptes sp1 | 0 | 1 | 1 | Anelaphus eximium (Bates, 1885)* | 1 | 0 | 1 |
| Urgleptes sp2 | 1 | 0 | 1 | Elaphidion sp | 0 | 2 | 2 |
| Urgleptes sp3 | 0 | 2 | 2 | Tethlimmena aliena Bates, 1872** | 1 | 0 | 1 |
| Myoxinus pictus (Erichson, 1847)* | 1 | 0 | 1 | Engyum virgulatum (Bates, 1880)* | 1 | 0 | 1 |
| Myoxinus sp | 1 | 0 | 1 | Compsibidion vanum (Thomson, 1867)* | 8 | 59 | 67 |
| Oreodera sp | 6 | 0 | 6 | Pleuromenus baccifer Bates, 1872* | 2 | 1 | 3 |
| Thryallis leucophaeus (White, 1855)* | 2 | 0 | 2 | Trachyderes elegans blandus Dupont, 1840* | 5 | 1 | 6 |
| Adetus analis (Haldeman, 1847)* | 0 | 1 | 1 | Parandrinae | |||
| Euryestola sp | 0 | 1 | 1 | Parandra sp1 | 0 | 1 | 1 |
| Colobothea hebraica (Bates, 1865)* | 2 | 3 | 5 | Parandra sp2 | 0 | 2 | 2 |
| Total de especímenes Total de especies | 155 37 | 140 36 | 295 |
Tabla 2 Diversidad de cerambícidos capturados en el borde e interior de la selva.
| Riqueza | 1 D | Equidad | Similitud | Chao 1 | |
|---|---|---|---|---|---|
| Borde | 37 | 15,96 | 0,77 | 0,47 | 56,00 |
| Interior | 36 | 12,69 | 0,71 | 0,47 | 54,86 |
Las trampas de alcohol capturaron 275 especímenes de dos subfamilias, pertenecientes a 50 especies de 30 géneros, de las cuales 36 especies de 20 géneros pertenecen a Lamiinae y 14 especies de diez géneros a Cerambycinae. Las trampas de luz capturaron 20 especímenes pertenecientes a seis especies de cinco géneros, de las cuales cuatro especies de cuatro géneros pertenecen a Lamiinae y dos especies de un género a Parandrinae. Las especies Euryestola sp, Eutrypanus mucoreus (Bates, 1872), Oncideres rubra Franz, 1959, Parandra sp1, Parandra sp2, Sternycha paupera (Bates, 1885), Taeniotes scalatus (Gmelin, 1790) fueron capturadas solo con este método.
El borde de la selva fue la zona con mayor abundancia y riqueza de cerambícidos, donde se recolectaron 155 especímenes de dos subfamilias pertenecientes a 37 especies de 26 géneros; Lamiinae fue la subfamilia con mayor diversidad con 133 individuos de 28 especies, distribuidas en 19 géneros y para Cerambycinae se recolectaron 22 individuos de nueve especies distribuidas en siete géneros. El género con mayor riqueza fue Leptostylus con seis especies, Leptostylus gibbulosus Bates, 1874 fue la especie más abundante con el 32,26 % de la recolecta para este sitio. En el interior se recolectaron 140 especímenes de tres subfamilias pertenecientes a 36 especies de 26 géneros; Lamiinae fue la subfamilia con mayor diversidad con 57 especímenes de 23 especies distribuidas en 16 géneros y para Cerambycinae se recolectaron 80 especímenes de diez especies, distribuidas en nueve géneros; de la subfamilia Parandrinae se capturaron tres especímenes de dos especies del mismo género. Los géneros con mayor riqueza fueron Leptostylus y Urgleptes con cuatro especies respectivamente, Compsibidion vanum (Thomson, 1867) fue la especie más abundante con el 42,14 % de la recolecta total para este sitio.
Diversidad
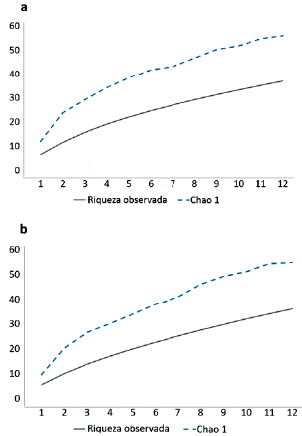
El índice de diversidad verdadera de orden 1D, mostró que el mayor valor de diversidad se obtuvo en el borde con 15,96 y el menor en el interior con 12,69, lo que indica que el borde es 1,26 más diverso que el interior. El índice de equidad (J) estableció que la comunidad de cerambícidos presenta equidades similares en el borde e interior de la selva con 0,77 y 0,71. Se determinó que las comunidades comparten una riqueza de 17 especies, con un valor de similitud (Is) del 47 % (Tabla 2). Los valores de riqueza esperada fueron de 56 y 54,86 especies para el borde e interior respectivamente, con completitudes de muestreo de 65,62 y 49,90 % (Fig. 1).
Distintividad taxonómica
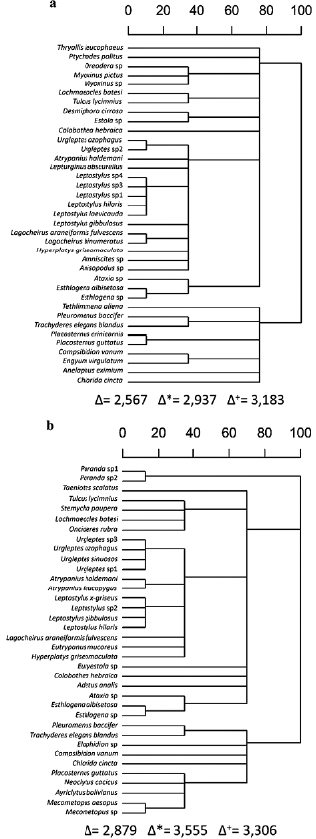
El índice de diversidad taxonómica (A), el cual considera la abundancia, mostró que las diversidades de las dos comunidades son similares. Sin embargo, el índice de distintividad taxonómica (∆*), al eliminar la posibilidad de elegir individuos de la misma especie, mostró que la diversidad es mayor en el interior. Al descartar las abundancias mediante el cálculo del índice de distintividad taxonómica promedio (∆*), se obtuvo que las distribuciones de las especies en las categorías taxonómicas tienen un valor similar entre ambas comunidades (Fig. 2).
Fluctuación anual de la comunidad
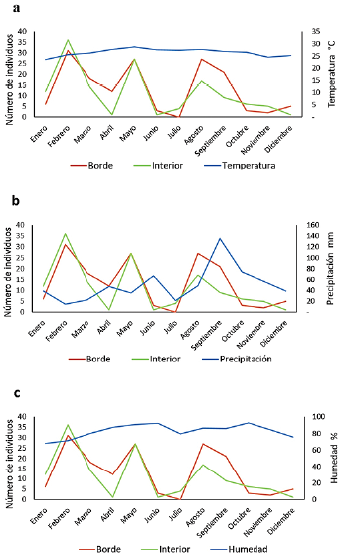
La fluctuación de la comunidad de cerambícidos presentó los máximos valores en su abundancia tanto en el borde como en el interior en febrero, mayo y agosto. Febrero fue el mes donde se registró la menor precipitación (14,29 mm) y el máximo pico de la comunidad (Fig. 3b). Sin embargo, mayo y agosto son los meses donde se registran valores medios de precipitación (35,48 y 48,38 mm) y dos repuntes en la abundancia de estos insectos. Así mismo, no se registró una relación aparente en la disminución o aumento de la abundancia de cerambícidos con los valores de temperatura y humedad (Fig. 3).
DISCUSIÓN
La riqueza de cerambícidos para el estado de Tabasco asciende a 47 especies, de acuerdo a las 12 especies reportadas por Noguera (2014) y los 35 nuevos registros determinados hasta nivel de especie en el presente estudio. Nuestro resultado presenta a las subfamilias Lamiinae y Cerambycinae como las más abundantes, resultado consistente a lo reportado por Luna-León et al. (2015) en un bosque tropical caducifolio de Guerrero, México. Sin embargo, en estudios realizados en otros estados del país (Toledo et al., 2002; Noguera et al., 2012; Morales-Morales et al., 2012) posicionan a Cerambycinae como la subfamilia más abundante por encima de Lamiinae. Lo anterior podría estar relacionado a los sitios evaluados, ya que los estudios realizados en bosques tropicales secos reportan una mayor riqueza de Cerambycinae (Toledo et al., 2002; Noguera et al., 2009; 2012), caso contrario a lo registrado en bosques tropicales lluviosos donde Lamiinae es la más diversa (Montero et al., 2007; Gutiérrez et al., 2014). Otro factor que puede influir en los resultados, son el tipo de trampas empleadas en las capturas, ya que Noguera et al. (2012) mencionan que el método más efectivo en sus recolectas es la captura directa. Este tipo de técnica favorece la recolecta de las especies de la subfamilia Cerambycinae, los cuales son más activas en el día debido a su tipo de alimentación (polen, néctar y follaje), mientras que las especies de Lamiinae se alimentan de exudados de árboles fermentados (terpenos y polifenoles), hojas, tallos, conos de coníferas y hongos (MacKay et al., 2014; Álvarez et al., 2015; Wang, 2017).
El género con mayor riqueza de especies en el estudio fue Leptostylus, dato similar a lo reportado por Noguera (2014) en la revisión de la biodiversidad de Cerambycidae en México. Lo anterior, puede atribuirse a que los cerambícidos de menor tamaño tienden a ser más ricos y abundantes en ecosistemas tropicales (Sataral et al., 2015), ya que se encuentran asociados a ramas pequeñas, donde sus larvas pueden vivir y desarrollarse (Noerdjito, 2012). Compsibidion vanum fue la especie más abundante en el interior de la selva, la cual ha sido registrada en otros estudios en áreas conservadas, tal como lo describe Nascimento et al. (2017) para la Reserva ecológica Michelin en Brasil. Por su parte, la más abundante en el borde fue L. gibbulosus, una especie de hábito espermatófago que se ha reportado alimentándose de Sapindus sp (Romero Nápoles et al., 2007; Hernández-Jaramillo et al., 2012), por lo que es posible que este aprovechando las semillas de especies vegetales presentes en el borde.
Las capturas de especies con un solo ejemplar durante el estudio obedecen a un comportamiento característico de los grupos megadiversos en ambientes tropicales, como son los artrópodos, donde se registra una alta riqueza de especies con bajas abundancias (Basset et al., 2012). Además, en el caso particular de los cerambícidos presentes en nuestro estudio, podría deberse a los cortos periodos de vida como adultos de Cerambycinae y Lamiinae (Wang, 2017), aunado al tipo de alimentación, ya que algunas tribus de Cerambycinae, como Clytini depende de la temporada de floración de la planta hospedera (Wang, 2002), y Lamiinae de la presencia de troncos y árboles caídos que liberan compuestos volátiles (Wang, 2017), los cuales son abundantes después de tormentas con fuertes vientos (Eriksson et al., 2008). El interior de la selva fue el único sitio donde se capturaron dos especies de la subfamilia Parandrinae, esto puede estar relacionado a las condiciones requeridas para el desarrollo de sus larvas, ya que las especies de esta subfamilia necesitan hasta dos años para completar su ciclo de vida, e incluso hay especies que se establecen en árboles muertos en los cuales pueden desarrollarse varias generaciones (Wang, 2017).
Las diferencias encontradas según el índice de diversidad verdadera, podrían deberse a los requerimientos necesarios en la reproducción y alimentación, ya que algunas especies están fuertemente asociadas a su planta hospedera y la variación que existe en la vegetación a través del tiempo (Goldsmith et al., 2007; Noguera et al., 2012), registrándose en este caso un mayor enriquecimiento estructural de la vegetación en el borde (Gerónimo-Torres et al., 2019), lo cual influye positivamente en la diversidad de especies.
Las altas equidades de las comunidades de cerambícidos presentadas en el borde e interior de la selva, es producto de la repartición del espacio por parte de los cerambícidos (Sataral et al., 2015), ya que al colocar las trampas a diferentes alturas se pudieron capturar especies asociadas a diferentes estratos vegetales, donde se obtuvieron valores de abundancias similares para cada especie. Los valores de completitud de muestreo según la riqueza esperada, son similares a datos obtenidos por Toledo et al. (2002) y Noguera et al. (2007; 2009) quienes registraron entre el 53 y 68 % de las especies presentes en los sitios. Lo anterior, puede deberse a las limitaciones metodológicas utilizada durante la recolecta de los insectos (Noguera et al., 2012), aunado a los cortos periodos de vida de los adultos (Wang, 2017) y la heterogeneidad del sitio de estudio, lo cual limita la recolecta de especies poco comunes asociadas a plantas hospederas menos abundantes (Noguera et al., 2012). De igual manera la heterogeneidad y el recambio de la vegetación del borde e interior de la selva podría explicar la baja similitud de especies entre ambos sitios, ya que se ha reportado que las diferentes especies de cerambícidos seleccionan diferentes especies de árboles y plantas hospederas, y que algunas de estas especies de escarabajos están íntimamente relacionadas con una determinada planta (Noerdjito, 2011).
La incorporación de las métricas propuestas por Warwick y Clarke (1995) a los estudios ecológicos ayudan a comprender aún mejor las disimilitudes ecológicas entre las especies y la diversidad de una comunidad (Pérez-Hernández, 2019). En el caso particular del presente estudio se puede observar que los valores de A, A* y A+ implican una baja separación filogenética entre las especies de cerambícidos en ambas comunidades, probablemente producto de la cercanía del borde y el interior de la selva.
Los resultados observados en la fluctuación de la comunidad de cerambícidos en el borde e interior de la selva son similares a lo reportado por Ordóñez-Reséndiz y Martínez-Ramos (2017) en bosques de la Sierra de Taxco, Guerrero, donde registran al mes de agosto entre los meses con mayor abundancia. Sin embargo, la mayor abundancia en nuestro estudio también fue registrada en febrero, resultado que difiere con lo reportado por Noguera et al. (2007; 2009; 2012) y Toledo et al. (2002) quienes registran a febrero como el mes de menor abundancia en sus estudios. Al contrastar la fluctuación de las comunidades de cerambícidos con las variables ambientales, se determina que los mayores picos de abundancia en el estudio se presentaron cuando se registraron los menores niveles de precipitación, momento donde se presentan las condiciones óptimas para poder emprender el vuelo de los adultos, como se ha reportado para otros grupos de insectos (Marini et al., 2013; Stadelmann et al., 2013; Gerónimo-Torres et al., 2019). Lo anterior difiere a lo reportado por Noguera et al. (2007; 2009; 2012) en bosques secos y caducifolios, los cuales registran la mayor abundancia a principios y durante la temporada de lluvias, ya que el agua es un factor limitante en los procesos de productividad primaria.
CONCLUSIONES
Se determinó que las diversidades encontradas entre el borde e interior de la selva son similares, así como la riqueza de especies registradas en ambos sitios, sin embargo, el número de especies compartidas fue menor al 50 %. Lo anterior deja en evidencia que la presencia de algunas especies está mediada por la distribución de su planta hospedera y a los requerimientos ambientales para su reproducción. La fluctuación de la comunidad de cerambícidos indica que el mayor número de individuos es capturado en los meses donde se presentaron niveles bajos de precipitación, posiblemente porque se presenta en esos momentos condiciones favorables para poder emprender el vuelo. Finalmente, debido a que la curva de acumulación de especies aún no presenta una asíntota, se podría incrementar nuevos registros para el estado implementando otros métodos de recolecta que han mostrado gran eficacia, como la captura directa.