Las infecciones producidas por parásitos del orden Haemosporida (Valkiünas, 2005), se transmiten a una amplia gama de aves Bradshaw et al., (2017) afectando tanto la sangre como los órganos de su hospedero (Pérez-Tris et al., 2015). En colibríes (Familia: Trochilidae), aves endémicas del continente americano, se han reportado parásitos de los géneros Haemoproteus (Valkiünas et al., 2004), Leucocytozoon (Matta et al., 2014) y Plasmodium (Marzal et al., 2015), como causantes de infecciones en poblaciones silvestres. Los estudios de Mijares et al. (2012), Harrigan et al. (2014), Marzal et al. (2015) y Moens et al. (2016), evidencian que las poblaciones de colibríes se encuentran infectadas frecuentemente y los parásitos que las afectan representan, por lo general, nuevos reportes en la literatura, tal es el caso de los cuatro linajes moleculares de Haemoproteus archilochus identificados en el norte de California en las especies colibrí de Ana (Calypte anna) y colibrí gorginegro (Archilochus alexandri) (Bradshaw et al., 2017).
En Colombia, los estudios orientados a identificar parásitos haemosporidios en colibríes han usado métodos de microscopía (Rodríguez et al., 2009; González, et al., 2014), herramientas moleculares (Gonzalez-Quevedo et al., 2016) , o ambas técnicas (Mantilla et al., 2013; González et al., 2015; Lotta et al., 2016). Todas estas investigaciones no se enfocaron exclusivamente en muestras de colibríes y la mayoría se realizaron en áreas protegidas (González et al., 2015; Lotta et al., 2015; Lotta et al., 2016; Gonzalez-Quevedo et al., 2016). Villamizar-Escalante (2017), caracterizó con métodos moleculares parásitos haemosporidios en 110 especies de aves en el departamento de Santander; sin embargo, no incluyó muestras de colibríes.
La presente contribución se enfoca en estimar la prevalencia de infección, así como reportar la presencia de los parásitos haemosporidios cuyas secuencias del gen Cyt b se identificaron en poblaciones de colibríes en el departamento de Santander. Para esto, se muestrearon seis localidades del departamento ubicadas sobre la vertiente occidental de la Cordillera Oriental de los Andes (Fig. 1), caracterizadas por ser zonas agroforestales o urbanas. El esfuerzo de muestreo se estimó en 170 horas-red por localidad (sensu Villarreal et al., 2004). Un total de 86 individuos de 20 especies de colibríes fueron capturados (rango = 1 hasta 24 individuos por especie) y después de la toma de muestras sanguíneas fueron liberados. De cada individuo se extrajo entre 10 y 50 jL de sangre por punción de la vena yugular, acorde a lo indicado por Owen (2011). La sangre se almacenó en tubos estériles con 50 jL de etanol absoluto y para la extracción de ADN se procedió según lo descrito en el protocolo de Green y Sambrook (2012). El diagnóstico de la infección se llevó a cabo empleando PCR con los cebadores 343F y 496R descritos por Fallon et al. (2003). Posteriormente, con el objetivo de amplificar un fragmento de 478 pb del gen Cyt b de los parásitos, se hizo PCR anidada con las muestras diagnosticadas como positivas según se encuentra descrito en Hellgren et al. (2004). Los productos de PCR anidada fueron visualizados en geles de poliacrilamida al 6 % teñidos con AgNO3 (Santos et al., 1993) y luego fueron purificados y secuenciados mediante la técnica Sanger en un ABI 3500 en el Servicio de Secuenciación y Análisis Molecular de la Universidad Nacional de Colombia (SSiGMoL). Las secuencias obtenidas se editaron con CodonCode Aligner v. 8.0.1 (CodonCode Corporation, 2018) y la identificación se realizó mediante el uso de BLAST (Altschul et al., 1990), comparando con secuencias depositadas en GenBank.
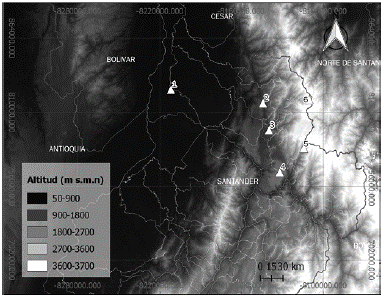
Figura 1 Localidades donde se muestrearon colibríes en el presente estudio. 1. Campo Duro, Municipio de Puerto Wilches (65 m s. n. m.); 2. San Benito, Municipio de Rionegro (902 m s. n. m.); 3. Campus Central de la Universidad Industrial de Santander - UIS, Municipio de Bucaramanga (959 m s. n. m.); 4. Hacienda El Roble, Municipio de Los Santos (1650 m s. n. m.); 5. La Esparta, Municipio de Santa Bárbara (1900 m s. n. m.); 6. La Laguna, Municipio de Vetas (3417 m s. n. m.).
Los resultados aquí reportados, no se corroboraron con técnicas de microscopia, pero los métodos basados en PCR se han considerado como adecuados para este tipo de identificaciones (Fallon y Rickfles, 2008). La infección se presentó en 37 muestras de 12 especies de colibríes (Tabla 1), siendo la prevalencia del 43 %. La Amazilia colirufa (Amazilia tzacatl), especie de colibrí de amplia distribución que en Colombia se encuentra hasta 2000 m s. n. m. (McMullan, 2018), mostró infección en el 45,8 % de los individuos capturados (n = 24). El 18 % de estos presentaron identidad del 100 % con la secuencia del gen Cyt b de Haemoproteus archilochus KY560447, reportada previamente en GenBank por Bradshaw et al. (2017). Las secuencias aisladas en este estudio corresponden a muestras tomadas en la Vereda San Benito, Municipio de Rionegro, Santander (Fig. 1) y se encuentran depositadas en GenBank con número de acceso MW548593 y MW548594; estas presentan 478 pb idénticos, su contenido nucleotídico es 73,2 % de AT y 26,8 % de CG y se corresponden con el linaje HUMHA4 identificado por Bradshaw et al. (2017).
Tabla 1 Especies y número de individuos de colibríes diagnosticados con infección por haemosporidios siguiendo el método sugerido por Fallon et al. (2003).
| Especies | No. de muestras analizadas | No. De muestras infectadas |
|---|---|---|
| Florisuga mellivora | 3 | 2 |
| Glaucis hirsutus | 7 | 6 |
| Phaethornis anthophilus | 3 | 2 |
| Phaethornis guy | 3 | 1 |
| Colibri cyanotus | 3 | 1 |
| Colibri coruscans | 6 | 3 |
| Anthracothorax nigricollis | 4 | 4 |
| Adelomyia melanogenys | 1 | 0 |
| Lesbia victoriae | 7 | 0 |
| Ramphomicron microrhynchum | 2 | 0 |
| Chalcostigma heteropogon | 1 | 0 |
| Aglaeactis cupripennis | 1 | 0 |
| Coeligena coeligena | 1 | 0 |
| Coeligena torquata | 1 | 0 |
| Boissonneaua flavescens | 1 | 1 |
| Campylopterus falcatus | 1 | 1 |
| Saucerottia castaneiventris | 5 | 3 |
| Saucerottia cyanifrons | 11 | 2 |
| Amazilia tzacatl | 24 | 11 |
| Uranomitra franciae | 1 | 0 |
| Total | 86 | 37 |
| Prevalência (%) | 43,0 |
Este es el primer reporte de secuencias del gen mitocondrial Cyt b de H. archilochus infectando a la especie Amazilia colirufa (A. tzacatl) en Colombia. El hemoparásito H. archilochus ha sido reportado en aves de la familia Trochilidae (Valkiünas, 2005). La descripción de este haemosporidio por Coatney y West (1938), se realizó en un colibrí gorgirrubí (Archilochus colubris) muestreado en Nebraska, U.S.A. A nivel del Neotrópico, Bennett y Borrero (1976), usando métodos de microscopia, lo reportaron infectando un individuo del Pico de Hoz Común (Eutoxeres aquila) muestreado en el sur occidente colombiano. La presencia de H. archilochus en diferentes regiones de Colombia, puede tener implicaciones en la conservación de las especies silvestres de colibríes, debido a que esta infección afecta el desempeño reproductivo y la supervivencia de sus hospederos (Godoy et al., 2014).
La identidad del 100 % entre la secuencia KY560447 con las aquí reportadas, sugiere la versatilidad que tiene este haemosporidio para infectar distintas especies dentro de la familia Trochilidae presentes en diferentes regiones zoogeográficas dentro de su distribución. A partir de los hallazgos obtenidos con evidencias de biología molecular se concluye que, H. archilochus infecta a Amazilia colirufa (A. tzacatl), hospedero no reportado en estudios anteriores. Adicionalmente, este haemosporidio se encuentra infectando colibríes en el departamento de Santander, lo cual sugiere la presencia de este en diferentes regiones de Colombia.















