Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Salud Uninorte
Print version ISSN 0120-5552On-line version ISSN 2011-7531
Salud, Barranquilla vol.24 no.2 Barranquilla July/Dec. 2008
ARTÍCULO ORIGINAL / ORIGINAL REVIEW
Reacción en cadena de la polimerasa para la detección de Salmonella sp. en leche en polvo: Optimización del método en 12 horas
Polimerase chain reaction technique for detecting Salmonella sp. in powdered milk: optimization of the method in 12 hours
José Villarreal Camacho1, Zamira Soto Varela2, Nicole Pereira San Andrés2, Lourdes Varela Prieto3, Rubén Jaramillo Lanchero4, Daniel Villanueva Torregroza4, Evelyn Mendoza Torres5
1 Microbiólogo. Investigador. joseluisvillarrealcamacho@hotmail.com
2 Estudiantes de microbiología, asistentes de investigación.
3 Docente Facultad de Medicina, Universidad Libre.
4 PhD. Docentes Facultad de Medicina, Universidad Libre.
5 Microbióloga, asistente de investigacióna, Universidad Libre.
Correspondencia: Universidad Libre, Seccional Barranquilla, Km. 7 Antigua Vía Puerto Colombia, Barranquilla (Colombia).
Fecha de recepción: 4 de septiembre de 2008
Fecha de aceptación: 29 de octubre de 2008
Resumen
Los métodos tradicionales para identificar Salmonella sp. se basan en el empleo de medios de cultivo que permiten la recuperación del microorganismo, el aislamiento en medios selectivos, la identificación bioquímica y caracterización serológica. Estos métodos son dispendiosos, tienen baja especificidad, baja sensibilidad y consumen mucho tiempo. El principal objetivo de este trabajo fue estandarizar y optimizar la técnica de PCR para detectar Salmonella sp. en 12 horas, a partir de ADN de cultivos puros y en muestras de leche en polvo, inoculadas intencionalmente con 200, 20 y 2 UFC/mL. Para la extracción del ADN se estudió la conveniencia de fenol:cloroformo:alcohol isoamílico y Chelex® 100. La temperatura de hibridización y las concentraciones de cloruro de magnesio, empleando un diseño factorial incompleto 6x7, permitieron establecer un límite de detección de hasta 10 pg de ADN en cultivos puros de Salmonella typhi. La PCR se basó en la exclusividad de los oligonucleótidos 139-141, los cuales amplificaron una banda de 284 pb para la identificación de género. Los resultados muestran que: (I) la adición de Novobiacina (45 mg/L) o de verde brillante (10 mg/L) como inhibidores de flora acompañante, después de las primeras tres horas del pre-enriquecimiento no selectivo de 6 horas, no influye significativamente en la recuperación de las células bacterianas; (II) obtener biomasa de la primera dilución en base 10 y emplear la técnica de fenol:cloroformo:alcohol isoamílico para la obtención de ADN, se pueden detectar 2 UFC/mL de Salmonella sp. en leche en polvo y que el tiempo de detección se reduce considerablemente.
Palabras claves: Salmonella sp., leche en polvo, PCR, diagnóstico molecular, diagnóstico microbiológico, optimización.
Abstract
The traditional methods to identify Salmonella sp. are based on the culture medium use that allows the recovery of the micro organism, isolation in selective media, biochemical and serologic characterization. These methods are tedious, have a low specificity and sensitivity and they generally consume a long time. The main objective of this study was to standardize and to optimize the PCR technique to detect Salmonella sp. in 12 hours, from DNA of pure cultures and from powdered milk samples, intentionally inoculated with 200, 20 and 2 CFU/mL. For the extraction of DNA, two methods were used: phenol:chloroform:isoamyl alcohol and chelex® 100. The optimization of the temperature of hibridización and the concentrations of Magnesium Chloride, using an incomplete factorial desing 6x7 allowed to establish a detection limit of up to 10 pg of DNA from pure cultures of Salmonella typhi. The PCR was based on the specificity of oligonucleotidos the 139-141, that amplified a band of 284 pb for the gender identification. The results show that: (I) the inhibitor addition of accompanying flora like Novobiocin (45 mg/L) or brilliant green (10 mg/L) as inhibitors of accompanying flora, after the first three hours in the nonselective pre-enrichment of 6 hours, does not significantly influence in the recovery of the bacterial cells, (II) when obtaining biomass of the first dilution in base 10 and using the phenol:chloroform:isoamyl alcohol technique for the extraction of DNA; can be detected 2 CFU/mL Salmonella s.p. from powdered milk and that the PCR technique reduces the time of test considerably.
Key words: Salmonella sp., powdered milk, PCR, molecular diagnosis, microbiologist diagnosis, optimization.
INTRODUCCIÓN
La Salmonella es uno de los principales agentes causantes de intoxicaciones alimentarias a nivel mundial. Dicha bacteria puede colonizar a la mayoría de los animales, incluyendo aves, reptiles, ganado, roedores y el ser humano (1). La OMS ha establecido los serotipos que afectan al ser humano con mayor frecuencia: S. typhimurium y S. enteritidis, los cuales son cada vez más resistentes a los antibióticos comunes, se multiplican a bajas temperaturas y responden efectivamente a los cambios del medio (2). La recuperación de Salmonella sp. se dificulta porque: primero, no es detectable en alimentos que tienen un bajo número de células (3) y segundo, los métodos tradicionales para la recuperación del microorganismo, aislamiento en medios selectivos, posterior identificación bioquímica y caracterización serológica, tienen baja especificidad, sensibilidad y consumen mucho tiempo (4).
Sin embargo, la implementación de técnicas como la PCR, la hibridación, el uso de biochips y de enzimas de restricción, entre otras, ha facilitado el diagnóstico microbiológico molecular de patógenos en alimentos. Actualmente se ha extendido la implementación de estas nuevas tecnologías y se han desarrollado investigaciones para el diagnóstico de Salmonella sp., mediante la evaluación de la selectividad de los oligonucleótidos después de una etapa previa de enriquecimiento de la muestra, demostrando una alta probabilidad de detectar un bajo número de células (5). Bajo el concepto de selectividad se incluyen los términos exclusividad e inclusividad. Exclusividad es la capacidad de un método para no detectar un rango relevante de cepas relacionadas que pueden provocar reacciones cruzadas, mientras que inclusividad es la capacidad de un método para detectar un rango de cepas verdaderamente positivas para los analitos blanco (6).
El objetivo de este trabajo fue optimizar el método de Reacción en Cadena de la Polimerasa (RCP), fundamentada en la exclusividad de los oligonucleótidos 139-141, para la identificación de Salmonella sp. en leche en polvo, después de una etapa previa de enriquecimiento de la muestra.
MATERIALES Y MÉTODOS
Microorganismos empleados y condiciones de crecimiento
Las cepas de Salmonella typhi, Salmonella paratyphi, Salmonella typhimurium y bacterias relacionadas con Salmonella como Klebsiella oxytoca, Kelbsiella pneumoniae y Morganella morganii, fueron cultivadas en caldo cerebro corazón (BHI; Oxoid, Solaar House, 19 Mercers Row, Cambridge, CB5 8BZ, UK) a 37°C.
Desarrollo de la PCR
Con el propósito de encontrar las mejores condiciones para amplificar el gen InvA, se estudió el efecto de la temperatura de hibridización de los oligonucleótidos y de la concentración de cloruro de magnesio, con seis y siete niveles de variación, respectivamente; proponiendo un diseño factorial incompleto 6x7 (8). El planteamiento de los experimentos y el análisis estadístico de los resultados se realizó mediante el programa Statgraphics Plus versión 5.1. Los oligonucleótidos 139 (5' GTGAAATTATCGCCACGTTCGGGCAA 3') y 141 (5' TCATCGCACCGTCAAAGGAACC 3') fueron empleados para amplificar el gen InvA de Salmonella sp., obteniendo un producto de 284 pb (9).
La PCR fue llevada a cabo en un volumen final de 25 µL, conteniendo tampón de PCR 1X (Tris-HCl [pH 8.4] 20 mM, KCl 50 mM), MgCl2 2 mM, dNTP 0.2 mM, 0.5 µM de cada oligonucleótido, 0.75 U de GoTaq ADN pol (Promega®, Madison WI 53711 USA), más 5 µL de ADN o muestra. El blanco contenía la misma mezcla, excepto la muestra de ADN y fue incluido en todos los experimentos. Se empleó un termociclador PTC-100 (MJ Research Inc. Ramsey, Minnesota, 55303 USA), programado de la siguiente manera: una desnaturalización inicial de 2' a 95°C, seguidos de 30 ciclos compuestos por 1' a 95°C, 1' a 59.9°C, 1' a 72°C y un paso final de extensión de 5' a 72°C. 10 µL de cada producto de PCR fueron cargados en gel de agarosa al 2% durante 1.5 h a 60 V, teñido con bromuro de etidio a una concentración final de 0.5 µg/mL y fotografiado sobre iluminación UV.
Selectividad de los oligonucleótidos 139-141 y límite de detección de ADN en cultivos puros
Para determinar la inclusividad de los oligonucleótidos 139-141, el ADN obtenidos de cultivos puros de Salmonella typhi, Salmonella paratyphi y Salmonella typhimurium fueron sometidos a PCR, y para determinar la exclusividad, microorganismos patógenos genéticamente relacionados con Salmonella como Klebsiella oxytoca, Kelbsiella pneumoniae y Morganella morganiii, fueron sometidos a PCR, empleando los mismos parámetros y condiciones de amplificación (6). El límite de detección fue determinado realizando diluciones de ADN de Salmonella typhi. en cultivos puros en el rango comprendido desde 1 ng hasta 1 fg (10).
Contaminación artificial de las muestras y determinación del límite de detección
100 µL de caldo BHI fueron sembrados por agotamiento en agar nutritivo e incubados por 24 horas a 37°C. Con el propósito de estandarizar el inoculo, 5 UFC fueron resuspendidas en 10 mL de agua estéril y fue ajustado hasta alcanzar una densidad óptica (DO) de 0.100. Para determinar la cantidad de UFC del inoculo, se realizó una serie de diluciones en base 10 de esta suspensión y 1 mL de las diluciones 10-6, 10-7 y 10-8, fue añadido intencionalmente a tres recipientes que contenían 25 g de leche en polvo homogenizada en 225 mL de agua peptonada (BPW; Oxoid, Basingstoke, UK) para realizar un paso de pre-enriquecimiento durante 6 horas (11). Con el propósito de suprimir la flora competitiva, en dos recipientes diferentes de cada dilución, se agregaron, a las tres horas del inicio del pre-enriquecimiento, 45 mg/L de Novobiocina y 10 mg/L de verde brillante, respectivamente (12). Cumplidas las 6 horas, se realizó una dilución 1:10 en agua destilada estéril, para disminuir la cantidad de proteína presente en la leche en polvo.
Determinación de Salmonella sp. por el método microbiológico
La detección de Salmonella sp. en leche en polvo fue realizada a partir de las diluciones 10-6, 10-7 y 10-8 como se describió anteriormente y de acuerdo con los métodos microbiológicos estandarizados por la Association of Official Analytical Chemist (AOAC) (13).
Extracción de ADN de la leche en polvo contaminada artificialmente
Se evaluó la conveniencia de la técnica con fenol:cloroformo:alcohol isoamílico y Chelex® 100. Para la obtención de biomasa, 1 mL de la muestra fue diluido en 9 mL de agua como se describió anteriormente, centrifugado por 5 minutos a 10.000 r.p.m. y lavado dos veces con tampón TE 1X (Tris-HCl 10 mM, EDTA 1mM, pH 8.0 ± 0.2).
El método de fenol:cloroformo:alcohol isoamílico se llevó a cabo resuspendiendo la biomasa en 600 µL de tampón TE 1X más SDS a una concentración final de 0.5% V/V y 2mg/mL de lisozima A. Esta mezcla se incubó durante 30' a 37°C. Para eliminar los péptidos y lípidos residuales se adicionaron 80 µL de una solución 5 M de NaCl más 100 µL de acetato de amonio 3 M y se incubó nuevamente durante 10 minutos a 65°C. La suspensión resultante se trató con una mezcla 125:24:1 de fenol:cloroformo:alcohol isoamílico. Una vez separadas las fases por centrifugación, la fase acuosa se trató con etanol absoluto (14) y el ADN precipitado fue lavado con etanol al 70% V/V, secado a 56°C y resuspendido en 20 µL de agua.
La extracción de ADN con el método de Chelex ® 100 se realizó mediante el lavado de la biomasa en 1 mL de buffer PBS y posterior resuspensión en 100 µL de agua más SDS a una concentración final de 0.5% V/V y 2 mg/mL de lisozima A, se incubó durante 30' a 37°C. 200 µL de Chelex® 100 a 5% p/v fueron añadidos, la mezcla fue incubada a 56°C por 30' y llevada a ebullición durante 8'; el tubo fue centrifugado a 12.000 rpm por 3' y el sobrenadante fue transferido a un tubo limpio (7). Para determinar la pureza y concentración de los ADN obtenidos se empleó un espectrofotómetro (Beckman DU 640, Europark Fichtenhain B13 47807Krefeld Germany).
Reproducibilidad de la PCR
La reproducibilidad de la técnica se evaluó mediante un ensayo piloto de 5 repeticiones de todo el proceso de PCR optimizado, bajo las mismas condiciones de manipulación, instrumentos y reactivos, pero con 5 operarios diferentes (15).
RESULTADOS
Desarrollo de la PCR
Según la matriz generada por el programa Statgraphics Plus versión 5.1, a cada producto de PCR visualizado en gel de agarosa (datos no mostrados) le fue asignado un valor numérico de acuerdo con el siguiente criterio de valoración: 0, no amplifica; 1, presencia de bandas tenues; 2, bandas intensas. Dichos valores fueron ingresados en el programa Statgraphics Plus versión 5.1, indicando que las variables temperatura de hibridación y concentración de cloruro de magnesio influyen significativamente sobre la amplificación con un intervalo de confianza del 95%, siendo P<0.05 para cada uno de los factores estudiados, mientras que la interacción entre ambas variables (datos no mostrados) no tienen un efecto estadísticamente significativo sobre la amplificación (P>0.05).
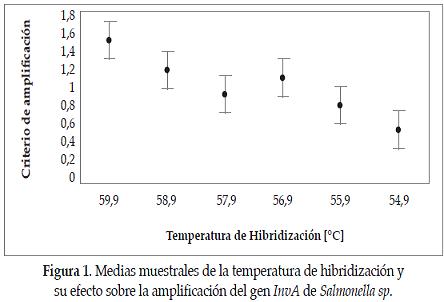
En la Figura 1 se grafican las medias muestrales de la temperatura de hibridización con intervalos de confianza al 95%, demostrando que a 59.9ºC se obtuvo la media más alta de amplificacion, cuyo valor decrece conforme disminuye la temperatura.
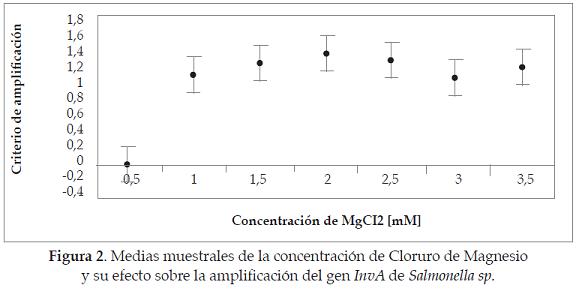
La Figura 2 indica que no se presentó amplificación a 0.5 mM; la mayor media de amplificación fue a 2mM para luego ir disminuyendo según el aumento en la concentración de cloruro de magnesio, por lo tanto se concluye que las mejores condiciones de temperatura de hibridización y de concentración de cloruro de magnesio para amplificar el gen InvA, fueron 59.9°C y 2mM, respectivamente. Sin embargo, al emplear concentraciones de cloruro de magnesio y de temperatura cercanas a las más altas, se pueden encontrar resultados satisfactorios.
Extracción de ADN
Las técnicas de extracción de ADN con fenol: cloroformo:alcohol isoamílico y Chelex® 100 fueron evaluadas. Se encontró que al realizar la extracción de ADN con Chelex® 100, a partir de cultivos puros de Salmonella sp., fue doblemente eficaz; en cambio, cuando la extracción de ADN se hace a partir de leche en polvo contaminada artificialmente con Salmonella sp., la mezcla fenol:cloroformo: alcohol isoamílico es más conveniente, porque el uso de dos solventes orgánicos como el fenol y el cloroformo en lugar de uno, permite la obtención de ácidos nucléicos libres de proteínas. Por tal motivo se adoptó el método de extracción de ADN con fenol: cloroformo:alcohol isoamílico (16).
Selectividad de los oligonucleótidos 139-141 y límite de detección de ADN en cultivos puros
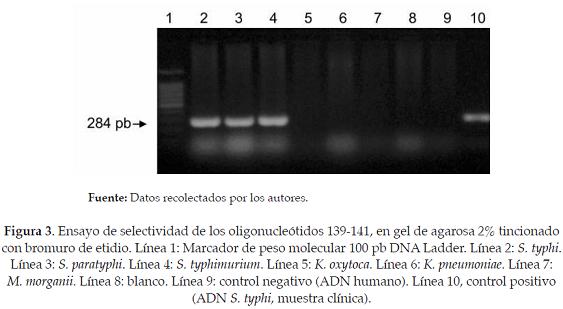
En el ensayo de exclusividad con Klebsiella oxytoca, Kelbsiella pneumoniae y Morganella morganii, no hubo amplificación. El ensayo de inclusividad con Salmonella typhi, Salmonella paratyphi y Salmonella typhimurium, mostró una banda característica de 284 pb, indicativa de amplificación (Figura 3).
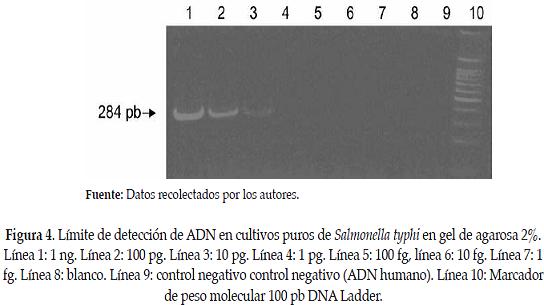
En los ensayos de PCR para determinar el límite de detección del ADN a partir de cultivos puros, se logró amplificar hasta 10 pg de ADN (ver Figura 4).
Contaminación artificial de las muestras y determinación del límite de detección
El conteo del inoculo ajustado a 0.100 D.O. fue de 200 UFC/mL y las diluciones 10-6,10-7 y 10-8, que fueron inoculadas intencionalmente, mostraron un conteo de 200 UFC/mL, 20 UFC/mL y 2 UFC/mL, respectivamente. Estos datos sugieren que la metodología empleada es capaz de detectar células de Salmonella sp. cuando es inoculada con 2 UFC/mL. La Novobiocina (45 mg/L) y verde brillante (10 mg/L), adicionada a los tres frascos con 225 mL de agua peptonada, no alteraron el crecimiento de Salmonella sp., y se observó igual crecimiento en presencia y en ausencia de estos (datos no mostrados) (12). Por lo tanto, se omite la adición de estos inhibidores. También se observó que la realización de una dilución 1:10 en agua destilada estéril para diluir las proteínas propias de la leche en polvo, cumplidas las 6 horas del pre-enriquecimiento, garantiza la obtención de ADN de buena calidad para el proceso de PCR.
DISCUSIÓN
La selectividad de los oligonucleótidos 139-141 utilizados en este trabajo ha sido objeto de estudio en varias investigaciones. La primera de ellas fue realizada por Rahn et al. (1992), en el que se amplificó una secuencia de 284 pb dentro del gen InvA para la detección de Salmonella. Para ello se emplearon 630 cepas de Salmonella y 142 géneros de bacterias diferentes a ésta. Todas las cepas evaluadas fueron detectadas, excepto de S. litchfield y S. Senftenberg, y por el contrario, ninguno de los géneros diferentes a Salmonella fue identificado (9).
Estos resultados son similares a los encontrados en este estudio, en el ensayo de selectividad de los oligonucleótidos 139-141. Dos Santos et al., en el año 2001, ratificaron el empleo de los mismos oligonucleótidos 139-141 para la amplificación del gen InvA, al comparar esta técnica con el método microbiológico tradicional. Ellos lograron la detección de Salmonella, mediante PCR, luego de la extracción del ADN por el método de fenol:cloroformo:alcohol isoamílico, y el uso de 1,5 mM de MgCl2 y una temperatura de hibridación de 54ºC, en un total de 96 horas (17), mientras que en nuestro estudio la detección se hizo en sólo 12 horas.
Soltani et al. (2005), evaluaron la selectividad de otro set de oligunucleótidos: malo2-F/ malo2-Ra que amplifican el gen InvA a través de un ensayo de PCR múltiple, y además se amplificó el gen Prt para identificar S.typhi, S. paratyphi A y B, S. enteritidis y el gen tyv solo para S. typhi and S. enteritidis, utilizando los oligonucleótidos parat-s/parat-as y tyvs/ tyv-as, respectivamente. La concentración de MgCl2 manejada fue de 1.5 mM y la temperatura de hibridación fue de 59ºC. parámetros que corresponden a los obtenidos mediante el diseño factorial incompleto 6X7, aplicado en este estudio. Sin embargo, el límite de detección de la técnica aplicada por Soltani et al. fue de 2.5 UFC/mL X 102 (18), valor superado por la metodología empleada en este estudio, con la cual se puede detectar 2 UFC/mL. Posteriormente, Cohen et al. (1996), evaluaron otros oligonucleótidos para la amplificación del gen fimA de Salmonella, alcanzando un límite de detección de 5 pg, (19) a diferencia de nuestro estudio, en el cual estuvo en el orden de 10 pg.
Con el fin de mejorar los procesos de diagnóstico molecular por la técnica de PCR, ésta se ha combinado con otros métodos, como la separación inmunomagnética utilizando anticuerpos (20, 21) o sondas fluorescentes (22) antes de cada ensayo o mediante el enriquecimiento selectivo con el medio Rappaport-Vassiliadis, BGA o XLD (23, 24). Sin embargo, los costos para la detección molecular de Salmonella sp. son elevados en comparación con los métodos tradicionales, pero la alta sensibilidad y alta especificidad que ofrece la PCR, los beneficios al sector salud al lograr un diagnóstico rápido y preciso, la relación costo-beneficio que otorga al sector productivo, permitiendo la liberación de productos alimenticios al mercado con mayor rapidez y el ahorro de costos, justifican la implementación de esta técnica.
CONCLUSIÓN
La legislación en Colombia requiere la ausencia de Salmonella sp., en 25 g de leche en polvo. En este estudio se encontró que no es posible amplificar el gen InvA directamente de leche en polvo y que un paso de preenriquecimiento por espacio de 6 horas es necesario, sin la adición de inhibidores de flora acompañante como Novobiacina o verde brillante. Además, es más conveniente emplear el método de fenol:cloroformo: alcohol isoamílico en comparación con Chelex ® 100, debido a la gran cantidad de proteínas presentes en la leche. La aplicación del diseño factorial incompleto 6X7 arrojó como resultado que al emplear 59.9°C de temperatura de hibridización y 2 mM de cloruro de magnesio, se establecen las mejores condiciones para amplificar el gen InvA de Salmonella sp., también se pueden encontrar resultados parecidos empleando temperaturas de hibridización y concentración de cloruro de magnesio, cercanas a las mejores.
La mayor contribución de este estudio fue el desarrollo de un protocolo que en 12 horas es capaz de detectar 2 UFC/mL de Salmonella sp. a partir de leche en polvo, agilizando marcadamente el tiempo de recuperación de un microorganismo de importancia en salud pública y en el sector productivo. Existe la posibilidad de emplear la misma metodología para la detección de otros microorganismos de difícil aislamiento en diferentes matrices (25), empleando los oligonucleótidos apropiados, y aplicar los resultados de este estudio para implementar controles sanitarios epidemiológicos.
Agradecimientos
Los autores agradecen a la bacterióloga Gloria Morales, directora del cepario de la Universidad de Santander en Valledupar (Colombia), por la donación de las cepas bacterianas en referencia; y al doctor Ramón Matos, por sus comentarios.
Financianción
Corporación Universidad Libre, Seccional Barranquilla.
Conflicto de intereses
Ninguno
REFERENCIAS
1. Herikstad H, Mortarjemi Y, Tauxe R V. Salmonella surveillance: a global survey of public health serotyping. Epidemiol Infect 2002 Sept; 129: 1-8. [ Links ]
2. Woo Y K. Genetic diversity of multi-resistant Salmonella enterica serotype typhimutium isolates from animals and humans. J. Microbiol 2006 feb; 44:106-11.2 [ Links ]
3. Waage A, Vardund S, Lund T, Kapperud V. Detection of low numbers of salmonella in enviromental water, sewage and food samples by a nested polymerase chain reaction assay. J. Appl. Microbiol 1999 Sept; 87: 418- 428. [ Links ]
4. Fricker C R. The isolation of salmonellas and campylobacters. J. Appl. Bacteriol 1987 Aug; 63: 99-116. [ Links ]
5. Löfström CH, Knutsson R, Engdahl CH, Radstrom P. Rapid and specific detection of Salmonella spp. in animal feed samples by PCR after culture enrichment. Appl Environ Microbiol 2004 Jan; 70: 69-75. [ Links ]
6. Feldsine P, Abeyta C, Andrews W. AOAC International Methods Committee Guidelines for validation of qualitative and quantitative food microbiological official methods of analysis. J. AOAC Int. 2002 Sept 85: 1187- 1200. [ Links ]
7. Sean P, Metzger D, Higuchi R. Chelex® 100 as a médium for simple extraction of DNA for PCR-Based typing from forensic material biotechniques 1991; 10: 506-513. [ Links ]
8. Gutiérrez Pulido H. Analisis factorial. Análisis y diseño de experimentos. Estados Unidos: McGraw-Hill Interamericana; 2004, p. 47. [ Links ]
9. Rahn K, De Grandis S A, Clarke R C, McEwen S A, Galán J E, Ginocchio C, et al. Amplification of an invA gene sequence of Salmonella typhimurium by polymerase chain reaction as a specific method of detection of Salmonella. Mol Cell Probes 1992 Aug; 6:271-279. [ Links ]
10. Trullols E, Ruisánchez I, Rius X. Validation of cualitative analytical methods. Trends Anal Chem 2004 Jan; 23: 137-145. [ Links ]
11. Moganedi K, Goyvaerts E, Venter S, Sibara M. Optimisation of the PCR-invA primers for the detection of Salmonella in drinking and surface waters following a pre-cultivation step. Water SA 2007; 33: 195-202. [ Links ]
12. Josefsen M H, Krausen M, Hansen F, Hoorfar J. Optimization of a 12-hour TaqMan PCR-based metod for detecction of Salmonella bacteria in meat. Appl Environ Microbiol 2007 May; 73: 3040-3048. [ Links ]
13. Philip T, Feldsine, A, Lienau H, Stephanie C. Leung, Linda A. Mui, Florence Humbert, Marylène Bohnert, Kirsten Mooijman, et al. Detection of Salmonella in fresh cheese, poultry products, and dried egg products by the ISO 6579 Salmonella Culture Procedure and the AOAC Official Method: Collaborative Study. J AOAC Int 2003 March; 86: 275-295. [ Links ]
14. Ausubel FM, Brent R, Kingston RE. Short protocols in molecular biology. United States of America: John Wiley & Sons; 2002, p. 2- 11. [ Links ]
15. ICONTEC. Microbiología de alimentos y alimentos para animales. Protocolo para la Validación de Métodos Alternos. Norma Técnica Colombiana de 066. Bogotá: Instituto Colombiano de Normas Técnicas y Certificación 1-87; 2001. [ Links ]
16. Sambrook J, MacCallum P, Russell D. Purification of nucleic acid. Molecular cloning: A laboratory manual. 3ra.ed. NY.USA; Col Spring Harbor Laboratory Press 2001; p. A8.9 [ Links ]
17. Dos Santos L, Nascimento V, De Oliveira S, Flores M, Pontes A, Ribeiro A, et al. Polymerase chain reaction (PCR) for the detection of salmonella in artificially inoculated chicken meat. Rev Inst Med Trop Sao Paulo 2001 Sept-Oct; 43:247-250 [ Links ]
18. Soltani M, Shahhosseiny M, Shahbazzadeh D, Karimi V, Mirzahoseini H, Mahboudi F, et al. Selective amplification of prt, tyv and invA genes by multiplex PCR for rapid detection of Salmonella typhi. Iran Biomed J 2005 July; 9: 135-138 [ Links ]
19. Cohen H, Mechanda S, Lin W. PCR Amplification of the fimA gene sequence of Salmonella typhimurium, a specific method for detection of Salmonella spp. Appl Environ Microbiol 1996 Dec; 62:4303-4308. [ Links ]
20. Jeníková G, Pazlarová J, Demnerová K. Detection of Salmonella in food samples by the combination of immunomagnetic separation and PCR assay. Int Microbiol 2000 Sept; 3: 225-229. [ Links ]
21. Hagren V, von Lode P, Syrjälä A, Korpimäki T, Tuomola M, Kauko O, Nurmi J. An 8- hour system for Salmonella detection with immunomagnetic separation and homogeneous time-resolved fluorescence PCR. Int. J Food Microbiol 2008 July; 125: 158-161. [ Links ]
22. Hagren V, Von Lode P, Syrjälä A, Soukka T, Lövgren T, Kojola H, Nurmi J. An automated PCR platform with homogeneous timeresolved fluorescence detection and dry chemistry assay kits. Anal Biochem 2008 March; 374: 411-416 [ Links ]
23. Ferraz S, Muller M, Macagnan M, Rodenbusch C, Wageck CL y Cardoso M. Detection of Salmonella sp. from porcine origin: a comparison between a PCR method and standard microbiological techniques. Braz J Microbiol 2005 Dec; 36: 373-377. [ Links ]
24. Schönenbrücher V, Mallinson E, Bülte M. A comparison of standard cultural methods for the detection of foodborne Salmonella species including three new chromogenic plating media. Int J Food Microbiol 2008 March; 123: 61-66. [ Links ]
25. ICONTEC. Microbiología de alimentos y alimentos para animales. Reacción en cadena de la polimerasa (PCR) para la detección de patógenos de alimentos. Requerimientos específicos para el método general. Norma Técnica Colombiana 5158. Bogotá: Instituto Colombiano de Normas Técnicas y Certificación; 2003. [ Links ]