Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Salud Uninorte
Print version ISSN 0120-5552On-line version ISSN 2011-7531
Salud, Barranquilla vol.24 no.2 Barranquilla July/Dec. 2008
ARTÍCULO DE REVISIÓN / REVIEW ARTICLE
REVISIONES CLÍNICAS / CLINICAL REVIEW
Diabetes Mellitus en el servicio de urgencias: manejo de las complicaciones agudas en adultos
Diabetes Mellitus in the emergency room: Handling acute complications in adults
Eder A. Hernández-Ruiz1, Jaime A. Castrillón-Estrada2, Juan G. Acosta-Vélez3, David F. Castrillón-Estrada4
1 Médico, Hospital Universidad del Norte.ederhernandez@hotmail.com
2 Residente de segundo año de Medicina Interna, Universidad del Norte.jaimeandres727@hotmail.com
3 Médico, Universidad del Norte.juan_acosta2@hotmail.com
4 Residente de primer año de Anestesiología, Universidad del CES.davidfelipe1007@yahoo.com
Correspondencia: Universidad del Norte, Km 5 vía a Puerto Colombia, A.A. 1569, Barranquilla (Colombia).
Fecha de recepción: 5 de julio de 2008
Fecha de aceptación: 1 de agosto de 2008
Resumen
La Diabetes Mellitus (DM) es una enfermedad de alta prevalencia, reconocida como un problema de salud pública, debido a sus altas tasas de morbilidad y mortalidad asociadas. Diferentes estudios han documentado que la falta de adherencia al tratamiento, constituye uno de los principales factores desencadenantes para las descompensaciones agudas en el paciente diabético. Dentro del espectro de dichas alteraciones se encuentran las crisis hiperglicémicas agudas, las cuales se han dicotomizado en dos entidades clínicas: la Cetoacidosis Diabética (CAD) y el Estado Hiperglicémico Hiperosmolar (EHH), que constituyen complicaciones metabólicas potencialmente fatales en el corto plazo y de las cuales pueden encontrarse cuadros superpuestos. Se han establecido criterios diagnósticos específicos buscando realizar un diagnóstico diferencial acertado, que permita un tratamiento idóneo; sin embargo, las tasas de morbilidad y mortalidad siguen siendo considerables. Por su parte, la Hipoglicemia también constituye una emergencia médica que, de no ser tratada oportunamente, puede ocasionar daño neurológico permanente e incluso la muerte. De lo anterior se deduce la importancia de que existan guías claras de manejo de estas alteraciones en todos los centros y servicios donde se preste atención médica de urgencias. Se siguen realizando investigaciones en busca de nuevas estrategias diagnósticas y terapéuticas que permitan un manejo más integral de la DM y sus complicaciones, en aras de mejorar la calidad de vida de los pacientes.
Palabras claves: Diabetes Mellitus, cetoacidosis diabética, estado hiperglicémico hiperosmolar, hipoglicemia.
Abstract
Diabetes Mellitus (DM) is a high prevalence disease, recognized as a public health problem because of its high morbidity and mortality rates. Some studies have expose that the lack of adherence to treatment is one of the main triggers for acute complications in diabetic patients. Those complications are the acute hyperglycemic crises, which are two clinical entities: Diabetic Ketoacidosis (DKA) and the Hyperglycemic Hyperosmolar State (HHS), which are potentially fatal metabolic complications in the short term and which can be found overlapping. They have established some specific diagnostic criteria in order to perform a correct differential diagnosis, which allows proper treatment, however, morbidity and mortality remain significantly high. Hypoglycemia is also a medical emergency, which if not treated on time, can cause permanent neurological damage and even death. That's why it is important to create clear guidelines to treat these complications, in all services, in order to provide emergency medical care. New researchs have been developed to find new diagnostic and therapeutic's strategies would allow a more integrated management of the DM and its complications, for the sake of improving patients' life quality.
Key words: Diabetes Mellitus, Diabetic Ketoacidosis, Hyperglycemic Hyperosmolar State, Hypoglycemia.
INTRODUCCIÓN
La Diabetes Mellitus (DM) es una patología caracterizada por un trastorno metabólico que lleva a un estado de hiperglicemia debido a una alteración en la secreción y/o acción de la insulina (1). Constituye un problema de salud pública cuya incidencia y prevalencia es creciente, y según la Organización Mundial de la Salud (OMS) se estima que en 2030 su prevalencia en América Latina habrá aumentado en 250% (2). En Colombia, el estudio de Aschner y colaboradores realizado en 1993, encontró una prevalencia global de 7%(3), cifra que se encuentra por encima de la determinada a nivel mundial para esos mismos años (4%)(4).
El presente artículo pretende revisar tres de las complicaciones potencialmente fatales (5,6) y causas principales de la atención del paciente diabético en urgencias.
CETOACIDOSIS DIABÉTICA
Generalidades
La CAD es un estado caracterizado fundamentalmente por tres hallazgos clínicos (7,8):
- Hiperglicemia (concentración plasmática de glucosa > 250 mg/dl)
- Acidosis metabólica (pH < 7.30 y nivel de bicarbonato de 18 mEq/L o menos)
- Cetosis.
La mayoría de los pacientes que presentan CAD padecen de DM tipo 1 (9) y constituyen entre el 8 al 29% de todos los ingresos hospitalarios con diagnóstico primario de diabetes (5). Sin embargo, los pacientes con DM tipo 2 también pueden presentar CAD, sobre todo en pacientes sometidos a situaciones de alto estrés catabólico y en algunos pacientes de grupos étnicos minoritarios (5,9). Se han encontrado pacientes con hallazgos clínicos mixtos de CAD y EHH, y las personas jóvenes, obesos y de edad avanzada, son grupos de alto riesgo para este tipo de presentaciones (10).
La incidencia de CAD se estima entre 4.6 a 8 por cada 1000 personas por año, entre el total de pacientes con diabetes (11). La tasa de mortalidad por CAD ha disminuido en los últimos años, llegando a ser < 5% en centros de atención experimentados (9,12,13). Dicha disminución se ha observado en todos los grupos de edad, y es más significativa en el grupo de los pacientes mayores de 65 años. Sin embargo, las tasas de mortalidad más altas por CAD se encuentran entre los pacientes mayores de 75 años y en los menores de 45 años (12).
Causas desencadenantes más frecuentes de CAD (5,9,14,15,16)
- Uso inadecuado o suspensión de la terapia de insulina, considerada el factor desencadenante más importante en la población afroamericana.
- Infecciones, entre las cuales la neumonía y las infecciones del tracto urinario comprenden entre el 30 al 50% de los casos.
- Primera manifestación en pacientes que debutan con Diabetes tipo 1, y constituye el 30% de la población que presenta CAD.
Otros factores precipitantes tanto para CAD como para EHH son: uso de medicamentos que alteren el metabolismo de los hidratos de carbono (glucocorticoides, agentes simpaticomiméticos, diuréticos tiazídicos y antisicóticos de segunda generación), infarto de miocardio, enfermedad cerebrovascular, pancreatitis, sangrado gastrointestinal, consumo de alcohol o cocaína y quemaduras (5,9,13,14,17). Se ha encontrado que el consumo de cocaína constituye un factor de riesgo independiente para episodios recurrentes de CAD (18). En cerca del 2 al 10% de los pacientes no es posible identificar una causa desencadenante (19).
FISIOPATOLOGÍA
Desde el punto de vista fisiopatológico la CAD y el EHH se fundamentan en tres alteraciones básicas como son (5,9,11-33,20):
- Alteración en la acción de la insulina circulante o disminución en su secreción.
- Imposibilidad de la glucosa para entrar en los tejidos sensibles a la insulina.
- Aumento en los niveles de las hormonas contrarreguladoras (glucagón, cortisol, catecolaminas y hormona de crecimiento).
En la CAD el déficit de insulina puede ser absoluto, mientras que en el EHH se encuentra una pequeña producción, que no controla la hiperglicemia pero sí puede evitar o disminuir la cetosis, al inhibir la lipólisis. La producción hepática de glucosa se encuentra aumentada gracias al déficit de insulina y al aumento de las hormonas contrarreguladoras, principalmente el glucagón, que favorecen los procesos de glucogenólisis y gluconeogénesis, siendo esta última la principal causa de hiperglicemia en pacientes con CAD (15,20).
Por otra parte, la hiperglicemia también se ve favorecida por la disminución en el uso de la glucosa circulante por parte de los tejidos sensibles a la acción de la insulina, como son el hígado, el músculo y el tejido adiposo.
La alta concentración de catecolaminas contribuye a disminuir la captación de glucosa en los tejidos periféricos. Por su parte, el incremento en los niveles de cortisol, favorece la degradación de proteínas, y aporta aminoácidos que sirven de sustrato para la gluconeogénesis. Así mismo, el déficit de insulina, aunado al aumento de las hormonas contrarreguladoras, lleva a producción de ácidos grasos libres a partir de los triglicéridos que se encuentran en el tejido adiposo,gracias a la activación de la enzima lipasa hormono-sensible, para luego ser convertidos en el hígado y el riñón en cuerpos cetónicos (Beta-hidroxibutirato y Acetoacetato), los cuales por el déficit de insulina no pueden completar su proceso catabólico en el ciclo de Krebs, se acumulan y son liberados a la circulación (9,11).
Finalmente, la hiperglicemia, ocasionada por todos los mecanismos anteriormente mencionados, origina un estado de deshidratación, diuresis osmótica y glucosuria. Por su parte, los cuerpos cetónicos favorecen la diuresis osmótica, lo cual aumenta el gasto urinario e incrementa la deshidratación y la pérdida de electrolitos, al mismo tiempo que, debido a su carácter ácido, disminuyen los mecanismos de buffer plasmáticos, consumiendo el bicarbonato, disminuyendo así el pH sérico (11).
La diuresis osmótica desencadenada por estos eventos fisiopatológicos lleva a una pérdida considerable de minerales y electrolitos (Sodio, Potasio, Calcio, Magnesio, Cloro y Fosfato), algunos de los cuales se pueden reponer rápidamente con el manejo médico, como el Na, K y el Cl y otros cuya reposición puede tomar días o semanas (21).
Por otra parte, dado que la insulina estimula la reabsorción de agua y sodio en el túbulo distal renal y de fosfato en el túbulo proximal, su déficit contribuye a mayor pérdida renal de agua y electrolitos (22).
PRESENTACIÓN CLÍNICA
Las alteraciones metabólicas propias de la CAD se pueden desarrollar en cuestión de horas, generalmente menos de 24, aunque pueden existir síntomas asociados a un control inadecuado de la DM en los días previos, como son: poliuria, polidipsia, polifagia, pérdida de peso, debilidad, deshidratación (5,23).
Signos y síntomas (5,7,9,10,16,23,24)
- Taquicardia: Secundaria a la hipovolemia y deshidratación.
- Taquipnea: Asociada a respiración de Kussmaul, con la cual el organismo trata de compensar la acidosis metabólica mediante la eliminación de dióxido de carbono
- Hipotermia: Aunque los pacientes pueden estar normotérmicos, generalmente hay hipotermia secundaria a un estado de vasodilatación periférica, aun en presencia de procesos infecciosos.
- Aliento cetónico: Los altos niveles de acetona en plasma ocasionan que al ser exhalada se presente un olor a fruta característico.
- Deshidratación: Debida a la pérdida de volumen y reflejada principalmente en sequedad de las mucosas y disminución en la turgencia de la piel.
- Dolor abdominal: Se presenta hasta en un 30% de los pacientes. De especial cuidado por tres razones:
- Puede ser originado por la misma CAD, o corresponder a una patología que pueda constituir un factor desencadenante para la CAD.
- Suele estar relacionado con la severidad de la acidosis
- Puede ser tan intenso que inicialmente podría ser confundido con un cuadro de abdomen agudo.
- Nauseas y vómitos: Presente en 50-80% de los pacientes. En algunos casos se evidencia presencia de hematemesis asociada a gastritis hemorrágica. El dolor abdominal, las nauseas y los vómitos se presentan más frecuentemente en pacientes con CAD que en aquellos con EHH, lo cual podría explicarse, por un aumento en la producción de prostaglandina I2 y E2 por parte del tejido adiposo, hecho que se ve favorecido por la ausencia de insulina característica de la CAD.
- Depresión del sensorio: El estado de conciencia puede variar desde alerta hasta el coma, el cual suele presentarse en menos del 20% de los pacientes.
Los pacientes que presenten alteraciones en el estado de conciencia, con una osmolaridad sérica efectiva menor de 320 mOsm/Kg, deben ser cuidadosamente evaluados para descartar otros procesos patológicos, como accidente cerebrovascular, infarto de miocardio, entre otros (5,9).
DIAGNÓSTICO
Ante la sospecha de CAD se debe realizar, tan pronto como sea posible, una glucometría capilar y determinar cetonas urinarias por tirillas (23). Sin embargo, en el abordaje de los pacientes en quienes se sospecha CAD o EHH se deben realizar los siguientes paraclínicos, en aras de establecer un diágnóstico definitivo (5,9,16):
- Glicemia plasmática
- Gases arteriales
- Nitrógeno ureico sanguíneo
- Creatinina sérica
- Cetonemia
- Electrolitos (Sodio, Potasio, Cloro, Magnesio, Fosfato)
- Bicarbonato
- Cálculo del Anion gap
- Uroanálisis
- Cetonuria
- Hemograma
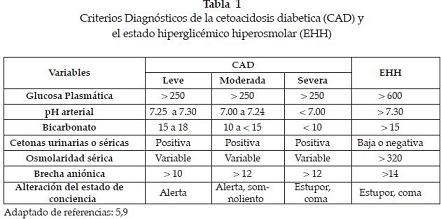
De acuerdo con los resultados de los exámenes y teniendo en cuenta los criterios establecidos por la Asociación Americana de Diabetes (ADA) (9), se puede clasificar a los pacientes como se indica en tabla 1
Los parámetros actualizados por la ADA en el 2006 han sido aplicados en la mayoría de países del mundo, incluyendo, por supuesto, los países de América, la mayor parte del continente europeo, africano y asiático (25). Estos criterios enfatizan en las concentraciones de glicemia necesarias para producir hiperosmolaridad y alteraciones del estado de conciencia, las cuales habitualmente deben superar los 600 mg/dL (9).
Otros paraclínicos que se deben realizar cuando a exista una indicación específica son (5,16):
- Electrocardiograma
- Radiografía de tórax
- Cultivos de esputo, orina y/o sangre
- Hemoglobina glicosilada (HbA1C)
- Prueba de embarazo en mujeres en edad fértil
En el contexto de la CAD y del EHH resulta de gran importancia hacer especial énfasis en los siguientes aspectos:
- CETONEMIA/CETONURIA: Constituyen parámetros importantes para su diágnostico pero no son criterio de resolución del cuadro. La medición se hace generalmente con el método que utiliza nitroprusiato, en el cual no se miden los niveles de beta-hidroxibutirato, que es el principal cetoácido en CAD, por lo que se podría subestimar la severidad del cuadro clínico.
- HBA1C: Es un elemento que nos permite diferenciar un estado de hiperglicemia crónica en un paciente con DM mal manejada, de un paciente que presenta una descompensación aguda de la enfermedad, a pesar de venir siendo controlada (5).
- LEUCOCITOSIS: Los pacientes con CAD o EHH suelen presentarla debido a hemoconcentración o cetosis. Sin embargo, valores superiores a 25000/mm3 sugieren la presencia de un proceso infeccioso y requieren mayores estudios. De igual forma, una elevación de los neutrófilos en banda indica infección con un 100% de sensibilidad y 80% de especificidad (5,16,26).
- HIPONATREMIA DILUCIONAL: Los niveles elevados de glucosa en sangre generan un gradiente osmótico que contribuye al paso de agua del espacio intracelular al extracelular. Este hecho se observa principalmente en células que usan el transportador dependiente de insulina GLUT-4, como son las células musculares y adipositos. Todo este proceso suele generar un estado de hiponatremia dilucional. El cálculo de la osmolaridad sérica es muy importante para realizar el diagnóstico de CAD o EHH y se obtiene de la siguiente manera: Osmolaridad sérica = (2 [Na + K] (mEq/L) + glucosa (mg/dL)/18 + BUN(mg/dL)/2.8.
La hiperosmolaridad causa distintos grados de hiponatremia en pacientes con CAD. Algunos autores recomiendan realizar la corrección del sodio (Na), agregando 1.6mEq/ L al Na, por cada 100 mg/dl de glucosa por encima del valor normal. De acuerdo con lo anterior, un hallazgo de hipernatremia en presencia de hiperglicemia, indicaría un nivel severo de pérdida de agua, hecho que se presenta cuando la hiperosmolaridad y la deshidratación son graves y prolongadas. De igual forma, los bajos niveles de insulina conllevan a una baja actividad de la enzima lipoprotein-lipasa, lo que se traduce en un estado de hipertrigliceridemia que favorece el efecto dilucional a nivel sanguíneo, ocasionando seudohiponatremia (5,16,23). - POTASIO SÉRICO (K): Tiende a salir al espacio extracelular debido a la ausencia de insulina, a la hipertonicidad y la acidosis. Esto ocasiona que generalmente se encuentren valores normales o elevados, a pesar que el nivel corporal total esté disminuido. Es por esto que los paciente que presenten bajos valores de K ameritan monitoreo cardíaco exhaustivo y urgente reposición del mismo, para evitar la aparición de arritmias cardíacas. Para realizar la corrección de la acidemia sobre el potasio sérico se debe sumar 0.6 mEq/L al potasio medido por cada 0.1 que caiga el valor del pH en los gases arteriales (2,9).
- BICARBONATO SÉRICO: Su valor a nivel sérico disminuye en diversos grados dependiendo de la gravedad de la CAD (2,9).
- ANION GAP: La CAD ocasiona un estado de acidosis metabólica con anion gap elevado, originado por el incremento de los niveles de cuerpos cetónicos. Sin embargo, en pocas ocasiones se puede encontrar pacientes con CAD, correctamente hidratados, cursando con acidosis hiperclorémicas sin alteraciones en el anion gap. Para calcular el anion gap se utiliza la siguiente fórmula: Anion gap = [Na - (CL + HCO3)] (16).
- AMILASA SÉRICA: Se encuentra elevada en la mayoría de los pacientes con CAD y puede representar efectos de la hipertonicidad y la hipoperfusión. Generalmente proviene de fuentes no pancreáticas como la glándula parótida (27,28).
- LIPASA SÉRICA: De gran importancia en pacientes que cursan con dolor abdominal, ya que si bien puede estar elevada en CAD, constituye un indicador más sensible y específico para procesos de pancreatitis (16).
Reevaluación de paraclínicos (9,11)
Inicialmente el control de la glicemia capilar debe ser horario hasta verificar que se están alcanzando los objetivos terapéuticos y posteriormente se controla cada 2 a 4 horas junto con electrolitos séricos, nitrógeno ureico, creatinina y pH venoso.
Diagnóstico diferencial (5,16,23)
Cetoacidosis alcohólica (CAA):
- Puede haber desde hipoglicemia hasta hiperglicemia que rara vez excede los 250mg/dl.
- Suele presentar acidosis profunda
- Asociado con abuso de alcohol y reciente disminución en el consumo del mismo.
Cetosis por inanición
- Puede haber desde hipoglicemia hasta hiperglicemia que rara vez excede los 250mg/dl.
- El nivel de bicarbonato sérico generalmente no es menor a 18 mEq/L.
Condiciones que originan acidosis metabólica con anion gap elevado:
- Acidosis láctica
- Ingestión de drogas, tales como: salicilatos, metanol, paralgehido.
- Insuficiencia renal crónica
ABORDAJE TERAPEÚTICO
objetivos del tratamiento para CAD y EHH (5,9,29)
- Mejorar y mantener un volumen circulatorio efectivo para garantizar una perfusión tisular adecuada (corrección de la deshidratación).
- En CAD, reponer aproximadamente el 50% del déficit de agua corporal total (5-8 litros), en las primeras 8 horas y el resto en las siguientes 16 horas.
- Disminución gradual de los niveles de glicemia.
- Corrección de los trastornos hidroelectrolíticos y de la osmolaridad plasmática.
- Identificar y tratar causa desencadenante.
- Prevenir complicaciones.
- Adecuado manejo nutricional.
- Implementar estrategias terapeúticas que garantizen un adecuado tratamiento de la DM a largo plazo y prevenir recurrencias.
Objetivos:
- Inicialmente dirigida al mejoramiento del volumen intersticial e intravascular
- Garantizar una adecuada perfusión renal
Dependiendo de la valoración inicial del estado de hidratación, se inicia con solución salina normal 0.9% (SSN 0.9%), así:
- 15-20 cc/Kg de peso o 1000-1500cc en la primera hora.
- Revalorar estado de hidratación, diuresis y alteraciones electrolíticas.
- Una vez hay evidencia clínica de reposición del volumen intravascular se continuará la rehidratación del paciente progresivamente.
- Si los niveles de sodio son normales o elevados: SSN 0.45% a una tasa de infusión de 4-14 cc/Kg/Hora.
- Si los niveles de sodio son bajos: SSN 0.9 % a una tasa de infusión de 4-14 cc/Kg/ Hora.
- Valorar continuamente la eficacia de la terapia hídrica de acuerdo con las variables hemodinámicas, condición clínica y balance hídrico.
- Cuando los niveles de glicemia alcancen los 200 mg/dl: cambiar los líquidos administrados por Dextrosa al 5% con SSN 0.45% a una tasa de infusión de 150-250 cc/ hora, para evitar hipoglicemia.
- Especial cuidado en pacientes con patologías cardiacas o renales por riesgo de sobrecarga hídrica.
- Los pacientes en shock cardiogénico, que no responden a la terapia hídrica, ameritaran monitoreo invasivo y uso de fármacos vasopresores.
Constituye la piedra angular en el manejo de la CAD y el EHH.
Aunque se ha visto que en CAD la vía de administración intramuscular y subcutánea tienen un efecto similar que la endovenosa, en casos de CAD severa se prefiere esta última. Una vez confirmado los niveles de potasio superiores a 3.3 mEq/L se procede así:
CAD severa
- Administrar insulina regular en bolo endovenoso a razón de 0.1 U/Kg de peso.
- Continuar infusión de insulina regular a razón de 0.1 U/Kg/Hora.
- Cuando los niveles de glicemia alcancen los 200 mg/dl se debe reducir la tasa de infusión a: 0.05-0.1U/Kg/Hora.
CAD leve/moderada
- Administrar insulina de acción rápida vía subcutánea (SC) a razón de 0.3 U/Kg inicialmente y luego otra dosis de 0.2 U/Kg una hora después.
- Continuar insulina de acción rápida a razón de 0.2 U/Kg SC cada 2 horas.
- Cuando los niveles de glicemia alcancen los 200 mg/dl se debe reducir la dosis de insulina a 0.1 U/Kg SC cada 2 horas.
La meta de la insulinoterapia es disminuir los niveles de glicemia a razón de 50-70 mg/ dl/Hora y mantenerla entre 150-200 mg/dl hasta la resolución de la CAD. De no ser así, se debe doblar la dosis de insulina hasta obtener los valores esperados.
Una vez resuelta la CAD y siempre que el paciente tolere la vía oral, se inicia esquema con insulina vía SC. Se debe continuar la infusión endovenosa hasta 1 a 2 horas después del inicio de la vía SC para garantizar niveles plasmáticos adecuados de insulina.
Es el electrolito que más se pierde en CAD, sin embargo, a pesar que existe una disminución de los niveles de K corporal total, puede haber hiperkalemia de leve a moderada. Durante el manejo de los pacientes con CAD se debe tener en cuenta que la hipokalemia es la anormalidad electrolítica que más frecuentemente puede comprometer la vida, ya que puede generar arritmias cardiacas letales y debilidad de los músculos respiratorios.
Por todo lo anterior, la ADA recomienda realizar la reposición de K (Ver Tabla 2) hasta obtener niveles por encima de 3.3 mEq/L antes de iniciar la terapia con insulina y luego mantenerlos entre 4 - 5 mEq/L.
Bicarbonato (5,9,16,19,23,29,30)
No hay estudios concluyentes que soporten el uso del bicarbonato en el manejo de los pacientes con CAD. Su uso sigue siendo controversial, ya que puede ocasionar múltiples efectos negativos, como empeoramiento de la hipokalemia y acidosis paradójica del sistema nervioso central. Sin embargo, se considera su uso solo cuando el pH < 7 de la siguiente forma:
- pH entre 6.9 - 7: 50 mmol de NaHCO3 en 200 cc de agua + 10 mEq de potasio para pasar en una hora.
- pH<6.9: 100 mmol en 400 cc de agua + 20 mEq potasio para pasar en dos horas.
Se debe reponer bicarbonato cada 2 horas hasta que el nivel de pH sea superior a 7.
Se debe mencionar que las muestras de sangre venosa permiten evaluar con certeza el pH. Por medio de la adición de 0.03 al valor leído por la máquina, se pueden obtener resultados similares a los de la sangre arterial. De igual forma, las muestras venosas también son comparables a las arteriales, en caso de requerirse la medición del bicarbonato. El uso de las muestras de sangre venosa son ideales en los pacientes estables, sin trastornos de la función respiratoria que requieren monitoreo frecuente del pH y el bicarbonato.
Los niveles de fósforo suelen estar normales o elevados al inicio del cuadro clínico, a pesar de que haya déficit del fósforo corporal total. La administración de insulina disminuye los niveles de fósforo.
La reposición de fosfato no ha mostrado ser benéfica para la mayoría de los pacientes con CAD. Sin embargo, debe considerarse en los siguientes casos:
- Fósforo sérico < 1 mg/dl
- Disfunción cardiaca
- Anemia
- Depresión respiratoria
Se repone con 20-30 mEq/L que se agregan a los líquidos de reemplazo, con el fin de disminuir el riesgo de paro cardíaco, debilidad del músculo esquelético y depresión respiratoria.
- Glicemia < 200 mg/dl
- Bicarbonato mayor o igual a 18 mEq/L
- pH venoso > 7.3
En la CAD la mayoría de las complicaciones están relacionadas al tratamiento. Las más comunes son:
- Hipoglicemia: Asociada a la sobreadministración de insulina.
- Hiperglicemia:Debido a la interrupción de la terapia con insulina.
- Hipokalemia: Generalmente ocasionada por la administración de insulina y bicarbonato.
- Hipercloremia: Por el excesivo suministro se solución salina 0.9%.
Otras complicaciones menos comunes:
- Edema cerebral: Complicación fatal, no muy frecuente, que ocurre principalmente en pacientes pediátricos.
- Sobrecarga hídrica: Sobre todo en pacientes con patologías cardíacas o renales de base.
- Síndrome de dificultad respiratoria: Complicación fatal que aparece muy rara vez.
- Tromboemblismo pulmonar: Favorecido porque la DM constituye un estado de hipercoagulabilidad que se acentúa en estado de CAD.
- Dilatación gástrica aguda: Complicación potencialmente letal pero poco común.
ESTADO HIPERGLICÉMICO HIPEROSMOLAR (EHH)
Generalidades
El EHH es una condición clínica caracterizada por un aumento significativo en los niveles de glucosa, hiperosmolaridad, deshidratación y escasos o nulos niveles de cetosis (5,31). Ocurre principalmente en pacientes con DM tipo 2, y en cerca del 30-40% de los casos constituye la primera manifestación de la enfermedad (32). La incidencia de EHH es menor a 1 caso por cada 1000 personas por año y a pesar de que su aparición es menos frecuente que la CAD; su mortalidad es superior, manteniéndose > 11% (9,32).
Entre las causas desencadenantes más frecuentes de EHH se encuentran las infecciones, considerada la principal causa desencadenante (observada en el 60% de los casos), y la neumonía es la más frecuente, seguida de las infecciones del tracto urinario y sepsis (5,32). El cumplimiento inadecuado de la dosificación de insulina es considerado otro factor importante en la génesis del EHH y se ha documentado que entre un 34 a 42% de los casos de EHH son desencadenados por falta de adherencia al tratamiento (5,34).
Si bien las bases fisiopatológicas de la CAD y el EHH son similares, hay algunas diferencias fundamentales como son:
- En el EHH se encuentra niveles de insulina, que si bien no son suficientes para controlar las alteraciones metabólicas de los hidratos de carbono, si inhiben la lipólisis y por ende minimizan la cetosis.
- Mayor grado de deshidratación y de hiperosmolaridad, favorecido por un período más prolongado de diuresis osmótica y de inadecuada administración de líquidos.
PRESENTACIÓN CLÍNICA
El paciente que desarrolla un EHH habitualmente es un paciente en su sexta a octava década de la vida (19) sin embargo, se puede presentar en cualquier edad; incluso, han sido reportados casos en lactantes menores (35). Es más frecuente en pacientes con DM tipo 2, sin embargo, no es exclusivo de este grupo. Los signos y síntomas habitualmente se desarrollan en el curso de días o semanas (12 días en promedio), con una clínica inicial constituida por síntomas hiperglicémicos típicos: polidipsia, poliuria, polifagia, visión borrosa y pérdida de peso (9,32).
Las alteraciones del estado de conciencia son frecuentes; sin embargo, solo entre un 10 a 30% de los pacientes se encuentran comatosos (9). Es más común la depresión progresiva del estado de conciencia, desde alerta hasta un estado de obnubilación, a medida que la osmolaridad aumenta y deshidrata la neurona. El coma se produce cuando la osmolaridad aumenta por encima de 350 mOsm/L y no con valores menores, motivo por el cual algunos autores sugieren buscar otras causas de coma en pacientes con osmolaridad inferior a esta cifra (19,32). Con el desarrollo de anormalidades electrolíticas pueden presentarse diversos grados de alteración del estado de conciencia, calambres musculares, parestesias y convulsiones. La hipokalemia generalmente se encuentra asociada con calambres musculares y parestesias, mientras que las manifestaciones neurológicas son producidas más frecuentemente por los trastornos del sodio.
Las manifestaciones gastrointestinales son infrecuentes (36), lo cual sugiere que ante un paciente con EHH y dolor abdominal debe indagarse profundamente por causas intraabdominales que hayan ocasionado la crisis; sin embargo, durante el EHH puede desarrollarse dolor abdominal a nivel hipocondrio derecho, con signos de irritación peritoneal, lo cual se ha asociado con hígado graso agudo (37). En un tercio de los pacientes se puede evidenciar alteración de las pruebas de función hepática e, incluso, han sido descritos casos de insuficiencia hepática aguda (38).
Todas las manifestaciones gastrointestinales suelen resolver por completo al controlar la crisis, por lo que su persistencia debe levantar sospecha de otras causas de dolor abdominal (19).
DIAGNÓSTICO
Del mismo modo que en la CAD, además del análisis del cuadro clínico, deben emplearse ayudas diagnósticas que nos permitan evaluar las concentraciones de glucosa, el estado ácido-base, el equilibrio hidroelectrolítico y la función renal, ya que cada uno de estos parámetros influye directamente en la conducta terapéutica. Ver Tabla 1.
Importante el cálculo de la osmolaridad sérica, la cual en EHH generalmente es mayor de 320 mOsm/L y el déficit de agua, lo cual representa aproximadamente 100 a 200 mL/kg, para un total de 9 a 10.5 litros en un adulto promedio (19,25).
Los pacientes con EHH pueden tener algún grado de acidemia, generalmente no menor de 7.3; sin embargo, cabe resaltar la alta frecuencia de cuadros superpuestos con características tanto de CD como de EHH, que obligan al monitoreo estricto del pH y el bicarbonato.
ABORDAJE TERAPEÚTICO
Los problemas más graves a los que se encuentra sometido un paciente con EHH son la deshidratación severa y las alteraciones electrolíticas que comprometen la vida. Por esto, además de las medidas generales y teniendo en cuenta las metas específicas para el manejo del EHH se debe hacer énfasis en:
Una vez valorado el estado de hidratación, se inicia manejo con SSN 0.9% bajo parámetros similares a los realizados en CAD, teniendo en cuenta que una vez se alcancen concentraciones de glucosa de 300 mg/dl, debe administrarse Dextrosa al 5% con SSN 0.45% a una tasa de infusión de 150-250 cc/ hora, para evitar hipoglicemia.
Una vez confirmado los niveles de potasio superiores a 3.3 mEq/L se procede así:
- Administrar insulina regular en bolo endovenoso a razón de 0.1 U/Kg de peso. (En este punto cabe resaltar que algunos autores no recomiendan el uso de un bolo inicial, debido a que la acción de lainsulina cristalina comienza a actuar en solo algunos minutos, por lo que la dosis de carga no añadiría ningún beneficio).
- Continuar infusión de insulina regular a razón de 0.1 U/Kg/Hora.
- Cuando los niveles de glicemia alcancen los 300 mg/dl se debe reducir la tasa de infusión a: 0.05-0.1U/Kg/Hora.
La meta de la insulinoterapia es mantener los niveles de glicemia entre 250-300 mg/dl hasta que la osmolaridad sérica sea igual o menor a 315 mOsm/Kg y el paciente se encuentre mentalmente alerta.
Aunque los niveles de potasio pueden estar normales o incluso altos al inicio del cuadro, hay que tener presente que todos los pacientes con EHH tienen disminuidos los niveles de potasio corporal total. La reposición del electrolito debe hacerse como se indica en la Tabla 2.
Criterios de resolución (9)
- Glicemia < 300 mg/dl
- Osmolalidad menor o igual a 315 mOsm/L
- Mejoría del sensorio
Al inicio del tratamiento los principales problemas que amenazan la vida son el inadecuado manejo de la vía aérea y una inadecuada reposición hídrica. Otras complicaciones importantes son:
- Hipoglicemia: Menos frecuente que en la CAD.
- Hipokalemia.
- Eventos tromboembólicos:Presente en un 1.2 a 2% de los pacientes.
- Edema cerebral: Es una de las complicaciones menos frecuentes de los pacientes adultos con EHH, sin embargo, conlleva una mortalidad cercana al 70%.
- Síndrome de dificultad respiratoria.
- Rabdomiolisis: Ha sido descrita con mayor frecuencia en pacientes con osmolaridad sérica superior a 360 mOsm/L.
Nuevas perspectivas (39,40,41,42,43,44)
Se están desarrollando nuevas estrategias diagnósticas, como el uso de test medidores de Beta-hidroxibutirato en servicio de urgencias(point-of-care test for the ketone beta-hydroxybutyrate) que permiten de manera rápida y sencilla distinguir entre una hiperglicemia simple de un estado de CAD, y de esta manera realizar un triage de los pacientes y establecer un manejo más apropiado y oportuno. Por otro lado, se ha visto que a pesar de que la insulina es uno de los instrumentos fundamentales para el manejo de la DM, algunos pacientes e, incluso, algunos médicos se ven reacios a adoptar la terapia con ésta, fenómeno conocido como resistencia sicológica a la insulina (RSI). Debido a esto, y después de varias décadas de investigación, la FDA (Food and Drug Administration) ha aprobado en Estados Unidos la administración de la insulina inhalada, una alternativa no invasiva, con la cual se espera reducir al mínimo los obstáculos para la iniciación de la insulinoterapia y de esta manera mejorar el control de la glicemia en pacientes con DM tipo 1 y 2. Sin embargo, se necesitan superar algunos obstáculos antes de generalizar su uso, como el hecho de que incrementan los anticuerpos contra la insulina, cuando se compara con la administración subcutánea. Además se necesitan más estudios a largo plazo que evalúen la seguridad pulmonar.
HIPOGLICEMIA
Generalidades
La hipoglicemia iatrogénica es el principal factor limitante en el control glicémico del paciente diabético y es causa de morbilidad recurrente en la mayoría de pacientes con diabetes tipo 1 y tipo 2 (45,46). En la diabetes tipo 1, el riesgo de hipoglicemia es inherente al tratamiento con insulina, y se presentan en promedio dos episodios de hipoglicemia asintomática cada semana y al menos un episodio de hipoglicemia severa anualmente (47,48,49). En la DM tipo 2, el riesgo de hipoglicemia severa es el 10% de lo evidenciado en DM tipo 1, aun en el caso de terapia insulínica estricta (45). En el UKPDS (Estudio Prospectivo de Diabetes en el Reino Unido), para diabéticos tipo 2 se evidenció hipoglicemia sintomática en 2.4% de los pacientes en uso de metformina, 3.3% con sulfonilureas y 11.2% con insulina, (50); así mismo, en el DCCT (Estudio de Control y Complicaciones de Diabetes) se observó hipoglicemias severas en el 65% de los pacientes con DM tipo 1 en tratamiento intensivo durante 6,5 años de seguimiento (47). Actualmente hay pocos estudios que aborden de forma directa la prevalencia de hipoglicemia en DM tipo 2, por tanto, las derivaciones actuales podrían subestimar las tasas reales del problema, especialmente en pacientes ancianos, a medida que se acercan al déficit insulínico aunado al deterioro en los sistemas de respuesta a la hipoglicemia (51). Investigaciones recientes sobre el tema se han centrado en dilucidar factores predisponentes, sistematizados junto a un conocimiento detallado de la fisiopatología de la respuesta frente al estrés producido por la hipoglicemia en el paciente diabético, que permita equilibrar la balanza entre el control glicémico y los efectos deletéreos de la hipoglicemia (52,53).
Definición
En mayo de 2005, el grupo de trabajo en hipoglicemia de la Asociación Americana de Diabetes (ADA) emitió un comunicado en el que unificaba las definiciones existentes y delimitaba los grados de severidad (54).
- Hipoglicemia severa: Evento que requiera la asistencia de otra persona para la administración de carbohidratos, glucagón u otras medidas de resucitación. Incluso si no se dispone del valor de glicemia plasmático, la recuperación neurológica atribuible a la restauración de la glicemia es considerada evidencia suficiente para el diagnóstico.
- Hipoglicemia sintomática documentada: Síntomas típicos de hipoglicemia asociados a niveles de glucosa en plasma < 70 mg/ dl.
- Hipoglicemia sintomática probable: Síntomas típicos de hipoglicemia sin comprobación de niveles de glucosa en plasma < 70mg/dl, pero presumiblemente ocasionados por dicha causa.
- Hipoglicemia relativa: Cualquier síntoma típico de hipoglicemia con niveles plasmáticos superiores a 70 mg/dl.
FISIOPATOLOGÍA
El problema central de la hipoglicemia se expresa en la necesidad del cerebro de usarla como metabolito energético obligado (55). La hipoglicemia es censada en el hipotálamo y otras áreas cerebrales, iniciando una respuesta autonómica generalizada, derivando en la liberación de hormonas contrarreguladoras que antagonizan la función de la insulina y alertan al individuo de la presencia de hipoglicemia.
Las principales hormonas de respuesta son el glucagón y la adrenalina que estimulan la liberación hepática de la glucosa y limitan la captación periférica muscular (56). La elevación de los niveles de glucagón en respuesta a bajos valores de glicemia plasmática se encuentra comprometida en la diabetes tipo 1, debido al parecer a defectos de señalización relacionados con el déficit insulínico endógeno; el incremento de glucagón en respuesta a otros estímulos se encuentra conservado (57,58). Igualmente, la respuesta adrenérgica se encuentra atenuada en DM tipo 1, fenómeno que origina una respuesta autonómica anómala, independiente de la neuropatía autonómica de base (Falla autonómica asociada a Hipoglicemia). Dicha alteración autonómica es secundaria a episodios recientes de hipoglicemia severa, y se caracteriza por comprometer la respuesta a episodios sucesivos de hipoglicemia. La neuropatía autonómica fue considerada hasta hace poco componente importante de la atenuación en la respuesta a la hipoglicemia; actualmente se piensa que no juega un papel importante en el fenómeno de hipoglicemia asintomática o insensibilidad a la hipoglicemia (Hipoglycemic unawarness), factor de riesgo principal para hipoglicemia severa iatrogénica. En la DM tipo 2, los mecanismos de defensa están intactos al comienzo de la enfermedad; sin embargo, en la evolución hacia el déficit insulínico, los episodios de hipoglicemia se hacen más frecuentes, tanto los asintomáticos como los severos, acercándose a la fisiopatología observada en la DM tipo 1 (59,60,61,62,63).
PRESENTACIÓN CLÍNICA
La clínica inicial depende de la activación de la respuesta autonómica (adrenérgica y colinérgica), cuyo inicio se ha documentado en niveles ligeramente inferiores al definitorio de la condición (65-70 mg /dl). Los síntomas neuroglicopénicos se presentan a partir de niveles inferiores de glicemia (55-60 mg/dl) (64). La tríada de Whipple, propuesta por el médico iraní Allen Oldfather Whipple para detectar hipoglicemia en pacientes no diabéticos con insulinomas, ha sido adoptada como el patrón clínico de referencia; incluye:
- Síntomas de hipoglicemia (autonómico o neuroglicopénicos) (Ver tabla 3).
- Niveles bajos de glicemia en plasma documentados.
- Resolución de los síntomas con la administración de glucosa.
Debe recordarse que los síntomas de hipoglucemia son idiosincráticos y exclusivos para cada persona, lo anterior sumado a la alta incidencia de episodios asintomáticos y no documentados, deriva en la recomendación de estimular al paciente diabético a autotratarse ante la sospecha de hipoglicemia (45,65).
FACTORES DE RIESGO
Los factores que comprometen la respuesta a la hipoglicemia y que aumentan el riesgo de hipoglicemia iatrogénica se encuentran adecuadamente estudiados en DM tipo 1, incluyen (45,66,67,68):
- Mayor duración de la diabetes.
- Déficit insulínico (DM 1 DM2 avanzada).
- Historia de episodios de hipoglicemia severa o hipoglicemia asintomática.
- Terapia hipoglicemiante agresiva evidenciada por niveles bajos de HbA1c u objetivos glicémicos más bajos.
- Tratamiento simultáneo con hipoglicemiantes orales.
- Tratamiento simultáneo con hipoglicemiantes orales.
- Consumo de alcohol.
- Hipoglicemia nocturna: Asociada a un intervalo prolongado entre ingestas y a la no disposición de una adecuada insulina basal, entre otros, ha cobrado importancia al relacionarse con el síndrome de (muerte en cama), que explica un 6% de las muertes en diabéticos menores de 40 años.
Recientemente se han publicado artículos que abordan los factores de riesgo para hipoglicemia en DM tipo 2 como objetivo primario, y se encontró relación entre la hipoglicemia asintomática, la mayor duración de la diabetes y estar casado, con la posibilidad de presentar cualquier episodio de hipoglicemia. El riesgo de hipoglicemia severa recidivante se relacionó con la presencia de neuropatía periférica, mientras que la duración prolongada de la diabetes antes del uso de insulina y el tratamiento con inhibidores de la enzima convertidota de angiotensina (IECAS) o antagonistas de receptores de angiotensina (ARA II), se asociaron a disminución en el riesgo. La concentración de péptido C y HbA1c no se relacionó con el riesgo de hipoglicemia severa. La insensibilidad a la hipoglicemia fue el principal factor de riesgo para hipoglicemia severa (68). En un subanálisis de hipoglicemia en DM tipo 2, derivado del UKPDS por Wright y cols, se encontró que la hipoglicemia fue más frecuente en los siguientes casos: pacientes más jóvenes ( 45 años) de sexo femenino; con peso normal; con menor hiperglicemia y en pacientes con auto-anticuerpos positivos contra islotes (69).
ABORDAJE TERAPEÚTICO
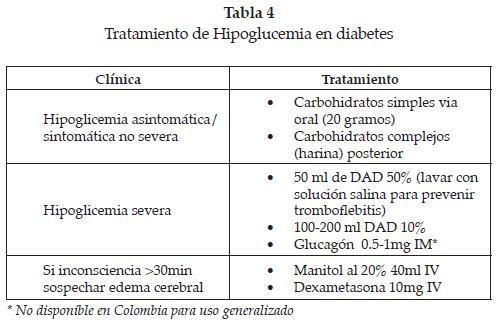
La mayoría de casos de hipoglicemia sintomática (y asintomáticos detectados) pueden autotratarse con ingesta de carbohidratos (jugos, leche, galletas, etc.). Es razonable una carga inicial de 20 gramos de glucosa. La carga de glucosa debe repetirse en 20 minutos si no hay mejoría o si persisten niveles bajos de glicemia. Debe tenerse en cuenta que la respuesta a la carga oral de glucosa es transitoria (2 horas) por lo que debe continuarse la ingesta (45).
El tratamiento parenteral es necesario en caso de hipoglicemia severa con incapacidad o imposibilidad de ingesta de carbohidratos, y la infusión de glucosa es el tratamiento preferido. El glucagón puede utilizarse principalmente en DM tipo 1, ya que en la DM tipo 2 constituiría un estímulo adicional para la secreción de insulina. En el caso de hipoglicemia debida a sulfonilureas, el glucagón podría inducir hipoglicemias de rebote severas, debido a su corta vida media y el tiempo de acción prolongado de las sulfonilureas (45,51). Debe vigilarse la posible aparición de flebitis debidas a soluciones con altas cargas de glucosa (Ver Tabla 4).
La decisión de hospitalización dependerá de la evolución clínica y la causa del episodio de hipoglicemia. En general, pacientes con recuperación rápida del estado y consciencia, en quienes se descarte recaída de hipoglicemia, no requieren admisión hospitalaria. Por el contrario, pacientes con hipoglicemia debida a sulfonilureas deben ser admitidos por 24 horas y en ocasiones recibir infusiones prolongadas de soluciones glucosadas debido al riesgo de hipoglicemia prolongada o recidivante en el periodo temprano, lo cual es más frecuente en pacientes con insuficiencia renal (excreción comprometida) e insuficiencia hepática (inhibición del metabolismo). Se han descrito casos de edema cerebral inducido por hipoglicemia que pueden beneficiarse del uso de manitol y glucocorticoides asociados a glucosa parenteral. Los efectos crónicos de la hipoglicemia repetida son motivos de debate; se ha informado que, en algunos pacientes, puede disminuir hasta en 6 puntos el coeficiente intelectual, aunque las implicaciones de este hecho no se han aclarado (70,71,72,73).
NUEVAS PERSPECTIVAS
En épocas pasadas se demostró una fuerte asociación entre el déficit de Enzima Convertidora de Angiotensina (ECA) y el riesgo de hipoglicemia en diabetes tipo 1 y 2. Dicho concepto ha sido revaluado recientemente en diversos estudios, en los que reiteradamente se descarta la utilidad de la ECA como predictor de hipoglicemia en diabetes (74,75,76,77).
La Monitoría de Glucosa Continua (CGMS, siglas en inglés), a través de dispositivos subcutáneos, viene estudiándose para la detección y tratamiento de la hipoglicemia nocturna y el monitoreo general del paciente diabético, logrando describir altas tasas de hipoglicemia no sintomática no detectadas anteriormente en pacientes con DM tipo 2. La Monitoría de Glucosa Continua constituye un método promisorio para que los pacientes diabéticos se familiaricen con la respuesta de su organismo a los diferentes tratamientos hipoglicemiantes, incluyendo dieta y ejercicio, para poder lograr un control más estable, disminuyendo los riesgos de las fluctuaciones en los niveles de glicemia (68,78).
Agradecimientos
Al doctor Julio César Durán, Especialista en Medicina Crítica, por sus acertadas indicaciones y su valiosa orientación.
Conflicto de intereses Ninguno
REFERENCIAS
1. AMERICAN DIABETES ASSOCIATION. Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 2005, jan; 28 ( Supl 1). [ Links ]
2. Wild S, Roglic R, Green A, Sicree R, King H. Global prevalence of diabetes. Estimates for the year 2000 and projections for 2030. Diabetes Care 2004; 27: 1047-1053. [ Links ]
3. Aschner P, King H, Triana de Torrado M, Rodriguez BM. Glucose intolerance in Colombia. A population-based survey in an urban community. Diabetes Care 1993; 16: 90-93. [ Links ]
4. King H, Aubert RE, Herman WH. Global burden of diabetes, 1995-2025: prevalence, numerical estimates, and projections. Diabetes Care 1998; 21: 1414-1431. [ Links ]
5. Kitabchi AE, Nyenwe EA. Hyperglycemic crises in Diabetes Mellitus: diabetic ketoacidosis and hyperglycemic hyperosmolar state. Endocrinol Metab Clin N Am 2006; 35: 725-751. [ Links ]
6. Guettier JM, Gorden P. Hypoglycemia. Endocrinol Metab Clin N Am 2006; 35: 753-766. [ Links ]
7. Trachtenbarg DE. Diabetic ketoacidosis. Am Fam Physician 2005;71:1705-14. [ Links ]
8. Kitabchi AE, Fisher JN. Diabetes mellitus. In: Glew RA, Peters SP, editors. Clinical studies in medical biochemistry. New York: Oxford University Press; 1987. p. 102-17. [ Links ]
9. Kitabchi AE, Umpierrez GE, Murphy MB, Barrett EJ, Kreisberg RA Hyperglycemic crises in adult patients with diabetes. Diabetes Care 2006; 29 (12): 2739-48. [ Links ]
10. 2006; 29 (12): 2739-48. 10. Gaglia JL,Wyckoff J, Abrahamson M. Acute hyperglycemic crisis in the elderly. Med Clin N Am 2004; 88: 1063-1084 [ Links ]
11. Chiasson JL, Aris-Jilwan N, Bélanger R, Bertrand S, Beauregard H, Ékoé JM, et al. Diagnosis and treatment of diabetic ketoacidosis and the hyperglycemic hyperosmolar state. CMAJ 2003; 168 (7):859-66. [ Links ]
12. Centers for Disease Control and Prevention. Diabetes surveillance system. Atlanta: US Department of Health and Human Services; 2003. Available at: www.cdc.gov/diabetes/statistics/mortalitydka. [ Links ]
13. Boord JB, Graber AL., Christman JW, Powers AC. Practical management of diabetes in critically Ill patients. Am J Respir Crit Care Med 2001 nov; 164 (10): 1763-1767 [ Links ] [ Links ]
15. Lebovitz HE. Diabetic ketoacidosis. Lancet 1995; 345:767-772. [ Links ]
16. Charfen MA, Fernandez-Frackelton M. Diabetic ketoacidosis. Emerg Med Clin N Am 2005; 23: 609-628 [ Links ]
17. Newcomer JW. Second generation (atypical) antipsycotics and metabolic effects: a comprehensive literature review. CNS Drugs 2005;19(Suppl 1):1-93. [ Links ]
18. Nyenwe EA, Loganathan RS, Blum S, et al. Active use of cocaine: an independent risk factor for recurrent diabetic ketoacidosis in a city hospital. Endocrine Practice, in press. [ Links ]
19. Magee MF, Bankim AB. Management of decompensated diabetes. Diabetic ketoacidosis and hyperosmolar hyperglycemic syndrome. Crit Care Clin 2001;17(1):75-106. [ Links ]
20. Nattrass M. Diabetic ketoacidosis. Medicine 2006; 34 (3): 104-106. [ Links ]
21. Howard RL, Bichet DG, Shrier RW. Hypernatremic polyuric states. In: Seldin D, Giebisch G, editors. The kidney: physiology and pathophysiology. New York: Raven; 1991, p. 1578. [ Links ] [ Links ]
23. Casteels K, Mathieu Ch. Diabetic ketoacidosis. Endocrine & Metabolic Disorders 2003; 4: 159-166 [ Links ]
24. Siperstein MD. Diabetic ketoacidosis and hyperosmolar coma. Endocrinol Metab Clin North Am 1992; 21: 415-32. [ Links ]
25. English P, Williams G. Hyperglycaemic crises and lactic acidosis in diabetes mellitus. Postgrad Med J. 2004; 80: 253-261. [ Links ]
26. Slovis CM,Mork VG, Slovis RJ, et al. Diabetic ketoacidosis and infection: leukocyte count and differential as early predictors of serious infection. Am J Emerg Med 1987; 5(1):1-5. [ Links ]
27. Fontaine P, Hautefeuille P, Mathieu C, et al. Blood amylase and lipase in diabetic ketoacidosis. Presse Med 1987; 16 (18):895-8. [ Links ]
28. Vinicor F, Lehrner LM, Karn RC, Merritt AD: Hyperamylasemia in diabetic ketoacidosis:sources and significance. Ann In Intern Med 1979; 91:200-204. [ Links ]
29. Eledrisi MS, Alshanti MS, Shah MF, Brolosy B, Jaha N. Overview of the diagnosis and management of diabetic ketoacidosis. Am J Med Sci 2006 May; 331 (5): 243-51. [ Links ]
30. Stewart C. Diabetic emergencies: diagnosis and management of hyperglycemic disorders. Emergency Medicine Practice 2004; 6(2):1-24. [ Links ]
31. Stoner GD. Hyperosmolar Hyperglycemic State. Am Fam Physician 2005; 71 (9): 1723- 30. [ Links ]
32. Nugent BW. Hyperosmolar Hyperglycemic State. Emerg Med Clin N Am 2005; 23: 629- 648. [ Links ]
33. Mbugua PK, Otieno CF, Kayima JK, Amayo AA, McLigeyo SO. Diabetic ketoacidosis: clinical presentation and precipitating factors at Kenyatta National Hospital, Nairobi. East Afr Med J. 2005; 82 (12 Suppl): S191-196. [ Links ]
34. Umpierrez GE, Kelly JP, Navarrete JE, Casals MM, Kitabchi AE. Hyperglycemic crises in urban blacks. Arch Intern Med 1997; 157: 669-675 [ Links ]
35. GolDMan SL. Hyperglycemic hyperosmolar coma in a 9-month-old child. Am J Dis Child 1979; 133: 181-183. [ Links ]
36. Umpierrez G, Freire AX. Abdominal pain in patients with hyperglycemic crises. J Crit Care 2002; 17: 63-67. [ Links ]
37. Matz R. Management of the hyperosmolar hyperglycemic syndrome. Am Fam Phys 1999; 60: 1468-1476. [ Links ]
38. Faintuch J, Machado MC, Bove P, Bisi H, Raia AA. Hyperosmolar coma with acute liver failure: fatal complication of venous hyperalimentation. Rev Paul Med 1975; 85: 127-130 [ Links ]
39. Charles RA, Bee YM, Eng PH, Goh SY. Point-of-care blood ketone testing: screening for diabetic ketoacidosis at the emergency department. Singapore Med J. 2007 Nov; 48(11):986-9. [ Links ]
40. Naunheim R, Jang TJ, Banet G, Richmond A. Point-of-care test identifies diabetic ketoacidosis at triage. ACAD Emerg Med 2006 Jun;13(6):683-5. [ Links ]
41. Royle P, Waugh N, McAuley L, McIntyre L, Thomas S. Inhaled insulin in diabetes mellitus. Cochrane Rev Abstract 2007. [ Links ]
42. Cochrane Rev Abstract 2007. 42. Siddiqui NI. Evaluation of inhaled insulin therapy for diabetes mellitus. Mymensingh Med J. 2007 Jul; 16 (2): 237-45 [ Links ]
43. Guntur VP, Dhand R. Inhaled insulin: extending the horizons of inhalation therapy. Respir Care 2007 Jul; 52 (7): 911-22. [ Links ]
44. Barnett AH, Bellary S. Inhaled human insulin (Exubera): clinical profile and patient considerations. Vasc Health Risk Manag 2007; 3 (1): 83-91 [ Links ]
45. Cryer PE, Davis SN, Shamoon H: Hypoglycemia in diabetes. Diabetes Care 2003; 26: 1902-1912. [ Links ]
46. Cryer PE. Hypoglycaemia: The limiting factor in the glycaemic management oftype I and type II diabetes. Diabetologia 2002; 45:937948. [ Links ]
47. The Diabetes Control and Complications Trial Research Group: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977-986. [ Links ]
48. Reichard P, Berglund B, Britz A, Cars I, Nilsson BY, Rosenqvist U: Intensified conventional insulin treatment retards the microvascular complications of insulin- dependent diabetes mellitus (IDDM): the Stockholm Diabetes Intervention Study (SDIS) after 5 years. J Intern Med 1991; 230: 101-108 . [ Links ] [ Links ]
50. The United Kingdom Prospective Diabetes Study Group: U.K. Prospective diabetes study. 16. Overview of 6 years therapy of type II diabetes: a progressive disease. Diabetes 1995; 44: 1249-1258. [ Links ]
51. Zammitt N., Frier BM. Hypoglycemia in type 2 Diabetes: pathophysiology, frequency, and effects of different treatment modalities. Diabetes Care 2005; 28; 2948-2961. [ Links ]
52. Donnelly LA, Morris AD, Frier BM, Ellis JD, Donnan PT, Durrant R, Band MM, Reekie G, Leese GP; DARTS/MEMO Collaboration. Frequency and predictors of hypoglycaemia in type 1 and insulin-treated type 2 diabetes: a population-based study. Diabet Med 2005; Jun; 22 (6): 749-55. [ Links ]
53. Pedersen-Bjergaard U, Agerholm-Larsen B, Pramming S, Hougaard P, Thorsteinsson B. Prediction of severe hypoglycaemia by angiotensin-converting enzyme activity and genotype in type 1 diabetes. Diabetologia 2003; Jan; 46 (1): 89-96. Epub 2002 Dec 18 (1, 22, 23). [ Links ]
54. American Diabetes Association Work group on Hypoglycemia: Defining and reporting hypoglycemia in Diabetes. A report from the American Diabetes Association Workgroup on Hypoglycemia. Diabetes Care 2005; 28: 1245-1249. [ Links ]
55. Cryer PE Hypoglycemia. Pathophysiology, diagnosis, and treatment. New York, Oxford Univ. Press 1997. [ Links ]
56. Heller S R. Hypoglycaemia in diabetes. In: Pickup J, Williams G, editors. Textbook of diabetes. 3rd ed. Oxford: Blackwell; 2002: 33.19-33.31. [ Links ]
57. Fukuda M, Tanaka A, Tahara Y, Ikegami H, Yamamoto Y, Kumahara Y, Shima K. Correlation between minimal secretory capacity of pancreatic beta-cells and stability of diabetic control. Diabetes 1988; 37: 81 - 88. [ Links ]
58. Banarer S, McGregor VP, Cryer PE. Intraislet hyperinsulinemia prevents the glucagon response to hypoglycemia despite an intact autonomic response. Diabetes 2002; 51: 958-965. [ Links ]
59. Dagogo-Jack SE, Craft S, Cryer PE. Hypoglycemia- associated autonomic failure in insulin-dependent diabetes mellitus. J Clin Invest 1993; 91: 819-828. [ Links ]
60. Cryer P E. Diverse causes of hypoglycemiaassociated autonomic failure in diabetes. N Engl J Med 2004; 350: 2272-9 [ Links ]
61. Gold AE, MacLeod KM, Frier BM. Frequency of severe hypoglycemia in patient swith type 1 diabetes with impaired awareness of hypoglycemia. Diabetes Care 1994; 17: 697-703. [ Links ]
62. Hepburn DA, MacLeod KM, Pell AC, Scougal IJ, Frier BM: Frequency and symptOMS of hypoglycaemia experienced by patients with type 2 diabetes treated with insulin. Diabet Med 1993; 10: 231-237. [ Links ]
63. Heller S R. How should hypoglycaemia unawareness be managed? In: Gill G, Williams G, Pickup J, eds. Difficult diabetes- current management challenges. Oxford: Blackwell; 2001, p. 167-8. [ Links ]
64. Mitrakou A, Ryan C, Veneman T, Mokan M, Jenssen T, Kiss I, Durrant J, Cryer P, Gerich J: Hierarchy of glycemic thresh-olds for counterregulatory hormone secretion, symptOMS, and cerebral dysfunction. Am J Physiol 1991; 260: E67-E74. [ Links ]
65. McAulay V, Deary IJ, Frier BM: SymptOMS of hypoglycaemia in people with diabetes. Diabet Med 2001; 18: 690-705. [ Links ]
66. Donnelly LA, Morris AD, Frier BM, Ellis JD, Donnan PT, Durrant R, Band MM, Reekie G, Leese GP; DARTS/MEMO Collaboration. Frequency and predictors of hypoglycaemia in type 1 and insulin-treated type 2 diabetes: a population-based study. Diabet Med 2005; Jun; 22 (6): 749-55. [ Links ]
67. Guillod L, Comte-Perret S, Monbaron D, Gaillard RC, Ruiz J. Nocturnal hypoglycaemias in type 1 diabetic patients: what can we learn with continuous glucose monitoring? Diabetes Metab. 2007 Nov; 33 (5): 360-365. [ Links ]
68. Akram K, Pedersen-Bjergaard U, Carstensen B, Borch-Johnsen K, Thorsteinsson B. Frequency and risk factors of severe hypoglycaemia in insulin-treated type 2 diabetes: a crosssectional survey. Diabet Med 2006; Jul; 23 (7): 750-6. [ Links ]
69. Wright AD, Cull CA, Macleod KM, Holman RR; for the UKPDS Group. Hypoglycemia in type 2 diabetic patients randomized to and maintained on monotherapy with diet, sulfonylurea, metformin, or insulin for 6 years from diagnosis: UKPDS73. J Diabetes Complications 2006; Nov-Dec; 20 (6): 395- 401. [ Links ]
70. Wiethop BV, Cryer PE. Alanine and terbutaline in treatment of hypoglycemia in IDDM. Diabetes Care 1993; 16: 1131-1136. [ Links ]
71. Bolli GB: How to ameliorate the problem of hypoglycemia in intensive as well as nonintensive treatment of type 1 diabetes. Diabetes Care 1999; 22 (Suppl. 2): B4-B52. [ Links ]
72. Carroll MF, et al. Severe hypoglycemia in adults. Rev Endoc Metabol Dis 2003; 4:149. [ Links ]
73. Cyer PE. Glucosa homeostasis and hypoglycemia. En: Larsen PR, Krokenberg HM, Melmed S, Polonski KS, editors. Williams Textbook of Endocrinology; 10 ed. Philadelphia: Saunders; 2003. p 1585-1599. [ Links ]
74. Pedersen-Bjergaard U, Agerholm-Larsen B, Pramming S, Hougaard P, Thorsteinsson B. Activity of angiotensin-converting enzyme and risk of severe hypoglycaemia in type 1 diabetes mellitus. Lancet 2001 Apr 21; 357(9264): 1248-53. [ Links ]
75. Pedersen-Bjergaard U, Agerholm-Larsen B, Pramming S, Hougaard P, Thorsteinsson B. Prediction of severe hypoglycaemia by angiotensin-converting enzyme activity and genotype in type 1 diabetes. Diabetologia 2003; Jan; 46 (1): 89-96. [ Links ]
76. Bulsara MK, Holman CD, van Bockxmeer FM, Davis EA, Gallego PH, Beilby JP, Palmer LJ, Choong C, Jones TW. The relationship between ACE genotype and risk of severe hypoglycaemia in a large population-based cohort of children and adolescents with type 1 diabetes. Diabetologia 2007; May; 50 (5): 965-71. [ Links ]
77. 965-71.77. Zammitt NN, Geddes J, Warren RE, Marioni R, Ashby JP, Frier BM Serum angiotensinconverting enzyme and frequency of severe hypoglycaemia in type 1 diabetes: does a relationship exist?. Diabet Med 2007; Sep 26; [Epub ahead of print]. [ Links ]
78. Weber KK, Lohmann T, Busch K, Donati-Hirsch I, Riel R. High frequency of unrecognized hypoglycaemias in patients with type 2 diabetes is discovered by continuous glucose monitoring. Exp Clin Endocrinol Diabetes 2007 Sep; 115(8):491-4. [ Links ]