Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Salud Uninorte
Print version ISSN 0120-5552On-line version ISSN 2011-7531
Salud, Barranquilla vol.25 no.1 Barranquilla Jan./June 2009
Síndromes coronarios agudos: epidemiología y diagnóstico
Acute coronary syndromes: epidemiology and diagnosis
Carlos A. Cassiani M.1, Armando Cabrera G.2
1 Médico general. FCCP. Instructor BLS-ACLS Fundación Salamandra-American Heart Association (AHA). Cali (Colombia). Grupo de investigación en Salud Pública (GISAP), Universidad de Santiago de Cali. Profesor de reanimación, Universidad Santiago de Cali. Candidato a magíster en Ciencias Básicas Biomédicas-Neurociencias, Universidad del Valle. kassio30@hotmail.com
2 Médico Internista. Universidad de Cartagena. Internista de urgencias, Hospital Universitario de Cartagena. Cartagena (Colombia).
Correspondencia: Calle 13A n.° 37-31, apto. 203 H, Santiago de Cali, Cali-Valle (Colombia).Resumen
Los síndromes coronarios agudos son un problema mayor de salud pública en todo el mundo. El síndrome coronario agudo (SCA) incluye infarto agudo de miocardio (IAM), con o sin elevación del ST y la angina inestable. La incidencia anual de IAM es 565.000 nuevos eventos y 300.000 ataques recurrentes cada año. Los factores de riesgo para enfermedad cardíaca isquémica (ECI) incluyen: tabaquismo, niveles elevados de lípidos séricos, hipertensión arterial, diabetes mellitus, obesidad mórbida, sedentarismo, bajo consumo diario de frutas y vegetales, consumo problemático de alcohol e índice psicosocial. La evaluación inicial de un SCA debe enfocarse en el disconfort toráxico, signos y síntomas asociados y factores de riesgo para SCA. Los marcadores biológicos de lesión miocárdica hoy no son fundamentales para decidir el manejo inicial, aunque han contribuido a una mayor sensibilidad del abordaje diagnóstico y aportan datos para el pronóstico de los pacientes.
Palabras clave: Síndromes coronarios agudos, epidemiología, diagnóstico.
Abstract
Acute coronary syndromes are a major public health problem. Acute coronary syndrome (ACS) includes acute myocardial infarction (AMI), with or without ST elevation and unstable angina. The annual incidence of AMI is 565,000 new events and 300,000 recurrent attacks each year. Risk factors for heart disease (CD) ischemic include: smoking, high levels of serum lipids, hypertension, diabetes mellitus, morbid obesity, sedentary lifestyle, low daily consumption of fruits and vegetables, alcohol problem and psychosocial index. The initial assessment of an ACS should focus on the discomfort chest, signs and symptoms and risk factors for ACS. Biological markers of myocardial injury today are not essential to decide the initial management but have contributed to an increased sensitivity of diagnosis and provide data for the prognosis of patients.
Keywords: Acute coronary syndromes, epidemiology, diagnosis.
Fecha de recepción: 13 de marzo de 2009
Fecha de aceptación: 28 de abril de 2009
Introducción
Los síndromes coronarios agudos son un problema mayor de salud pública en todo el mundo. En los últimos años han ocurrido muchos avances en la epidemiología, fisiopatología y tratamiento que han impactado en las guías de manejo y el pronóstico de estos pacientes, por lo que es necesario que los clínicos en los servicios de urgencia y las unidades de cuidados coronario, intensivo e intermedio tengan una permanente puesta al día sobre las tendencias de manejos de los pacientes con síndrome coronario agudo.
En este artículo se presenta una revisión actualizada de la epidemiología y enfoque diagnóstico inicial de los SCA en los servicios de urgencia con base en la evidencia actual disponible más sólida posible.
Definición
El término síndrome coronario agudo (SCA) fue introducido en 1985 por Fuster (1) para diferenciar los eventos fisiopatológicos específicos que distinguen la angina inestable y el infarto de miocardio de la enfermedad coronaria estable. El síndrome coronario agudo (SCA) es un término operacional especialmente útil en la evaluación de los pacientes con dolor torácico con el que se designa a cualquier conjunto de síntomas clínicos, compatibles con isquemia miocárdica aguda. Incluye cualquier tipo de infarto agudo de miocardio (IAM), con o sin elevación del ST, así como la angina inestable. En la práctica, el SCA clasifica en dos grupos los pacientes: aquellos que presentan un IAM con elevación del ST (IAMCEST), candidatos a reperfusión inmediata, y los que no presentan elevación del ST entre los que se incluyen el infarto agudo del miocardio sin elevación del ST (IAMSEST) y la angina inestable (AI) (2).
El aspecto más importante de esta clasificación es su utilidad para elegir el tratamiento. Los casos de SCACEST (síndrome coronario agudo con elevación del ST) habitualmente deben orientarse hacia la revacularización temprana de la arteria comprometida mediante fibrinolisis o angioplastia percutánea (3). En los pacientes sin elevación del segmento ST ("tiempo transcurrido desde que termina la despolarizacion ventricular hasta que empieza el período de repolarizacion") debe realizarse una estratificación individualizada de su grado de riesgo para determinar el tipo y la intensidad de la terapia (4).
El IAMCEST y la AI son dos procesos relacionados entre sí, pues su fisiopatología clínica y manejo son similares; difieren si la isquemia es lo suficientemente severa y/o prolongada como para provocar un daño miocárdico detectable mediante marcadores séricos de lesión miocárdica (5).
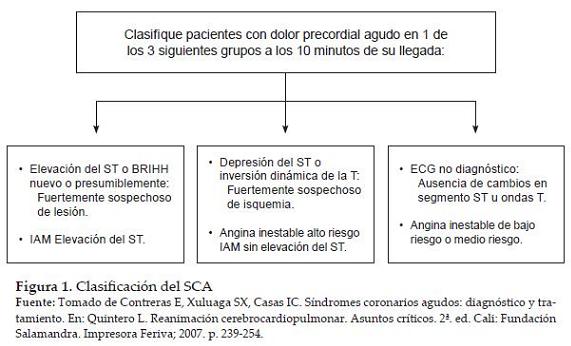
Todo esto ha llevado a redefinir el concepto de IAM y agrupar el IAMCEST y a la AI en el mismo proceso combinado (6) (fig. 1).
Epidemiología
La enfermedad coronaria (EC) es la causa número uno de muerte en el mundo occidental, lo que la constituye en un enorme problema de salud pública de trascendencia mundial (7).
Existen actualmente diversos estudios con metodologías bien establecidas que realizan la vigilancia epidemiológica de la enfermedad cardíaca. Esos estudios toman como su principal medida el IAM con base en tres elementos: dolor torácico, análisis electrocardiográfico y cambios en enzimas cardíacas. Cada uno de estos programas de vigilancia epidemiológica tiene diferentes puntos de vista de este importante problema, por lo tanto, aportan información epidemiológica complementaria (8).
Incidencia y prevalencia
Según la Asociación Americana del Corazón (AHA, por su sigla en inglés) 71.3 millones de americanos sufrieron alguna forma de enfermedad cardiovascular en el 2003. Cuando se analizan las altas hospitalarias en el 2004 en EE.UU., 1.565.000 correspondieron a SCA y de estas, 896.000 a IAM y 669.000, a AI (9). Para finales del 2007, unos 700.000 americanos sufrieron un nuevo evento coronario y cerca de 500.000 tuvieron uno recurrente. Se ha estimado que en Estados Unidos pueden ocurrir 175.000 IAM silentes cada año. Así, la incidencia anual de IAM es 565.000 nuevos eventos y 300.000 ataques recurrentes cada año, según datos del NHLBI (Instituto Nacional de Sangre, Corazón y Pulmón, por su sigla en inglés) (10).
El riesgo de desarrollar enfermedad coronaria (EC) a lo largo de la vida después de los 40 años es 49% para hombres y 32% para mujeres. En el estudio ARIC (riesgo de arteriosclerosis en comunidades, por su sigla en inglés) del NHLBI, la incidencia promedio ajustada por edad para EC por 1000 personas/año es 12.5, hombres blancos; 10.6, hombres negros; 4.0, mujeres blancas, y 5.1 para mujeres negras (13). El promedio de edad del primer IAM es 65.8 años para los hombres y 70.4 años para las mujeres (9). La incidencia de EC en mujeres después de la menopausia es 2 a 3 ve ces mayor que en las de mujeres de la misma edad antes de la menopausia (12).
En la actualidad, el número de pacientes hospitalizados por SCA sin elevación persistente del segmento ST excede al de admitidos por SCACEST (15); así el registro GRACE reunió a 10.693 pacientes con SCA entre 1999 y 2001 en Europa, América, Australia y Nueva Zelanda. En dicho estudio dos tercios del total correspondían a pacientes electrocardiograma (ECG) sin elevación del segmento ST (16).
En otro estudio observacional en el área de Worcester (Estados Unidos) se realizó un registro de IAM de 16 hospitales durante los año 1975-1997. Los resultados permitieron detectar a lo largo del tiempo un importante descenso en la incidencia de IAM con onda Q, en su mayoría procedentes del SCACEST: 171/100.000 habitantes en 1975 frente a 101/100.000 habitantes en 1997, así como de su tasa de mortalidad: 24% frente al 12%. Por el contrario, la incidencia del IAM sin onda Q mostraba un incremento constante junto con una tasa de mortalidad ajustada en 1922, casi idéntica que 22 años antes (15).
La incidencia del IAM y sus variaciones a través del tiempo se muestran en la tabla 1.
Mortalidad
La EC causó 1 de cada 5 muertes en Estados Unidos en el 2004. El total de muertes atribuidas a EC en el 2002 fue de 653.000; para IAM fue de 221.000, de tal forma que la EC es la causa individual más importante de muerte en hombres y mujeres americanos.
Cerca de cada 26 segundos, un americano sufrirá un evento coronario y cerca de cada minuto alguno morirá por esta causa. Alrededor del 38% de las personas que padecen un ataque al corazón, en un año dado fallecerán por esto mismo (9). Rea y col. en un estudio que evaluó la incidencia de paro cardíaco extrahospitalario informaron una incidencia de 6/1000 sujetos/año en personas con cualquier manifestación clínica de enfermedad cardíaca en comparación con 0.8/1000 sujetos/año para aquellos sin enfermedad cardíaca. Más aún, la incidencia de paro cardíaco (PC) fue de 13.6/1000 sujetos año en sujetos con IAM previo, hecho que revela la importancia crítica de los SCA en los paros cardíacos (22).
Según el NHLBI y el NCHS (Centro Nacional de Estadísticas en Salud, por su sigla en inglés), de 1994 al 2004, la tasa de mortalidad por EC declinó 33%, pero el número actual de muertes declinó solo un 18%. En el 2004 la tasa global de muertes por EC fue de 150.5 por 100.000 habitantes: 194.4 para hombres blancos, 222.2 para hombres negros; 115.4 para mujeres blancas; y 148.6 para mujeres negras (9).
Cerca del 83% de las personas que murieron por EC tenían 65 años o más; el promedio estimado de años de vida perdidos debido a un IAM fue de 15, según el NCHS (11).
Con base en los datos del FHS (Estudio Framinghan del Corazón, por su sigla en inglés) del NHLBI, el 70% al 89% de las muertes cardíacas súbitas ocurrieron en hombres y la incidencia anual es 3 a 4 veces mayor en hombres que en mujeres; sin embargo, esta disparidad decrece con el avance de los años. Por otro lado, las personas que sufrieron un IAM tuvieron una tasa de muerte súbita 4 a 6 veces mayor que la población general (23).
La mitad de los pacientes que mueren por IAM no llegan vivos al hospital. La fibrilación ventricular (FV) y la taquicardia ventricular sin pulso (TVSP) son los ritmos precipitantes en la mayoría de esas muertes (24), lo que pone de manifiesto la importancia crítica de reconocer tempranamente los síntomas del SCA en la escena prehospitalaria (25).
Un estudio de cohorte de 138.290 pacientes en Dinamarca, encontró que los factores predictores positivos de mortalidad fueron vivir solo, diabetes mellitus (DM), presencia de onda Q, taquicardia y bloqueo completo de rama derecha del haz de Hiss, mientras que los predictores negativos de mortalidad fueron dolor torácico y elevación del segmento ST (26).
Las tasas de mortalidad por IAM y sus variaciones en el tiempo se resumen en la tabla 2.
Factores de riesgo
De acuerdo con un estudio de casos y controles desarrollados en 52 países (INTERHEART), 9 factores de riesgo, fácilmente mensurables y modificables, dieron cuenta de más del 90% del riesgo de un IAM inicial. El efecto de estos factores de riesgo es consistente en hombres y mujeres a través de las diferentes regiones geográficas y por grupos étnicos, gracias a lo cual es aplicable mundialmente. Esos nueves factores incluyeron: tabaquismo, niveles elevados de lípidos séricos, hipertensión arterial, diabetes mellitus, obesidad mórbida, sedentarismo, bajo consumo diario de frutas y vegetales, consumo problemático de alcohol e índice psicosocial (30).
Este abordaje de factores de riesgo complementa el enfoque de factores de riesgo convencionales (hipertensión, diabetes, hiperlipidemia, tabaquismo) para enfermedad coronaria, que ha sido ampliamente establecido en diversos estudios epidemiológicos (31).
Pronóstico
Las personas que sobreviven a un IAM, tienen un chance de enfermar o morir 1.5 a 15 veces mayor que la población general. El riesgo de otro IAM, muerte súbita, angina de pecho (AP), falla cardíaca y ataque cerebrovascular es sustancial en este grupo de pacientes; por ejemplo, el porcentaje de personas que sufrirán muerte súbita 5 años después de su primer IAM a las edades entre 40 a 69 años es: 1.1% para hombres blancos; 1.9%, mujeres blancas; 2.5%, hombres negros; 1.4%, mujeres negras; en el grupo de 70 años o más, los porcentajes se incrementan más de 3 veces en todos estos grupos (23).Por otro lado, la Clínica Mayo encontró que la rehabilitación cardíaca después de un IAM es subutilizada, particularmente, en mujeres y ancianos. Así, las mujeres tuvieron 55% menos probabilidad que los hombres de participar en este proceso terapéutico. Solamente 32% de hombres y mujeres de 70 años o más la recibieron, en comparación con 66% de personas en edades comprendidas entre 60 a 69 años y 81% en aquellos menores de 60 años (32).
Costos
Los costos directos e indirectos estimados por EC para el 2007 fueron de 151.6 billones de dólares. En el 2001, 11.6 billones de dólares fueron pagados a empresas de salud por costos hospitalarios en donde la EC fue el principal diagnóstico (33).
En el 2004, se estimaron 1.285.000 angioplastias en pacientes hospitalizados, 427.000 revascularizaciones coronarias quirúrgicas, 1.471.000 cateterismos cardíacos, 68.000 des fibriladores implantables, y 170.000 marcapasos se colocaron para pacientes hospitalizados en los Estados Unidos (9).
Situación en Colombia
En Colombia, de acuerdo con las estadísticas publicadas por el Ministerio de la Protección Social en el informe sobre la Situación de salud en Colombia -Indicadores de salud 2007-, la enfermedad isquémica del corazón es la principal causa de muerte tanto en hombres como en mujeres mayores de 45 años o más, e incluso supera las muertes violentas o los cánceres combinados. La tasa de mortalidad atribuible a esta enfermedad fue de 107,3 por 100.000 habitantes en personas de 45 a 64 años, y de 867,1 por 100.000 habitantes para personas de 65 años o más (34). Sin embargo, en el país se desconoce globalmente la magnitud actual de la carga de la enfermedad cardíaca isquémica en términos de prevalencia de factores de riesgo, a excepción de la obesidad y el sedentarismo; por tanto, se necesitan estudios epidemiológicos globales sobre este aspecto (34).
Diagnóstico
Presentación clínicaEl síntoma clásico asociado con SCA es disconfort o dolor en el tórax; sin embargo, los síntomas pueden incluir disconfort en otras áreas del tronco, náuseas, falta de aliento, diaforesis, náusea, y mareo (35).
Los síntomas del IAM son característicamente más intensos que los de la angina y duran más de 15 minutos. Es posible que se presenten síntomas atípicos en ancianos, mujeres y diabéticos (35).
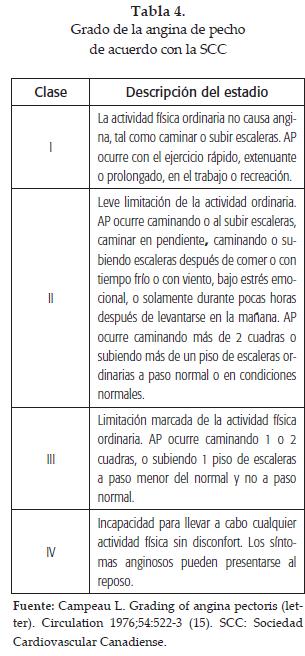
Existen 3 presentaciones principales de la angina inestable (AI): 1) angina de reposo; 2) angina severa de reciente comienzo; y 3) angina in cresscendo (tabla 3) (36). Los criterios para el diagnóstico de la angina se gradúan de acuerdo con la clasificación de la Sociedad Cardiovascular Canadiense (CSCC) (tabla 4) (41).
El personal de urgencias debe evaluar rápidamente al paciente con un posible SCA y determinar si el dolor en el tórax corresponde a una causa cardíaca o si corresponde a una situación que amenaza la vida del paciente, para lo cual se vale del ABC de la reanimación. Idealmente dentro de los 10 primeros minutos de la llegada del paciente al servicio de urgencia, el personal asistencial debe obtener una historia clínica orientada al problema, e iniciar el manejo farmacológico básico, mientras se monitoriza al paciente y se realiza un electrocardiograma de 12 derivaciones (37).
La evaluación debe enfocarse en el disconfort toráxico, signos y síntomas asociados, factores de riesgo para SCA, datos personales que puedan contraindicar el uso de fibrinolíticos u otras terapias. Esta evaluación inicial debe ser muy eficiente porque si el paciente cursa con un IAMCEST, las metas de repefusión son la administración de fibrinolíticos dentro de los primeros 30 minutos del arribo (intervalo puerta a droga) o para la realización de la angioplastia percutánea dentro de los 90 minutos del arribo (puerta a inflado del balón en la unidad de cateterismo cardíaco (38,39).
Eventos silentes
Los pacientes que experimentan un SCA no siempre consultan por disconfort torácico. El estudio Framingham fue el primero en mostrar que más o menos la mitad de todos los IAM pueden ser clínicamente silentes y no reconocidos por el paciente (40). Cano et al. encontraron que un tercio de los 434.877 pacientes con IAM confirmado en el NRMI, ingresaron al hospital con síntomas diferentes al dolor torácico. Entre estos pacientes, había más probabilidad de encontrar mujeres, ancianos, diabéticos y personas con insuficiencia cardíaca previa, en comparación con los IAM con disconfort torácico. Adicionalmente, estos sujetos demoraron más en consultar al hospital (media de 7.9 vs. 5.3 h), disminuyendo la probabilidad que se les diagnosticara un IAM (22.2% vs. 50.3%). También presentaron menos chance de recibir fibrionolisis o ICP, ASA, beta bloqueadores o heparina. En los pacientes con IAM silente se informó 2.2 veces más probabilidad de morir durante la hospitalización (tasa de mortalidad hospitalaria 23.3% vs. 9.3%) (41).
Los proveedores de la salud deben mantener un alto índice de sospecha para SCASEST cuando evalúan mujeres, diabéticos, ancianos o aquellos pacientes con disnea inexplicable (42), así como aquellos con historia de IC (insuficiencia cardíaca) o ACV (ataque cerebrovascular) al igual que pacientes con dolor torácico cuyos marcapasos permanentes les puede impedir el reconocimiento del SCASEST en el electrocardiograma de 12 derivaciones (6). El examen físico es realizado para ayudar al diagnóstico, descartar otras causas que expliquen los síntomas del paciente y evaluar las complicaciones relacionadas con el SCA. Sin embargo, aunque la evaluación de los síntomas y signos clínicos pueden aumentar el nivel de sospecha del SCA, no hay evidencia que soporte la utilidad de signos clínicos individuales o combinados, para confirmar el diagnóstico (34).
Hallazgos electrocardiográficos
Cuando el paciente se presenta con síntomas sugestivos de SCA, el clínico usa los hallazgos electrocardiográficos para clasificar al paciente en cualquiera de estos 3 grupos (37).
1. Elevación del segmento ST o bloqueo completo de rama izquierda, nuevo o presumiblemente nuevo, caracterizado por elevación del segmento ST > de 1mm (0.1 mV en 2 o más derivaciones precordiales contiguas o 2 o más derivaciones adyacentes de los miembros). Se clasifica como infarto agudo del miocardio con elevación del segmento ST (IAMCEST).
2. Depresión isquémica del segmento ST > 0.5 mm (0.05 mV) o inversión dinámica de la onda T con dolor o disconfort. Se clasifica como angina inestable de alto riesgo / infarto agudo del miocardio sin elevación del segmento ST (IAMSEST). En esta categoría también se incluye una elevación del segmento ST mayor o igual de 0.5 mm, no persistente o transitoria por < 20 minutos.
3. Un electrocardiograma normal o cambios no diagnósticos en el segmento ST o la onda T: incluye pacientes con electrocardiograma (ECG) normal, o aquellos con desviación del segmento ST menor de 0.5 mm (0.05 mV) o una inversión de la onda T menor o igual de 0.2mV. Este grupo necesita estudios cardíacos seriados y pruebas funcionales (estratificación) para definir la conducta.
La morfología del segmento ST es definitiva para definir el tratamiento fibrinolítico. Los infartos con elevación del segmento ST pueden beneficiarse de este, mas no así los infartos sin elevación del segmento ST (26).
Marcadores séricos
Troponinas cardíacas La irrupción de las troponinas cardíacas (TPC) ha modificado el escenario tradicional del SCA, estableciendo unos nuevos criterios en la definición del IAM, en la determinación del riesgo cardiovascular y en la elección del mejor tratamiento (42). Estas proteínas se hallan situadas en el filamento fino del complejo tropomiosina de las miofibrillas, aunque existe también una pequeña cantidad libre en el citoplasma, y constan de tres subunidades: T, I y C. Las TPC I y T son cardioespecíficas, porque tienen una secuencia de aminoácidos diferente a la del músculo esquelético, mientras que la TPC C carece de cardioespecificidad y de utilidad clínica (43).
La gran sensibilidad de las TPC permite detectar necrosis miocárdicas focales que no son tan grandes como para elevar la creatincinasa total y su fracción MB. Alrededor de un tercio de pacientes con angina de reposo y ausencia de elevación del segmento ST, que antes eran etiquetados de AI por la normalidad de las enzimas cardíacas tradicionales, deben ser ahora diagnosticados de "microinfarto" o "lesión miocárdica menor", debido a la elevación de las TPC (37). El grupo conjunto de la Sociedad Europea y Americana de Cardiología acordó que las TPC eran los mejores marcadores de necrosis miocárdica y decidió incluirlas en su nueva definición del IAM basada en una concentración máxima de TPC T o I, excediendo del límite de decisión (percentil 99 de los valores para un grupo de control de referencia) en al menos una ocasión durante las primeras 24 h, desde el acontecimiento clínico inicial (5). Las TPC aparecen en el suero a las 4-10 h del comienzo, elevadas durante 4-10 días. Este patrón de liberación tan prolongado dificulta el diagnóstico de reinfarto y puede requerir la utilización de biomarcadores cardíacos de duración más corta, como la mioglobina o la creatincinasa-MB (37).
La elevación de las TPC permite realizar una estratificación precoz del riesgo cardiovascular en pacientes con SCA (38). En un análisis prospectivo, Ohman et al. (44) encontraron que un valor de TPC T elevada (> 0,1 ng/ml) se asociaba con una mortalidad a los 30 días más alta (el 11,8 frente al 3,9%; p < 0,001). Igualmente, Antman et al. (45), mediante un análisis retrospectivo y cualitativo de la TPC I, notaron que la mortalidad a los 42 días era del 3,7 frente al 1,0% (p < 0,001), según la determinación enzimática fuera positiva o negativa; cuando el estudio se limitó únicamente al grupo de pacientes con un análisis negativo de la creatincinasa-MB, también detectaron mayor mortalidad en los enfermos con TPC I positiva (el 2,5 frente al 0,8%; p < 0,05) (45). Sin embargo, estos datos no justifican que las TPC se utilicen como único marcador de riesgo, puesto que una TPC normal no excluye por sí misma la aparición de complicaciones. Así, Kontos et al. (46) estudiaron a una cohorte de 1.929 pacientes consecutivos ingresados desde urgencias por sospecha de IAM, y apreciaron que aquellos con una TPC I anormal (> 1,0 ng/ml) tenían una mayor probabilidad de presentar complicaciones (el 43 frente al 13%) o una enfermedad coronaria significativa (el 41 frente al 17%); sin embargo, la sensibilidad para las complicaciones o para la enfermedad coronaria significativa resultó baja (el 14 y el 21%, respectivamente).
Las TPC también permiten seleccionar el tratamiento más adecuado de los pacientes con SCA sin elevación del segmento ST (43). El estudio CAPTURE (47) demostró que los pacientes con TPC T elevada al ingreso tenían una incidencia de muerte o infarto de miocardio no fatal del 23,9% cuando eran tratados con placebo y del 9,5% cuando eran tratados con abciximab (p = 0,002), mientras que el grupo de pacientes con TPC T normal tenía una incidencia de muerte o infarto de miocardio en el grupo tratado con abciximab mayor (9,4%) que en el grupo placebo (7,5%; p = NS). Del análisis de estos datos puede inferirse que los pacientes con nulo o escaso aumento de las TPC tiene bajo riesgo y es poco probable que puedan beneficiarse del tratamiento intravenoso con inhibidores glucoprotéicos IIb/ IIIa. Los pacientes con mayores valores de TPC han perdido cantidades significativas de miocardio y la coronariografía precoz, quizá sea la mejor alternativa con vistas a la cirugía de revascularización o a la intervención coronaria percutánea asociada a inhibidores glucoprotéicos IIb/IIIa. Los pacientes con valores intermedios de TPC todavía no han perdido una cantidad sustancial de miocardio y son unos excelentes candidatos para la administración de heparinas no fraccionadas, así como para una estrategia invasiva precoz complementada con inhibidores intravenosos glucoprotéicos IIb/IIIa (2,4,5,6).
Como la elevación de las TPC solo indica que se ha producido un daño miocárdico, pero no su mecanismo de producción, en ausencia de evidencia clínica o electrocardiográfica de isquemia miocárdica deben buscarse otras causas de lesión cardíaca, como miocarditis o traumatismo cardíaco (contusión, ablación, cardioversión) (34). Aunque se ha argüido que la insuficiencia renal podría interferir con el valor pronóstico de las TPC, debido a que su aclaramiento puede estar disminuido, Avilés et al. (48) han demostrado que los valores de TPC T predicen el pronóstico a corto plazo de muerte e infarto de miocardio en pacientes con SCA, independientemente de los valores de aclaramiento de creatinina.
En definitiva, el nuevo criterio de IAM, basado en el descenso del umbral diagnóstico proporcionado por la determinación de las TPC, originará un aumento de la incidencia y una disminución de la mortalidad global del infarto de miocardio.
Creatinfosfocina (CK)
Aunque no son específicos del miocardio, durante varias décadas los marcadores bioquímicos empleados para la confirmación del daño miocárdico han sido la CK y su fracción MB (49). Estos, aunque son útiles, no permiten identificar adecuadamente a los pacientes con necrosis miocárdica mínima; tienen escasa especificidad en ciertos pacientes (como ejemplo, en aquellos con daño muscular concomitante, enfermedad tiroidea y/o renal, 5% de los pacientes presentan elevación de la fracción MB como consecuencia de miopatía esquelética) y poseen un limitado poder pronóstico (50). Sus niveles plasmáticos se incrementan entre 6-10 horas después de establecido el infarto, proporcionando una sensibilidad cercana a 90% (en ausencia de trombólisis) y sensibilidad de 36-48% cuando se determina en un período de tiempo más corto, pues alcanzan «pico» máximo a las 12-24 h, y retornan a la normalidad entre 36-72 h. Debido a su cinética, se recomiendan las mediciones de CK-MB cada 12 horas como una práctica adecuada. Obteniendo mediciones en un lapso más frecuente, se incrementa la sensibilidad diagnóstica de esta enzima. Los niveles pico de CK-MB desaparecen de manera más rápida que la CK total (51). Para hacer diagnóstico específico se utiliza el índice que resulta de dividir la CK total/ CKMB, tomando como nivel diagnóstico un valor > 3.0 veces (5). Sin embargo, el valor aislado de estas enzimas resulta poco útil y es práctica común realizar una curva enzimática de 24 horas a fin de corroborar el diagnóstico de IAM (52).
Proteína C reactiva (PCR)
Con el reconocimiento de la aterosclerosis como un proceso inflamatorio, muchos marcadores de inflamación han sido evaluados como potenciales herramientas predictoras de riesgo de eventos coronarios (53). Se han descrito diversos marcadores de inflamación; sin embargo, su valor clínico y pronóstico es incierto debido a la falta de evidencia como predictores de riesgo (54). La proteína C reactiva (PCR) es un marcador sensible de inflamación sistémica descubierta en 1930 y se le denominó así por la reacción que presenta con el polisacárido C pneumocócico en el plasma de pacientes durante la fase aguda de neumonía pneumocócica (55). Estudios prospectivos realizados en varones aparentemente sanos, particularmente con niveles de lípidos bajos y/ o con factores de riesgo coronario alto o bajo, indican que los niveles elevados de PCR de alta sensibilidad proporcionan un valor pronóstico a corto y largo plazo de presentación del primer IAM, morbimortalidad debido al daño de la célula miocárdica asociada a enfermedad coronaria o muerte súbita por causas cardíacas (55).
Mioglobina
La mioglobina es el primer marcador que se eleva después del daño celular miocárdico (56). Es una proteína compuesta por una cadena polipeptídica y un grupo prostético heme presente en todas las fibras del músculo estriado, y cerca de 2% se encuentra en tejido de masa cardíaca y esquelética (47,52). Debido a que la mioglobina «escapa» rápidamente hacia la célula miocárdica demandante, esta puede ser detectada 2 horas después de ocurrido el infarto, con nivel sérico «pico» entre 3 a 15 horas. Su sensibilidad al momento de la presentación del evento es de 49% y su especificidad de 91% (56).
Un estudio realizado en 309 pacientes ingresados por dolor precordial para determinar la sensibilidad de la mioglobina demostró que esta mejora de acuerdo a las horas de evolución de iniciado el dolor torácico, 49% en el momento de la presentación del evento. A las 3 horas la sensibilidad fue de 89%, a las 4 horas de 93% y a las 5 horas llegó a 96% (tomando como valor de corte 90 μg/mL) (57). La especificidad de la mioglobina en el diagnóstico de IAM puede incrementarse mediante el monitoreo con un marcador adicional como la anhidrasa carbónica III (57).
Péptido natriurético auricular
Un nuevo biomarcador que ahora puede ser utilizado en las guías de manejo de los SCA es el péptido natriurético atrial (PAN) (37). El PAN pertenece a la familia de las hormonas peptídicas y juega un rol fundamental en la homeostasis y las enfermedades cardiovasculares. El PAN es excretado tanto por los miocitos auriculares como por los ventriculares, donde el principal sitio de producción es el ventrículo izquierdo (58). El PAN es una prohormona almacenada en la aurícula, que es liberada en forma activa: PAN C- terminal y en forma inactiva: PAN N-terminal (NT-PAN), por lo cual es menos rápida de clarificar en la circulación y más estable que el PAN (59).
La utilidad de la evaluación de esta neurohormona fue mostrada inicialmente para el diagnóstico y evaluación de la IC (58). Desde entonces, numerosos estudios prospectivos han documentado su valor pronóstico independiente de los factores de riesgo convencionales para mortalidad en pacientes con EAC estable o inestable (58).
Una revisión de los estudios disponibles en SCA mostró que cuando se mide en el primer contacto con el paciente o durante la estancia hospitalaria, el PAN es un fuerte predictor de tanto de mortalidad a largo y corto plazo en pacientes con SCAEST y AI/ SCASEST (58) Los niveles aumentados de NT-PAN están asociados proporcionalmente con tasas de mortalidad a largo y corto plazo; así se han descrito tasas de mortalidad con quartiles en incremento a 1 año de 1.8% , 3.9%,7.7%, y 19.2%, respectivamente (p< 0.001) en el estudio GUSTO-IV de 6.809 pacientes (59). Este valor pronóstico fue independiente de una historia previa de IC y signos clínicos o de laboratorio para disfunción ventricular izquierda a la admisión o durante la estancia hospitalaria (60).
Conclusiones
Los síndromes coronarios agudos continúan siendo un problema importante de salud pública en todo el mundo, por su alta morbimortalidad y los altos costos directos e indirectos derivados de ello así como un reto diagnóstico para los clínicos.Se observa una tendencia hacia la disminución de la mortalidad en la enfermedad coronaria tal vez por los avances en el diagnóstico y el diseño de estrategias farmacológicas en los últimos años y al énfasis que se ha dado al control de los factores de riesgo. La definición moderna del síndrome coronario agudo pone especial énfasis en el análisis de la morfología del segmento ST, el cual guía la estrategia de revascularización del vaso culpable, que es la meta terapéutica esencial actualmente.
La importancia dada hoy a los biomarcadores de lesión miocárdica como las troponinas ha modificado el escenario tradicional del SCA, permitiendo diagnosticar más casos de IAM antes clasificados como anginas, lo que se traduce en un aumento de la incidencia y una disminución consecuente de la mortalidad global del IAM.
Conflictos de interesesLos autores declaran no tener ningún conflicto de interés.
REFERENCIAS
1. Fuster V, Steele OM, Chesebro JH. Role of platelets and thrombosis in coronary atherosclerotic disease and suden death. J. Am Coll Cardiol 1985;5:b175-84. [ Links ]
2. Antman EM, Anbe DT, Armstrong PW, Bates ER, Green LA, Hand M, et al. ACC/ AHA guidelines for the management of patients with ST-elevation myocardial infarction; a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Commi ttee to Revise the 1999 Guidelines for the Management of patients with acute myocardial infarction) J Am Coll Cardiol 2004;44(3):E1-E211. [ Links ]
3. Van de Werf F, Ardissino D, Betriu A, Cokkinos DV, Falk E, Fox KAA, et al. The Task Force on the management of acute myocardial infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2003;24:28-66. [ Links ]
4. Braunwald E, Antman EM, Beasley JW, Califf RM, Cheitlin MD, Hochman JS, et al. American College of Cardiology; American Heart Association, Committee on the management of patients with unstable angina and non-ST segment elevation myocardial infarction. ACC/AHA 2002 guideline update for the management of patients with unstable angina and non-ST segment elevation myocardial infarctionsummary article: a report of the American College of Cardiology/American Heart Association task force on practice guidelines (Committee on the management of patients with unstable angina). J Am Coll Cardiol 2002;40:1366-1374. [ Links ]
5. Vasan RS. Biomarkers of cardiovascular disease. Molecular basis and prac ical t considerations. Circulation 2006;113:23352362. [ Links ]
6. Alpert JS, Thygesen K, White HD, Jaffe AS. Implications of the universal definition of myocardial infarction. Nat Clin Pract Cardiovasc Med 2008;5(11):678-9. [ Links ]
7. Writing Group Members, Thom T, Haase N, et al. Heart disease and stroke statisticsd 2006 update. A report from the American Heart Association Statistics Committee and Stroke Statistics Subcommittee, 10.1161/ CIRCULATIONAHA.105.171600. Circulation 2006. [ Links ]
8. Roger VL. Epidemiology of Myocardial Infarction. Med Clin N Am 2007;91:537-552. [ Links ]
9. Rosamond W, Flegal K, Furie K, Go A, Greenlund K, Haase N, et al. Heart disease and stroke statistics--2008 update: a report from the American Heart Asso iation c Statistics Committee and Stroke Statistics Sub committee. Circulation 2008;117(4):25-146. [ Links ]
10. Boland LL, Folsom AR, Sorlie PD, Taylor HA, Rosamond WD, Chambless LE et al. Occurrence of unrecognized myocardial infarction in subjects aged 45 to 65 years (the ARIC study). Am J Cardiol. 2002;90:927-31. [ Links ]
11. Lloyd-Jones DM, Larson MG, Beiser A, Levy D. Lifetime risk of developing coronary heart disease. Lancet 1999;353:89-92. [ Links ]
12. Kannel WB, Hjortland MC, McNamara PM, Gordon T. Menopause and risk of cardiovascular disease: the Framingham study. Ann Intern Med 1976;85:447- 52. [ Links ]
13. Mandelzweig L, Battler A, Boyko V, Bueno H, Danchin N, Filippatos G, et al. The second Euro Heart Survey on acute coronary syndromes: characteristics, treatment, and outcome of patients with ACS in Europe and the Mediterranean Basin in 2004. European Heart Journal 2006;27:2285-93. [ Links ]
14. Goldberg RF, Steg PG, Sadiq I, Granger GB, Jackson EA, Budaj A, et al. Extent of, and factors associated with, delay to hospital presentation in patients with acute coronary disease (the GRACE registry). Am J Cardiol 2002;89:791-796. [ Links ]
15. Furman MI, Dauerman HL, Goldberg RJ, Yarzebski J, Lessar D, Gore JM. Twenty-two yaer (1975 to 1997) trends in the incidence, in hospital and long-term case fatality rates from initial Q-wave and no Q-wave myocardial infarction: a multi-hospital, community-wide perspective. J Am Coll Cardiol 2001;37:1571-80. [ Links ]
16. Rosamond WD, Chambless LE, Folsom AR, Cooper LS, Conwill DE, Clegg L, et al.Trends in the incidence of myocardial infarction and in mortality due to coronary heart disease. N Engl J Med 1998;339:861-7. [ Links ]
17. McGovern PG, Jacobs DR Jr, Shahar E, Arnett DK, Folsom AR, Blackburn H, et al. Trends in acute coronary heart disease mortality, morbidity, and medical care from 1985 through 1997: the Minnesota heart survey. Circulation 2001;104(1):19-24. [ Links ]
18. Roger VL, Jacobsen SJ, Weston SA, Goraya TY, Killian J, Reeder GS, et al. Trends in the incidence and survival of patients with hospitalized myocardial infarction, Olmsted County, Minnesota, 1979 to 1994. Ann Intern Med 2002;136(5):341-8. [ Links ]
19. Arciero TJ, Jacobsen SJ, Reeder GS, Frye RL, Weston SA, Killian JM, et al. Temporal trends in the incidence of coronary disease. Am J Med 2004;117(4):228-33. [ Links ]
20. Goldberg RJ, Yarzebski J, Lessard D, Gore JM. A two-decades (1975 to 1995) long experience in the incidence, in-hospital and long-term case-fatality rates of acute myocardial infarction: a community-wi de perspective. J Am Coll Cardiol 1999; 33(6):1533-9. [ Links ]
21. Goff DC, Nichaman MZ, Chan W, Ramsey DJ, Labarthe DR, Ortiz C. Greater incidence of hospitalized myocardial infarction among Mexican Americans than non-Hispanic whites. The Corpus Christi Heart Project, 1988-1992. Circulation 1997;95(6):1433-40. [ Links ]
22. Rea TD, Pearce RM, Raghunathan TE, Lemaitre RN, Sotoodehnia N, Jouven X, et al. Incidence of out-of-hospital cardiac arrest. Am J Cardiol 2004;93:1455-1460. [ Links ]
23. Thom TJ, Kannel WB, Silbershatz H, D'Agostino RB. Cardiovascular disease in the United States and preventive approaches. In: Fuster V, Alexander RW, O Rourke RA, eds. Hurst s The Heart, Arteries and Veins. 10th ed. New York, NY: McGraw-Hill; 2001. [ Links ]
24. Cohen MC, Rohtla KM, Lavery CE, Muller JE, Mittleman MA. Metaanalysis of the morning excess of acute myocardial infarction and sudden cardiac death [published correction appears in Am J Cardiol 1998;81:260]. Am J Cardiol 1997;79:1512-1516. [ Links ]
25. Chiriboga D, Yarzebski J, Goldberg RJ, Gore JM, Alpert JS. Temporal trends (1975 through 1990) in the incidence and casefatality rates of primary ventricular fibrillation complicating acute myocardial infarction: a communitywide perspective. Circulation 1994;89: 998-1003. [ Links ]
26. Nielsen KM. Acute coronary syndrome: incidence and prognosis. Dan Med Bull 2006;53:95. [ Links ]
27. Rationale and design of the GRACE (Global Registry of Acute Coronary Events) Project: a multinational registry of patients hospitalized with acute coronary syndromes. AmHeart J. 2001;141(2):190-9. [ Links ]
28. McGovern PG, Pankow JS, Shahar E, Doliszny KM, Folsom AR, Blackburn H, et al. Recent trends in acute coronary heart diseased mortality, morbidity, medical care, and risk factors. The Minnesota Heart Survey Investigators. N Engl J Med 1996;334(14):884-90. [ Links ]
29. Sytkowski PA, D Agostino RB, Belanger A, Kannel WB. Sex and time trends in cardiovascular disease incidence and mortality: the Framingham Heart Study, 1950-1989. Am J Epidemiol 1996;143(4):338-50. [ Links ]
30. Yusuf S, Hawken S, Ounpuu S, Dans T, Avezum A, Lanas F, et al. INTERHEART Study Investigators. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): casecontrol study. Lancet.2004;364:937-952. [ Links ]
31. Khot UN, Khot MB, Bajzer ChB, Sapp SK, Ohman EM, Brener SJ, et al. Prevalence of conventional risk factors in patients with coronary heart disease. JAMA 2003;290:898904. [ Links ]
32. Witt BJ, Jacobsen SJ, Weston SA, Killian JM, Meverden RA, Allison TG, et al. Cardiac rehabilitation after myocardial infarction in the community. J Am Coll Cardiol 2004;44:988-996 [ Links ]
33. Centers for Medicare and Medicaid Services. Health Care Financing Review: Medicare and Medicaid Statistical Supplement. Centers for Medicare and Medicaid Services: Baltimore, Md; 2003 citado marzo 21 2008. Disponible en: http://www.cms.hhs.gov/ p apps/review/Supp/. [ Links ]
34. Beltrán JR, Beltrán R, Caicedo VM, García M, García E, Gómez EA, et al. Guías colombianas de cardiología . Síndrome coronario agudo sin elevación del ST. Rev Col Cardiol 2008;15 Supl 3:143-232. [ Links ]
35. Blomkalms A, Gilber B. Chest Pain Unit Concept: Rationale and diagnostic strategies. Cardiol Clin 2005;23:411-421. [ Links ]
36. Braunwald E. Unstable angina: a classi fi cation. Circulation 1989;80:410-4. 37. Campeau L. Letter: grading of angina pectoris. Circulation 1976;54: 522-3. [ Links ] [ Links ]
38. ACC/AHA 2007 Guidelines for the Management of Patients With Unstable Angina/ NonST-Elevation Myocardial Infarction: A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines for the Management of Patients With Unstable Angina/NonST-Elevation Myocardial In farc ion): Developed in Collaboration with t the American College of Emergency Physicians, the Society for Cardiovascular Angiography and Interventions, and the Society of Thoracic Surgeons: Endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation and the Society for Academic Emergency Medicine. Circulation 2007;116;e148-e304. [ Links ]
39. Kannel WB. Silent myocardial ischemia and infarction: insights from the Framingham Study. Cardiol Clin 1986;4:583-91. [ Links ]
40. Canto JG, Shlipak MG, Rogers WJ, et al. Prevalence, clinical characteristics, and mortality among patients with myocardial infarction presenting without chest pain. JAMA 2000;283:3223-9. [ Links ]
41. Abidov A, Rozanski A, Hachamovitch R, et al. Prognostic significance of dyspnea in patients referred for cardiac stress testing. N Engl J Med 2005;353:1889-98. [ Links ]
42. Ortega J. Síndromes coronarios agudos en la era de las troponinas. Editorial Med Intensiva 2003;27(8):538-40. [ Links ]
43. Bleier J, Vorderwinkler KP, Falkensammer J, Mair P, Dapunt O, Puschendorf B, et al. Different intracellular compartmentations of cardiac troponins and myosin heavy chains: a casual connection to their different early release after myocardial damage. Clin Chem 1998;44:1912-8. [ Links ]
44. Ohman EM, Armstrong PW, Christenson RH, Granger CB, Katus HA, Hamm CW, et al. Cardiac troponin levels for risk stratification in acute myocardial ischemia. N Engl J Med 1996; 335:1333-41. [ Links ]
45. Antman EM, Tanasijevic MJ, Thompson B, Schactman M, McCabe CH, Cannon CP, et al. Cardiac-specific troponin I levels to predict the risk of mortality in patients with acute coronary syndrome. N Engl J Med 1996;335:1342-9. [ Links ]
46. Kontos MC, Anderson FP, Alimard R, Ornato JP, Tatum JL, Jesse RL. Ability of troponin I to predict cardiac events in patients admitted from the emergency department. J Am Coll Cardiol 2000;36:1818-23. [ Links ]
47. Hamm CW, Heeschen C, Goldman B, Vahanian A, Adgey J, Macaya Miguel C. Benefit of abciximab in patients with refractory unstable angina in relation to serum troponin T levels. N Engl J Med 1999;340:1623-9. [ Links ]
48. Avilés RJ, Askari AT, Lindahl B, Wallentin L, Jia G, Ohman EM, et al. Troponin T levels in patients with acute coronary syndromes, with or without renal dysfunction. N Engl J Med 2002;346:2047-52. [ Links ]
49. Barba JR. Síndrome coronario agudo: Marcadores de lesión miocárdica. Rev Mex Patol Clin 2007;54(3):116-135. [ Links ]
50. Roldán TI, Baello MP, Sevilla TB, Sanz AS, Salim MM, et al. Valor pronóstico de la troponina T en pacientes hospitalizados con angina o infarto sin elevación del segmento ST. Rev Esp Cardiol 2003;5(1):35-42). [ Links ]
51. Adams III JE, Abendschein DR, Jaffe AS. Biochemical markers of myocardial injury. Is MB creatine kinase the choice for the 1990s? Circulation 1993;88(2):750-763. [ Links ]
52. Hollander JE. The future of cardiac bio markers. New concepts and emerging technologies for emergency physicians. Emergency Medicine Cardiac Research Education Group 2005;4:1-6. [ Links ]
53. Gabay C, Kushner I. Acute-phase proteins and other systemic responses to inflammation. N Engl J Med 1999;340:448-454. [ Links ]
54. Nissen SE, Tuzcu M, Schoenhagen P, Crowe T, Sasiela WJ, et al. Statin therapy, LDL cholesterol, C-reactive protein, and coronary artery disease. N Engl J Med 2005;352:29-38. [ Links ]
55. Danesh J, Wheeler JG, Hirschfield GM, Eda S, Eiriksdottir G et al. C-reactive protein and other circulating markers of inflammation in the prediction of coronary heart disease. N Engl J Med 2004; 350:1387-1397. [ Links ]
56. Masson JF, Obando L, Beudoin S, Booksh K. Sensitive and realtime fiber-optic-based surface plasmon resonance sensors for myoglobin and cardiac troponin I. Talanta 2004;62:865-870. [ Links ]
57. Murphy MJ, Berding CB. Use of measure ments of myoglobin and cardiac tro onins in p the diagnosis of acute myo ardial infarction. Critical Care Nurse 1999;19(1):58-66. [ Links ]
58. Felker GM, Peterson JW, Mark DB. Natriuretic peptides in the diagnosis and management of heart failure. CMAJ 2006; 175(6):611-617. [ Links ]
59. Wang TJ, Larson MG, Levy D, Benjamin EJ, Leip EP, et al. Plasma natriuretic peptide levels and the risk of cardiovascular events and death. N Engl J Med 2004;350:655-663. [ Links ]
60. Richards M, Nicholls MG, Espiner EA, Lainchbury JG, Troughton RW, et al. Comparison of B-type natriuretic peptides for assessment of cardiac function and prognosis in stable ischemic heart disease. J Am Coll Cardiol 2006; 47(1):52-60. [ Links ]