Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Salud Uninorte
Print version ISSN 0120-5552On-line version ISSN 2011-7531
Salud, Barranquilla vol.25 no.2 Barranquilla July/Dec. 2009
ARTÍCULO DE REVISIÓN / REVIEW ARTICLE
Factores epidemiológicos en la inmunopatogénesis de la alergia a los alimentos
Epidemiological factors in food allergy immunopathogenesis
Juan R. Urrego Álvarez1, Luz del C. Hernández Bonfante2, Javier Marrugo Cano3
1 Químico Farmacéutico, estudiante de Maestría en Inmunología, Universidad de Cartagena (Colombia). jmarrugoc@unicartagena.edu.co
2 Odontóloga, profesional universitario, Instituto de Investigaciones Inmunológicas, Universidad de Cartagena (Colombia).
3 Médico, Inmunólogo, profesor titular, Instituto de Investigaciones Inmunológicas, Universidad de Cartagena (Colombia).
Correspondencia: Universidad de Cartagena. Carrera 6 N° 36-100 Calle de la Universidad, Cartagena (Colombia).
Fecha de recepción: 20 de junio de 2009
Fecha de aceptación: 1 de agosto de 2009
Resumen
La alergia a los alimentos (A A) es un problema de salud en los países desarrollados. En estos países, las prevalencias oscilan entre el 6 y el 8% en niños y alrededor del 3% en adultos. Un reciente metaanálisis mostró una marcada heterogeneidad en las cifras de prevalencia, atribuida principalmente a diferencias metodológicas o poblacionales. De otra parte, hay muy pocos estudios que revelen la verdadera dimensión del problema en los países en vías de desarrollo. Los escasos estudios existentes se realizaron con cuestionarios y sin confirmación de los diagnósticos con pruebas objetivas. En general, los síntomas de alergia a los alimentos se presentan más frecuentemente en las primeras etapas de la vida y casi siempre son desencadenados por un número limitado de alimentos, como la leche, el huevo, el maní, etc. Recientemente se han desarrollado varios modelos animales que han facilitado el entendimiento de algunos de los mecanismos inmunopatogenicos involucrados en esta enfermedad. En diversos estudios epidemiológicos y experimentales se ha sugerido que algunos factores genéticos y ambientales (nutricionales, microbianos, farmacológicos y contaminantes) podrían jugar algún papel importante en la epidemiología y la patogénesis de la A A.
Palabras clave: Adyuvantes, alergia a los alimentos, factores de riesgo inmunopatogenesis, modelos animales, prevalencia.
Abstract
Food allergy (FA) is an important health problem in developed countries. In these countries the prevalence ranging between 6 to 8% in children and about 3% in adults. A recent metaanalysis showed a marked heterogeneity in the prevalence of food allergy that could be a result of differences in study design, methodology, or differences between populations. In addition, there are very few studies to reveal the true dimension of the problem in developing countries. In these countries the few existing studies were conducted with questionnaires and without confirmation of the diagnoses with objective test. In general the symptoms of food allergy occurs more frequently in the early stages of life and are almost always triggered by a limited number of food, such as milk, eggs, peanuts, etc. Recently, several animal models have been developed and they have facilitated the understanding of some of the immunopathogenic mechanisms involved in this disease. In various epidemiological and experimental studies have suggested that some genetic and environmental factors (Nutritional, microbial, pharmacological and pollutants) could play an important role in the epidemiology and the pathogenesis of FA.
Keywords: Adjuvants, animal models, food allergy, immunophatogenesis, prevalence, risk factors.
INTRODUCCIÓN
En las dos últimas décadas ha surgido un gran interés por el entendimiento de los mecanismos inmunopatogenicos de la alergia a los alimentos (A A), así como por la identificación de los factores de riesgo epidemiológicos que influyen en su desarrollo. A pesar de estos esfuerzos, aún hay muchos interrogantes por resolver(l). En los países industrializados, entre el 6 y el 8% de los niños tienen alergia a algún alimento, mientras que en los adultos las cifras de prevalencia son de alrededor del 3%(2).
Sin embargo, en un reciente metaanálisis que revisó los datos de más de 50 estudios de diferentes países, los autores observaron discrepancias en las cifras de prevalencia, lo que según su análisis podría deberse a diferencias metodológicas, culturales, poblacionales o genéticas(3).
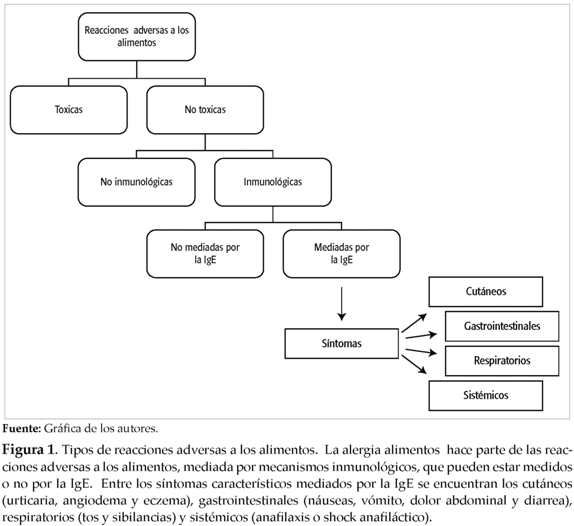
La A A es catalogada como una reacción adversa y no tóxica a antígenos alimenticios que puede o no estar mediada por la IgE. La A A mediada por IgE (también referida como A A Tipo I) es la responsable de la mayoría de las reacciones de hipersensibilidad alimenticia, está involucrada el 30 al 50% de las reacciones anafilácticas que se presentan en los servicios de urgencias de Estados Unidos y causa alrededor de 200 muertes al año(4-6).
En la figura 1 se observa la clasificación de los diferentes tipos de reacciones adversas a los alimentos.
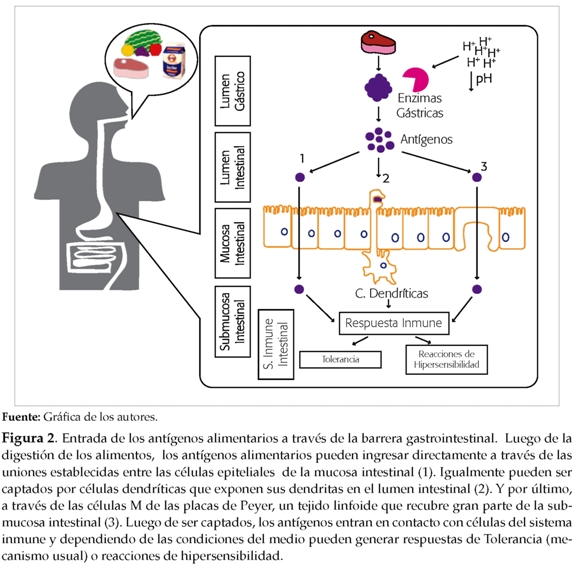
El proceso se inicia con la ingestión del alimento por parte de un individuo genéticamente susceptible. Las proteínas de la matriz alimenticia, entre ellas los alérgenos, entran en contacto y atraviesan las barreras epiteliales del intestino y posteriormente interactúan con elementos del sistema inmune (ver figura 2).
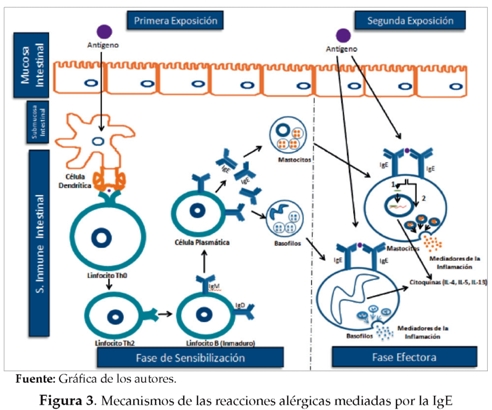
Esta interacción resulta en la polarización de la respuesta hacia el perfil Th2, con linfocitos productores de citoquinas como la IL-4, IL-5 y la IL-13, lo que facilita la síntesis de la IgE por parte de los LB y de conjunto mantienen el proceso inflamatorio de tipo alérgico. La IgE se une a su receptor de alta afinidad (FceRI) en el basófilo y el mastocito y en una segunda exposición el alérgeno inicia el proceso de degranulación de estas células, lo cual permite la liberación y síntesis de una serie de agentes farmacológicos como la histamina.
Estos son los responsables de la anafilaxis y de otras manifestaciones clínicas observadas en los pacientes con A A.
En este artículo haremos una revisión detallada de los avances en el conocimiento de los mecanismos inmunopatogénicos involucrados en la A A, así como de los factores de riesgo epidemiológicos más importantes que facilitan el desarrollo de este importante problema de salud.
EPIDEMIOLOGÍA
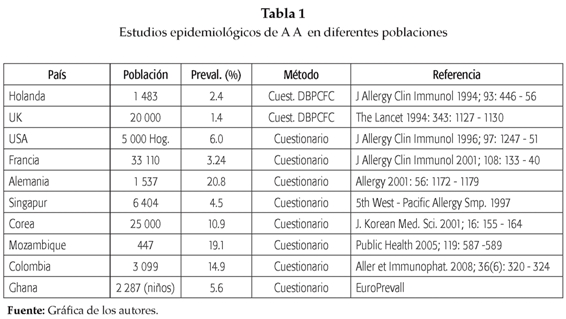
La alergia a los alimentos es un importante problema de salud que en los últimos años ha aumentado su incidencia en países industrializados(7). En las dos últimas décadas se han realizado múltiples estudios de autopercepción, que sugieren que entre el 5 al 25% de la población adulta cree que ellos o sus hijos han tenido alguna reacción alergica a los alimentos (A A), sin embargo, estas encuestas tienden a sobreestimar la verdadera prevalencia de la A A en la población.
La validación de los estudios de percepción con pruebas adicionales ha arrojado cifras de prevalencia que oscilan entre el 1.8 y el 8% de la población, y es la infantil la que reporta cifras más elevadas(8).
En los países en vías de desarrollo hay escasa información que permita establecer la verdadera importancia de la A A como un problema de salud pública.
En algunos de ellos se han iniciado estudios de percepción con los que se pretende establecer si la A A es un problema de salud(9). En una reciente publicación de autopercepción realizado por nuestro grupo en la ciudad de Cartagena (Colombia) reportamos una prevalencia del 14.9%. A pesar de ser una cifra elevada, al menos es un primer paso hacia el establecimiento de las bases epidemiológicas de la A A en nuestro país y en Latinoamerica(10). Sin embargo, estas aproximaciones son válidas como punto de partida para tener una idea global del problema.
En un reciente metaanálisis en el que se revisaron más de 50 publicaciones de diferentes países se observó una marcada heterogeneidad en las cifras de prevalencia reportadas entre los diversos estudios analizados. En las publicaciones de autopercepción de la A A, los alimentos más comúnmente implicados eran: la leche (1.2 al 17%), los huevos (0.2 al 7%), el maní, el pescado (0 al 2%) y los mariscos (0 al 10%). Sin embargo, cuando se examinaron los estudios que emplearon el Reto Oral Doble Ciego Placebo Control (DBPCFC, por sus siglas en inglés), estas cifras estimadas disminuyeron a los siguientes valores: la leche (0 al 3%), los huevos (1.7%), el maní (0.2 a 1.6%), entre otros. Como posibles explicaciones a la heterogeneidad en las cifras de prevalencia, los autores destacaron la falta de protocolos de encuestas estandarizados, la poca sensibilidad y especificidad de las pruebas cutáneas y de los test de IgE específica, las diferencias culturales y étnicas, y posiblemente diferencias genéticas entre las poblaciones estudiadas(3).
Recientemente, en 2005 la Unión Europea inició un estudio multicéntrico en el que participan 56 sociedades de 21 países (de los cuales 19 son de la Unión Europea, Ghana, China e India) y la colaboración adicional de centros y sociedades de Estados Unidos, Australia y Nueva Zelandia, denominado "Europrevall". En este estudio se utilizan protocolos comunes estandarizados (incluyendo el diagnóstico de alergia a alimentos) para obtener estimativos reales de la pre-valencia de A A, e identificar los alimentos más frecuentemente implicados. Igualmente busca estimar la incidencia en varias cohortes con niños que van desde su nacimiento hasta los 2 años y medio de edad, en centros comunitarios con niños en edad escolar y en adultos (11). En la tabla 1 se destacan algunos de los estudios epidemiológicos más importantes.
INMUNOPATOGÉNESIS DE LA ALERGIA ALIMENTICIA
Constantemente el humano se expone a proteínas provenientes de los alimentos necesarias para los procesos anabólicos y metabólicos que garanticen la homeostasis. Sin embargo, en un pequeño porcentaje de la población, algunas de estas proteínas desencadenan reacciones de hipersensibilidad que incluso pueden comprometer la vida del individuo(5). La respuesta de tipo alérgico mediada por IgE posee dos fases: la primera, conocida como de sensibilización, en la que se desarrolla la respuesta Th2 (IL-4,IL-5,IL-13), que conlleva a la síntesis y producción de IgE y a su unión al receptor de alta afinidad (FceRI) en mastocitos y basófilos; la segunda, denominada fase efectora, en la que a la siguiente exposición al alergeno se desencadena la degranulación de los mastocitos y basófilos, se liberan agentes farmacológicos como la histamina y la serotonina y se inicia la síntesis de otros como los leucotrienos y citoquinas (ver figura 3), responsables de algunos de los efectos observados en los tejidos de los individuos con enfermedades alérgicas como la A A. Estas manifestaciones abarcan una gran variedad de síntomas cutáneos (urticaria, angiodema y eczema), gastrointestinales (nauseas, vómito, dolor abdominal y diarrea), respiratorios (tos y sibilancias) y sistémicos (anafilaxis, causante de un colapso debido a la hipotensión).
Evidencias experimentales y modelos animales de la alergia alimenticia
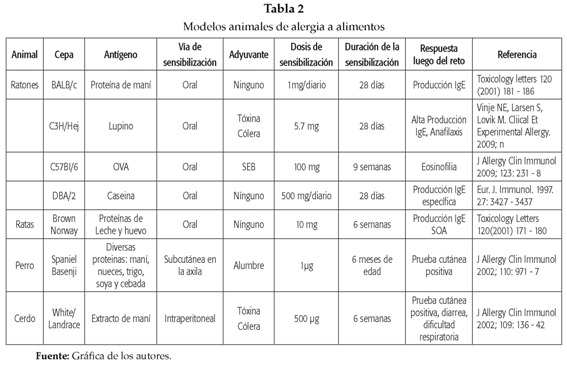
En el desarrollo de la respuesta inmune contra los antígenos de los alimentos se han propuesto varias hipótesis, cada una apoyada en evidencias experimentales, especialmente en modelos animales (ver tabla 2). Algunos sugieren que el inicio de ésta se presenta por una falla en la generación de tolerancia por parte de los linfocitos T antígeno específicos con actividad reguladora, que perderían el papel regulador sobre las células Th2; otra sería el efecto adyuvante y sobre las células dendríticas que ejercerían algunos componentes propios de la matriz alimenticia o derivados de microorganismos como la toxina B del Staphylococus aureus (SEB) (12). Adicionalmente, hay evidencia que demuestra que la tolerancia a través del tracto gastrointestinal se puede perder incluso cuando el individuo se sensibiliza por otras rutas como la piel(13).
Papel de los adyuvantes en la alergia a los alimentos
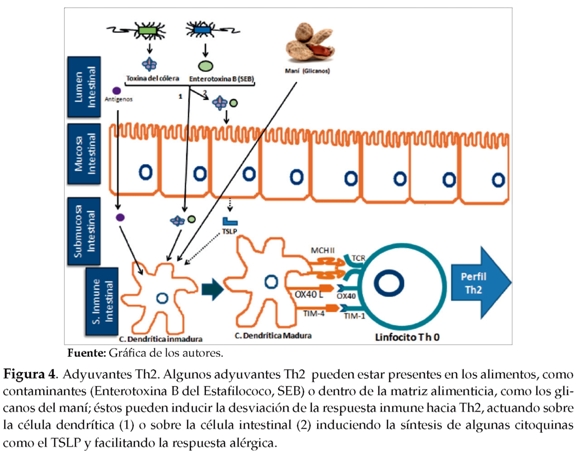
Los adyuvantes son sustancias que rompen la tolerancia oral cuando son administradas concomitantemente con antígenos alimenticios en modelos animales de A A. Su mecanismo de acción aun es desconocido, sin embargo existen evidencias que demuestran su papel estimulador sobre las células presentadoras de antígeno (CPA) y sobre las células del epitelio intestinal, las cuales al ser activadas pueden producir citoquinas como el TSLP (Linfopoyetina estromal tímica), que favorece la respuesta Th2(14). En estudios in vitro utilizando la toxina del cólera (adyuvante Th2) se observa cómo esta sustancia promueve la maduración y el aumento en la expresión de moléculas coestimuladoras en células dendríticas. Berin y cols. mostraron que esta toxina induce la síntesis de la molécula OX40 en estas células, la cual es una de las responsables de inducir la diferenciación de linfocitos hacia el perfil Th2 (15). De igual manera, Feng y cols. observaron que al tratar una cepa murina con la toxina del cólera en conjunto con extracto de maní se estimulaba la expresión de la molécula TIM-4 en células dendríticas(16). Recientemente se ha podido establecer en un modelo similar que la interacción entre TIM-1 (presente en los linfocitos T) y el TIM-4 juega un papel importante en la polarización hacia el perfil Th2 (17).
El uso de adyuvantes en modelos animales ha servido para estudiar algunos de los mecanismos moleculares de la A A. Adicionalmente, su papel como facilitador del rompimiento de tolerancia y polarización de la respuesta en los linfocitos T hacia el perfil Th2 refuerza la hipótesis de ser uno de los elementos claves en los mecanismos de sensibilización en seres humanos. Otro adyuvante importante en modelos animales es la Enterotoxina B del Staphylococcus aureus (SEB), la cual ha mostrado ser un potente regulador de la expresión de TIM-4 de las células dendríticas. El S. aureus es un microorganismo comensal que coloniza las vías aéreas y la piel de individuos susceptibles, en especial la de pacientes con dermatitis atópica, en los que más del 90% de los Staphylococus aureus aislados producen SEB, lo cual podría ser la causa por la que estos individuos son más susceptibles de desarrollar alergia a los alimentos(18).
Igualmente, es el principal responsable de la contaminación de alimentos en Estados Unidos(19). Por estas razones, la SEB con su efecto adyuvante Th2 podría jugar un papel importante en la sensibilización a alérgenos de alimentos. En la figura 4 se destacan algunos de los mecanismos más importantes que involucran a los adyuvantes como elementos importantes en la etapa de inducción de la respuesta Th2 en la A A.
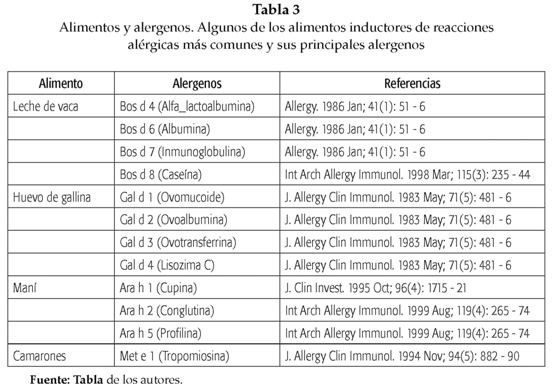
De otra parte, es interesante observar que en la mayoría de los estudios epidemiológicos de A A publicados hasta la fecha solamente un pequeño grupo de alimentos sean los implicados de la mayoría de reacciones alérgicas, y dentro de éstos, unas pocas proteínas sean las responsables directas de las reacciones (alérgenos mayores). A pesar de que la población general se encuentra expuesta a una amplia variedad de alimentos propios de cada cultura gastronómica, en la tabla 3 se destacan algunos de los alimentos alergénicos más importantes y sus principales alérgenos. Por tal motivo, es posible que el alimento tenga propiedades inherentes a su constitución que lo convierta en un potente alergeno(13). Existe evidencia de que las estructuras glicanos de algunos helmintos actúan como adyuvantes Th2; estos compuestos han sido encontrados asociados a proteínas de plantas. Shreffler y cols. observaron que el alergeno mayor del maní, Ara h 1, una proteína que contiene gli-canos en su estructura, inducía la activación de células dendríticas monociticas a través del DC-SING (Dendritic cell specific ICAM-grabbing nonintegrin (DC-SIGN)(CD209). Se ha demostrado que este tipo de célula dentrífica promueve la desviación de la respuesta inmune hacia un perfil Th2(17). Ver figura 4.
La mucosa intestinal en la alergia alimenticia
Las proteínas de los alimentos sufren una serie de clivajes por la acción de proteasas presentes en las secreciones intestinales, lo cual reduce a péptidos menos complejos la mayoría de las proteínas de los alimentos; esto facilita el paso de estos nutrientes al torrente circulatorio. En modelos animales se ha demostrado que una reducción de la actividad de estas proteasas o la manipulación de las barreras epiteliales de la mucosa intestinal trae como consecuencia la pérdida de la tolerancia oral(12). De otra parte, Ventura y cols. demostraron que los individuos con alergia a los alimentos tenían un incremento significativo en la permeabilidad intestinal, lo que sugiere que esta alteración podría ser importante para la sensibilización a las proteínas alimentarias(20).Además de las funciones protectoras realizadas, las uniones delgadas entre las células epiteliales y las proteasas, existen otros componentes importantes que contribuyen a un adecuado funcionamiento del sistema gastrointestinal, como son: El pH gástrico, la IgA, la flora intestinal normal y el estado psicológico, entre otros.
El pH gástrico
La disminución del pH del estómago mediante fármacos es el tratamiento más común para las enfermedades acido-pépticas. Scholl y cols. observaron que la administración de ranitidina y omeprazol, antiácidos ampliamente conocidos, aumentaban la sensibilización a algunos alergenos de alimentos en modelos animales y en algunos paciente s tratados con estos me dicamentos; esto refuerza la hipótesis de que un procesamiento digestivo normal es importante para la prevención de la sensibilización a alergenos de alimentos(21).
El estrés psicológico
El estrés es otro de los factores que alteran las funciones de la barrera epitelial. En un modelo con ratas, las cuales fueron sometidas a condiciones estresantes, como quitarles el agua o a condiciones adversas de temperatura, se observó cómo la función intestinal decrecía y aumentaba la permeabilidad a macromoléculas enteras a través de los en-terocitos(22). Adicionalmente, Yang y cols. mostraron que al alimentar ratas estresadas con antígenos alimentarios tenían un mayor riesgo a sensibilizarse, y se observaron un aumento significativo de IL-4 y una disminución en la expresión de Interferón- en la mucosa del intestino(23).
Papel de la flora gastrointestinal
La flora gastrointestinal juega un papel muy importante en la integridad de la mucosa. En un modelo murino en el que se colonizó el tracto gastrointestinal de los animales con Candida albicans, para lograr un sobrecrecimiento de la levadura y OVA, se observó un aumento en los niveles de IgE específicos para el antígeno, además de un aumento en la permeabilidad a OVA en comparación con los controles(24).
Papel de la sIgA (IgA secretora)
La sIgA es importante en los mecanismos inmunitarios de las mucosas, su presencia es clave para la homeostasis intestinal. Este anticuerpo es el encargado de regular la población de microorganismos de la flora intestinal(25). Eigenmann y cols. observaron que la secreción de IgA en la mucosa intestinal decrecía en un modelo murino de A A mientras que en los ratones tolerantes los niveles de esta inmunoglobulina aumentaban; adicionalmente observaron un incremento en los niveles de IL-10 y TGF-β, citoquinas que aumentan la secreción de IgA(26).
Papel de algunas citoquinas
Algunas citoquinas, especialmente las relacionadas con la respuesta Th2, han sido implicadas en la patogénesis de A A.
Hogan y colaboradores han mostrado el papel que tiene la IL-9 en la homeostasis de la mucosa intestinal. Observaron que ratones deficientes de esta citoquina no desarrollaban reacciones anafilácticas cuando eran retados con el antígeno en un modelo experimental de anafilaxis intestinal. Por el contrario, las cepas de ratones que sobreexpresaban esta citoquina fueron susceptibles a sensibilización oral con OVA en ausencia de cualquier adyuvante exógeno. Adicionalmente se producía un fenotipo de anafilaxis intestinal caracterizado por mastocitosis, aumento en la permeabilidad y filtrado vascular(27).
Exposición cutánea a alergenos de alimentos en la alergia alimenticia
La piel puede ser una de las vías principales de sensibilización a alergenos de alimentos. Algunos modelos animales han mostrado que la exposición primaria de antígenos de alimentos en pequeñas heridas inducidas por abrasión conlleva al desarrollo síntomas como anafilaxis luego del reto. Strid y cols. observaron que la exposición epicutánea de extracto proteico de maní en ratones induce una potente respuesta de tipo Th2. Adicionalmente, la tolerancia oral al maní se pierde cuando se expone nuevamente al antígeno por vía cutánea en un ratón previamente expuesto por vía oral (28).
FACTORES DE RIESGO EN EL DESARROLLO DE LA ALERGIA A LOS ALIMENTOS
A pesar de los avances en el conocimiento de la inmunopatogénesis de la A A, aún se desconocen muchos de los factores responsables del inicio de esta enfermedad. Es probable que la alergia a los alimentos, al igual que el resto de las enfermedades alérgicas, resulte de la interacción entre los alergenos (alimentos) e individuos susceptibles genéticamente. Además, en esta interacción pueden influir otros factores como los ambientales, entre los que se destacan los propios de la matriz alimenticia, contaminantes ambientales, que al estar presentes en algunos alimentos puedan influir en la respuesta alérgica, y otros factores como algunas vitaminas y ácidos grasos presentes en los alimentos. A continuación describiremos algunas de estos factores de riesgo asociados a A A.
Factores genéticos
Es probable que existan factores genéticos involucrados en la patogénesis de la alergia a los alimentos, muchos de los cuales pueden sobreponerse con los implicados en la atopia, lo que hace más complejo establecer cuál o cuáles son los genes directamente responsables en la A A. Sicherer y cols., en un estudio realizado en gemelos, en el que al menos un miembro padecía alergia al maní, establecieron un porcentaje de heredabilidad del 81,6%(29). De igual manera, en algunos estudios que utilizan modelos animales se ha demostradola importancia de la constitución genética como factor predisponente para desarrollar A A. Xiu-Min y cols. compararon en 2 cepas de ratones (C3H/HeJ y BALB/c) la respuesta de IgE y los síntomas de A A presentados luego de sensibilizar y retar a los animales con alérgenos de alimentos como el maní o la leche de vaca en condiciones idénticas; como adyuvante los autores utilizaron la toxina del cólera. Luego del reto observaron que la cepa C3H/HeJ exhibía altos niveles de IgE especifica a maní y síntomas de anafilaxia, mientras que en la cepa BALB/c no se detectó reacciones de hipersensibilidad, sin embargo, se observó una significativa producción de IgE específica en esta cepa.
De otra parte, estudios que utilizan marcadores en genes polimórficos han reportado diversas asociaciones entre algunos marcadores y la A A. Entre los genes más estudiados se encuentran los del sistema HLA, los de algunas citoquinas y otros relacionados con moléculas del la inmunidad innata.
Papel del HLA
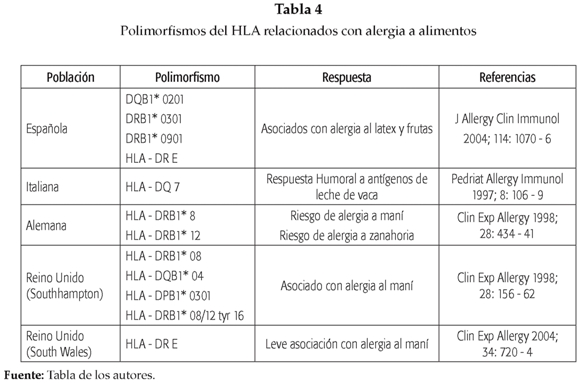
Algunos polimorfismos en las moléculas del complejo mayor de histocompatibilidad han sido asociados con la sensibilización a alérgenos de alimentos. Las moléculas del MHC son una interfase mediante la cual péptidos exógenos (por ejemplo, de alérgenos de alimentos) son presentados al sistema inmune adaptativo. Estas moléculas se caracterizan por ser muy polimórficas y las variaciones suelen presentarse en la región de la molécula que participa en la unión del péptido (surco). Se ha observado que existen homologías en las regiones de unión que son compartidas por muchos alelos del HLA y han sido clasificadas por Ou y cols. en distintos grupos funcionales(30). Algunos de estos grupos han sido asociados con el desarrollo de muchas patologías del sistema inmunológico, como la artritis y la tiroiditis de Hashimoto, entre otras(31, 32). También se han asociado algunos alelos con la susceptibilidad o la protección a padecer enfermedades alérgi-cas(33, 34). Carlos Blanco y cols. encontraron que el grupo funcional E del HLA-DR y los polimorfismos DQB1*0201, DRB1*0301 y *0901 estaban asociados con alergia al látex y frutas (Síndrome látex-frutas), el cual se presenta por reactividad cruzada entre algunas frutas como el banano, el kiwi, la piña y el látex (35). De otra parte, Barbara Camponeschi y cols. reportaron en población italiana una asociación entre el alelo HLA DQ7 y la respuesta humoral a los antígenos de la leche vaca(36). Otro estudio, realizado en población alemana, encontró que los alelos HLA-DRB1*8 y HLA-DRB1*12 están asociados con un alto riesgo en desarrollar alergia a maní y zanahoria respectivamente(37). Igualmente, en población del Reino Unido se realizaron 2 estudios. De un lado, Howell y cols. hallaron asociación entre alergia al maní y cuatro alelos del HLA clase II: HLA-DRB1*08, HLA-DRB1*08/12 tyr 16, DQB1*04 y DPB1*0301(38), mientras que Jones y cols. reportaron una débil asociación entre la alergia al maní y los alelos HLA-B*07 y HLA-DRB1*11, la cual desaparecía al hacerse las correcciones por el número de alelos, por lo que los autores sugieren que estos alelos podría influir en la susceptibilidad a desarrollar alergia al maní (39). En la Tabla 4 se resumen algunos de los estudios más importantes.
Polimorfismos de los genes de la citoquinas
Las citoquinas son un grupo heterogéneo de moléculas producidas por las células en respuesta a estímulos. Ellas actúan de manera paracrina y autocrina sobre receptores específicos presentes en la membrana de las células. Un buen número de ellas participa tanto en la respuesta inmune innata como en la adaptativa. Algunas variaciones en los genes que codifican para las citoquinas podrían influir en su expresión y desencadenar condiciones patológicas como algunas enfermedades inflamatorias y alérgicas. Mediante el uso de diversas estrategias se han podido identificar en los distintos genes de las citoquinas algunos polimorfismos asociados a enfermedades(40). La IL-13 es quizás una de las citoquinas más estudiadas en la patogénesis de las alergias; esta citoquina es producida principalmente por células Th2, aunque también es expresada en otras células importantes en el desarrollo de la enfermedad, como los eosinófilos, mastoci-tos y basófilos. Su función es estimular a las células B para que sinteticen IgE(40). En un estudio realizado en población norteamericana, Cameron y cols. examinaron un polimorfismo en el gen de la IL-13 (-1112 C > T), asociado con asma, atopia, dermatitis atópica y alergia a alimentos; en este estudio, los autores encontraron que individuos homocigóticos para este SNP producían niveles significativamente más altos de IL 13, lo que podría conllevar al desarrollo de alergia (Perfil Th2) (p = 0.015)(41).
En otro estudio realizado por investigadores del Reino Unido y Arabia Saudita encontraron un polimorfismo en la región 3` UTR el factor de transcripción STAT6 (STAT6 G) asociado con susceptibidad y severidad en la alergia al maní. El STAT6 es esencial en la vía de señalización de la IL-13 e IL-4 (citoquinas Th2). La frecuencia del alelo STAT6 G fue significativamente más alta en pacientes con alergia a maní, comparada con los controles (P<0.0001, OR=2.9 95% IC: 1.7 - 4.9)(42).
Genes de la Respuesta Inmune Innata
Se ha observado también que algunos genes cuyos productos participan en la respuesta inmune innata están asociados al desarrollo de alergia a alimentos.
Los componentes de la inmunidad innata juegan un papel primordial en la sensibilización a los alergenos, al condicionar la respuesta inmune adaptativa y desviarla hacia un perfil Thl o Th2. Este último es el responsable principal de las manifestaciones alérgicas. Jessica Woo y colaboradores encontraron asociación entre el polimorfismo -159 CàT del CD14 y alergia a los alimentos. El CD14 es el receptor para el LPS, componente principal de la pared de bacterias que juega un papel determinante en la activación de las células presentadoras de antígeno, incluyendo macrófagos y células dendríticas, para la posterior secreción de citoquinas y mediadores de la inflamación. Esta molécula puede regular el balance Th1/ Th2 y aumentar la secreción de IL-12, la que induce la producción de INF-y, la cual antagoniza la producción de IgE(43).
Papel de la filagrina
Como se mencionó anteriormente, las barreras epiteliales son un medio mecánico de protección frente a factores medioambientales. Un estudio reciente encontró que los pacientes con una mutación en el gen de la filagrina tenían mayor riesgo de sufrir eczema, el cual es un factor de riesgo para padecer alergia a los alimentos. Esta mutación en el gen de la filagrina causa un defecto ya conocido en mecanismo protector de las barreras epiteliales, lo que facilitaría la penetración de los alergenos a través de una barrera epitelial defectuosa, y permitiría una sensibilización temprana a alergenos de alimentos y a una desviación en general hacia la atopia(44-46).
Factores nutricionales
Los hábitos alimenticios han experimentado muchos cambios en la mayoría de las poblaciones durante las últimas décadas, debido fundamentalmente a la globalización de la economía, al aumento de la población y a los cambios en el modo de vida de las sociedades industrializadas. Algunos ejemplos de estos cambios son el alto consumo de comidas procesadas (enlatados), la disminución en el consumo de productos frescos (frutas, verduras y pescados) y un mayor consumo de margarinas y aceites vegetales. A raíz de esto existe una tendencia por parte de algunos investigadores a establecer relaciones entre la dieta y el desarrollo de alergias; básicamente existen 2 teorías relacionadas que merecen discusión: la primera de ellas es la hipótesis del cambio en el consumo de ácidos grasos y la segunda es la hipótesis de la vitamina D(1).
Hipótesis en el cambio del consumo de Ácidos Grasos
En las últimas décadas, los patrones de consumo de los ácidos grasos en la mayoría de las poblaciones han cambiado, se ha observado una reducción en la ingesta de grasas de origen animal y un aumento en el consumo de grasas de origen vegetal.
Este cambio en la dieta ha traído consigo un aumento en la ingesta de ácidos grasos ω- 6 poliinssaturados (ej: acido linoleico, presente en grasas de origen vegetal) y un reducido consumo de ácidos grasos ω- 3 poliinssaturados (ej: acido eicosapentanóico, presente en altas concentraciones en algunos peces).
Este fenómeno ha sido motivo de investigación, y posiblemente se encuentre asociado con un incremento en las enfermedades alérgicas(47).
Esta hipótesis plantea que los ácidos grasos ω- 6 poliinssaturados favorecen la producción de prostaglandina E2 (PGE2), mientras que los ácidos grasos ω- 3 poliinssaturados inhiben la producción de PGE2. Se ha observado que esta prostaglandina reduce la producción de INF-y por los linfocitos T, lo que trae como consecuencia un incremento en la producción de IgE por parte de los linfocitos B. Recientemente, Kull y col. mostraron que el consumo regular de pescado (fuente natural de ácidos grados co-3 poliinsaturados) antes del primer año de edad parece estar asociado con una disminución en el riesgo de padecer enfermedades alérgicas y también a sensibilizarse con alergenos de alimentos durante los primeros 4 años de vida(48).
De otra parte, Dunstan y cols., en un estudio realizado en mujeres embarazadas atópicas, buscaron determinar si una dieta rica en aceite de pescado (aprox 3.7g de ácidos grasos cc - 3 poliinsaturados) durante su gestación podría modificar la respuesta inmune en los infantes. Notaron que los infantes en el grupo de las madres que recibieron el aceite de pescado eran 3 veces menos propensos a tener pruebas cutáneas positivas al huevo a la edad de 1 año (odds ratio, 0.34; al 95% de confianza; P=0.055)(49).
Hipótesis de la vitamina D
Aunque es controversial, algunos investigadores tienen evidencias del papel de la vitamina D como factor de riesgo epidemiológico en las enfermedades alérgicas. Un estudio realizado por Wjst y cols., en individuos residentes en granjas ubicadas en la región de Bavaria (Alemania), sugirió que la introducción de la vitamina D como suplemento nutricional para prevenir el raquitismo fue la responsable del incremento sorpresivo en la prevalencia de las enfermedades alérgicas en los niños(50).
De otra parte, Milner y cols. estudiaron una cohorte de niños de EE.UU. (la mayoría de ellos eran afroamericanos de bajos recursos) y encontraron que el consumo temprano de vitamina D fue asociado con un mayor riesgo para A A (OR: 1.63; 95% CI: 1.21-2.20)(51).
Contrariamente, otros investigadores le atribuyen a la vitamina D un factor protector frente a las alergias. Argumentan que una inadecuada biosíntesis o consumo de vitamina D es el factor responsable del incremento de las enfermedades alérgicas.
La luz solar participa en la biosíntesis de la vitamina D; por tanto, el nuevo estilo de vida de las sociedades industrializadas, caracterizado por la permanencia en ambientes cerrados durante la mayor parte del tiempo, se asocia a deficiencias en la concentración de vitamina D, y posiblemente sea uno de los causantes del aumento en la prevalencia de la A A. Igualmente existen estudios que evidencian un aumento del asma y enfermedades alérgicas a medida que las regiones se alejan del ecuador. Camargo y cols. observaron que las prescripciones del medicamento EpinPen (usado para controlar los síntomas de anafilaxis) eran mayores en los estados del norte de EE.UU. (alejados del ecuador)(52).
Los estudios in vitro que tratan de probar el papel de la Vitamina D en la patogénesis de la A A resultan controversiales. Imazeki I y cols. demostraron que la vitamina D inhibe la proliferación in vitro de las células Th1 y la producción de citoquinas como la IL-2 y el INF-γ, lo que facilitaría la desviación de la respuesta inmune hacia el perfil Th2(53). Sin embargo, hay reportes en la literatura que muestran que la vitamina D promueve el desarrollo de células T reguladoras tanto in vivo como in vitro, lo que podría regular la respuesta alérgica (54).
Exposición temprana a los alergenos de alimentos
La alergia a los alimentos es una enfermedad que se presenta más frecuentemente en niños menores de 5 años de edad. En la actualidad aún se debate si es conveniente o no una exposición temprana a alimentos potencialmente alergénicos (huevo, leche etc.), que permitan la inducción de tolerancia a estos antígenos. Hasta hace poco la Academia Americana de Pediatría (AAP) y su par del Reino Unido recomendaban que las familias con un historial hereditario de atopia evitaran consumir maní antes de los primeros 3 años de vida y otros alimentos comúnmente implicados en reacciones alérgicas, como la leche de vaca antes del primer año, los huevos antes del segundo año y los pescados y nueces antes del 3 año de vida. Además que las madres embarazadas evitaran consumir maní durante el periodo de gestación y lactancia(1).
Recientemente, la APP ha cambiado de posición en sus recomendaciones y ha afirmado que no existe evidencia que pruebe que la introducción tardía de estos alimentos disminuya el riesgo de sensibilización.
Es más, estudios recientes demuestran todo lo contrario, que suprimir los alimentos durante el periodo de gestación y lactancia falla en reducir los niveles de IgE. Varios estudios ecológicos muestran que los países que introducen el maní en su dieta en las etapas más tempranas de la vida tienen menor prevalencia de alergia al maní. Lack y cols. observaron que la prevalencia de alergia al maní en dos comunidades judías, una de ellas en Reino Unido y la otra en Israel, eran muy diferentes. Mientras que en el primero las cifras fueron del 1.85%, en el segundo fue de sólo el 0.17%. El maní es introducido en etapas tempranas y es consumido más frecuentemente en Israel que en el Reino Unido; adicionalmente, el promedio mensual en el consumo de maní en niños de 8 a 14 años de Israel es de 7.1 g de proteína de maní, mientras que en el Reino Unido es de 0 g (P < 0.001). Los autores resaltan en su estudio que las discrepancias entre las dos prevalencias no se debían a la clase social, ni a diferencias en el fondo genético. Estos datos cuestionan seriamente aquellos que afirman que la introducción temprana del maní es un factor de riesgo para desarrollar la enfermedad(55).
Los microorganismos en el desarrollo de alergia a alimentos
Algunos estudios epidemiológicos demuestran que la exposición constante a algunos microorganismos en el periodo neonatal y posnatal ofrece protección frente al desarrollo de enfermedades alérgicas(56). Sin embargo, en alergia a alimentos hay pocos estudios sobre el papel que desempeñan los microorganismos como factor de riesgo epidemiológico.
El nacimiento por cesárea ha sido asociado en algunos estudios como un factor de riesgo para desarrollar A A. Eggesbo y cols. investigaron este factor en una cohorte en la que participaron 2803 niños de Noruega, a quienes les realizaron encuestas de au-topercepción. Se observó que los niños de madres alérgicas que nacieron por cesárea tenían un riesgo 7 veces mayor de padecer reacciones alérgicas al huevo, al pescado y a las nueces (odds radio 7; CI 1.8-28; P=0.05). Koplin y cols. realizaron un metaanálisis en el que analizaron la asociación entre el nacimiento por cesárea y un aumento en la A A. En esta revisión se encontró que los niños nacidos por cesárea tenían un mayor riesgo de sensibilizarse a alérgenos de alimentos comparado con los niños que nacieron por parto normal; además, uno de los estudios analizados mostró que los niños nacidos por cesárea tenían una mayor ocurrencia de síntomas característicos de la A A (57).
Se ha observado que la colonización de la flora intestinal es diferente en ambos casos; los niños nacidos por parto natural están expuestos en mayor medida a la flora microbiana de la madre. Grólund y cols. encontraron que los niños nacidos por parto normal alcanzaban una colonización intestinal más rápida y mayor número de bacterias intestinales del grupo Bacteroides fragilis, mientras que los niños nacidos por cesárea tenían menor grado de colonización bacteriana. A los 6 meses de edad, el promedio de colonización bacteriana en ambos grupos fue de 76% para los nacidos por parto normal y 36% por cesárea (P=0.009). Por tal motivo, una temprana colonización de la flora intestinal en el niño puede protegerlo contra el desarrollo de A A (58), posiblemente por un incremento en el número de LT reguladores(59).
Otro de los microorganismos al que se la ha implicado en la A A es el Helicobacter pylori (Hp); su papel como factor de riesgo aún es controversial. Algunos autores le atribuyen un papel protector(60, 61), mientras que otros lo han identificado como un factor de riesgo, debido a que produce un aumento de la permeabilidad gástrica, lo que facilitaría la sensibilización a las proteínas alimentarias(62).
Papel de los contaminantes ambientales
Una de las industrias con mayor crecimiento e innovación de productos es la química. Desde que comenzó el desarrollo de esta industria se calcula que se han producido y diseminado en el medio ambiente aproximadamente 100 000 nuevas sustancias químicas. Además, cada año esta cifra se va incrementando en 1 000 nuevas sustancias(63). Algunos estudios relacionan el aumento de la contaminación ambiental con el desarrollo de alergias. Sin embargo, hay pocos estudios que relacionen la contaminación ambiental con el desarrollo de A A.
Uno de los contaminantes ambientales más comunes es el mercurio; este compuesto es empleando en minería y varios procesos industriales como la producción de hidróxido de sodio. También este compuesto hace parte de amalgamas que se utilizan en el tratamiento de las caries dentales. Watzl y cols. observaron en un modelo animal que la exposición a mercurio concomitantemente con OVA aumentaba la IgE específica al antí-geno; además observaron algunos daños en las células epiteliales intestinales de las ratas expuestas, lo cual lleva a un incremento de la permeabilidad intestinal. Como se discutió anteriormente, este aumento en la permeabilidad podría ser la causa de la sensibilización al OVA en las ratas expuestas(64). Estos hallazgos ponen en evidencia el mercurio como un posible factor de riesgo epidemiológico de A A; sin embargo, no conocemos de estudios en humanos expuestos al mercurio en los que se demuestre un aumento en la prevalencia de alergia a los alimentos.
Otra fuente importante de contaminantes ambientales es el humo del cigarrillo. El consumo de cigarrillos se ha incrementado en los últimos años; incluso algunos estudios gubernamentales afirman que las personas se inician en el tabaquismo cada vez a más temprana edad. En el humo del cigarrillo hay más de 4000 contaminantes químicos provenientes del procesamiento del tabaco. Kuligy cols. investigaron si la exposición al humo del tabaco durante el embarazo y la etapa posnatal tenía algún efecto en la sensibilización a alergenos alimentarios durante los primeros 3 años de vida.
En este estudio, los investigadores tomaron 342niños, a los cuales se les realizaron pruebas de IgE durante los 3 años de seguimiento. Observaron que los niños de madres expuestas al humo del cigarrillo en el periodo post y prenatal tenían mayor riesgo de sensibilizarse a alergenos de alimentos (odds ratio: 2.3, 95% C.I.: 1.1±4.6); adicionalmente, los niños con madres que sólo estaban expuestas en el periodo postnatal tenían 2.2. veces mayor riesgo de de sufrir A A (65). Igualmente, Lannero y cols. realizaron un estudio similar en una cohorte de 4089 niños, de los cuales 2614 fueron analizados midiéndoles los niveles de IgE a alergenos inhalados y alergenos de alimentos. Estos autores no encontraron asociación entre fumar en el periodo prenatal y A A, sin embargo, hallaron asociación en el periodo posnatal (OR 1.46 (95% CI 1.11 to 1.93). Los resultados de este último estudio son más contundentes debido al gran número de individuos estudiados en la cohorte(66).
CONCLUSIONES
Es muy difícil separar los factores que influyen en la A A y los de las demás enfermedades atópicas, debido posiblemente a que éstas comparten factores de riesgo. A pesar de la falta de claridad en las cifras epidemiológicas, cada día se conocen más estudios que tratan de definir el problema de la A A como un problema de salud pública, especialmente en los países desarrollados. En los países en vías de desarrollo se han realizado pocos estudios epidemiológicos, y los escasos realizados sólo han utilizado la metodología del cuestionario, lo que hace imposible concluir que la A A sea un problema de salud pública.
En relación con la inmunopatogenesis de la A A, los modelos animales han ayudado a entender de una manera racional algunos de los mecanismos celulares y moleculares involucrados en la génesis y progresión de esta enfermedad.
Al menos con los estudios recientes quedan dudas sobre el papel de algunas dietas restrictivas a las madres durante la gestación y a los niños en los primeros meses de vida como un factor que influya en un aumento en la susceptibilidad a la A A en la infancia. A pesar de no haber muchos estudios, queda claro que la A A tiene un componente genético que influye en la capacidad de los individuos a responder con IgE a algunos antígenos alimenticios. De otra parte, hay cada día más evidencia del papel activo que juega la mucosa del tracto gastrointestinal con todos sus elementos en la tolerancia a los antígenos alimenticios y en el desarrollo de la A A.
A pesar de lo controversial y de no haber muchos estudios que demuestran el papel de la contaminación ambiental de algunos nutrientes de la dieta y de la matriz alimenticia en el desarrollo de la A A, se puede concluir que muchos de estos factores influirían tanto en el aumento en el riesgo de desarrollar A A como en el de las atopias en general.
Agradecimientos
A la Universidad de Cartagena por su apoyo y a los profesores del Instituto de Investigaciones Inmunológicas de la Universidad de Cartagena por la lectura crítica de este manuscrito, el cual fue el seminario I del estudiante J.R.A.
Conflicto de interés: Ninguno.
Financiación: Instituto de Investigaciones Inmunológicas de la Universidad de Cartagena.
REFERENCIAS
1. Lack G. Epidemiologic risks for food allergy. J Allergy Clin Immunol 2008 Jun;121(6):1331-6. [ Links ]
2. Lack G. Clinical practice. Food allergy. N Engl J Med 2008 Sep 18;359(12):1252-60. [ Links ]
3. Rona RJ, Keil T, Summers C, Gislason D, Zuid-meer L, Sodergren E, et al. The prevalence of food allergy: A meta-analysis. J Allergy Clin Immunol 2007 Jul 10. [ Links ]
4. Matasar MJ, Neugut AI. Epidemiology of anaphylaxis in the United States. Curr Allergy Asthma Rep 2003 Jan;3(1):30-5. [ Links ]
5. Atkins D, Bock SA. Fatal anaphylaxis to foods: epidemiology, recognition, and prevention. Curr Allergy Asthma Rep 2009 May;9(3):179-85. [ Links ]
6. Tang ML, Osborne N, Allen K. Epidemiology of anaphylaxis. Curr Opin Allergy Clin Immunol 2009 Aug;9(4):351-6. [ Links ]
7. Isolauri E, Huurre A, Salminen S, Impivaara O. The allergy epidemic extends beyond the past few decades. Clin Exp Allergy 2004 Jul;34(7):1007-10. [ Links ]
8. Sampson HA. Food allergyaccurately identifying clinical reactivity. Allergy 2005;60 Suppl 79:19-24. [ Links ]
9. Lunet N, Falcao H, Sousa M, Bay N, Barros H. Self-reported food and drug allergy in Maputo, Mozambique. Public Health 2005 Jul;119(7):587-9. [ Links ]
10. Marrugo J, Hernandez L, Villalba V. Prevalence of self-reported food allergy in Cartagena (Colombia) population. Allergol Immunopathol (Madr) 2008 Nov-Dec;36(6):320-4. [ Links ]
11. Mills EN, Mackie AR, Burney P, Beyer K, Frewer L, Madsen C, et al. The prevalence, cost and basis of food allergy across Europe. Allergy 2007 Jul;62(7):717-22. [ Links ]
12. Chehade M, Mayer L. Oral tolerance and its relation to food hypersensitivities. J Allergy Clin Immunol 2005 Jan;115(1):3-12; quiz 3. [ Links ]
13. Berin MC, Mayer L. Immunophysiology of experimental food allergy. Mucosal Immunol 2009 Jan;2(1):24-32. [ Links ]
14. Taylor BC, Zaph C, Troy AE, Du Y, Guild KJ, Comeau MR, et al. TSLP regulates intestinal immunity and inflammation in mouse models of helminth infection and colitis. J Exp Med 2009 Mar 16;206(3):655-67. [ Links ]
15. Blazquez AB, Berin MC. Gastrointestinal dendritic cells promote Th2 skewing via OX40L. J Immunol 2008 Apr 1;180(7):4441-50. [ Links ]
16. Feng BS, Chen X, He SH, Zheng PY, Foster J, Xing Z, et al. Disruption of T-cell immunoglobulin and mucin domain molecule (TIM)-1/TIM4 interaction as a therapeutic strategy in a dendritic cell-induced peanut allergy model. J Allergy Clin Immunol 2008 Jul;122(1):55-61, e1-7. [ Links ]
17. Shreffler WG, Castro RR, Kucuk ZY, Charlop-Powers Z, Grishina G, Yoo S, et al. The major glycoprotein allergen from Arachis hypogaea, Ara h 1, is a ligand of dendritic cell-specific ICAM - grabbing nonintegrin and acts as a Th2 adjuvant in vitro. J Immunol 2006 Sep 15;177(6):3677-85. [ Links ]
18. Ganeshan K, Neilsen CV, Hadsaitong A, Schleimer RP, Luo X, Bryce PJ. Impairing oral tolerance promotes allergy and anaphylaxis: a new murine food allergy model. J Allergy Clin Immunol 2009 Jan;123(1):231-8 e4. [ Links ]
19. Dinges MM, Orwin PM, Schlievert PM. Exotoxins of Staphylococcus aureus. Clin Microbiol Rev 2000 Jan;13(1):16-34, table of contents. [ Links ]
20. Ventura MT, Polimeno L, Amoruso AC, Gatti F, Annoscia E, Marinaro M, et al. Intestinal permeability in patients with adverse reactions to food. Dig Liver Dis 2006 Oct;38(10):732-6. [ Links ]
21. Scholl I, Untersmayr E, Bakos N, RothWalter F, Gleiss A, Boltz-Nitulescu G, et al. Antiulcer drugs promote oral sensitization and hypersensitivity to hazelnut allergens in BALB/c mice and humans. Am J Clin Nutr 2005 Jan;81(1):154-60. [ Links ]
22. Saunders PR, Kosecka U, McKay DM, Perdue MH. Acute stressors stimulate ion secretion and increase epithelial permeability in rat intestine. Am J Physiol 1994 Nov;267(5 Pt 1):G794-9. [ Links ]
23. Yang PC, Jury J, Soderholm JD, Sherman PM, McKay DM, Perdue MH. Chronic psychological stress in rats induces intestinal sensitization to luminal antigens. Am J Pathol 2006 Jan;168(1):104-14; quiz 363. [ Links ]
24. Yamaguchi N, Sugita R, Miki A, Takemura N, Kawabata J, Watanabe J, et al. Gastrointestinal Candida colonisation promotes sensitisation against food antigens by affecting the mucosal barrier in mice. Gut 2006 Jul;55(7):954-60. [ Links ]
25. Peterson DA, McNulty NP, Guruge JL, Gordon JI. IgA response to symbiotic bacteria as a mediator of gut homeostasis. Cell Host Microbe 2007 Nov 15;2(5):328-39. [ Links ]
26. Frossard CP, Hauser C, Eigenmann PA. Antigen-specific secretory IgA antibodies in the gut are decreased in a mouse model of food allergy. J Allergy Clin Immunol 2004 Aug;114(2):377-82. [ Links ]
27. Forbes EE, Groschwitz K, Abonia JP, Brandt EB, Cohen E, Blanchard C, et al. IL-9- and mast cell-mediated intestinal permeability predisposes to oral antigen hypersensitivity. J Exp Med 2008 Apr 14;205(4):897-913. [ Links ]
28. Strid J, Hourihane J, Kimber I, Callard R, Strobel S. Epicutaneous exposure to peanut protein prevents oral tolerance and enhances allergic sensitization. Clin Exp Allergy 2005 Jun;35(6):757-66. [ Links ]
29. Sicherer SH, Furlong TJ, Maes HH, Desnick RJ, Sampson HA, Gelb BD. Genetics of peanut allergy: a twin study. J Allergy Clin Immunol 2000 Jul;106(1 Pt 1):53-6. [ Links ]
30. Ou D, Mitchell LA, Tingle AJ. A new categorization of HLA DR alleles on a functional basis. Hum Immunol 1998 Oct;59(10):665-76. [ Links ]
31. Lard LR, Boers M, Verhoeven A, Vos K, Visser H, Hazes JM, et al. Early and aggressive treatment of rheumatoid arthritis patients affects the association of HLA class II antigens with progression of joint damage. Arthritis Rheum 2002 Apr;46(4):899-905. [ Links ]
32. Kokaraki G, Daniilidis M, Yiangou M, Arsena-kis M, Karyotis N, Tsilipakou M, et al. Major histocompatibility complex class II (DRB1*, DQA1*, and DQB1*) and DRB1*04 subtypes' associations of Hashimoto's thyroiditis in a Greek population. Tissue Antigens 2009 Mar;73(3):199-205. [ Links ]
33. Torres-Galvan MJ, Quiralte J, Blanco C, Castillo R, Carrillo T, Perez-Aciego P, et al. Pocket 4 in the HLA-DRB1 antigen-binding groove: an association with atopy. Allergy 2000 Apr; 55(4):398-401. [ Links ]
34. Caraballo L, Marrugo J, Jimenez S, Angelini G, Ferrara GB. Frequency of DPB1*0401 is significantly decreased in patients with allergic asthma in a mulatto population. Hum Immunol 1991 Nov;32(3):157-61. [ Links ]
35. Blanco C, Sanchez-Garcia F, Torres-Galvan MJ, Dumpierrez AG, Almeida L, Figueroa J, et al. Genetic basis of the latex-fruit syndrome: association with HLA class II alleles in a Spanish population. J Allergy Clin Immunol 2004 Nov;114(5):1070-6. [ Links ]
36. Camponeschi B, Lucarelli S, Frediani T, Barbato M, Quintieri F. Association of HLA-DQ7 antigen with cow milk protein allergy in Italian children. Pediatr Allergy Immunol 1997 May; 8(2):106-9. [ Links ]
37. Boehncke WH, Loeliger C, Kuehnl P, Kal-bacher H, Bohm BO, Gall H. Identification of HLA-DR and -DQ alleles conferring susceptibility to pollen allergy and pollen associated food allergy Clin Exp Allergy. 1998 Apr;28(4):434-41. [ Links ]
38. Howell WM, Turner SJ, Hourihane JO, Dean TP, Warner JO. HLA class II DRB1, DQB1 and DPB1 genotypic associations with peanut allergy: evidence from a family-based and case-control study. Clin Exp Allergy 1998 Feb;28(2):156-62. [ Links ]
39. Hand S, Darke C, Thompson J, Stingl C, Rolf S, Jones KP, et al. Human leucocyte antigen polymorphisms in nut-allergic patients in South Wales. Clin Exp Allergy 2004 May;34(5):720-4. [ Links ]
40. Smith AJ, Humphries SE. Cytokine and cytokine receptor gene polymorphisms and their functionality. Cytokine Growth Factor Rev 2009 Feb;20(1):43-59. [ Links ]
41. Hoffjan S, Nicolae D, Ober C. Association studies for asthma and atopic diseases: a comprehensive review of the literature. Respir Res 2003;4:14. [ Links ]
42. Amoli MM, Hand S, Hajeer AH, Jones KP, Rolf S, Sting C, et al. Polymorphism in the STAT6 gene encodes risk for nut allergy. Genes Immun. 2002 Jun;3(4):220-4. [ Links ]
43. Woo JG, Assa'ad A, Heizer AB, Bernstein JA, Hershey GK. The -159 C-->T polymorphism of CD14 is associated with nonatopic asthma and food allergy. J Allergy Clin Immunol 2003 Aug;112(2):438-44. [ Links ]
44. Marenholz I, Kerscher T, Bauerfeind A, Esparza-Gordillo J, Nickel R, Keil T, et al. An interaction between filaggrin mutations and early food sensitization improves the prediction of childhood asthma. J Allergy Clin Immunol 2009 Apr;123(4):911-6. [ Links ]
45. Muller S, Marenholz I, Lee YA, Sengler C, Zitnik SE, Griffioen RW, et al. Association of Filaggrin loss-of-function-mutations with atopic dermatitis and asthma in the Early Treatment of the Atopic Child (ETAC) population. Pediatr Allergy Immunol 2009 Jun;20(4):358-61. [ Links ]
46. Ching GK, Hon KL, Ng PC, Leung TF. Filaggrin null mutations in childhood atopic dermatitis among the Chinese. Int J Immunogenet 2009 Aug;36(4):251-4. [ Links ]
47. Black PN, Sharpe S. Dietary fat and asthma: is there a connection? Eur Respir J. 1997 Jan;10(1):6-12. [ Links ]
48. Kull I, Bergstrom A, Lilja G, Pershagen G, Wickman M. Fish consumption during the first year of life and development of allergic diseases during childhood. Allergy 2006 Aug;61(8):1009-15. [ Links ]
49. Dunstan JA, Mori TA, Barden A, Beilin LJ, Taylor AL, Holt PG, et al. Fish oil supplementation in pregnancy modifies neonatal allergen-specific immune responses and clinical outcomes in infants at high risk of atopy: a randomized, controlled trial. J Allergy Clin Immunol 2003 Dec;112(6):1178-84. [ Links ]
50. Wjst M. Another explanation for the low allergy rate in the rural Alpine foothills. Clin Mol Allergy 2005 Jun 5;3:7. [ Links ]
51. Milner JD, Stein DM, McCarter R, Moon RY. Early infant multivitamin supplementation is associated with increased risk for food allergy and asthma. Pediatrics 2004 Jul;114(1):27-32. [ Links ]
52. Camargo CA, Jr., Clark S, Kaplan MS, Lieberman P, Wood RA. Regional differences in EpiPen prescriptions in the United States: the potential role of vitamin D. J Allergy Clin Immunol 2007 Jul;120(1):131-6. [ Links ]
53. Imazeki I, Matsuzaki J, Tsuji K, Nishimura T. Immunomodulating effect of vitamin D3 derivatives on type-1 cellular immunity. Biomed Res 2006 Feb;27(1):1-9. [ Links ]
54. Cantorna MT, Zhu Y, Froicu M, Wittke A. Vitamin D status, 1,25-dihydroxyvitamin D3, and the immune system. Am J Clin Nutr 2004 Dec; 80(6 Suppl):1717S-20S. [ Links ]
55. Du Toit G, Katz Y, Sasieni P, Mesher D, Maleki SJ, Fisher HR, et al. Early consumption of peanuts in infancy is associated with a low prevalence of peanut allergy. J Allergy Clin Immunol 2008 Nov;122(5):984-91. [ Links ]
56. Schaub B, Liu J, Hoppler S, Schleich I, Huehn J, Olek S, et al. Maternal farm exposure modulates neonatal immune mechanisms through regulatory T cells. J Allergy Clin Immunol 2009 Apr;123(4):774-82 e5. [ Links ]
57. Koplin J, Allen K, Gurrin L, Osborne N, Tang ML, Dharmage S. Is caesarean delivery associated with sensitization to food allergens and IgE-mediated food allergy: a systematic review? Pediatr Allergy Immunol 2008 Dec;19(8):682-7. [ Links ]
58. Gronlund MM, Lehtonen OP, Eerola E, Kero P. Fecal microflora in healthy infants born by different methods of delivery: permanent changes in intestinal flora after cesarean delivery. J Pediatr Gastroenterol Nutr 1999 Jan;28(1):19-25. [ Links ]
59. Jyonouchi H. Non-IgE mediated food allergy. Inflamm Allergy Drug Targets 2008 Sep;7(3):173-80. [ Links ]
60. Konturek PC, Rienecker H, Hahn EG, Raithel M. Helicobacter pylori as a protective factor against food allergy. Med Sci Monit 2008 Sep;14(9):CR452-8. [ Links ]
61. Corrado G, Luzzi I, Pacchiarotti C, Lucarelli S, Frediani T, Cavaliere M, et al. Helicobac-ter pylori seropositivity in children with atopic dermatitis as sole manifestation of food allergy. Pediatr Allergy Immunol 2000 May;11(2):101-5. [ Links ]
62. Figura N, Perrone A, Gennari C, Orlandini G, Giannace R, Lenzi C, et al. CagA-positive Helicobacter pylori infection may increase the risk of food allergy development. J Physiol Pharmacol 1999 Dec;50(5):827-31. [ Links ]
63. http://www.greenpeace.org/espana/contaminaci-n/contaminaci-n-de-r-os. [cited]; Available from: http://www.greenpeace.org/espana/contaminaci-n/contaminaci-n-de-r-os. [ Links ]
64. Watzl B, Abrahamse SL, Treptow-van Lishaut S, Neudecker C, Hansch GM, Rechkemmer G, et al. Enhancement of ovalbumin-induced antibody production and mucosal mast cell response by mercury. Food Chem Toxicol 1999 Jun;37(6):627-37. [ Links ]
65. Kulig M, Luck W, Lau S, Niggemann B, Bergmann R, Klettke U, et al. Effect of pre- and postnatal tobacco smoke exposure on specific sensitization to food and inhalant allergens during the first 3 years of life. Multicenter Allergy Study Group, Germany. Allergy 1999 Mar; 54(3):220-8. [ Links ]
66. Lannero E, Wickman M, van Hage M, Bergstrom A, Pershagen G, Nordvall L. Exposure to environmental tobacco smoke and sensitisation in children. Thorax 2008 Feb;63(2):172-6. [ Links ]