Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Salud Uninorte
versão impressa ISSN 0120-5552versão On-line ISSN 2011-7531
Salud, Barranquilla v.27 n.1 Barranquilla jan./jun. 2011
Comparación de los métodos de preservación de especímenes Anopheles (Diptera: Culicidae) para la extracción de ADN
Comparison of preservation methods of Anopheles (Diptera: Culicidae) specimens for DNA extraction
Tatiana Castano Sepúlveda1, Paola Sanchez Zapata1, Lorena Viana Guerra1, Margarita Correa Ochoa1, Lina Gutierrez Builes1, Mario Zapata Tamayo2
1 Grupo de Microbiologia Molecular, Escuela de Microbiologia, Universidad de Antioquia. Medellín (Colombia).2 Grupo de Investigación en Microbiologia Veterinaria, Escuela de Microbiologia, Universidad de Antioquia. Medellin (Colombia).
Correspondencia: Lina Gutierrez Builes, Escuela de Microbiologia, Universidad de Antioquia, calle 67 n° 53-108, Bloque 5-410. Tel (574) 219 5495. Fax (574) 219 5486. Medellin (Colombia). liangutibui@gmail.com
Fecha de recepción: 25 de octubre de 2010 Fecha de aceptación: 27 de marzo de 2011
Resumen
Objetivos: Evaluar diferentes tratamientos de preservación de especímenes Anopheles albimanus para conocer su utilidad para conservar la cantidad y calidad del ADN que permita su análisis en estudios moleculares posteriores.
Materiales y métodos: Se realizó un estudio comparativo experimental con tres bloques de tratamientos de preservación: sílica gel, etanol y congelación; los dos últimos bloques se dividieron en dos niveles cada uno: etanol absoluto, etanol al 70% y congelación a -20°C, congelación a -80°C respectivamente. El bloque control estuvo conformado por especímenes frescos sin tratamiento de preservación. Se extrajo el ADN de cada espécimen, se cuantificó por espectrofotometría y se amplifico el espaciador interno transcrito 2 (ITS2) mediante PCR. Se realizó un análisis comparativo entre bloques de tratamiento usando la frecuencia de amplificación de ITS2.
Resultados: Se obtuvo la amplificación de ITS2 de todos los especímenes sin preservación previa, del 60% de los preservados en sílica gel y del 20% de los preservados en congelación a -80°C y en etanol al 70%. Se halló diferencia estadísticamente significativa (p<0,05) entre las proporciones de amplificación observadas. No se obtuvo amplificación de los especímenes preservados en congelación a -20°C y no se observó una correlación por regresión logística (p>0,05) entre el índice DO260/DO280 y la concentración de ADN de los especímenes que presentaron amplificación de ITS2.
Conclusiones: Los datos sugieren que la conservación en sílica gel o la congelación que se vayan a -80°C pueden ser las mejores condiciones para la preservación de especímenes Anopheles a utilizar en estudios moleculares posteriores.
Palabras clave: Anopheles, malaria, ADN, preservación de muestras, reaction en cadena de la polimerasa.
Abstract
Introduction: Various methodologies have been reported for long term specimen preservation, which protect the DNA from degradation allowing its posterior analysis in molecular studies. However, the effectiveness of the preservation methods may vary among insect groups; therefore, it is convenient to determine the preservation method to be used with a particular group before performing molecular studies with a large number of specimens.
Objetives: An experimental comparative study was conducted to evaluate different preservation treatments for Anopheles albimanus, to know their utility in conserving the quantity and quality of DNA to be used in subsequent molecular studies.
Methods: DNA was extracted from each specimen, it was then quantified by spectrophotometer and the Internal Transcribed Spacer 2 (ITS2) was amplified by PCR.
Results: ITS2 amplification was obtained in all specimens without previous preservation, in 60% of those preserved in sílica gel and in 20% of those preserved at -80°C and in 70% ethanol. A significant difference (p<0.05) was found between amplification proportions. Amplification was not obtained in specimens preserved frozen at -20°C and not correlation by logistic regression was observed between the DO260/DO280 index and DNA concentration of specimens presenting ITS2 amplification.
Conclusions: The data suggest that keeping specimens in silica gel or frozen at -80°C may be the best conditions to preserve Anopheles specimens for subsequent molecular studies.
Key words: Anopheles, malaria, DNA, samples preservation, polymerase chain reaction.
Introducción
La malaria es una enfermedad potencialmente mortal, causada por parásitos protozoos del género Plasmodium (Coccidia: Plasmodiidae) que se transmiten a las personas a través de la picadura de mosquitos hembra del género Anopheles (Diptera: Culicidae) (1, 2). Es una de las enfermedades parasitarias de mayor impacto a nivel mundial; se registra en 9 paises de América, principalmente en aquellos que comparten la selva amazónica, y en 8 paises de América Central y el Caribe (3). Colombia reporta aproximadamente el 20% del total de casos de malaria de la región de las Américas y el riesgo mayor de transmisión se presenta en las zonas rurales ubicadas en la parte alta del rio Sinú, Bajo Cauca, Urabá y en la región Pacífica (4).
Aproximadamente 50 especies de Anopheles están descritas como vectores de la malaria (5). Anopheles albimanus, Anopheles aquasalis, Anopheles darlingi, Anopheles nuneztovari s.l. y Anopheles pseudopunctipennis s.l. han sido reportados como vectores principales en América Latina (2), mientras que para Colombia se consideran como vectores principales a las especies: An. albimanus, An. darlingi y An. nuneztovari s.l. (6).
Entre las estrategias adoptadas para el control de la malaria, el control de vectores ha sido una de las más efectivas, al bloquear el ciclo de transmisión del parásito (7). Es asi como en los últimos anos han cobrado relevancia los estudios que permiten profundizar en el conocimiento del vector, con un enfoque de investigation básica y/o aplicada (8); principalmente aquellos dirigidos a la identificación de las especies y la descripción de la distribución, bionomia y capacidad vectorial de los Anopheles spp. presentes en las zonas endémicas (9-10). En la actualidad, la mayoria de estos estudios incluyen el análisis del ADN de los especimenes, evaluando secuencias tanto de ADN nuclear como mitocondrial (10), que son amplificadas mediante técnicas moleculares como la Reacción en Cadena de la Polimerasa (PCR), técnica altamente sensible a la contaminación, inestabilidad y degradación del ADN (11).
La integridad del ADN puede ser afectada por diversos factores, como cambios de temperatura, la exposición a fuentes de radiación, variación del pH, presencia de microorganismos, procesos enzimáticos y quimicos, entre otros; que a su vez pueden afectar o dificultar el análisis y la obtención de datos moleculares, principalmente cuando se pretende el análisis de muestras preservadas por largos periodos de tiempo (11-14).
En general, la obtención de ADN a partir de especimenes frescos es más conveniente para mantener la integridad del mismo (15); sin embargo, en algunas ocasiones no es posible realizar la extracción del ADN de los especimenes recién recolectados, y es necesario conservarlos por periodos de tiempo prolongados usando diferentes métodos de preservación (16), tales como: la inmersión de la muestra en etanol absoluto (17-18) o al 70% (19, 20), la conservación en seco, anadiendo silica gel (21), o la congelación a -20°C (22) o a -80°C (23).
Los análisis de biologia molecular requieren que el ADN que se va a analizar sea de buena calidad; por ello, la verificación de la calidad del ADN extraido es un paso esencial para la aplicación de procedimientos posteriores. Teniendo en cuenta que existe poco conocimiento sobre la capacidad que poseen los diferentes métodos de preservación para mantener la integridad del material genético obtenido de mosquitos del género Anopheles, en est e estudio se compararon cinco métodos para la preservación de especimenes An. albimanus: inmersión en etanol absoluto y al 70%, congelación a -20°C y a -80°C y conservación en seco anadiendo sílica gel, con el fin de evaluar cuál(es) de estos mét odos permite(n) obtener un ADN de buena calidad y cantidad para ser utilizado posteriormente en estudios moleculares.
MATERIALES Y METODOS
Colección de especímenes y métodos de preservación
Los mosquitos adultos, Anopheles albimanus, analizados en este trabajo se recolectaron en un trabajo entomológico previo, realizado en el corregimiento Pangui, ubicado en el municipio Nuqui, en el depart amento del Chocó (5°39' N, 77°18' W). Los detalles de la estrategia de muestreo y de identification de los especimenes pueden ser consultados en Gutiérrez et al. (24).
El tiempo entre la captura de los especímenes y la etapa final de preservación en los tratamientos evaluados en este estudio no fue superior a una semana; sin embargo, durante el periodo de pretratamiento se almacenaron todos los especimenes en viales individuales agujerados en la tapa y almacenados en bolsas selladas que contenian silica gel.
Para el tratamiento de cada espécimen An. albimanus se separaron las extremidades (alas y patas) y se preservó de manera individual el cuerpo (cabeza, tórax y abdomen) durante un periodo minimo de 5 meses para el tratamiento de silica gel y de hasta 26 meses para los tratamientos de preservación en etanol absoluto, etanol al 70%, congelación a -20°C y congelación a -80°C, sin considerar el tiempo como una variable para examinar en este estudio.
Para todos los tratamientos de preservación los especimenes se almacenaron en viates individuales, de la siguiente manera: Para todos los tratamientos de preservación los especimenes se almacenaron en viales individuales; de la siguiente manera: para etanol absoluto y etanol al 70%, los especimenes se almacenaron sumergidos directamente en la concentración de etanol correspondiente de acuerdo con el diseno experimental; para los especimenes almacenados en congelación no se adicionó ningún aditivo al vial que contenia el espécimen, simplement e se depositaron en la temperatura correspondiente de acuerdo con el diseno del estudio, y en el caso de la preservación en silica gel se realizó un agujero en la tapa de cada vial y se almacenó en bolsas herméticamente selladas que contenian la silica gel de manera externa al vial.
Diserto experimental
Este estudio se realizó bajo un modelo experimental de comparación de bloques, en el que la variable independiente correspondió a los métodos de preservación de especimenes y la variable dependiente o de respuesta correspondió a la amplificación del marcador molecular ITS2 mediante PCR.
Se consideraron como unidades experimentales los especimenes An. albimanus preservados en cada nivel de tratamiento y se realizó un cálculo de muestra no probabilistico por conveniencia. En el diseno experimental se establecieron tres bloques de tratamientos: silica gel, etanol y congelación; los dos últimos bloques se dividieron, a su vez, en dos niveles cada uno: etanol absoluto, etanol al 70% y congelación a -20°C, congelación a -80°C respectivamente.
El bloque de silica gel fue almacenado a temperatura ambiente, donde la temperatura promedio en Medellin est á entre 19 y 24°C (25); el bloque control estuvo conformado por especimenes frescos sin tratamiento de preservación (An. albimanus donados de la colonia del PECET, Universidad de Antioquia). Cada uno de los grupos que se iban a comparar, incluyendo el control, contenian 5 especimenes o réplicas; a cada réplica se le realizaron 3 mediciones, tanto en el procedimiento de cuantificación del ADN como en la amplificación mediante PCR de la secuencia del espaciador interno transcrito 2 (ITS2).
Extracción y cuantificación del ADN
Se realizó la extracción del ADN genómico de cada una de las 5 réplicas dispuestas en los diferentes bloques de tratamiento. Como un paso previo a la extracción del ADN, se lavó cada espécimen con 100 ml de etanol al 95% y con 100 ml de TE 1X, excepto aquellas muestras pertenecientes a los bloques de etanol, que se lavaron una vez en 100 ml de TE 1X.
La extracción de ADN se realizó mediante el uso de soluciones salinas y la posterior precipitación con etanol (26), como se describe brevemente: la lisis celular se efectuó mediante maceración y homogenización de cada muestra en 100 ml de buffer de lisis (NaCl 0,1M, sucrosa 0,1M, Tris 0,1M, pH 9,1, EDTA 0,05, SDS 0,5%), se adicionó acetato de potasio (1M) y se incubó toda la noche a -20°C. Finalmente, mediante tres procesos de precipitación sucesiva, usando etanol absoluto y etanol al 70%, se obtuvo el ADN de cada espécimen, el cual fue homogenizado en 25 ml de buffer TE (Tris 10mM, EDTA 1mM, pH 7,6), y el producto final se almacenó a -20°C.
La cuantificación del ADN extraido de cada espécimen se realizó por medio de la lectura de absorbancia de tres diluciones diferentes, cada una con un volumen final de 100 ml (dilución 1:50), a una densidad óptica de 260 y 280 nm, mediante espectrofotometria de luz (Smartspec 3000® de BIORAD, Hercules, CA).
Para cada medición se determinó el indice DO260/DO280 para evaluar la pureza del material extraido, cuyo valor se espera en un rango de 1,7 a 1,9 cuando el ADN está libre de contaminantes de tipo proteico o RNA (27).
Amplificación por PCR de ITS2
Como un indicador final de la calidad del ADN extraido de cada espécimen sometido a los diferentes métodos de preservación se realizaron tres reacciones diferentes de amplificación por PCR de las secuencias ITS2 por cada réplica; este marcador molecular fue elegido para este estudio por su utilidad para la identificación molecular de diferentes especies del genero Anopheles. en total se realizaron 90 reacciones de am-plificación, procesadas en tres fechas diferentes, siguiendo las condiciones descritas por Zapata et al. (28).
Como control positivo de la amplificación se utilizó un clon que contiene la secuencia de ITS2 de An. albimanus.
Los productos de la PCR-ITS2 se analizaron mediante una electroforésis en gel de agarosa al 1% con tinción con bromuro de etidio y visualizados en el transiluminador UV - BIORAD 2000 (Hércules CA, USA).
Se usó el marcador de peso molecular HyperLadder I de 200-10.000 pb (Bioline, London, UK) para determinar el tamano de los productos de PCR.
Análisis estadístico
Se compararon los resultados correspondientes a la frecuencia de amplificación obtenida en cada bloque, niveles y subniveles de tratamiento. Los resultados obtenidos de la frecuencia de amplificación se analizaron comparativamente entre bloques de tratamiento. Las medidas de dependencia utilizadas fueron : la "t" de Student, la diferencia de proporciones, el test exacto de Fischer y la regresión logistica. Para el análisis estadístico y la graficación se utilizó el paquete estadistico SPSS versión 10 (SPSS Inc., Chicago, IL).
RESULTADOS
Cantidad y calidad del ADN extraído
Se obtuvo una concentración promedio de ADN de 122,5 ^g/mL para las muestras preservadas en etanol absoluto, 151,2 ^g/mL para las de etanol al 70%, 179,1 |jg/mL para las muestras preservadas en silica gel, 180,3 |jg/mL para las de congelación a -80°C, 210,7 |jg/mL para congelación a -20°C y 97,4 |jg/ mL para los especimenes sin tratamiento de preservación.
Los valores promedio de 100,9 |jg/mL, 83,4 |jg/mL, 216,1 |Jg/mL, 311,2 |jg/mL y 97,4 |jg/mL correspondieron a la concentración de ADN de las muestras que presentaron amplificación en la PCR-ITS2, almacenadas previamente en etanol absoluto, etanol al 70%, silica gel, congelación a -80°C y especimenes frescos respectivamente.
El promedio obtenido de la concentración de ADN de todas las muestras que amplificaron en la PCR-ITS2 fue de 190,6 |Jg/mL, con una desviación estándar (DE) de 91,9; mientras que para las muestras que no amplificaron en la PCR-ITS2 se observó un valor promedio de 161,8 |jg/mL (DE: 76,5).
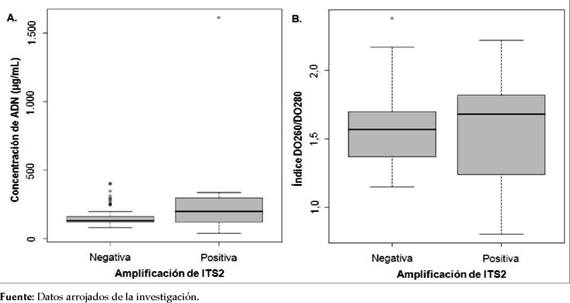
No se observaron diferencias significativas (p>0,05) entre los valores de concentración de ADN de las muestras que amplificaron por PCR-ITS2 y las que no amplificaron (Figura 1A).
Figura 1. Datos de la concentración de ADN y el indice DO260/DO280 vs. los resultados de amplificación de ITS2 A. Concentración de ADN de las muestras que presentaron amplificación positiva o negativa en la PCR-ITS2. B. Índice DO260/DO280 de las muestras que presentaron amplificación positiva o negativa en la PCR-ITS2.
Los valores obtenidos del indice DO260/ DO280 de las muestras analizadas oscilaron entre 1,5 a 1,9, y no se observaron diferencias significativas (p>0,05) entre los valores de las muestras con y sin amplificación por PCR-ITS2.Se observó un valor promedio de 1,5 (DE: 0,38), respecto al indice DO260/DO280 correspondiente a las muestras que presentaron amplificación en la PCR-ITS2, mientras que para las muestras que no presentaron amplificación de ITS2 se encontró un valor promedio de 1,6 (DE: 0,28) (Figura 1B).
Amplificación por PCR de ITS2
Se obtuvo amplificación de ITS2 del 60% de las muestras conservadas en silica gel, de un 20% de las muestras preservadas en congelación a -80°C, etanol al 70% y etanol absoluto respectivamente, y no se obtuvo amplificación de las muestras en congelación a -20°C. En los especimenes frescos, tomados como control, se obtuvo amplificación en la totalidad de las muestras analizadas. Se encontró diferencia estadísticamente significativa (p=0,0031) entre las proporciones de amplificación de los diferentes tratamientos; la prueba de Fischer, evaluada de forma independiente para el tratamiento de silica, presentó un resultado estadísticamente significativo (p=0,0504) y el análisis de regresión logística entre los valores de concentración y la proporción obtenida de amplificación de ITS2 presentó convergencia (|31=0,0042), con un valor de p no significativo (p= 0,21).
En general, se observó variación de los datos de concentración de ADN y del indice DO260/DO280 obtenido para las muestras que amplificaron mediante la PCR-ITS2 y que se habian preservado en los diferentes tratamientos (Figura 2).
Figura 2. Datos de la concentración de ADN y el indice DO260/DO280 en las muestras que presentaron amplificación positiva en la PCR-ITS2 y discriminado por tratamiento de preservación. A. Concentración de ADN de las muestras que presentaron amplificación positiva en la PCR-ITS2. B. Índice DO260/DO280 de las muestras que presentaron amplificación positiva en la PCR-ITS2.
Teniendo en cuenta los resultados de amplificación obtenidos en las reacciones de PCR-ITS2 realizadas inicialmente se realizaron dos reacciones de PCR adicionales tomando como ADN molde el producto de amplificación de la PCR inicial.
En las figuras 3 y 4 se presentan los resultados de las reacciones de reamplificación realizadas a las muestras de ADN dispuestas en los diferentes tratamientos. La figura 3 muestra los resultados de la primera reamplificación, en la que se observó la amplificación de una de las muestras dispuest as en el bloque congelación a -80°C, la amplificación de todos los especímenes frescos y no se observó amplificación de las muestras preservadas en congelación a -20°C; mientras que en la figura 4 se pueden observar los resultados correspondientes a la segunda reamplificación por PCR, en la que se obtuvo la amplificación de las tres repeticiones de uno de los especimenes preservados en etanol absoluto, de dos de las tres repeticiones de uno de los especimenes preservados en etanol al 70%, de cinco repeticiones de tres de los cinco especimenes preservados en silica gel y de todos los especimenes sin preservación, usados como control.
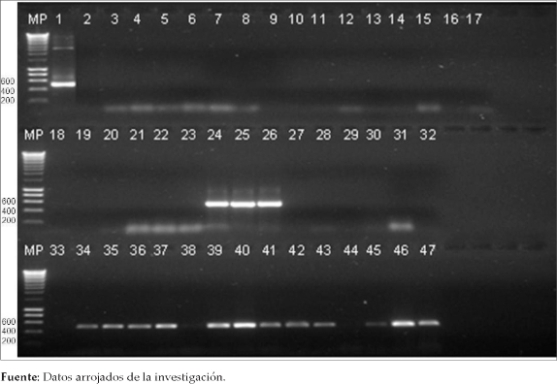
Figura 3. Reamplificación de los productos de PCR-ITS2 del ADN extraido de los especimenes An. albimanus preservados en los diferentes tratamientos (producto de PCR esperado de 560 pb aproximadamente).Electroforesis de agarosa al 1%.Carriles: MP: Marcador de peso molecular en pb. 1: Control positivo - clon de ITS2 de An. albimanus, 2: Control negativo -agua ultra pura, 3-17: ADN An. albimanus preservado en congelación a -20°C, 5 especimenes por triplicado, 18-32: ADN An. albimanus en congelación a -80°C, 5 especimenes por triplicado, 33-47: ADN An. albimanus (sin preservación), 5 especimenes por triplicado.
Figura 4. Segunda reamplificación de los productos de la PCR-ITS2 del ADN extraído de los especímenes An. albimanus preservados en los diferentes tratamientos (producto de PCR esperado de 560 pb aproximadamente). Electroforesis en gel de agarosa 1%.Carriles: MP: Marcador de peso molecular en pb. 1: Control positivo - clon de ITS2 de An. albimanus, 2: Control negativo - agua ultra pura, 3-5: ADN An. albimanus preservado en etanol absoluto a temperatura ambiente, 1 espécimen por triplicado; 6: ADN An. albimanus preservado en etanol absoluto a temperatura ambiente, 7-9: ADN An. albimanus en etanol al 70% a temperatura ambiente, 1 espécimen por triplicado, 10-18: ADN An. albimanus en sílica gel a temperatura ambiente, 3 especímenes por triplicado, 19-33: ADN An. albimanus (sin preservación), 5 especímenes por triplicado.
DISCUSION
La preservación adecuada de los especímenes es un paso importante para realizar estudios moleculares posteriores; sin embargo, la aplicación de técnicas moleculares altamente sensibles depende de factores como la pureza, calidad y cantidad del material genético extraído (29). Diferentes estudios han mostrado que la efectividad de los diferentes métodos de preservación para mantener la integridad del material genético de muestras biológicas depende de factores inherentes a la naturaleza de la muestra y al mecanismo de acción ejercido por cada preservativo sobre el material preservado (15, 30-34).
Por su capacidad para deshidratar el medio e inactivar nucleasas, mediante la disminución de la disponibilidad de cofactores enzimáticos, como el Mg y Mn (13, 35, 36), el etanol ha sido considerado como uno de los métodos más efectivos para la preservación de insectos. Otras ventajas son su disponibilidad y bajo costo en comparación con otros reactivos como la acetona y el nitrógeno líquido (31, 34).
Igual que el etanol, la congelación ha sido altamente recomendada como método de preservación de muestras biológicas, por conservar la integridad del ADN al reducir la actividad metabólica del cuerpo preservado, inhibir el crecimiento microbiano y el ataque enzimático que se presenta sobre el espécimen luego de la muerte celular, asegurando la viabilidad de la muestra por períodos largos de tiempo (37, 38).
Estudios previos realizados en tardígrados (29) y garrapatas (32) no encontraron diferencias significativas en la capacidad de preservación de métodos como la congelación a -80°C y el etanol absoluto y al 70%.
En este estudio se encontró igual porcentaje de amplificación de ITS2 (20%) de los especímenes preservados tanto en etanol (absoluto y al 70%) como en congelación a -80°C. El etanol y la congelación a -80°C presentan el mismo mecanismo de inactivación de endonucleasas; sin embargo, en este estudio se observó que las muestras preservadas en congelación a -80°C presentaron mayor concentración de ADN y mejor rendimiento de amplificación de ITS2 (al obtenerse resultados de amplificación desde la reacción inicial de PCR), lo que sugiere que este método es más efectivo para la conservación adecuada del material genético de especímenes Anopheles spp.
En cuanto al método de preservación en sílica gel, Mandrioli et al. (15) reportaron que éste no presenta buenos resultados en cuanto a su capacidad para conservar la calidad del ADN extraído de insectos lepidópteros; sin embargo, algunos estudios adicionales coincidieron en reportar que éste es un buen método para preservar los tejidos animales (31), por ejemplo, de insectos himenópteros (33), ya que permite conservar la estructura morfológica de la muestra y la realización de análisis de ADN posteriores, aunque no conserva adecuadamente la musculatura interna del espécimen, por no tener la capacidad de penetrar hasta los tejidos.
El mecanismo de acción de la sílica gel como preservativo está basado en su estructura (dióxido de sílice), que le otorga la capacidad de formar microporos internos, actuando como un sistema amortiguador que controla la humedad tanto en el ambiente como en el espécimen preservado (39).
En este estudio se observó mayor porcentaje de amplificación de los especímenes preservados en sílica gel, aproximadamente tres veces más (60%), en comparación con los demás métodos de preservación evaluados.
Los resultados de amplificación del marcador ITS2 de la totalidad de los especímenes sin preservación, en contraste con los resultados obtenidos para los especímenes preservados, permiten evidenciar el proceso de degradación que sufre el ADN durante el tiempo de almacenamiento, al igual que la capacidad diferencial que presenta cada método para conservar la calidad o integridad del ADN (15). Adicionalmente, los resultados observados respecto al índice DO260/DO280 de las muestras analizadas no mostraron diferencias significativas entre los valores de las muestras que amplificaron en la PCR-ITS2 y aquellas que no lo hicieron; en este caso, el índice de pureza no fue un factor determinante para la obtención de amplificación de la secuencia ITS2 mediante PCR.
Finalmente, el indicador |31 y su respectivo valor p (resultado de la regresión logística de las variables concentración de ADN vs. amplificación de ITS2), combinados con el valor p de la prueba de Fischer (evaluado para los datos de las muestras preservadas en sílica gel), ubicados en un margen tan cercano a la no significancia, sugieren una falta de poder estadístico o potencia estadística del diseno, que podría ser atribuido al número de replicas utilizado por conveniencia (5 por tratamiento). Sin embargo, la variación que se observó en este estudio respecto a los resultados de amplificación del marcador ITS2 mostraron cuán importante es la elección acertada del método de preservación de los especímenes para la obtención de resultados eficientes en las técnicas moleculares posteriores a la extracción del ADN.
Teniendo en cuenta los datos obtenidos respecto a la amplificación de ITS2 y la concentración de ADN, se sugiere que los métodos de preservación sílica gel y congelación a -80°C presentan mayor utilidad para la preservación de especímenes Anopheles spp. en comparación con los demás métodos analizados en este estudio. Adicionalmente, se recomienda la realización de estudios complementarios, en los que se evalué la influencia del tiempo de almacenamiento, se trabaje con un tamano de muestra mayor y se incluyan especímenes de colonia, para lograr un control mayor de las variables a analizar.
Contribuciones de los autores
TCS, PSZ y LVG participaron en el concepto y diseno del estudio, realizaron el procesamiento y análisis de las muestras y escribieron el manuscrito. MCO, MZT y LAG contribuyeron en el concepto y diseno del estudio, el análisis de los datos y ayudaron en la preparación del manuscrito.
Agradecimientos: Los autores expresan sus agradecimientos al personal que labora en el insectario del Programa de Estudio y Control de Enfermedades Tropicales-PECET, Sede de Investigación Universitaria-SIU, Universidad de Antioquia, por la donación de especímenes An. albimanus, usados como controles en el estudio.
Conflicto de intereses: Los autores declaramos que no existen conflictos de intereses que puedan influir en forma alguna en los resultados presentados y discutidos en este trabajo.
Financiación: Este trabajo estuvo anidado al proyecto financiado por el Comité para el Desarrollo de la Investigación -CODI- de la Universidad de Antioquia a MCO, código 8700-039.
REFERENCIAS
(1) Cox-Singh J, Davis TM, Lee KS, Shamsul SS, Matusop A, Ratnam S et al. Plasmodium knowlesi malaria in humans is widely distributed and potentially life threatening. Clin Infect Dis 2008; 15; 46 (2): 165-71. [ Links ]
(2) Flemming G. Biologia y ecologia de los vectores de la malaria en las Américas. Washington D.C.; 1986. [ Links ]
(3) OMS. Informe sobre paludismo en el mundo. United kingdom; 2005. [ Links ]
(4) INS. Boletín Epidemiológico Semanal. Estadísticas del Sistema de Vigilancia en Salud Pública - SIVIGILA. Bogotá: Instituto Nacional de Salud, Subdirección de Vigilancia y Control en Salud Pública; 2009. [ Links ]
(5) Kiszewski A, Mellinger A, Spielman A, Malaney P, Sachs SE, Sachs J. A global index representing the stability of malaria transmission. Am J Trop Med Hyg 2004; 70 (5): 486-98. [ Links ]
(6) Olano VA, Brochero H, Sáenz R, Quinones M, Molina J. Mapas preliminares de la distribución de especies de Anopheles vectores de malaria en Colombia. Biomédica 2001; 21: 402-8. [ Links ]
(7) WHO. Malaria vector control and personal protection. Geneva (Switzerland):World Health Organization; 2006. [ Links ]
(8) Hay SI, Guerra CA, Tatem AJ, Noor AM, Snow RW. The global distribution and population at risk of malaria: past, present, and future. Lancet Infect Dis 2004; 4 (6): 32-736. [ Links ]
(9) Donnelly MJ, Simard F, Lehmann T. Evolutionary studies of malaria vectors. Trends Parasitol 2002; 18 (2): 75-80. [ Links ]
(10) Norris DE. Genetic markers for study of the anopheline vectors of human malaria. International Journal for Parasitology 2002; 32(13):1607-15. [ Links ]
(11) Blackburn M, Gait M, Loakes D, Williams D. Nucleic Acids in chemistry and biology. 3th ed. Cambridge, UK: Royal Society of Chemistry; 2006. [ Links ]
(12) Dean M, William J, Ballard O. Factors affecting mitochondrial DNA quality from museum preserved Drosophila simulans. Entomol Exp et Appl 2001; 98: 279-83. [ Links ]
(13) King JR, Porter SD. Recommendations on the use of alcohols for preservation of ant specimens (Hymenoptera, Formicidae). Insect Soc 2004; 51: 197-202. [ Links ]
(14) Paabo S, Poinar H, Serre D, Jaenicke-Despres V, Hebler J, Rohland N et al. Genetic analyses from ancient DNA. Annual Review of Genetics 2004; 38: 645-79. [ Links ]
(15) Mandrioli M, Borsatti F, Mola L. Factors affecting DNA preservation from museumcollected lepidopteran specimens. Entomol Exp et Appl 2006; 120: 239-44. [ Links ]
(16) Oliveira C, Fungaro M, Camargo L, Lopes J. Systematics, morphology and physiology. Análise comparativa da estabilidade do DNA de Dalbulus maidis (DeLong & Wolcott) (Hemiptera: Cicadellidae) sob diferentes métodos de preservação para uso em RAPD-PCR. Neotrop Entomol 2002; 31 (2): 225-31. [ Links ]
(17) Pecor J, Gaffigan T. Laboratory and field protocols. Washington, D.C.: Walter Reed Biosystematics Unit. Smithsonian Institution; 1997. [ Links ]
(18) Temu EA, Yan G. Microsatellite and mitochondrial genetic differentiation of Anopheles arabiensis (Diptera: Culicidae) from western Kenya, the Great Rift Valley, and coastal Kenya. Am J Trop Med Hyg 2005; 73 (4): 726-33. [ Links ]
(19) Molina-Cruz A, de Mérida AM, Mills K, Rodriguez F, Schoua C, Yurrita MM et al. Gene flow among Anopheles albimanus populations in Central America, South America, and the Caribbean assessed by microsatellites and mitochondrial DNA. Am J Trop Med Hyg 2004; 71 (3 ): 350-9. [ Links ]
(20) Tripet F, Toure YT, Taylor CE, Norris DE, Dolo G, Lanzaro GC. DNA analysis of transferred sperm reveals significant levels of gene flow between molecular forms of Anopheles gambiae. Molecular ecology 2001; 10 (7): 1725-32. [ Links ]
(21). Mouatcho JC, Hargreaves K, Koekemoer LL, Brooke BD, Oliver SV, Hunt RH et al. Indoor collections of the Anopheles funestus group (Diptera: Culicidae) in sprayed houses in northern KwaZulu-Natal, South Africa. Malaria Journal 2007; 6: 30. [ Links ]
(22) Miller DN, Bryant JE, Madsen EL, Ghiorse WC. Evaluation and optimization of DNA extraction and purification procedures for soil and sediment samples. Appl Environ Microbiol 1999; 65 (11): 4715-24. [ Links ]
(23) Manguin S, Wilkerson RC, Conn JE, RubioPalis Y, Danoff-Burg JA, Roberts DR. Population structure of the primary malaria vector in South America, Anopheles darlingi, using isozyme, random amplified polymorphic DNA, internal transcribed spacer 2, and morphologic markers. Am J Trop Med Hyg 1999; 60 (3): 364-76. [ Links ]
(24) Gutierrez LA, Naranjo N, Jaramillo LM, Muskus C, Luckhart S, Conn JE et al. Natural infectivity of Anopheles species from the Pacific and Atlantic Regions of Colombia. Acta tropica 2008 Aug; 107 (2): 99-105. [ Links ]
(25) IGAC. Atlas de Colombia. 5â ed. Bogotá, D.C.: Instituto Geográfico Agustín Codazzi; 2002. [ Links ]
(26) Birungi J, Munstermann L. Genetic structure of Aedes albopictus (Diptera: Culicidae) populations based on mitochondrial ND5 sequences: evidence for an independent invasion into Brazil and United States. Ann Entomol Soc Am 2002; 95 (1): 125-32. [ Links ]
(27) Sharp P, Frederick M, Ausubel R, Kingston R, Moore D, Seidman J et al., editors. Current Protocols in Molecular Biology. Cambridge (Massachusetts): John Wiley and Sons; 2003. [ Links ]
(28) Zapata MA, Cienfuegos AV, Quiros OI,Quinones ML, Luckhart S, Correa MM. Discrimination of seven Anopheles species from San Pedro de Uraba, Antioquia, Colombia, by polymerase chain reaction-restriction fragment length polymorphism analysis of its sequences. The American Journal of Tropical Medicine and Hygiene 2007; 77 (1): 67-72. [ Links ]
(29) Schill R. Comparison of different protocols for DNA preparation and PCR amplification of mitochondrial genes of tardigrades. J Limnol 2007; 66: 164-70. [ Links ]
(30) Deevong P, Hongoh Y, Inoue T, Trakul-naleamsai S, Kudo T, Noparatnaraporn N et al. Effect of temporal sample preservation on the molecular study of a complex microbial community in the gut of the Termite Microcerotermes sp. Microbes Environ 2006; 21 (2): 78-85. [ Links ]
(31) Fukatsu T. Acetone preservation: a practical technique for molecular analysis. Molecular ecology 1999; 8 (11): 1935-45. [ Links ]
(32) Mtambo J, Van Bortel W, Madder M, Roe-lants P, Backeljau T. Comparison of preservation methods of Rhipicephalus appen-diculatus (Acari: Ixodidae) for reliable DNA amplification by PCR. Experimental & applied acarology 2006; 38 (2-3): 189-99. [ Links ]
(33) Quicke D, Belshaw R, López-Vaamonde C. Preservation of hymenopteran specimens for subsequent molecular and morphological study. Zoolog Scripta 1999; 28: 261-7. [ Links ]
(34) Tayutivutikul J, Pongprasert W, Royce L, Ruangrit K. Comparison of preservation techniques for Silkworm (Bombyx mori L.) DNA based on Polymerase Chain Reaction (PCR) products. CMU Journal 2003; 2 (2): 107-14. [ Links ]
(35) O'Meally D, Livingston S. Opportunistic collection of tissue in the field. First ed. Sydney: The Australian Museum. Tissue collection manager. The Ken and Yasuko Myer Molecular Evolutionary Biology Unit; 2001. p.25. [ Links ]
(36) Vidal A, Ahmed A, Pérez R, Medina M,Carrillo O. Concentraciones séricas de calcio y magnesio en alcohólicos durante el tratamiento de desintoxicación. Rev Cubana Aliment Nutr 1998; 12: 96-101. [ Links ]
(37) Ávila-Portillo L, Madero J, López C, León M, Acosta L, Gómez C et al. Fundamentos de criopreservación. Rev Colomb Obstet Ginecol 2006; 57 (4): 291-300. [ Links ]
(38) Hofreiter M, Jaenicke V, Serre D, Haeseler A, Paabo S. DNA sequences from multiple amplifications reveal artifacts induced by cytosine deamination in ancient DNA. Nucleic acids research 2001 Dec 1; 29 (23): 4793-9. [ Links ]
(39) Weintraub S. Demystifying silica gel. Washington, D.C.: Object Specialty Group Post-prints, American Institute for Conservation;2002. p. 24. [ Links ]