Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Salud Uninorte
Print version ISSN 0120-5552On-line version ISSN 2011-7531
Salud, Barranquilla vol.27 no.2 Barranquilla July/Dec. 2011
ARTÍCULO DE REVISIÓN / REVIEW ARTICLE
Síndrome de Hellp: Revisión
Hellp Syndrome: Review
Edgar E. Rivas Perdomo1, César Mendivil Ciódaro2
1 Ginecólogo y Obstetra, Universidad de Cartagena. Clínica Universitaria San Juan de Dios. Cartagena (Colombia). erivasperdomo@gmail.com.
2 Jefe del Departamento de Ginecología y Obstetricia, Universidad de Cartagena (Colombia). cemen-cio23@gmail.com.
Correspondencia: Edgar Rivas Perdomo. El Prado, Avenida Cartagena n° 32-43. Cartagena (Colombia). erivasperdomo@gmail.com
Fecha de recepción: 22 de agosto de 2011
Fecha de aceptación: 2 de octubre de 2011
Resumen
Se presenta una revisión sobre el síndrome HELLP con mayor énfasis en las nuevas teorías que pretenden explicar la fisiopatología y unas recomendaciones para su manejo. Este síndrome se caracteriza por daño endotelial microvascular; sin embargo, su fisiopatología aún no está bien definida. Existe un creciente interés en las citoquinas inflamatorias, factores genéticos y ambientales en la patogénesis de la misma. Al considerarla una microangiopatía difusa del embarazo se presta atención a los factores angiogénicos, y podría ser explicada por el desbalance de los factores angiogénicos circulantes, caracterizado por altos niveles circulantes de tirosincinasa tipo fms 1 soluble, endoglina y otros factores antiangiogénicos, bajos niveles circulantes de factor de crecimiento placentario y factor de crecimiento endotelial vascular.
El impacto sistémico es de tal magnitud que los niveles séricos de proteínas de choque térmico son significativamente superiores en los pacientes con el síndrome HELLP. Para el diagnóstico es preciso la presentación clínica y estudios que demuestren la alteración de los parámetros que lo caracterizan. Se presentan alternativas para los exámenes cotidianos, como la baja concentración de haptoglobina, que puede ser usada para el diagnóstico de hemólisis y es el marcador de preferencia para la misma. La glutatión S-transferasa-a1 plasmático podría ser un indicador más sensible que las transaminasas para diagnóstico temprano de daño hepático. Finalmente se presentan recomendaciones de manejo clínico de la enfermedad, que incluye la necesidad de manejo interdisciplinario en una unidad de cuidados intensivos.
Palabras clave: Síndrome Hellp, factores angiogénicos, endoglinas, haptoglobinas, glutatión S-Transferasa-Al.
Abstract
A HELLP syndrome review is presented, with greater emphasis on new theories that seek to explain the pathophysiology and management recommendations. The syndrome is characterized by microvascular endothelial damage. However, the pathophysiology of the syndrome is not yet well defined. There is a growing interest in inflammatory cytokines, genetic and environmental factors in the pathogenesis of the same. To consider it a diffuse Microangiopathy pregnancy pays attention to the angiogenic factors and could be explained by the imbalance of the circulating angiogénics, characterized by high circulating levels of tirosincinasa factors type 1 soluble fins and endoglin and other angiogenic factors and lower circulating levels of placental growth factor and vascular endothelial growth factor. The systemic impact is of such magnitude that serum levels of heat shock proteins are significantly higher in patients with the HELLP syndrome. The diagnosis necessitates the clinical presentation and studies showing the alteration of the parameters that characterize it. Alternatives for everyday exams as the low concentration of which can be used for the diagnosis of hemolysis and is the preference for the same marker haptoglobin are presented. Glutathione S-transferase-al plasma could be a more sensitive transaminases to diagnosis early liver damage. Finally, recommendations are presented for clinical management of the disease, including the need for interdisciplinary management in an intensive care unit.
Key words: Syndrome Hellp, angiogenics factors, endoglinas, haptoglobin, glutathione s-transferase-al.
INTRODUCCIÓN
El síndrome hellp se caracteriza por daño endotelial microvascular, seguido por activación, agregación y consumo de plaquetas, lo cual resulta en una isquemia distal y necrosis hepatocelular. La formación de microtrombos lleva a una hemólisis microangiopática con la presencia típica de fragmentos de eritrocitos en un extendido de sangre periférica (1). Suele ser considerado como una clínica especial de la preeclampsia. Sin embargo, en el 15% de los casos puede ocurrir en ausencia de signos de la misma (2).
No hay consenso respecto a la definición de los criterios biológicos para el diagnóstico del síndrome HELLP. En su publicación, Weinstein describió las observaciones de 29 pacientes que presentaron una trombocitopenia inferior a 100 000/mm3, citólisis hepática y un frotis de sangre alterado (hematíes crenados y esquistocitos).
Aspectos epidemiológicos
Ocurre en cerca del 3/1000 de los embarazos y a menudo es una emergencia médica, con una mortalidad de 1-2% y una mortalidad fetal del 10-35%, lo cual depende de la edad gestacional al momento del parto (3). Katz en un estudio en Brasil en 2008 indica tasa de mortalidad con síndrome HELLP en 3,8%; en otro estudio reciente fue de 4,7% y en un estudio español realizado entre pacientes internadas fue dos veces mayor (4). En otro estudio realizado en Bucaramanga (Colombia) sobre mortalidad materna, las causas más frecuentes fueron los trastornos hipertensivos del embarazo (THE), como preeclampsia, eclampsia y síndrome HELLP (26,5%) (5). Y en nuestro medio, Monterrosa en 2002 reportó que el síndrome HELLP complicó el 7% de las pacientes con preeclampsia (6).
En el 70% de los casos, el síndrome se diagnostica anteparto: 10% antes de las 27 semanas de gestación, 70% entre las 27 y 37 semanas de gestación y 20% después de las 37 semanas. En el 30% de los casos se diagnostica en el posparto (7).
En la literatura se ha reportado un rango de mortalidad entre 0 y 24% (8, 9). Entre las causas más frecuentes de muerte materna con síndrome HELLP se cuentan las hemorragias cerebrales, lo cual se encuentra en el 45% de las necropsias (9, 10).
Se asocia con desprendimiento prematuro de placenta, además de RCIU y parto pretérmino (2).
El riesgo de recurrencia en embarazos posteriores se reporta en valores muy diversos: 19 a 27% según Mihu (7), o muy raro, como del 3% según Gasem, con alto riesgo de complicaciones obstétricas, como hipertensión inducida por el embarazo (19%), parto pretérmino (21%) y restricción del crecimiento intrauterino (12%) (8).
La tasa de recurrencia del síndrome HELLP es del 27% en los embarazos siguientes, y la incidencia de trastornos hipertensivos del embarazo es del orden del 30% en mujeres con historias previas de síndrome HELLP (11).
Los resultados neonatales del síndrome HELLP son controversiales. Los neonatos de madres con síndrome HELLP son más propensos a ser pequeños para la edad gestacional, con mayor riesgo de asfixia perinatal y síndrome de dificultad respiratoria, y la morbilidad respiratoria y cardiovascular podría ser fuertemente agravada por síndrome HELLP cuando se presenta antes de las 32 semanas de gestación, pero ello no ha sido encontrado por otros autores (9).
La mortalidad perinatal depende de la edad gestacional al momento de desarrollarse la entidad, y se estima en 34% en neonatos de menos de 32 semanas de gestación y en 8% después de las 32 semanas de gestación. En general, se considera entre el 30 al 40% (8).
Fisiopatología
El síndrome HELLP es la traducción de la diversidad biológica de microangiopatías materna que puede ocurrir durante la preeclampsia. Su fisiopatología es desconocida y supone mecanismos que son difíciles de diferenciar de los de la preeclampsia (de la cual se considera que es una complicación), ya que los resultados de las pruebas en el síndrome de hellp no son específicos de él (2) y las lesiones útero-placentarias también han sido descritas en enfermedades autoinmunes y genéticas de la madre. En la actualidad hay un creciente interés en el papel de las citoquinas inflamatorias en la patogénesis del síndrome hellp.
Las citoquinas inician la respuesta inmune controlando la migración leucocitaria y el desarrollo de linfocitos. La infiltración de macrófagos a la decidua ha sido implicada en la generación de pérdidas recurrentes y preeclampsia. La interleuquina 10 (IL-10) es importante en la regulación de la función inmune y sus niveles elevados pueden tener efecto inhibitorio sobre los macrófagos, particularmente sobre la liberación de citoquinas. Además, se ha reportado que la IL-10 desempeña un importante papel inhibitorio en la regulación de la respuesta de las células T e inflamación aguda. Se ha encontrado significativamente elevado en el líquido amniótico de fetos pequeños para la edad gestacional y son la principal causa de morbilidad y mortalidad perinatal, y aunque no han sido debidamente estudiados en el papel que pudieran jugar en procesos obstétricos fisiológicos o patológicos, están implicados en el proceso de angiogénesis o angiostasis en las unidades de contracción y en el sistema linfático (12), y según Lerardi, hay una fuerte relación entre las transaminasa y los niveles de a -TNF que sugiere que esta citoquina pudiera estar envuelta en la enfermedad y en el desarrollo temprano de lesión hepática (13).
El ambiente inmune cambia dramáticamente en la preeclampsia. Los neutrófilos, monocitos y los linfocitos son excesivamente activados, así como las células NK; y las células T CD4+ y CD8+ también se encuentran en un estado activo (14). La alteración materna en el embarazo temprano impide cambiar normalmente la respuesta inmunitaria Th1 a una de tipo Th2. La respuesta inmunitaria Th1 tiene efectos nocivos para el embarazo tardío, mientras que la respuesta Th2 facilita la tolerancia materna al tejido fetoplacentario y el mantenimiento del embarazo (15).
De otra parte, Valderrama-Aguirre y cols. han descrito cómo los experimentos de mapeo genético, de alcance genómico y de ligamiento, han identificado regiones cromosómicas asociadas a preeclampsia en todos los cromosomas, con un patrón leve de concentración hacia los brazos largos de los cromosomas 2 y 22; sin embargo, la identificación de los genes particularmente involucrados ha sido evasiva. Los polimorfismos génicos más estudiados se clasifican en cinco grupos: 1) polimorfismos de genes vasoactivos (por ejemplo: M235T del gen AGT, I/D del gen ACE y E298D del gen eNOS), 2) mutaciones y polimorfismos de genes trombofílicos (por ejemplo: 1691G > A del factor V Leiden, 677C > T del gen MTHFR y 20210G > A del gen protrombina), 3) polimorfismos en genes del metabolismo lipídico y estrés oxidativo (por ejemplo: Exon3 Tyr113His del gen EPHX y Exon 6 Asn291Ser del gen LPL), 4) polimorfismos de genes involucrados en la respuesta inmune e inflamatoria (por ejemplo, -308G>A del gen TNFa y -1082G>A del gen de IL10), y 5) otros, entre los cuales se encuentran genes implicados en immu-nogenética, placentación e impronta y factores de crecimiento (15).
Es conocido que el síndrome hellp es una microangiopatía difusa del embarazo resultado de una falla en la implantación trofo-blástica (2), que podría estar mediada por diversos factores angiogénicos, genéticos, infecciosos como citomegalovirus, etc. (17). Esta falta de aplicación implica un desequilibrio local en la expresión de los mediadores vasodilatadores, tales como la prostaciclina, los óxidos nítricos y vasoconstrictores, entre los cuales la endotelina (ET) puede jugar un papel importante (18, 2), que conduciría a la isquemia placentaria. Sin embargo, la isquemia placentaria sola no es suficiente para provocar el trastorno, como sí lo es para producir restricción del crecimiento intrauterino (19).
La placenta humana se somete a altos niveles de la angiogénesis y vasculogénesis durante el desarrollo fetal. La angiogénesis es el proceso de neovascularización de vasos sanguíneos preexistentes, mientras que la vasculogénesis es el proceso de formación de los vasos sanguíneos a partir de células precursoras angioblásticas. Además, la placenta humana se somete a un proceso de mimetismo vascular (también conocida como "pseudovasculogénesis") cuando el citotrofoblasto placentario se convierte de un epitelio a un fenotipo endotelial normal de la placenta durante su desarrollo (19).
La lista de moléculas pro- y anti-angiogénicas que podrían desempeñar un papel en condiciones normales del desarrollo de la placenta vascular se está ampliando exponencialmente, pero la familia de los productos de genes del factor de crecimiento endotelial vascular (VEGF) ha sido el más ampliamente estudiado. VEGF-A es un mitógeno endotelial específico y un factor de supervivencia que existe en cuatro isoformas: VEGF121, VEGF165, VEGF189 y VEGF206 (19).
En 2008 Nagy expuso que es el polimorfismo en los genotipos (-460-TT y +405CC) de transporte de esos VEGF que interactúan con otros factores genéticos y ambientales lo que podría desarrollar el síndrome HELLP (20). Recientemente se han utilizado los perfiles de expresión génica para la búsqueda de factores producidos por la placenta en la preeclampsia. Usando este enfoque de macroanálisis del mRNA de tejido placentario de pacientes con preeclampsia se ha identificado el aumento de las cantidades de al menos dos proteínas circulantes que podrían desempeñar un papel importante en la patogénesis de la enfermedad: la sFlt1 soluble (tirosincinasa soluble tipo fms 1), que es mayormente regulada en pacientes con preeclampsia y actúa como un potente antagonista de VEGF, y el factor de crecimiento placentario (PlGF).
Tanto VEGF y PlGF son realizados por la placenta y se distribuyen en altas concentraciones durante el embarazo. Los niveles de sFlt1 circulantes son aumentados considerablemente en las mujeres con la preeclampsia y antes de la aparición de los síntomas clínicos (2, 20, 21). Se estima que un valor de 957 g/dl entre las semanas 25 y 28 de gestación tiene una sensibilidad del 80% y una especificidad del 100% para predecir la preeclampsia (23).
La forma soluble del sFlt-1 es la proteína antiangiogénica por excelencia. Al unirse con los factores de crecimiento placentario y endotelial impide su funcionamiento adecuado, que culmina con disfunción endotelial. Existen dos formas de este receptor: la de tirosincinasa unida a la membrana placentaria, la cual trasmite las señales angiogénicas (Flt1), y la forma soluble secretada como ectodominio, cuya única función importante es la captura del factor de crecimiento vasculoendotelial y el factor de crecimiento placentario (sFltl-1). Como a este sFlt-1 le falta el dominio citosólico, su función es restringir o reducir las concentraciones libres del factor de crecimiento vasculoendotelial y placentario, que son accesibles para interactuar con el receptor Flt1 y la cinasa 1 hepática fetal (15).
Otro factor soluble antiangiogénico secretado por la placenta que aparece elevada en mujeres con preeclampsia es la endoglina soluble (sEng), que es un receptor angiogénico expresado principalmente sobre la superficie de células endoteliales, pero también por el sincitiotrofoblasto placentario. La Eng actúa como un cofactor para la transformación del factor de crecimiento beta (fi-TGF) a una potente molécula pro-angiogénica en células endoteliales (21, 24, 25). La Eng mRNA es sobrerregulada en la placenta preeclámptica (21) y altera la unión al receptor TGF-(31 del endotelio, y disminuye la activación de la enzima óxido nítrico sintetasa y, con ello, la vasodilatación (25, 22).
En estudios en roedores, la sobreexpresión de la endoglina por medio de vectores adenovirales lleva a un incremento en la permeabilidad vascular e induce una hipertensión moderada sin proteinuria significativa. Pero la sobreexpresión de ambos, sFlt1 y endoglina soluble, causa daño vascular severo, proteinuria en el rango nefrótico, hipertensión severa y un síndrome similar al síndrome HELLP y restricción en el crecimiento intrauterino (21, 22). Levine encontró en su estudio que el aumento en la concentración de la endoglina soluble iba acompañado, por lo general, de un aumento en la relación sFlt1: PlGF (21).
La isquemia placentaria es la causa de microangiopatías difundida a través de dos fenómenos:
• Producción de la placenta y luego puesta en libertad en la circulación general de radicales libres, y de sFlt1 microvellosidades sincitiales (2).
• Activación de neutrófilos y por el que se fijan en el endotelio vascular (2).
El efecto acumulativo de estos dos fenómenos da lugar a una vasoconstricción sistémica. Se agrava la isquemia placentaria y es responsable de la activación inapropiada del proceso de coagulación. El daño micro-vascular, que es una vasoconstricción y fenómenos trombóticos asociados con depósitos de fibrina y la adhesión celular, son los responsables mecánicos de la hemólisis por contacto directo (2).
La trombocitopenia es el resultado de una deficiencia de prostaciclina responsable de la agregación plaquetaria y de un exceso de tromboxano A2, lo que origina una destrucción plaquetaria. Del mismo modo, la activación del endotelio vascular desempeña un papel importante en el síndrome hellp. La activación de las células endoteliales libera multímeros von Willebrand (VW), que reaccionan con plaquetas y participan en la trombocitopenia. Por lo tanto, las tasas de disminución de la actividad de la proteína de escisión adamts 13 han sido evidentes en los pacientes con el síndrome hellp; esto se traduce en un aumento de la participación de multímeros trombóticos vw y la microangiopatía observada (2, 27).
El hígado es el órgano predominantemente afectado en la zona periportal. Incluye numerosos depósitos obstructivos de fibrina diseminados en las sinusoides hepáticas; una necrosis focal de hepatocitos lleva a la citolisis de hígado, trombosis y hemorragia intrahepática. Todas estas lesiones contribuyen a la congestión sinusoidal con hipertensión intraparenquimatosa que puede ser responsable del hematoma subcapsular del hígado y hemoperitoneo. No hay ninguna correlación entre las anomalías y el grado de daño histológico del hígado (2).
Madách y cols. demostraron que los niveles séricos de la proteína de shock térmico (Hsp70) (proteínas que se producen en la respuesta a factores de estrés, como el calor, condiciones de oxidación y toxinas) son significativamente menores en mujeres embarazadas sanas que en mujeres sanas no embarazadas. Además, las concentraciones séricas de Hsp70 fueron encontradas más elevadas en pacientes con hipertensión inducida por el embarazo, en preeclampsia y en preeclampsia sobreagregada. Por primera vez en la literatura se informó que los niveles séricos de Hsp70 son significativamente superiores en los pacientes con el síndrome hellp que en pacientes preeclámpticas sin este. Y en 2008 demostraron una fuerte correlación de los marcadores de hemólisis (niveles de hemoglobina libre en plasma, actividad de LDH sérica y niveles de bilirrubina total) y de lesión hepatocelular (aminotransferasas séricas activas) en síndrome hellp. Además, demostraronque la concentración circulante de Hsp70 refleja la severidad de la enfermedad por la significativa correlación inversa a los conteos bajos de plaquetas. Por el contrario, no encontraron ninguna relación entre los niveles séricos de Hsp70 y de los marcadores de inflamación, coagulación, fibrinólisis o insuficiencia renal (1).
La a-hemoglobina de estabilización de proteínas (ahsp), anteriormente denominada factor eritroide relacionado con la diferenciación (feder), es un fragmento molecular específico que se une a las cadenas de hemoglobina y evita la precipitación de la a-globina en la línea celular eritroide. Se ha considerado a la ahsp como una proteína de choque térmico y se ha demostrado que si está ausente, la aglobina se vuelve inestable y genera especies reactivas de oxígeno (ros) que daña a la célula. ashp parece inhibir la producción de ros de la a-globina mediante la reducción de su capacidad inherente para participar en reacciones redox. La reducción de ahsp puede significar una menor protección de factores de estrés, y el estrés oxidativo lleva a daño del eritrocito, con la subsecuente hemólisis observada en el síndrome hellp (28).
La patogénesis del síndrome hellp se desconoce hasta el momento; así, se han reportado múltiples alteraciones bioquímica y genéticas en pacientes estudiadas como elevación de Proteína placentaria 13 (ga-lectin-13) (29) y la presencia de alteraciones genéticamente determinadas de la oxidación de ácidos grasos de cadena larga en el feto que predisponen a la madre a sufrir síndrome hellp, como una alteración mitocondrial (30).
El síndrome hellp podría ser explicado por el imbalance de los factores angiogénicos circulantes, caracterizado por altos niveles circulantes de sFlt1 y endoglina, y otros factores antiangiogénicos y bajos niveles circulantes de PIGF y VEGF (ambas proangiogénicos). Se cree que las concentraciones relativamente elevadas de factores antiangiogénicos desencadenan las lesiones celulares del endotelio a nivel hepático, renal y cerebral, así como en la placenta (31, 32). Mientras que VEGF, sEng y sFlt-1 son mediadores de disfunción endotelial, otros factores llevan a una placentación aberrante, tales como las proteínas de la matriz extracelular, factor inductor de la hipoxia 1 y 2, factor beta de crecimiento y miembros de la familia de las metaloproteinasas (31).
La disfunción endotelial se demuestra por el aumento del tono simpático e incrementada respuesta presora a la norepinefrina y la mayor sensibilidad a la angiotensina II. También hay alteraciones en los mediadores vasoactivos derivados del endotelio, tales como la disminución de prostaglandinas dilatadoras, como prostaglandina I2. (PGI2) y óxido nítrico, así como una incrementada cantidad de vasoconstrictores, como tromboxano A2 y endotelina (22).
Manifestaciones clínicas
Las manifestaciones clínicas iniciales suelen ser las mismas que se presentan en la preeclampsia. De hecho, se estima que el síndrome HELLP es una complicación o una forma terciaria de la preeclampsia - eclampsia. Sin embargo, hay una presentación lineal del cuadro así, Stella 2007 presenta un caso atípico de síndrome HELLP con tensión arterial normal, que según Sibai en el 2011 ello puede presentarse en el 20% de los casos. Por lo tanto, el diagnóstico de síndrome de HELLP no puede ser descartado en las pacientes normotensas o en aquellas pacientes que tengan otros signos y síntomas compatibles con preeclampsia (34). Como resultado, los pacientes podrían ser diagnosticados erróneamente de diversos trastornos médicos y quirúrgicos, incluyendo apendicitis, gastroenteritis, glomerulonefritis, pielonefritis, hepatitis viral, e incluso el hígado graso agudo del embarazo (AFLP) ( 35).
Los signos y síntomas clásicamente están relacionados con el impacto del vasoespasmo sobre el hígado materno. Así, la mayoría de las pacientes se presentan con signos y síntomas de compromiso hepático, que incluye ictericia, náuseas (con vómito o sin este) y dolor epigástrico (36). Otros síntomas incluyen dolor en el hombro derecho, malestar general, cefalea, disturbios visuales y sangrado mucocutáneo. El examen físico puede revelar un leve dolor en cuadrante superior derecho y edema periférico. Usualmente, los pacientes tienen hipertensión y proteinuria. Las anormalidades patológicas a nivel hepático incluyen hemorragia periportal, necrosis focal parenquimatosa con deposición hialina, fibrina microtrombos y esteatosis. La biopsia hepática no está indicada por el riesgo de inducir hemorragia (3).
El diagnóstico de síndrome hellp es más seguro cuando el paciente presenta signos y síntomas de preeclampsia - eclampsia y la tríada de anormalidades de laboratorio que sugieren anemia hemolítica por destrucción de glóbulos rojos, daño y disfunción hepática y trombocitopenia (10, 3), los cuales se presentan más comúnmente en el tercer trimestre o en el posparto.
Criterios de laboratorio para diagnóstico
Los resultados de laboratorios para este síndrome incluyen: anemia hemolítica microangiopática con esquistocitos y reticulocitos presentes en un extendido de sangre periférica, bilirrubina sérica total mayor de 1,2 mg/100 ml y la lácticodeshidrogenasa sérica (LDH) de más de 600 U/l. La hemoglobina liberada es convertida en bilirrubina no conjugada en el bazo o puede estar en el plasma unida a haptoglobina. El complejo haptoglobina-hemoglobina es clareado lentamente por el hígado, llevando a niveles bajos o indetectables de haptoglobina en la sangre, aún con hemólisis moderada. La baja concentración de haptoglobina (< 1 g/L - < 0.4 g/L) puede ser usada para el diagnóstico de hemólisis y es el marcador de preferencia para la misma. Así, el diagnóstico de hemólisis se realiza con base en la alta concentración de LDH y la presencia de bilirrubina, pero la demostración de bajas concentraciones o concentraciones indetectables de haptoglobina es un indicador más específico (9).
Otro criterio diagnóstico es el conteo de plaquetas menor de 50 000/ ml. La disminución de plaquetas se debe a la microangiopatía con aumento de la actividad plaquetaria; las plaquetas son activadas y adheridas al endotelio vascular dañado, resultando una incrementada destrucción plaquetaria con una vida media más corta (9, 36) y AST sérica de más de 70 U/l; raramente exceden los 1000 U/l. Cuando sus valores lo exceden, se debe pensar en otra entidad hepática, como la hepatitis. Sin embargo, cuando el síndrome HELLP progresa hasta la ruptura hepática, puede estar asociado con transaminasas marcadamente elevadas (36, 37). La glutatión S-transferasa-al (a-GST o GST-a1) plasmática podría ser un indicador más sensible que la AST y ALT para diagnóstico temprano de daño hepático, pero su medición no está ampliamente disponible y no aparece como procedimiento diagnóstico de rutina (9). Es importante tener un alto grado de sospecha para el síndrome, ya que podría presentarse de forma atípica, sin todos los síntomas descritos, inclusive sin proteinuria (33, 37).
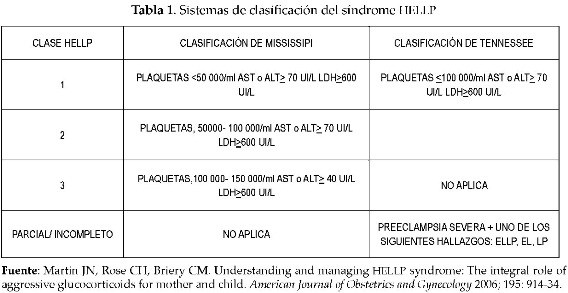
Clasificación
Los sistemas de clasificación han sido creados para ayudar a los médicos a identificar a los pacientes con riesgo de sufrir una significativa morbilidad materna y para guiar la intervención terapéutica, así como para evaluar su eficacia o resultados y permitir, además, comparar los diferentes resultados. La clasificación de Tennessee define al HELLP como completo o verdadero si están presentes todos los criterios siguientes:
1. Trombocitopenia moderada a severa con plaquetas en 100 000/ ml o menos.
2. Disfunción hepática con transaminasas AST 70UI o más.
3. Evidencia de hemólisis con un extendido de sangre periférica anormal, además de enzimas LDH > 600 Ul/l o bilirrubinas > 1,2mg/ dl.
Los pacientes que solo presentan algunos de estos parámetros son denominados hellp parcial o incompleto (10).
El sistema Mississippi divide al síndrome HELLP en tres grupos de acuerdo con el conteo de plaquetas:
1. Clase 1: Trombocitopenia severa (plaquetas < 50 000/ml), evidencia de disfunción hepática (AST o ALT > 70 UI/ L) y evidencia sugestiva de hemólisis (LDH sérica total 600UI/l).
2. Clase 2: Requiere similares criterios, excepto que la trombocitopenia es moderada (>50 000 a 100 000/ml).
3. Clase 3: Incluye pacientes con trombo-citopenia leve (> 100 000 a 150 000/ml), disfunción hepática leve (AST o ALT > 40 UI/ L) y hemólisis (LDH > 600 UI/l). Las anormalidades de bilirrubinas no son encontradas (10) (tabla 1).
Tratamiento
El propósito de tratar un trastorno hipertensivo es disminuir las probabilidades de eventos adversos vasculares, principalmente accidentes cerebrovasculares u otras complicaciones del sistema nervioso central. Aunque el riesgo absoluto es muy bajo en mujeres jóvenes, la preeclampsia - eclampsia continúa siendo una causa de morbilidad y mortalidad materna relacionada primeramente con el sistema nervioso central (38). Por su parte, al tratar a una paciente con síndrome hellp se debe establecer como prioridad asegurar y estabilizar la condición materna, particularmente las anomalías de la coagulación (39). El tratamiento definitivo es el parto, seguido de medidas de soporte a menudo en una unidad de cuidados intensivos. Se debe anotar que la necesidad de adelantar el parto no obliga a la realización de cesárea de forma inmediata, y se deben seguir las directrices que se siguen para preeclampsia severa con utilización de prostaglandinas para madurar el cérvix si el Bishop no es favorable, sin embargo, debe evitarse una inducción prolongada. Se estima que en caso de cesárea, la laparotomía media infraumbilical se asocia a menos complicaciones que la incisión de Pfannenstiel. Sin embargo, en nuestra observación ello pareciera no cumplirse. Y con recuento de plaquetas >50 000/ ul se puede optar por esta última incisión; se recomienda dejar un drenaje subaponeurótico, evitar la exploración del hígado, por el riesgo de rotura de posibles hematomas subcapsulares, y realizar profilaxis de la enfermedad tromboembólica con heparina de bajo peso molecular (37).
En la mayoría de las pacientes se produce una reversión del cuadro en las siguientes 24-48 horas, sin embargo, en algunos casos los síntomas pueden continuar durante 14 días (27, 40, 3). Los datos recientes indican que la disfunción endotelial puede persistir durante años después del episodio y que las mujeres que sufren preeclampsia podrían tener un alto riesgo de desarrollar enfermedad cardiovascular en el futuro (22).
Si el trastorno se manifiesta después de las 34 semanas de gestación y se documenta la madurez pulmonar fetal, el parto debe producirse tan pronto como se estabilice la madre (41, 35). Se puede inducir el parto vaginal, pero en ocasiones es necesaria la cesárea con uso de anestesia general y transfusión de plaquetas; sin embargo, tiene el riesgo de mayor sangrado, debido a la trombocitopenia y a la dificultad de controlar la tensión arterial, por la depleción de volumen (41).
Las alteraciones de los parámetros de laboratorio generalmente duran 48-72 horas posparto. Durante ese tiempo, la paciente deberá permanecer en la unidad de cuidados intensivos y recibir, además de la transfusión de plaquetas, los factores de coagulación que sean necesarios para controlar la coagulación intravascular diseminada (CID) (31). Se debe agregar la transfusión de plaquetas en caso de que el recuento de éstas sea inferior a 40 000. En dicha circunstancia, debe transfundirse la cantidad necesaria para elevar las plaquetas por encima de 50 000, recordando que cada unidad de plaquetas elevará el recuento en 10 000 por ml (39). Las transfusiones repetidas de plaquetas no son necesarias porque el consumo es rápido y el efecto es transitorio. De seis a diez unidades de plaquetas pueden ser administradas justo antes de la intubación traqueal (35). Si no existe esta indicación de urgencias, entonces se recomienda la plasmaféresis para el síndrome hellp que persistente después de 72 horas posparto. El conteo de plaquetas se normaliza dentro de una semana del parto (3). Si por causa de la hemólisis desciende el hematocrito a niveles inferiores a 24%, se debe transfundir además glóbulos rojos empacados (39). El cambio de plasma anteparto no revierte al síndrome hellp, pero si se realiza periparto, podría minimizar la morbilidad y la mortalidad (11).
Uno de los aspectos más importantes en el manejo del síndrome hellp es mantener la perfusión tisular, lo cual se relaciona con los volúmenes intravascular, que puede estar disminuido y condicionar alteraciones funcionales orgánicas como la renal. Así, el aporte de líquidos es esencial y la cantidad estará en función de la gravedad de la enfermedad (37). En general, se hace un suministro entre 100-120 cc/hora (43). En presencia de oliguria, es prioritario dar líquidos, con la finalidad de evitar una insuficiencia renal aguda. puede ser de utilidad colocar un catéter central para estimar en forma cuidadosa la cantidad de líquidos que se debe suministrar (42). Se ha estimado la utilidad de soluciones expansoras del plasma, pero el estudio petra no encontró ningún beneficio en su utilización al compararlas con cristaloides (44, 45).
La hipertensión es manejada agresivamente, si es necesario, con agentes parenterales. El uso de antihipertensivos no altera el curso del trastorno hipertensivo. Y generalmente se utiliza cuando la tensión arterial diastólica es > 105- 110 o la tensión arterial sistólica es >160 mm Hg, niveles en los cuales son apreciables los riesgos de complicaciones vasculares (31).
El labetalol, la hidralazina y la nifedipina son los medicamentos preferidos para la hipertensión aguda, y se utiliza más reservadamente la nitroglicerina diluida (10) por la toxicidad materna y fetal por cianuro (46). Se recomienda labetalol, en dosis de 20-40 mg I.V cada 15 minutos, por una hora (máximo: 220 mg), y la dosis de nifedipina es de 10-20 mg V.O cada 30 minutos, por una hora (máximo: 50 mg) (39) (tabla 2).
Otra preocupación derivada del uso de bloqueadores de los canales de calcio consiste en el mayor riesgo de depresión neuromuscular cuando se utiliza en combinación con sulfato de magnesio, que puede resultar en parálisis o insuficiencia cardiaca (46). El uso de monitoría invasiva raramente es necesaria en obstetricia. Sin embargo, una línea arterial tiene bajo riesgo y podría ser de utilidad en aquellas pacientes con tensión arterial consistentemente elevada, por encina de 160/110, y cuando se hace necesario la utilización de un vasodilatador; además, podría ser útil en pacientes con coagulopatías que necesiten frecuentes transfusiones y en obesos. Si se desarrolla edema pulmonar, entonces podría servir para monitorear los gases sanguíneos (11).
El sulfato de magnesio es administrado para prevenir las convulsiones. Diferentes estudios demuestran la superioridad del sulfato de magnesio para la prevención de convulsiones al compararlo con la fenitoína, nimodipina (46). Sibai, citado por Rivas, recomienda una dosis de carga de sulfato de magnesio de 6 g y una dosis de mantenimiento de 2g/ hora en una infusión continua (39). Estos regímenes no necesitan vigilancia de los niveles séricos de magnesio, porque los efectos clínicos pueden ser monitoreados con los reflejos tendinosos. Además de que se agrega un rango terapéutico más amplio que el índice de toxicidad, que tiene el régimen de 2 g/hora (47). Sin embargo, recomendamos el esquema de impregnación con 4 gramos e infusión a 1 gramo por hora.
Se hacen manejos específicos para la insuficiencia renal y edema pulmonar. No parece haber claridad respecto al tiempo que debe durar la terapia con sulfato de magnesio para el manejo de la preeclampsia en el postparto. De forma arbitraria se establece 12 a 24 horas, y cuando se ha establecido el síndrome hellp, este se instaura por 48 horas. Fontenot et al. en 2005 propusieron la aparición de la diuresis ( > 100 cc/hora por dos horas seguidas) en el período postparto como el parámetro clínico determinante para la interrupción del sulfato de magnesio en pacientes con preeclampsia grave. En su estudio con 48 pacientes y 50 controles, la suspensión del sulfato de magnesio a la aparición de la diuresis no se relacionó con resultados adversos ni en la necesidad de reiniciar la terapia en referencia (48).
Algunas veces, después del uso de corticoides y expansores del plasma se observa una mejoría transitoria, aunque normalmente antes de diez días debe terminarse el embarazo, ya sea por interés materno o fetal. La evidencia sugiere que los corticoides en dosis estándar mejoran los resultados perinatales cuando son usados en mujeres con síndrome hellp antes de las 34 semanas de gestación (34), y hay poca evidencia de que los valores de laboratorio mejoren con el uso de dexametasona en altas dosis (25, 34). Fonseca en un estudio clínico, doble ciego aleatorizado con 132 pacientes, no encontró diferencias en la evolución del síndrome utilizando o no dexametasona (49).
El manejo para este síndrome se torna problemático antes de las 34 semanas. El parto podría ser diferido por varios días si no hay complicaciones maternas ni sufrimiento fetal. Se administran corticosteroides para acelerar la madurez pulmonar fetal. La transfusión de plaquetas es necesaria para la trombocitopenia profunda (20 000 plaquetas / dl) o de signos de sangrado activo asociados con trombocitopenia moderada (50 000 plaquetas / dl) (27, 10). En los casos de verdadero síndrome hellp, si además aparecen signos de CID, se debe terminar la gestación, independientemente de la edad gestacional (39).
La indicación predominante de la terminación del embarazo incluye distrés fetal o muerte fetal. Y el manejo conservador plantea riesgos asociados que incluyen: desprendimiento prematuro de placenta, edema pulmonar, alteraciones renales (que incluten la elevación de la creatinina, hiponatremia, diabetes insípida nefrogénica e insuficiencia renal aguda), eclampsia, muerte perinatal y muerte materna (11, 39).
La ruptura hepática asociada al síndrome hellp tiene una mortalidad del 40-60% debido al choque hemorrágico y falla multisistémica. Con el fin de mejorar la supervivencia materna de las pacientes con el síndrome hellp asociados con ruptura hepática es necesario un enfoque interdisciplinario temprano en un centro con amplia experiencia en cirugía de hígado (incluido el trasplante hígado).
Los cuidados postoperatorios son igualmente difíciles, con una propensión hacia la falla de varios órganos y sistemas. Sin embargo, con un enfoque agresivo multidisciplinario, las tasas de mortalidad se pueden disminuir en un 50%. Los embarazos subsecuentes no parecen llevar un mayor riesgo de ruptura de hígado en la población general, pero debe ser seguida cuidadosamente por un obstetra de alto riesgo.
Las pacientes con síndrome hellp que presentan una elevación progresiva de las bilirrubinas o la creatinina por más de 72 horas después del parto se podrían beneficiar del cambio de plasma con plasma fresco congelado. En caso de continuar la hemólisis, trombocitopenia persistente e hipoproteinemia, es necesario la sustitución de eritrocitos y trombocitos postparto, así como la suplementación de albúmina, como regímenes estándares de tratamiento. Se ha utilizado furosemida para tratar los problemas de diuresis en el postparto, pero un metanálisis concluye que ésta no es útil para prevenir o tratar la falla renal aguda en adultos. La disminución de volumen conlleva a una vasoconstricción intravascular y agrava la lesión renal. Se debe administrar un bolo intravenoso de 250 a 500 ml de líquido si la oliguria es persistente, y si es necesario, se debe realizar monitoreo central de la paciente (9).
Guía de manejo en la Unidad de Cuidados Intensivos
1. Ingresar a la paciente con síndrome de
Hellp
2. Realizar historia clínica completa
3. Estudios de laboratorio
a. Hemograma
b. Recuento de plaquetas
c. Uroanálisis
d. Pruebas de función hepática
e. Pruebas de función renal (creatinina sérica, nitrógeno ureico y depuración de creatinina)
f. Pruebas de coagulación
g. Proteínas totales, albúmina, globulina
h. Ionograma
i. Gases arteriales, si se considera necesario
4. Inicio de soluciones cristaloides
5. Medicamentos
a. Antihipertensivos
b. Diuréticos en caso necesario
c. Sulfato de magnesio
6. Soporte orgánico específico
a. Ventilación mecánica
b. Hemodiálisis o hemofiltración
c. Soporte hemodinámico con fármacos inotrópicos o vasoactivos
7. Monitoreo
a. Colocación de catéter central
b. Colocar sonda de Foley
c. Cálculo de la presión coloidosmótica
d. Catéter de flotación, si es necesario
e. Oximetría de pulso continua en caso de disfunción pulmonar
f. Monitoreo de funciones orgánicas: renal, hepática, cardiopulmonar, plaquetas, tiempos de coagulación, y en caso necesario, nivel sérico de fibrinógeno
g. Monitoreo fetal
8. Estabilización antes del parto
Fuente: Poblano M, Yáñez JJ. Tratamiento de la preeclampsia/eclampsia. En: González A, Conde JM, Eds. Cuidados intensivos en la paciente obstétrica. México: Prado; 2003.
Conflicto de intereses: Ninguno.
REFERENCIAS
(1) Madách K, Molvarec A, Rigo J, Nagy B, Pénzes I, Karádi I et al. Elevated serum 70 kDa heat shock protein level reflects tissue damage and disease severity in the syndrome of hemolysis, elevated liver enzymes, and low platelet count. Eur J. Obstet. Gynecol and Reprod Biol 2008; 139133-138. [ Links ]
(2) Collinet P, Jourdian M. Le HELLP syndrome. Réanimation 2007; 16:386-392 [ Links ]
(3) Cappell MS. Hepatic disorders severely affected by pregnancy: medical and obstetric management. Med Clin N Am 2008; 92: 739-760. [ Links ]
(4) Katz L, Ramos M, Miranda GV, Pinto J. Perfil clínico, laboratorial e complicacoes de pacientes com síndrome hellp admitidas em uma unidade de terapia intensiva obstétrica. Rev. Bras. Ginecol. Obstet 2008; 30:8086. [ Links ]
(5) Cáceres-Manrique F, Díaz-Martínez L. La mortalidad materna en el Hospital Universitario Ramón González Valencia entre 1994-2004. Rev Colomb Obstet Ginecol 2007; 58:99-107. [ Links ]
(6) Monterrosa A, Bello, A. Incidencia y aspectos clínicos relacionados con la eclampsia en el Hospital de Maternidad "Rafael Calvo", Cartagena (Colombia), 1995-2001. Rev Colomb Obstet Ginecol 2002; 53: 279-290. [ Links ]
(7) Mihu D, Costin N, Mihu C, Seicean A, Ciortea R. hellp syndrome - a Multisystemic disorder. J Gastrointestin Liver Dis 2007; 16(4): 419 -424. [ Links ]
(8) Gasem T, Al Jama F, Burshaid S, Rahman J, AL Suleiman SA, Rahman MS. Maternal and fetal outcome of pregnancy complicated by hellp syndrome. J Maternal-Fetal. Neonatal Med 2009; 22 (12): 1140-1143. [ Links ]
(9) Haram K, Svendsen E, Abildgaard U. The hellp syndrome: Clinical issues and management. A Review. BMC Pregnancy and Childbirth 2009; 9:8 doi: 10.1186/1471-23939-8. [ Links ]
(10) Martin JN, Rose CH, Briery CM. Understanding and managing hellp syndrome: The integral role of aggressive glucocorticoids for mother and child. American Journal of Obstetrics and Gynecology 2006; 195: 914-34. [ Links ]
(11) Moake J, Baker KR. Thrombotic thrombocytopenic purpura hemolytic-uremic syndrome, and hellp. In: Belfort M, Saade G, Foley M, Phelan, DIldy III G. Critical care obstetrics. 5a ed. Wilwy-Blackwell; 2010. [ Links ]
(12) Tranquilli Al, Landi B, Corradetti A, Giannubilo SR, Sartini D, Pozzi V et al. Inflammatory cytokines patterns in the placenta of pregnancies complicated by hellp (hemolysis, elevated liver enzyme, and low platelet) syndrome. Cytokine 2007; 40: 82-88. [ Links ]
(13) Lerardi E, Margiotta M, Giorgio F, Nacchiero C, Valle ND, Stoppino G et al. Tumor necrosis alpha (tnf-a) serum levels and hypertransaminasemia are strongly related in the early stages of hemolysis, elevated liver enzymes, lowplatelets (hellp) syndrome. Abstracts / Digestive and Liver Disease 2008; 40S:S1-S195. [ Links ]
(14) Saito S, Shiozaki A, Nakashima A, Sakai M, Sasaki Y. The role of the immune system in preeclampsia. Molecular Aspects of Medicine 2007; 28 192-209. [ Links ]
(15) Duarte Mote J, Díaz S, Rubio J, Lee Eng Castro V, Fernández L, Castro J y cols. Preeclampsia y disfunción endotelial. Bases fisiopatológicas. Med Int Mex 2006; 22:220-30. [ Links ]
(16) Valderrama-Aguirre A, Gallo D, Cifuentes R. ¿Cuáles son los avances de la genómica y la proteómica en el tamizaje y/o predicción de la preeclampsia? Rev Colomb Obstet Ginecol 2011; 62:64-70. [ Links ]
(17) Dildy III GA, Belfort MA, Smulian JC. Preeclampsia recurrence and prevention. Semin Perinatol 2007; 31:135-141. [ Links ]
(18) Lamarca BD, Alexander BT, Gilbert JS, Ryan MJ, Sedeek M, Ydney R, Murphy SR et al. Pathophysiology of hypertension in response to placental ischemia during pregnancy: A Central Role for Endothelin? Gend Med 2008; 5[Suppl A]: S133-S138 . [ Links ]
(19) Kopcow HD, Karumanchi SA. Angiogenic factors and natural killer (nk) cells in the pathogenesis of preeclampsia. Journal of Reproductive Immunology 2007; 76:23-29. [ Links ]
(20) Nagy B, Savli H, Molvarec A, Várkonyi T, Rigó B, Hupuczi P et al. Vascular endothelial growth factor (vegf) polymorphisms in hellp syndrome patients determined by quantitative real-time pcr and melting curve analyses. Clinica Chimica Acta 2008; 389: 126-131. [ Links ]
(21) Levine RJ, Lam C, Qian C, Yu KF, Maynard SE, Sachs B et al. Soluble endoglin and other circulating antiangiogenic factors in preeclampsia. N Engl J Med 2006; 355:9921005. [ Links ]
(22) Mutter WP, Karumanchi SA. Molecular mechanisms of preeclampsia. Microvascular Research 2008; 75:1-8. [ Links ]
(23) Berkane N, Lefevre G, Hertig A. Angiogenic factors in preeclampsia: so complex, so simple? Nephrol Dial Transplant 2007; 22: 2753 -2756. [ Links ]
(24) Stepan H, Geipel A, Schwarz F, Krämer T, Wessel N, Faber R. Circulatory soluble endoglin and its predictive value for preeclampsia in second-trimester pregnancies with abnormal uterine perfusion. Am J Obstet Gynecol 2008; 198:175.e1-175.e6. [ Links ]
(25) Mohaupt M. Molecular aspects of preeclampsia. Molecular Aspects of Medicine 2007; 28 :169 -191. [ Links ]
(26) Lindheimer MD, Umans JG. Explaining and predicting preeclampsia. N Engl J Med 2006; 355: 1056-57. [ Links ]
(27) Beucher G, Simonet T, Dreyfus M. Prise en charge du hellp. Gynécologie Obstétrique & Fertilité. doi: 10.1016 / j.gyobfe.2008.08.015. [ Links ]
(28) Emmanuelli M, Sartini D, Rossi V, Corradetti A, Landi B, Vianna CR et al. Alpha-hemoglobin-stabilizing protein (ahsp) in hemolysis, elevated liver enzyme, and low platelet (hellp) syndrome, intrauterine growth restriction (iugr) and fetal death. Cell Stress and Chaperones 2008; 13:67-71 [ Links ]
(29) Than N, Rahman O, Magenheim R, Nagy B, Fule T, Hargitai B et al. Placental Protein 13 (galectin-13) has decreased placental expression but increased shedding and maternal serum concentrations in patients presenting with preterm preeclampsia and hellp syndrome. Virchows Arch 2008; 453(4): 387- 400. [ Links ]
(30) Illsinger S, Janzen N, Sander S, Schmidt K, Bednarczyk J, Mallunat L et al. Preeclampsia and hellp Syndrome: Impaired mitochondrial function in umbilical endothelial cells. Reproductive Sciences 2010; 17(3): 219226. [ Links ]
(31) Irminger-Finger I, Jastrow N, Irion O. Preeclampsia: A danger growing in disguise. International J Biochemistry Cell Biol 2008; 40: 1979 -1983. [ Links ]
(32) Steinberg G, Khankin EV, Karumanch SA. Angiogenicfactors andpreeclampsia. Thrombosis Research 2009; 123 (Suppl. 2): S93 - S99. [ Links ]
(33) Stella CL, Malik KM, Sibai B. hellp syndrome: an atypical presentation. Am J ObstGynecol 2008; e6 - e8. [ Links ]
(34) Sibai B. HypertensiveEmergencies. In: Foley MD, Strong TH, Garite TJ. Obstetric Intensive Care Manual. 3a ed. usa: McGraw-Hill; 2011. p. 49 - 60. [ Links ]
(35) Eruo FU, Sibai BM. Hypertensive diseases in pregnancy. In: Reece EA, Hobbins JC. Clinical Obstetrics. The Fetus & Mother. 3ä ed. Massachusetts: Blackwell Publishing; 2007. p. 683 - 699. [ Links ]
(36) 2) Dildy III GA. Complications of preeclampsia. In: Dildy III GA. Critical care obstetrics. 4ä ed. Massachusetts: Blackwell science; 2004. [ Links ]
(37) Huarte M, Modroño A, Larrañaga C. Conducta ante los estados hipertensivos del embarazo. An Sist Sanit Navar 2009; 32 (Supl. 1): 91-103. [ Links ]
(38) Magee L, von Dadelszen P. The Management of Severe Hypertension. Semin Perinatol 2009; 33:138 -142. [ Links ]
(39) Rivas- Perdomo EE, Soto-Yances A. Atención integral del embarazo con criterio de riesgo. Cartagena (Colombia); 2007. [ Links ]
(40) Lefkou E, Hunt BJ. Bleeding disorders in pregnancy. Obstet Gynaecol Reprod Med 2008; 18: 217- 223. [ Links ]
(41) Leeman L, Fontaine P. Hypertensive disorders of pregnancy. Am Family. Phys 2008;78:93 -100. [ Links ]
(42) Poblano M, Yáñez JJ. Tratamiento de la preeclampsia/eclampsia. En: González A, Conde JM, Eds. Cuidados intensivos en la paciente obstétrica. México: Prado; 2003. [ Links ]
(43) García-Marqués E, Iniesta S, Marbán E, Martínez-Lara A, Orensanz I, Zapardiel I. Urgencias del segundo y tercer trimestre En: Zapardiel Gutiérrez I, de la Fuente Valero J, Bajo Arenas JM. Guía práctica de urgencias en obstetricia y ginecología. Madrid: Sociedad Española de Ginecología y obstetricia; 2008. p. 33-36. [ Links ]
(44) Ganzevoort W, Rep A, Bonsel GJ, Fetter W, Van Sonderen L, De Vries J et al. FOR THE PETRA INVESTIGATORS. A randomised controlled trial comparing two temporising management strategies, one with and one without plasma volume axpansion, for severe and early onset pre-eclampsia. bjog, 2005; 112:1358-1368. [ Links ]
(45) Ganzevoort W, Rep A, Bonsel GJ, De Vries J. Wolf H. FOR THE PETRA INVESTIGATORS. A randomised trial of plasma volume expansion in hypertensive disorders of pregnancy: Influence on the pulsatility indices of the fetal umbilical artery and middle cerebral artery. Am J Obstet Gynecol 2005; 192: 233 - 9. [ Links ]
(46) Solomon CG, Seely EW. Hypertension in pregnancy. Endocrinol Metab Clin N Am 2006; 35: 157-171. [ Links ]
(47) Steegers EA, von Dadelszen P, Duvekot JJ, Pijnenborg R. Pre-eclampsia. www.thelancet.com Published online July 1, 2010 DOI: 10.1016/S0140-6736 (10) 60279-6 [ Links ]
(48) Fontenot M, Lewis D, Frederick J, Wang Y, De Franco E, Groome LJ, Evans A. A prospective randomized trial of magnesium sulfate in severe preeclampsia: Use of diuresis as a clinical parameter to determine the duration of postpartum therapy. Am J Obstet Gynecol 2005; 192: 1788 - 94. [ Links ]
(49)Fonseca J, Méndez F, Cataño C, Arias F. Dexamethasone treatment does not improve the outcome of women with hellp syndrome: A double-blind, placebo-controlled, randomized clinical trial. Am J. Obstet Gynecol 2005; 193(5):1591-1598. [ Links ]