Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Salud Uninorte
Print version ISSN 0120-5552
Salud, Barranquilla vol.29 no.3 Barranquilla Sept./Dec. 2013
Artículo original / ORIGINAL ARTICLE
Modelización molecular de las interacciones de 9-aminoacridinas con ácidos nucleicos
Molecular modeling of the 9-aminoacridines interactions with nucleic acids
Sandra Cotes Oyaga1, José Cotuá Valdés2, Sigrid Borja Páez2, Keylin Hurtado Márquez2
Correspondencia: Sandra Cotes Oyaga. Departamento de Química y Biología, Universidad del Norte, km 5, antigua vía a Puerto Colombia. Barranquilla (Colombia). scotes@uninorte.edu.co.Fecha de recepción: 17 de mayo de 2013
Fecha de aceptación: 7 de mayo de 2013
Resumen
Objetivos: Calcular por medio de la modelización molecular descriptores moleculares para un grupo de 9-aminoacridinas (9-AA 2 a-e) de actividad biológica comprobada, los pares de bases Adenina-Timina (AT) y Guanina-Citosina (GC) y sus respectivos complejos.
Materiales y métodos: Las geometrías moleculares de las 9-AA2 a-e y las bases nitrogenadas del ADNfueron optimizados usando el método DFT B3LYP/6-31G**. Las propiedades de las 9-AA 2 a-e aisladas y sus interacciones más estables con AT y GC fueron investigadas usando el mismo método.
Resultados: Los resultados mostraron que las 9-AA 2 a-e presentan gran deslocalización de cargas, altas polarizabilidades y altos momentos dipolares, los cuales son propiedades determinantes para estudios de interacciones intermoleculares. Las 9-AA 2 a-e son aceptores de electrones, mientras que los pares de bases son donadores de electrones.
Conclusiones: Del conjunto de 9-AA estudiadas, la 9-AA 2(d) presenta las mayores atracciones intermoleculares con los pares de bases del ADN, y la 9-AA 2(b) las más débiles.
Palabras clave: ADN, 9-Aminoacridinas, cálculos DFT.
Abstract
Objectives: To calculate a set of molecular descriptors of a group of 9-aminoacridines (9-AA 2 a-e), of DNA base pairs adenine-thymine (AT) and guanine-cytosine (GC) and their respective complexes.
Materials and Methods: Molecular geometries of 9-AA 2 a-e and DNA base pairs were optimized using the DFT B3LYP/6-31G ** method. The properties of the isolated 9-AA 2 a-e and stable interactions with AT and GC were studied using the same method.
Results: The results showed that 9-AA 2 a-e have large charges, high dipole moments and high polarizabilities, properties which are decisive for intermolecular interaction studies. 9-AA 2 a-e are electron acceptors while base pairs are electron donors.
Conclusions: 9-AA 2(d) showed the strongest intermolecular interactions with DNA base pairs and 9-AA 2(b) the weakest.
Keywords: DNA, 9-Aminoacridines, DFT calculations.
Introducción
Una de las características que presentan los ácidos nucleicos es que pueden interactuar de manera reversible y no covalente con diversas especies químicas que presentan bajo peso molecular. Así, los derivados de acridina 1 que surgen de la sustitución estructural se constituyen en centro de interés por sus propiedades farmacéuticas como antitumoral (1-5), antiviral (6-8), antiprionica (9-10), antimicrobiana (11), antinflamatoria y analgésica (12).
Solo hasta 1948 se reportó por primera vez la actividad anticancerígena de las 9-AA (13), la cual se explica p or la intercalación del heterociclo de la acridina entre las bases adyacentes de los ácidos nucleicos (14). Hoy en día, las 9-AA siguen siendo usadas en el tratamiento de diversas enfermedades, tales como el lupus eritematoso, artritis reumatoidea, malaria, chagas, y otras, incluso, exhiben un amplio espectro de aplicaciones (15).
La importancia de la sustitución en el grupo 9-amino de la Acridina 1 para la actividad biológica ha sido reportada en la literatura (16); su conjugación con biomoléculas puede modular su actividad, biodisponibilidad y aplicabilidad, y también se ha descubierto que cadenas laterales peptídicas orientan la selectividad por ciertas secuencias (17).
Por otra parte, la actividad biológica usualmente se correlaciona con la intensidad de las fuerzas intermoleculares, siendo múltiples los factores responsables de la interacción. Todas las sustancias que intercalan en el ADN lo hacen a través de interacciones no covalentes y puentes de hidrógeno con los pares de bases. Las atracciones electrostáticas son responsables de la especificidad y selectividad de las sustancias; y en el caso de sistemas polares y sistemas policíclicos aromáticos, la polarizabilidad, nucleofilia y electrofilia juegan un papel significativo, siendo la dispersión de la energía uno de los mayores componentes estabilizantes del sistema.
En este trabajo presentamos las estructuras e interacciones de cinco 9-AA sustituidas 2 a-e (ver figura 1) y los pares de bases del ADN AT y GC, conjugados peptídicos que han sido sintetizados y presentan afinidad por el ADN (18,19). Una fuerte interacción con el ADN se correlaciona con su citotoxicidad, sin embargo, limita su distribución extravascular. Sebestik y colaboradores diseñaron los conjugados peptídicos 9-AA 2 a-e usando sustituyentes de selectividad opuesta por el ADN; dado que la 9-AA (1) presenta afinidad por las bases GC, se adicionaron secuencias peptídicas afines por AT. Los conjugados peptídicos de la 9-AA 2 a-e exhiben una débil interacción con el ADN, que se explica por el rol competitivo ejercido por los sustituyentes, y que podría favorecer una mejor velocidad de difusión extravascular.
En este artículo se estudia teóricamente por primera vez las interacciones de las 9-AA 2 a-e con el ADN necesarias para una difusión corporal rápida. Se optimizaron las geometrías de los complejos de las 9-AA 2 a-e con los pares de bases y se evalúan las variables estructurales responsables de las interacciones con el ADN, tales como las cargas atómicas y distancias de enlace, los efectos de la polarizabilidad, momento dipolar y energía de los orbitales de frontera HOMO y LUMO por la Teoría del Funcional de la Densidad (DFT).
Métodos
Las estructuras de mínima energía de las moléculas aisladas y los complejos formados entre 9-AA 2 a-e y los pares de bases fueron halladas con métodos de mecánica molecular (MMFF) usando el software Spartan '08 (20). Por medio del método DFT, nivel B3LYP y base 6-31G** se optimizaron las 9-AA 2 a-e, los pares de bases GC, AT y los complejos que estos forman.
Se calcularon los descriptores moleculares (cargas atómicas, distancias de enlace, ángulos de enlace, momento dipolar, polarizabi-lidad y orbitales frontera HOMO y LUMO) de las moléculas aisladas y sus respectivos complejos moleculares usando el paquete GAUSSIAN 03 (21) por el método DFT, nivel B3LYP y base 6-31G**.
Resultados y discusión
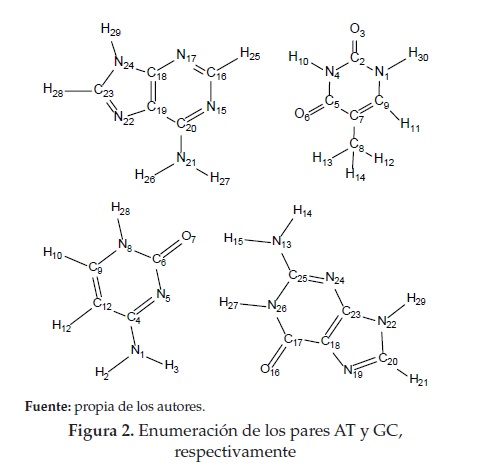
La enumeración de los pares de bases del ADN, AT y GC de Watson-Crick es visualizada en la figura 2. Las estructuras optimizadas de los complejos formados entre 9-AA 2 a-e con los pares de bases del ADN se muestran en las figuras 3 y 4. Es claro que no se conserva la coplanaridad en la interacción de las 9-AA 2 a-e con GC y de la 9-AA 2(c) con AT.
Algunos descriptores moleculares, tales como cargas atómicas, polarizabilidad, momento dipolar y energía de los orbitales moleculares de frontera de las bases aisladas, los pares de bases, las 9-AA 2 a-e y sus complejos, son mostrados en la tabla 1.
El anillo central de las 9-AA 2 a-e al formar los complejos con los pares de bases nitrogenadas presenta cambios significativos en las cargas atómicas, especialmente en los átomos de carbono adyacentes al N14. Sin embargo, los cambios más significativos se presentan al interactuar con el par GC. Por ejemplo, la carga atómica del C13 de la 9-AA 2(a) es de 0,225, la cual cambia a -0,095 al interactuar con AT, mientras que al interactuar con GC su carga cambia a -0,222. La interacción más fuerte con GC se presentó con la 9-AA 2(d), que exhibió además pérdida de la coplanaridad y cambios en los ángulos de enlace de los sistemas heterocíclicos.
Algunos átomos electronegativos de las 9-AA 2 a-e, después de formar los complejos con GC, proveen parte de sus cargas a los átomos de hidrógeno de este par de bases, formando posibles puentes de hidrógeno, interacción que podría estar asociada a la pérdida de la coplanaridad. Por ejemplo, el H14 de GC es atraído por el N14 de la 9-AA 2(b) y por el O36 de la 9-AA 2(d), respectivamente; el O35 de la 9-AA 2(c) atrae al H28 de GC y al H30 en AT y en la 9-AA 2(e), el N14 atrae al H2 de GC (ver figuras 3 y 4). A partir del estudio de los cambios de las cargas atómicas de los pares de bases, la interacción más fuerte con respecto a AT se produjo en los complejos AT---9-AA 2(c) y AT---9-AA 2(d). Los átomos N15---H10 y O6---H27 en AT involucrados en los puentes de hidrógeno de estos sistemas presentaron los cambios más altos en sus cargas atómicas.
Por otra parte, las cadenas peptídicas de las 9-AA 2(a, b, d y e) presentan un puente de hidrógeno intramolecular entre H32 y C35=O (figura 1), los cuales desaparecen por interacción con G-C, y se observan grandes cambios en las cargas atómicas y en los ángulos de torsión en las cadenas. En las 9-AA 2(a y b), los cambios en los ángulos de torsión se presentan a la altura del C25, lo cual impide la formación del puente de hidrogeno. En el complejo 9-AA 2(d y e)---GC, los átomos de oxígeno presentes en las cadenas peptídicas de estas 9-AA 2 a-e cambian sus ángulos de enlace, y se orientan hacia algunos hidrógenos en GC, lo cual impide también la formación del puente de hidrógeno intramolecular antes mencionado.
Entre las 9-AA 2 a-e, la que presentó la diferencia de energía de los orbitales frontera más baja fue la 9-AA 2 (d), (0,127 eV), lo cual indica que es la molécula más susceptible al ataque nucleofílico de la serie en estudio, sin embargo, la reactividad basada en la teoría de los orbitales moleculares de frontera se conserva dentro del mismo rango. Las 9-AA 2 a-e tienden a presentar valores negativos en las energías de los orbitales de frontera (HOMO y LUMO), por lo tanto son buenos aceptores de electrones.
Los valores de las energías del orbital LUMO de las bases aisladas y de los pares de bases son más positivos en comparación con los de las 9-AA 2 a-e, por lo tanto, las bases aisladas y los pares de bases son ciertamente donadores de electrones, lo cual se corresponde con el potencial de ionización de las bases (22-24).
La 9-AA 2(c) y 2 (d) presentan los mayores momentos dipolares: 5,571 y 3,615 debye, respectivamente. En cuanto a la polarizabilidad molecular de las bases aisladas del ADN, el valor más alto es el de Guanina (191,180) y entre los pares de bases GC (246, 291). Las 9-AA 2 a-e, al ser moléculas grandes, tienen facilidad de dispersión de carga, lo cual contribuye a la estabilización de las interacciones moleculares. Del conjunto de 9-AA en estudio, la que presentó la polarizabilidad más alta fue la 9-AA 2(c) (350, 554).
Se podría argumentar que los cambios más significativos en las interacciones moleculares presentadas en 9-AA 2(c) y (d) se deben a un compromiso entre polarizabilidad y momento dipolar, ya que la 9-AA 2(e) presenta la mayor polarizabilidad de la serie en estudio pero su momento dipolar es el segundo más bajo. Igualmente, se observa que GC, al poseer la mayor polarizabilidad y mayor momento dipolar de los pares de bases, favorece interacciones moleculares fuertes. En este orden de ideas, las interacciones más débiles con el ADN se presentan en la 9-AA 2(b), lo cual podría traducirse en una mejor difusión extravascular de este tipo de conjugado peptídico de la acridina.
Conclusión
Las 9-AA 2 a-e presentan alta polarizabilidad y son buenos aceptores de electrones, mientras que los pares de bases son buenos donadores de electrones, resultando interacciones favorables entre los dos sistemas. Del conjunto de moléculas estudiadas, la 9-AA 2(d) y el par GC presentan las interacciones más fuertes, y la 9-AA 2(b) las más débiles.
Conjugados peptídicos del tipo 9-AA 2(b), con polarizabilidad y momento dipolar moderados podrían presentar una mejor difusión extravascular; factores que podrían considerarse en el diseño de nuevos conjugados peptídicos de las 9-AA para potencial uso medicinal. Se observó que hay formación de puentes de hidrógeno en las cadenas peptídicas de las 9-AA 2 a-e y átomos de hidrógeno presentes en GC, lo cual podría facilitar la pérdida de la coplanaridad en las interacciones; contrario a lo que ocurre entre las 9-AA 2 a-e con AT. La pérdida de la coplanaridad conllevaría a cambios en la estructura 3D del ADN.
Conflicto de interés: ninguno.
Financiación: este estudio fue realizado gracias al apoyo y financiación de la Dirección de Investigación, Desarrollo e Innovación (DIDI) de la Universidad del Norte. Proyecto 200602750.
Notas
1 Departamento de Química y Biología, Universidad del Norte (Colombia).
2 Universidad del Atlántico, Km 7 Antigua Vía a Puerto Colombia, Barranquilla (Colombia).
Referencias
1. Belmont P, Bosson, Godet T, Tiano M. Anticancer Agents Med Chem 2007; (7):139-169. [ Links ]
2. Charmantray F, Demeunynck M, Carrez D, Croisy A, Lansiaux A, Bailly C, Colson P. 4-Hydroxymethyl-3-aminoacridine Derivatives as a New Family of Anticancer Agents. J Med Chem 2003; (6): 967-977. [ Links ]
3. Heald RA, Stevens MFG. Antitumour polycyclic acridines. Palladium (0) mediated syntheses of quino[4,3,2-kl]acridines bearing peripheral substituents as potential telomere maintenance inhibitors. Org Biomol Chem 2003; (19):3377-3389. [ Links ]
4. Hegde R, Thimmaiah P, Yerigeri MC, Krishnegowda G, Thimmaiah KN, Houghton PJ. Anti-calmodulin acridone derivatives modulate vinblastine resistance in multidrug resistant (MDR) cancer cells. Eur J Med Chem 2004; (2):161-177. [ Links ]
5. Kimura M, Kato A, Okabayashi I. Acridine derivatives. IV. Synthesis, molecular structure, and antitumor activity of the novel 9-anilino-2,3-methylenedioxyacridines+. J Heterocycl Chem 1992; (29):73-80. [ Links ]
6. Fujiwara M, Okamoto M, Okamoto M, Watanabe M, Machida H, Shigeta S, Konno K, Yokota T, Baba M. Acridone derivativesare selective inhibitors of HIV-1 replication in chronically infected cells. Antiviral Res 1999; (43):189-199. [ Links ]
7. Luedtke NW, Liu Q, Tor Y. RNA-ligand interactions: affinity and specificity of amino-glycoside dimers and acridine conjugates to the HIV-1 Rev response element. Biochemistry 2003; (42):11391-11403. [ Links ]
8. Taraporewala IB. Thiazolo[5,4-b]acridines and thiazolo[4,5-b]acridines: probable pharmacophores of antiviral and anti-tumor marine alkaloids. Tetrahedron Lett Cheminform 1991; (32):39-42. [ Links ]
9. Korth C, May BCH, Cohen FE, Prusiner SB. Acridine and phenothiazine derivatives as pharmacotherapeutics for prion disease. Proc Natl Acad Sci USA 2001; (98):9836-9841. [ Links ]
10. May BCH, Fafarman AT, Hong SB, Rogers M, Deady LW, Prusiner SB, Cohen FE. Potent inhibition of scrapie prion replication in cultured cells by bis-acridines. Proc Natl Acad Sci USA 2003; (100):3416 -3421. [ Links ]
11. Kavitha HP. Synthesis and Antimicrobial Activity of 1-(9'-Acridinyl)- 5-(4-Substituted Phenyl) Tetrazoles. Asian J Chem 2004; (16):1191-1193. [ Links ]
12. Sondhi SM, Johar M, Singh N, Shukla R, Raghubir R, Dastidar SG. Synthesis of sulpha drug acridine derivatives and their evaluation for anti-inflammatory, analgesic and anticancer activity. Indian J Chem 2002; (41)B:2659-2666. [ Links ]
13. Lasnitzki I, Wilkinson. The effect of acridine derivatives on growth and mitosis of cells in vitro. J H Brit J Cancer 1948; (2):369-375. [ Links ]
14. Le Pecq JB, Le Bret M, Barbet J, Roques B. DNA polyintercalating drugs: DNA binding of diacridine derivatives. Proc Natl Acad Sci USA 1975; (8): 2915-2919. [ Links ]
15. a) Wallace D. The use of quinacrine (Atabrine) in rheumatic diseases: A reexamination. J Semin Arthritis Rheum 1989; (18):282-296. b) [ Links ]
Korth C, May BC, Cohen FE, Prusiner, SB. Acridine and phenothiazine derivatives as pharmacotherapeutics for prion disease. Proc Natl Acad Sci USA 2001; (98):9836-9841. [ Links ]
c) Krauth-Siegel RI, Bauer H, Schirmer RH. Dithiol Proteins as Guardians of the Intracellular Redox Milieu in Parasites: Old and New Drug Targets in Trypanosomes and Malaria-Causing Plasmodia Angew. Chem Int Ed 2005; (44):690-715 [ Links ]
d) Marquis, JK. Pharmacological significance of acetylcholinesterase inhibition by tetrahydroaminoa-cridine. Biochem Pharmacol 1990; (40): 10711076. [ Links ] e) Freeman SE, Dawson RM. Tacrine: a pharmacological review. Prog Neurobiol 1991; (36):257-277. [ Links ]
16. a) Denny WA. In small molecules DNA and RNA Binders (Demeunynck M, Bailly C, Wilson WD, Eds.). Weinheim: Wiley-VCH Verlag GmbH & Co; 2003. p. 482-502. [ Links ] b) Brown BR, Firth WJ, Yielding LW. Mutant. Res Fund Mol Mechn Mutagen 1980; (72): 373-388. [ Links ]
17. Carlson CB, Stephens OM, Beal PA. Recognition of double-stranded RNA by proteins and small molecules. Biopolymers 2003; (70):86-102. [ Links ]
18. Sebestik J, Stibor I, Hlavcek J. New Peptide Conjugates with 9-Aminoacridine: Synthesis and Binding to DNA. J Pept Sci 2006; (12):472-480. [ Links ]
19. Carlson CB, Beal PA. Point of attachment and sequence of immobilized Peptide-acridine conjugates control affinity for nucleic acids. J Am Chem Soc 2002;( 124):8510-8511. [ Links ]
20. SPARTAN '08 build 132. Wavefunction Developers: B.J. Deppmeier, A.J. Driessen, T.S. Hehre, W.J. Hehre, J.A. Johnson, P.E. Klunzinger, J.M. Leonard, I.N. Pham W.J. Pietro, Jianguo Yu. Q-Chem Developers: Y. Shao, L. Fusti-Molnar, Y. Jung, J. Kussmann, C. Ochsenfeld, S. T. Brown, A. T. B. Gilbert, L. V. Slipchenko,S. V. Levchenko, D. P. O'Neill, R. A. DiStasio Jr., R. C. Lochan, T. Wang, G. J. O. Beran, N. A. Besley, J. M., Herbert, C. Y. Lin, T. Van Voorhis, S. H. Chien, A. Sodt, R. P. Steele, V. A. Rassolov, P. E. Maslen, P. P. Korambath, R. D. Adamson, B. Austin, J. Baker, E. F. C. Byrd, H. Dachsel, R. J. Doerksen, A. Dreuw, B. D. Dunietz, A. D. Dutoi, T. R. Furlani,S. R. Gwaltney, A. Heyden, S. Hirata, C.-P. Hsu, G. Kedziora, R. Z. Khalliulin, P. Klunzinger, A. M. Lee, M. S. Lee, W. Liang, I. Lotan, N. Nair, B. Peters, E. I. Proynov, P. A. Pieniazek,Y. M. Rhee, J. Ritchie, E. Rosta, C. D. Sherrill, A. C. Simmonett, J. E. Subotnik, H. L. Woodcock III, W. Zhang, A. T. Bell, A. K. Chakraborty, D. M. Chipman, F. J. Keil, A. Warshel, W. J. Hehre, H. F. Schaefer III, J. Kong, A. I. Krylov, P. M. W. Gill, M. Head-Gordon, Wavefunction Inc. Irvine CA. Copyright © 1995 - 2009. [ Links ]
21. Gaussian 09, Revision A.02, M. J. Frisch, G. W. Trucks, H. B. Schlegel, G. E. Scuseria, M. A. Robb, J. R. Cheeseman, G. Scalmani, V. Barone, B. Mennucci, G. A. Petersson, H. Nakatsuji, M. Caricato, X. Li, H. P. Hratchian, A. F. Izmaylov, J. Bloino, G. Zheng, J. L. Sonnenberg, M. Hada, M. Ehara, K. Toyota, R. Fukuda, J. Hasegawa, M. Ishida, T. Nakajima, Y. Honda, O. Kitao, H. Nakai, T. Vreven, J. A. Montgomery, Jr., J. E. Peralta, F. Ogliaro, M. Bearpark, J. J. Heyd, E. Brothers, K. N. Kudin, V. N. Staroverov, R. Kobayashi, J. Normand, K. Raghavachari, A. Rendell, J. C. Burant, S. S. Iyengar, J. Tomasi, M. Cossi, N. Rega, J. M. Millam, M. Klene, J. E. Knox, J. B. Cross, V. Bakken, C. Adamo, J. Jaramillo, R. Gomperts, R. E. Stratmann, O. Yazyev, A. J. Austin, R. Cammi, C. Pomelli, J. W. Ochterski, R. L. Martin, K. Morokuma, V. G. Zakrzewski, G. A. Voth, P. Salvador, J. J. Dannenberg, S. Dapprich, A. D. Daniels, O. Farkas, J. B. Foresman, J. V. Ortiz, J. Cioslowski, and D. J. Fox. Gaussian, Inc., Wallingford CT; 2009. [ Links ]
22. Saito I, Nakamura T, Nakatani K, Yoshioka Y. Yamaguchi K, Sugiyama H. Mapping of the Hot Spots for DNA Damage by OneElectron Oxidation: Efficacy of GG Doublets and GGG Triplets as a Trap in Long-Range Hole Migration. J Am Chem Soc 1998; (120):12686-12687. [ Links ]
23. Prat F, Houk KN, Foote CS. Effect of Guanine Stacking on the Oxidation of 8-Oxoguanine in B-DNA. J Am Chem Soc 1998; (120):845-846. [ Links ]
24. Colson AO, Sevilla MD. Elucidation of Primary Radiation Damage in DNA through Application of Ab Initio Molecular Orbital Theory. Int J Radiat Biol 1995; (67):627-645. [ Links ]













