Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Salud Uninorte
On-line version ISSN 2011-7531
Salud, Barranquilla vol.30 no.2 Barranquilla May/Aug. 2014
Susceptibilidad antimicrobiana y genotipificación de Pseudomonas aeruginosa de pacientes con fibrosis quística y otras patologías en Cartagena (Colombia)
Antimicrobial susceptibility and genotypification of Pseudomonas aeruginosa from cystic fibrosis patients and other diseases in Cartagena (Colombia)
Javier A. Baena Del Valle1, Claudio J. Gómez Alegría2, Doris E. Gómez Camargo3
1 Facultad de Medicina, Universidad de Cartagena. Grupo de Investigación unimol, Cartagena (Colombia).
2 Facultad de Ciencias, Departamento de Farmacia, Universidad Nacional de Colombia. Grupo de Investigación unimol, Bogotá, D.C. (Colombia).
3 Facultad de Medicina, doctorado en Medicina Tropical, Universidad de Cartagena. Grupo de Investigación unimol, Cartagena (Colombia).
Correspondencia: Javier Baena. Av. calle 116 n° 9 - 16 Edificio Guadalair, Apto 705. Cel. 3008173129. jbaenad@hotmail.com.
Resumen
Objetivo: el objetivo de este estudio fue analizar el genotipo y susceptibilidad antimicrobiana de Pseudomonas aeruginosa de pacientes con fibrosis quística y otras patologías. Materiales y métodos: se analizaron 20 aislados de pacientes con fibrosis quística y 20 de pacientes con otras enfermedades por medio de la prueba de susceptibilidad antimicrobiana por microdilución en caldo y técnica del ADN polimorfo amplificado aleatorio. Resultados: se observó que los aislados de pacientes con fibrosis quística presentaron mayor resistencia (56 %) en comparación con aislados de pacientes sin fibrosis quística (25 %). Los antimicrobianos más efectivos en ambos grupos fueron cefepima, ceftriaxona y meropenem. Desde el punto de vista genotípico, se observa heterogeneidad entre las cepas de pacientes con fibrosis quística y dos grupos con cepas idénticas de origen hospitalario, lo que sugiere una posible transmisión cruzada.
Conclusión: Concluimos que los porcentajes de resistencia de Pseudomonas aeruginosa en este estudio son altas, y este hallazgo se acentúa en el caso de pacientes con fibrosis quística, lo cual deja muy pocas opciones de tratamiento. La tipificación por técnica del ADN polimórfico amplificado aleatorio permitió conocer la variabilidad de genotipos para tener control sobre la transmisión de cepas, lo cual constituye un tópico de importancia en el sistema de salud y el mejoramiento de la calidad de vida de los pacientes.
Palabras clave: Pseudomonas aeruginosa, técnica del ADN polimórfico amplificado aleatorio, fibrosis quística, pruebas antimicrobianas de difusión por disco, plásmidos.
Abstract
Objective: Our aim was to analyze genotype and antimicrobial susceptibility of Pseudo-monas aeruginosa from cystic fibrosis patients and other diseases. Materials and methods: We analyzed 20 isolates from cystic fibrosis patients and 20 from patients with other diseases by dilution antimicrobial susceptibility test and random amplified polymorphic DNA technique.
Results: We found that isolates from cystic fibrosis patients had higher resistance (56 %) than isolates from patients without cystic fibrosis (26 %). The most effective antimicrobi-als in both groups were cefepime, ceftriaxone and meropenem. With regard to the geno-type, we observed heterogeneity between strains from cystic fibrosis patients and two clus-ters with identical strains from hospital origin, suggesting a possible cross transmission. Conclusion: We concluded that the resistance rate of Pseudomonas aeruginosa in this study was high and this finding is accentuated in patients with cystic fibrosis, leaving few treatment options. Typification by random amplified polymorphic DNA technique allowed us to know the variability of genotypes to control strain transmission; this is an important topic to optimize health services and the quality of life of our patients.
Key words: Pseudomonas aeruginosa, random amplified polymorphic DNA technique, cystic fibrosis, disk diffusion antimicrobial tests, plasmids.
Introducción
La fibrosis quística (FQ) es una enfermedad hereditaria autosómica recesiva causada por mutaciones en el gen CFTR (Regulador de la Conductancia Transmembrana de la Fibrosis Quística) que causan defectos severos en el transporte transepitelial del ión cloruro, lo cual afecta la composición del moco, secreciones glandulares y depuración mucociliar; esto resulta en una mayor predisposición a la colonización bacteriana de las vías aéreas que progresivamente lleva a exacerbaciones respiratorias ya un proceso inflamatorio crónico (1). Este padecimiento también se caracteriza por presentar otras anormalidades gastrointestinales y nutricionales que aumentan la morbilidad y mortalidad de los pacientes afectados (2).
La FQ afecta a más de 30 000 personas en Estados Unidos (3), y en Latinoamérica la incidencia varía debido a la heterogenicidad étnica; se han encontrado valores significativos como 1/3.900 y otros considerablemente bajos de 1/8.500 (4, 5). El microorganismo más frecuentemente aislado en las secreciones respiratorias de pacientes con FQ es Pseudomonas aeruginosa, el cual coloniza las vías aéreas en el 30% de los niños entre dos y cinco años y en el 80 % de los adultos con FQ (6 - 8), asociándose con deterioro y reducción de la función pulmonar, que finalmente conduce a fallo respiratorio y muerte del paciente (9, 10).
Las primeras cepas que colonizan las vías aéreas de pacientes con FQ son similares a las encontradas en otras partes del organismo y en el ambiente, pero el deterioro pulmonar progresivo va acompañado de un proceso adaptativo que promueve la conversión hacia cepas mucoides, caracterizadas por su producción de alginato. Las consecuencias de este proceso son el establecimiento de la colonización pulmonar, formación de biopelículas de microcolonias, reducción de la susceptibilidad a los antimicrobianos y desarrollo de una infección pulmonar crónica (1, 11, 12).
Esta bacteria rara vez causa infecciones serias en pacientes sanos, y aun patologías diferentes a FQ, como infecciones de vías urinarias, infecciones de heridas cutáneas y del tracto gastrointestinal, son más fáciles de erradicar y la resistencia antimicrobiana no es tan elevada como en el caso de pacientes con FQ infectados de forma crónica (13, 14).
En los últimos años se ha observado un gran aumento en la resistencia de P. aeruginosa a los antibióticos comúnmente usados en pacientes con FQ (15, 16). En Colombia se han realizado algunos estudios de susceptibilidad antimicrobiana y serotipificación de aislados de P. aeruginosa en diferentes servicios hospitalarios; algunos de estos han reportado un creciente aumento de la resistencia antimicrobiana a quinolonas y algunas cefalosporinas (17 - 20). Sin embargo, en Colombia no se han realizado estudios de P. aeruginosa aisladas de pacientes con FQ con el fin de conocer las características genotípicas que determinan su virulencia y multirresistencia en este grupo de pacientes (21, 22).
La infección crónica producida por P. aeru-ginosa en pacientes con FQ también está determinada por el desarrollo y selección de cepas con altas tasas de mutaciones que le permiten adaptarse al ambiente complejo y exigente presente en los pulmones de pacientes con FQ. La heterogeneidad de este hábitat es ejercida por la acción leucocitaria, tejido pulmonar en deterioro y tratamientos antimicrobianos realizados durante muchos años. La presencia constante de estas cepas representa una gran preocupación en el abordaje médico de este tipo de pacientes porque son más resistentes a los antimicrobianos, y es muy probable que sean resistentes incluso a nuevos fármacos en diseño (21, 22).
La relación epidemiológica entre cepas de P. aeruginosa de pacientes con FQ ha sido ampliamente estudiada y depende del tipo de tratamiento que reciben los pacientes y el contacto con otros pacientes con la misma condición (23, 24). Algunos reportes en los que se utilizaron técnicas de genotipificación molecular han mostrado la frecuente presencia de cepas transmisibles de P. aeruginosa entre pacientes con FQ que asisten al mismo centro de salud o que guardan alguna relación entre sí (25 - 28). Estos clones podrían ser más virulentos y empeorar el pronóstico de los pacientes (25 - 28), mientras que en otros estudios se ha encontrado que los pacientes están colonizados por clones únicos diferentes entre sí que han sido adquiridos en etapas tempranas de la enfermedad (29, 30).
El objetivo de nuestro estudio fue determinar la susceptibilidad antimicrobiana y conocer los patrones moleculares obtenidos mediante el método de la reacción en cadena de la polimerasa de ADN polimórfico amplificado aleatoriamente (RAPD -PCR) de muestras de P. aeruginosa aisladas de pacientes con FQ y pacientes con otras entidades clínicas diferentes a FQ en la ciudad de Cartagena de Indias (Colombia).
Materiales y métodos
Obtención y procesamiento de muestras:
el proceso de recolección de muestras se desarrolló en la ciudad de Cartagena de Indias entre 2008 y 2009, donde se recolectaron 20 muestras de esputo, previo enjuague oral con agua potable, de pacientes con FQ pertenecientes al Programa de "Atención Integral del Paciente con Fibrosis Quística y su Familia", coordinado por el grupo de investigación UNIMOL en la Facultad de Medicina de la Universidad de Cartagena. Adicionalmente se registraron datos de filiación y tipo de colonización de los pacientes. Se seleccionaron además 20 aislados positivos para P. aeruginosa provenientes de cultivos realizados a pacientes hospitalizados con entidades no-FQ en el Hospital Naval de Cartagena, Clínica Madre Bernarda y Hospital Universitario del Caribe (Cartagena de Indias) que se recolectaron y almacenaron por un periodo de 3 meses.
Cultivo microbiológico e identificación:
El aislamiento e identificación de las poblaciones bacterianas se realizó en el Laboratorio de Investigaciones (Facultad de Medicina, Universidad de Cartagena, Cartagena de Indias, Colombia), en el cual se cultivaron las muestras en medios enriquecidos y selectivos, como Cetrimide, MacConkey, EMB y sangre (Oxoid, Hampshire, United Kingdom). Se efectuó incubación a 37°C por 24 horas, y se realizó la coloración respectiva (Gram), además de analizar las características fenotípicas de las colonias (color, olor, pigmentación y mucosidad, entre otras). Adicionalmente se sembraron placas de Agar Mueller - Hinton (Oxoid, Hampshire, United Kingdom), que se incubaron a 42°C por 48 horas y se realizó la prueba de oxidasa, confirmando la naturaleza de P. aeruginosa. En casos en los que el tipo de bacteria aislada no era claro, se permitió el crecimiento en agares específicos de Pseudomonas spp, como agares F y P (Oxoid, Hampshire, United Kingdom) y utilización del sistema API 20 NE (bioMérieux Vitek, Hazelwood Mo, EU) para confirmar la naturaleza del microorganismo. El cultivo se conservó en caldo LB (Luria Bertani Sigma-Aldrich, Allenton PA, EU) para posterior análisis y realización de nuestro estudio.
Análisis de sensibilidad antimicrobiana:
se realizaron pruebas de susceptibilidad antimicrobiana para todos los aislados utilizando el método de microdilución en caldo de acuerdo con las indicaciones del CLSI (31). Los siguientes antimicrobianos fueron ensayados: amikacina, cefepima, ceftriaxona, ciprofloxacina, gentamicina, meropenem y piperacilina/tazobactam (todos obtenidos de fuentes comerciales). Los puntos de corte para todos los antibióticos utilizados fueron de acuerdo con los criterios del CLSI (32). La concentración mínima inhibitoria (CMI) fue definida como la concentración de antibiótico más baja que inhibió el crecimiento visible de microorganismos. P. aeruginosa se consideró multirresistente si se encontraba resistencia a todos los antimicrobianos ensayados en al menos dos de las siguientes tres clases: betalactámicos (cefepima, ceftriaxona, meropenem, piperacilina/tazobactam), aminoglucósidos (amikacina, gentamicina) y quinolonas (ciprofloxacina) (33, 34).
Extracción de ADN bacteriano: para la obtención del ADN se siguió el método de CTAB (35). Las muestras fueron analizadas mediante electroforesis en geles de agarosa (figura 1) y se congelaron a -65°C, en un periodo máximo de 1 semana hasta su utilización en la RAPD-PCR.
Amplificación de ADN bacteriano por RAPD - PCR: la RAPD - PCR fue desarrollada en tubos de PCR de 200 uL (Simport, Beloeil Qc, Canada). Cada reacción estandarizada se llevó a cabo en un volumen final de 25 uL que contenía 100 ng de ADN molde, 7,5 pM de cebador, 200 uM de cada deoxinucleótido trifosfatado (dNTPs) (Invitrogen Brasil Ltda, Sao Paulo, Brasil), 0,5 U de Taq DNA polime-rasa recombinante (Invitrogen Brasil Ltda., Sao Paulo, Brasil) en un amortiguador que consistió en 20 mM Tris - HCl (pH 8,4), 50 mM KCl y 3mM MgCl2 (Invitrogen Brasil Ltda., Sao Paulo, Brasil). Todos los experimentos fueron realizados por duplicado. Para la identificación y tipificación molecular de los distintos aislados bacterianos se empleó el cebador aleatorio OPY - 2 (CATCGCCGCA) (Eurofins MWG Operon, Huntsville AL, EU).
Todas las reacciones de amplificación por PCR se realizaron en termociclador Genius (Techne Incorporated, Burlington NJ, EU). El programa de ciclos utilizado fue 94°C por cinco minutos, 36°C por cinco minutos y 72°C por cinco minutos (un ciclo), 94°C por 1 minuto, 36°C por 1 minuto y 72°C por 1 minuto (34 ciclos), finalmente 72°C por 10 minutos (un ciclo).
Los productos de reacción fueron analizados por electroforesis en gel de agarosa al 1 %. La separación se llevó a cabo a 80 voltios constantes por 90 minutos (temperatura ambiente) posteriormente las imágenes fueron digitalizadas y los patrones de bandas se analizaron graficando un dendrograma por medio de coeficientes de similitud de Jaccard, para lo cual se utilizó el software Biodiversity Pro Versión 2 (NHM & SAMS, Londres, UK.
Análisis estadístico: para el análisis estadístico de las variables se utilizó la prueba X2, considerando estadísticamente significativo un valor de p<0,05. Los cálculos se realizaron mediante el programa MedCalc versión 9,6,2,0 (MedCalc Software bvba, Mariakerke, Bélgica).
Aspectos éticos: este estudio fue aprobado por el Departamento de Investigaciones y el Comité de bioética de la Universidad de Cartagena. Todos los pacientes y padres de familia acudientes, en los casos necesarios, firmaron consentimiento informado previo a la recolección de datos y muestras.
Resultados
Origen de los aislados: se estudió un total de 40 aislados provenientes de 36 pacientes. De estos, 20 (50 %) eran procedentes de pacientes con FQ, cuya distribución y tipo de colonización se detallan en la tabla 1, y 20 (50 %) de cultivos de pacientes no-FQ (tabla 2).

Todas las cepas de pacientes con FQ fueron aisladas de esputo. La mayoría de los aislados de pacientes no-FQ fueron tomados de urocultivos (35 %), secreciones de quemaduras (15 %), exudados de heridas (10 %) y coprocultivos (10 %).
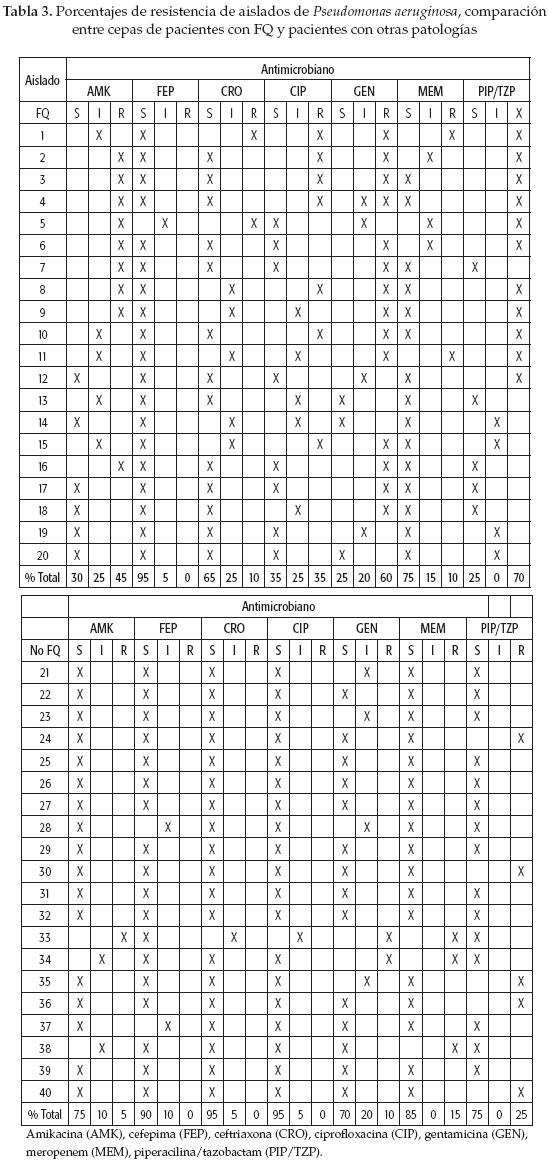
Sensibilidad antimicrobiana: los resultados de la resistencia a los antimicrobianos estudiados se detallan en la tabla 3. Los antibióticos más activos en los dos grupos fueron cefepima, cefriaxona y meropenem, con porcentajes de resistencia global <20 %; por otro lado, gentamicina (55 %), piperacilina/tazobactam (48 %) y amikacina (43 %) presentaron en general altos porcentajes de resistencia.
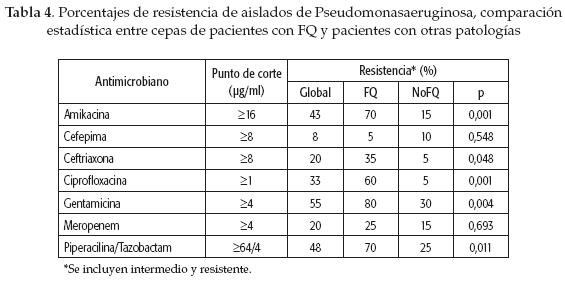
Los aislados provenientes de pacientes con FQ presentaron mayor resistencia antimicrobiana (56 %) que los de pacientes no-FQ (25 %). En este grupo, los porcentajes de resistencia a amikacina (70 %), ceftriaxona (35 %), ciprofloxacina (60 %), gentamicina (80 %) y piperacilina/tazobactam (70 %) fueron significativamente superiores (p <0,05) a los encontrados en pacientes no-FQ (15, 5, 5, 30 y 25 %, respectivamente) (tabla 4).
Del total de aislados provenientes de pacientes con FQ, el 50 % presentó un patrón de multirresistencia, y se encontró un solo caso de multirresistencia en los aislados de pacientes no-FQ.
Con respecto a la resistencia cruzada a los antimicrobianos, se observó que el 88 % de los aislados de pacientes con FQ resistentes a gentamicina lo fueron también a amikacina, y todos los aislados resistentes a piperacilina/ tazobactam fueron resistentes a meropenem y ciprofloxacina. En el grupo no-FQ, todos los aislados resistentes a gentamicina lo fueron también a amikacina y meropenem.
Análisis por RAPD - PCR: la figura 2 muestra los perfiles RADP obtenidos con el cebador OPY - 2, los cuales presentan de uno a quince fragmentos de ADN en cada carril de electro-foresis. El vínculo filogenético entre los aislados de P. aeruginosa obtenidos, incluyendo la cepa ATCC 15692, está expresado por medio de un dendrograma (figura 3).
El dendrograma obtenido por medio de coeficientes de Jaccard mostró dos grupos (grupo A y grupo B), que contienen a su vez subgrupos de 5 a 9 aislados que presentaron un perfil de RAPD - PCR similar utilizando un punto de corte arbitrario de 50 %.
Todos los aislados del grupo A provenían de pacientes no-FQ. El subgrupo A1 estuvo formado por un clúster A1.1 integrado por 6 aislados (29, 30, 31, 32, 33 y 34) que presentaron el mismo patrón electroforético (similitud 100 %); este clúster guardó similitud de 92 % con el aislado 35. Todas los aislados del subgrupo A1 provenían de diferentes pacientes de un mismo centro hospitalario. Por otro lado, el subgrupo A2, formado por los aislados 25 y 26, también presentó un patrón electroforético idéntico, pero estas muestras son originarias de un hospital diferente al del subgrupo A1.
El grupo B estuvo conformado por aislados de pacientes con FQ y presentó dos subgrupos con similitud de 54 % entre sí. El subgrupo B1 (aislados 6, 7, 8) tuvo el mismo patrón de RAPD; sus aislados pertenecen a niños con FQ sin ningún vínculo familiar, todos con colonización crónica por la bacteria y con servicios de atención médica independiente. El subgrupo B2 estuvo conformado por los aislados 5 y 9 con similitud de 70 %, también pertenecientes a adolescentes con FQ sin vínculos familiares y habitantes de localidades distintas.
Los aislados 3 y 4 corresponden a un mismo paciente; asimismo, los aislados 8, 14 y 15 pertenecen a un adolescente de 16 años de edad, y los aislados 16 y 17 también provienen de otro paciente; estas cepas presentaron patrones electroforéticos muy heterogéneos, con porcentajes de similitud bajos. Todos estos son pacientes con FQ, colonizados de forma crónica por Pseudomonas aeruginosa.
Discusión
Los pacientes con FQ son susceptibles a la colonización crónica del tracto respiratorio por Pseudomonas aeruginosa y progresivamente desarrollan una infección que lleva a una pérdida irreversible de la función pulmonar determinando la alta morbi - mortalidad de esta enfermedad (2, 36 - 38). Las cepas de P. aeruginosa que son aisladas de pacientes con FQ crónicamente colonizados tienen un patrón de susceptibilidad antimicrobiana y patrones de genotipificación diferentes a las cepas obtenidas del ambiente y de pacientes que no tienen esta enfermedad (39 - 41).
Los aislados de pacientes con enfermedades diferentes a FQ provinieron principalmente de orina (35 %), secreciones de quemaduras (15 %) y exudados de heridas (10 %); estos orígenes coinciden con los frecuentemente encontrados en otros estudios (42, 43).
En este estudio, los aislados de pacientes con FQ presentaron mayor resistencia antimicrobiana que los de pacientes no-FQ, con diferencia significativa en los porcentajes de resistencia de 5 de los 7 antimicrobianos ensayados. Este fenómeno ha sido ampliamente reportado; en el último sondeo nacional de resistencia antimicrobiana de P. aeruginosa en el Reino Unido se confirmó que las 98 cepas provenientes de pacientes con FQ eran notablemente más resistentes que las aisladas en muestras de diferente origen (43). Sin embargo, son necesarios estudios con un mayor número de aislados para identificar patrones de sensibilidad característicos de nuestro medio.
Todos los pacientes con FQ presentaron colonización crónica por P. aeruginosa desde temprana edad; esto podría estar relacionado con el aumento en la resistencia antimicrobiana vista en este estudio, sumado a otros factores, como presión selectiva por antibioticoterapia, tasa de mutaciones y mucosidad (1, 2, 9).
En general, el antimicrobiano más activo de la serie fue cefepima, con un porcentaje de resistencia de 8 %. En otros estudios este antimicrobiano ha presentado buenos porcentajes de sensibilidad, entre 80 y 90 % (44 - 46), y sigue siendo de gran valor en el tratamiento de exacerbaciones pulmonares en pacientes con FQ (47).
Ceftriaxona y meropenem también mostraron buena sensibilidad en ambos grupos (porcentaje de resistencia global de 20 %). Este último fármaco ha sido reportado como el más activo en estudios de sensibilidad antimicrobiana en algunos hospitales europeos (44, 48), y sigue conservando buena sensibilidad desde su introducción al mercado, según estudios realizados en varios países (46, 49). En ensayos con aislados de pacientes con FQ también se han observado buenos valores de susceptibilidad antimicrobiana sin cambios significativos a largo del tiempo (49, 50).
En el grupo de cepas de pacientes con FQ se observó elevada resistencia a ciprofloxacina (60 %), en comparación con el grupo No-FQ (5 %). En algunos lugares se ha evidenciado una disminución en la sensibilidad a este antimicrobiano debido a la frecuente utilización en este tipo de pacientes; a pesar de esto, los porcentajes de susceptibilidad antimicrobiana continúan siendo aceptables (49).
En nuestro estudio, amikacina fue más activa que gentamicina en ambos grupos, pero en general se observan elevados porcentajes de resistencia, especialmente en los aislados de pacientes con FQ. La sensibilidad a esta familia de antimicrobianos suele ser variable de acuerdo con la zona geográfica y los mecanismos de resistencia prevalentes en cada sitio (44). En un importante sondeo de resistencia antimicrobiana en Estados Unidos de América se reportó una disminución significativa en la sensibilidad a los aminoglúcosidos en aislados de P. aeruginosa en un período de 10 años (51), mientras que en otros estudios se mantienen bajos porcentajes de resistencia, especialmente a amikacina (42, 44, 52).
Con respecto a la resistencia cruzada entre los aminoglúcosidos utilizados en este estudio, observamos que el 80 % de los aislados del grupo FQ y todos los del grupo no-FQ que eran resistentes a gentamicina lo fueron también a amikacina; comúnmente se suele observar que aislados resistentes a gentami-cina conservan susceptibilidad a amikacina o a otro tipo de aminoglucósido (46).
La genotipificación de microorganismos como P. aeruginosa es de gran utilidad en la vigilancia epidemiológica de pacientes con FQ y control de brotes epidémicos a nivel hospitalario (53, 54). La RAPD - PCR y el análisis correspondiente asistido por computadora es una muy buena opción para estudiar este tipo de muestras por su poder discriminatorio y efectividad (55 - 57), lo que nos permitió tener conocimientos parciales sobre el vínculo genético existente entre cepas provenientes de pacientes con FQ y de pacientes no-FQ en Cartagena.
En este estudio observamos que seis pacientes (clúster A1.1) internados en un mismo hospital presentaron infecciones causadas por un mismo aislado de P. aeruginosa, la cual presentó un genotipo idéntico al ser analizado por RAPD - PCR (figuras 2 y 3). Este fenómeno también se evidenció en tres pacientes pertenecientes a otro centro hospitalario (subgrupo B1). El agrupamiento de aislados de diferentes pacientes por su similitud sugiere que han sido adquiridos por una fuente de infección común o son producto de una infección cruzada. Esto es un hallazgo de gran relevancia, pues P. aeruginosa es uno de los patógenos nosocomiales más frecuentes y virulentos, lo cual amerita que se deban tomar rigurosas medidas de higiene y prevención en la realización de procedimientos invasivos, diagnósticos y terapéuticos para evitar complicaciones a pacientes hospitalizados por diferentes condiciones clínicas (58 - 59).
En el caso de los pacientes con FQ, observamos heterogeneidad entre la mayoría de los aislados. Se encontró solo relación clonal en los aislados que integran el subgrupo B1 (6, 7, 8) y B2 (5 y 9); estas muestras fueron aisladas todas de diferentes pacientes sin ningún vínculo familiar que asisten a diferentes centros asistenciales de la ciudad y tienen terapistas independientes. Es probable que el aislado en común haya sido adquirido durante algún encuentro esporádico entre los pacientes o se trate de una cepa circulante proveniente de una fuente ambiental, como ha sido reportado anteriormente en otros estudios (27, 60, 61).
A pesar del riesgo de colonización cruzada entre pacientes con FQ, en la mayoría de los aislados estudiados se observa poca relación clonal, lo cual sugiere que la implementación de medidas para el control de la infección, como la segregación de pacientes y cuidadosas prácticas de higiene (36), están siendo puestas en práctica y deben seguirse realizando para limitar el riesgo de diseminación de este patógeno.
Con respecto a varios aislados provenientes de un mismo paciente con FQ, se encontró que sus patrones RAPD eran diferentes; esto contrasta con los hallazgos de algunos estudios de genotipificación en este tipo de pacientes, en los que al establecerse la colonización crónica por P. aeruginosa persiste la misma cepa, y por lo general conserva similitud clonal y estabilidad en el perfil de RAPD cuando se evalúan aislados obtenidos en diferentes periodos (53, 55). Estas variantes en aislados pertenecientes a un mismo paciente podrían ser explicadas por la complejidad genética de P. aeruginosa, cuyo genoma es frecuentemente descrito como una entidad con grandes re-arreglos genéticos en los que la adquisición y pérdida de segmentos de ADN son responsables de la diversidad genética entre las cepas. La flexibilidad genética de este microorganismo le permite adaptarse en un ambiente hostil como lo son las vías aéreas del paciente con FQ (60, 62, 63).
Este estudio presenta algunas limitaciones, como la no utilización de otros cebadores aleatorios en el experimento de RAPD - PCR, lo cual podría garantizar una genotipicación más detallada. Además de incorporar otros antibióticos de uso frecuente en pacientes con FQ.
El conocimiento de la susceptibilidad de P. aeruginosa a los agentes antimicrobianos no solo guía el tratamiento de pacientes infectados, sino que también ayuda a identificar la prevalencia de cepas resistentes en diferentes centros asistenciales. En países en desarrollo existen factores de riesgo que contribuyen al incremento de la resistencia antimicrobiana, como la falta de políticas y control en la formulación de antibióticos, inestabilidad en el sistema de salud y falta de reportes e investigaciones al respecto.
Conclusión
En conclusión, las tasas de resistencia de Pseudomonas aeruginosa en nuestro estudio fueron altas, y este hallazgo se acentúa en el caso de pacientes con FQ, lo cual deja pocas opciones de tratamiento, lo que obliga a los profesionales de salud a establecer un correcto y racional uso de antimicrobianos y a tomar medidas con el fin de evitar la transmisión cruzada y adaptación de la bacteria al pulmón del paciente con FQ. Es necesaria además la caracterización molecular de los mecanismos de resistencia de estas cepas con el fin mejorar el control de la infección y diseñar estudios dirigidos a la creación de fármacos efectivos. Por otro lado, la caracterización molecular de aislados de P. aeruginosa por medio de RAPD - PCR nos permitió conocer la variabilidad de genotipos entre los pacientes para tener control sobre la transmisión de cepas, lo cual es de gran utilidad para los centros de salud y el mejoramiento de la calidad de vida de los pacientes.
Agradecimientos
Agradecemos a Luis Veloza Cabrera y Melissa Arrieta Franco por participar en las jornadas de recolección de muestras, y a César Cantillo por el suministro de muestras clínicas para el aislamiento de Pseudomonas aeruginosa obtenidas de pacientes no-FQ. A la Universidad de Cartagena, Facultad de Medicina por la dotación de los laboratorios.
Financiación: propia del grupo de investigación y laboratorios de la Universidad de Cartagena.
Referencias
1. Govan JR, Deretic V. Microbial pathogene-sis in cystic fibrosis: mucoid Pseudomonas aeruginosa and Burkholderia cepacia. Mi-crobiol Rev 1996;60(3): 539-574. [ Links ]
2. Lyczak J, Cannon C, Pier G. Lung infections associated with cystic fibrosis. Clin Microbiol Rev 2002;15(2): 194-222. [ Links ]
3. O'Sullivan BP, Freedman SD. Cystic fibrosis. Lancet 2009;30: 373(9678): 1891-1904. [ Links ]
4. Pérez MM, Luna MC, Pivetta OH, Keyeux G. CFTR gene analysis in latin american CF patients: heterogeneous origin and distribu-tion of mutations across the continent. J Cyst Fibros 2007;6(3): 194-208. [ Links ]
5. World Health Organization. The Molecular Genetic Epidemiology of Cystic Fibrosis: Report of a Joint Meeting of WHO/ECFTN/ ICF(M)A/ECFS. Geneva, WHO; 2004. Disponible en URL: http://www.who.org/genomics. [ Links ]
6. Tramper-Stranders GA, van der Ent CK, Slieker MG, Terheggen-Lagro SW, Teding van Berkhout F, Kimpen JL et al. Diagnostic value of serological tests against Pseudomo-nas aeruginosa in a large cystic fibrosis population. Thorax 2006;61(8): 689-693. [ Links ]
7. Coutinho HD, Falcáo-Silva VS, Gonzalves GF. Pulmonary bacterial pathogens in cystic fibrosis patients and antibiotic therapy: a tool for the health workers. Int Arch Med 2008;1(1): 24. [ Links ]
8. Li Z, Kosorok MR, Farrell PM, Laxova A, West SE, Green CG et al. Longitudinal de-velopment of mucoid Pseudomonas aeru-ginosa infection and lung disease progres-sion in children with cystic fibrosis. JAMA 2005;293(5):581-588. [ Links ]
9. Heijerman H. Infection and inflammation in cystic fibrosis: a short review. J Cyst Fibros 2005; 4 Supl 2: 3-5. [ Links ]
10. Van Daele SG, Franckx H, Verhelst R, Schelstraete P, Haerynck F, Van Simaey L et al. Epidemiology of Pseudomonas aeruginosa in a cystic fibrosis rehabilitation centre. Eur Respir J 2005 25(3): 474-481. [ Links ]
11. Oliver A, Mena MD, Maciá. Evolution of Pseudomonas aeruginosa pathogenicity: from acute to chronic infections. En: Baque-ro F, Nombela C, Cassell GH, Gutiérrez JA, editores. Evolutionary biology of bacterial and fungal pathogens. Washington, D.C: ASM Press; 2008. [ Links ]
12. Anwar H, Strap JL, Costerton JW. Establish-ment of aging biofilms: possible mechanism of bacterial resistance to antimicrobial thera-py. Antimicrob Agents Chemother 1992;36(7): 1347-1351. [ Links ]
13. Foweraker J. Recent advances in the micro-biology of respiratory tract infection in cys-tic fibrosis. Br Med Bull 2009;89: 93-110. [ Links ]
14. Foweraker JE, Laughton CR, Brown DF, Bil-ton D. Phenotypic variability of Pseudomo-nas aeruginosa in sputa from patients with acute infective exacerbation of cystic fibro-sis and its impact on the validity of antimi-crobial susceptibility testing. J Antimicrob Chemother 2005;55(6): 921-927. [ Links ]
15. Conway SP, Brownlee KG, Denton M, Pec-kham DG. Antibiotic treatment of multi-drug-resistant organisms in cystic fibrosis. Am J Respir Med 2003;2(4): 321-332. [ Links ]
16. Lambiase A, Raia V, Del Pezzo M, Sepe A, Carnovale V, Rossano F. Microbiology of airway disease in a cohort of patients with cystic fibrosis. BMC Infect Dis 2006;11: 6-4. [ Links ]
17. Leal AL, Eslava-Schmalbach J, Alvarez C, Buitrago G, Méndez M; Grupo para el Control de la Resistencia Bacteriana en Bogotá. Canales endémicos y marcadores de resistencia bacteriana en instituciones de tercer nivel de Bogotá, Colombia. Rev Salud Pública (Bogotá) 2006;8 Supl 1: 59-70. [ Links ]
18. Álvarez C, Cortés J, Arango A, Correa C, Leal A. Grupo para el Control de la Resistencia Bacteriana en Bogotá. Anti-microbial resistance in intensive care units in Bogotá, Colombia, 2001-2003. Rev Salud Pública (Bogotá) 2006;8 Supl 1: 86-101. [ Links ]
19. Rodríguez B, Vásquez E, Sussmann O, Máttar S, Jaramillo CA. Antimicrobial sus-ceptibility and serotyping of Pseudomo-nas aeruginosa strains isolated in Bogotá, Columbia. Eur J Clin Microbiol Infect Dis 2000;19(2): 152-154. [ Links ]
20. Moreno CA, Rosenthal VD, Olarte N, Gómez WV, Sussmann O, Agudelo JG et al. Device-associated infection rate and mortality in intensive care units of 9 Colombian hos-pitals: findings of the International Nosocomial Infection Control Consortium. Infect Control Hosp Epidemiol 2006;27(4): 349-356. [ Links ]
21. Maciá MD, Blanquer D, Togores B, Saule-da J, Pérez JL, Oliver A. Hypermutation is a key factor in development of multiple-antimicrobial resistance in Pseudomonas aeruginosa strains causing chronic lung infections. Antimicrob Agents Chemother 2005;49(8): 3382-3386. [ Links ]
22. Oliver A, Cantón R, Campo P, Baquero F, Blázquez J. High frequency of hypermuta-ble Pseudomonas aeruginosa in cystic fibrosis lung infection. Science 2000;288(5469): 1251-1254. [ Links ]
23. Jelsbak L, Johansen HK, Frost AL, Th0ger-sen R, Thomsen LE, Ciofu O et al. Molecular epidemiology and dynamics of Pseudomo-nas aeruginosa populations in lungs of cys-tic fibrosis patients. Infect Immun 2007;75(5): 2214-2224. [ Links ]
24. McCallum SJ, Gallagher MJ, Corkill JE, Hart CA, Ledson MJ, Walshaw MJ. Spread of an epidemic Pseudomonas aeruginosa strain from a patient with cystic fibrosis (CF) to non-CF relatives. Thorax 2002;57(6): 559-560. [ Links ]
25. Anthony M, Rose B, Pegler MB, Elkins M, Service H, Thamotharampillai K et al. Ge-netic analysis of Pseudomonas aeruginosa isolates from the sputa of Australian adult cystic fibrosis patients. J Clin Microbiol 2002; 40(8): 2772-2778. [ Links ]
26. Armstrong DS, Nixon GM, Carzino R, Bigham A, Carlin JB, Robins-Browne RM et al. Detection of a widespread clone of Pseudomonas aeruginosa in a pediatric cys-tic fibrosis clinic. Am J Respir Crit Care Med 2002;166(7): 983-937. [ Links ]
27. Ojeniyi B, Frederiksen B, Hoiby N. Pseudo-monas aeruginosa cross-infection among patients with cystic fibrosis during a winter camp. Pediatr Pulmonol 2000;29(3): 177-181. [ Links ]
28. Picard E, Aviram M, Yahav Y, Rivlin J, Blau H, Bentur L et al. Familial concordance of phenotype and microbial variation among siblings with CF. Pediatr Pulmonol 2004;38(4): 292-297. [ Links ]
29. Schmid J, Ling LJ, Leung JL, Zhang N, Kol-be J, Wesley AW et al. Pseudomonas aeru-ginosa transmission is infrequent in New Zealand cystic fibrosis clinics. Eur Respir J 2008;32(6): 1583-90 [ Links ]
30. Greenberg D, Yagupsky P, Peled N, Gol-dbart A, Porat N, Tal A. Lack of evidence of transmission of Pseudomonas aerugino-sa among cystic fibrosis patients attending health camps at the Dead Sea, Israel. Isr Med Assoc J 2004; 6(9): 531-534. [ Links ]
31. Clinical and Laboratory Standards Institute (CLSI). Methods for dilution antimicrobial sus-ceptibility tests for bacteria that grow aerobica-lly; Approved Standard (M07-A8). 8a ed. Way-ne (PA): Clinical and Laboratory Standards Institute (CLSI); 2009. P. 1 -88. [ Links ]
32. Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; Nineteenth informational supplement (M100-S19). 9& ed. Wayne (PA): Clinical and Laboratory Standards Institute (CLSI); 2009. P. 1 -156. [ Links ]
33. Hill D, Rose B, Pajkos A, Robinson M, Bye P, Bell S et al. tic susceptabilities of Pseu-domonas aeruginosa isolates derived from patients with cystic fibrosis under aerobic, anaerobic, and biofilm conditions. J Clin Mi-crobiol 2005;43(10): 5085-5090. [ Links ]
34. Cystic Fibrosis Foundation. Consensus Con-ference. Microbiology and infectious diseases in cystic fibrosis, vol. V, sección 1. Bethesda (MD): Cystic Fibrosis Foundation; 1994. [ Links ]
35. Wilson K. Preparation of Genomic DNA from Bacteria. En: Ausubel FM, Brent R, Kingston RE, Moore DD, Seidman JG, Smith JA, Struhl K, Eds. Current protocols in molecular biology, vol. 1. New York (NY): John Wi-ley & Sons; 1995. p. 241- 245. [ Links ]
36. Saiman L, Siegel J. Infection control in cystic fibrosis. Clin Microbiol 2004;17(1): 57-71. [ Links ]
37. Harrison F. Microbial ecology of the cystic fibrosis lung. Microbiology 2007;153(4): 917923. [ Links ]
38. Gibson RL, Burns JL, Ramsey BW. Pathophysiology and management of pulmonary infections in cystic fibrosis. Am J Respir Crit Care Med 2003;168(8): 918-951. [ Links ]
39. Lanotte P, Watt S, Mereghetti L, Dartigue-longue N, Rastegar-Lari A, Goudeau A et al. Genetic features of Pseudomonas aeruginosa isolates from cystic fibrosis patients compared with those of isolates from other origins. J Med Microbiol 2004;53(1): 73-81. [ Links ]
40. Tümmler B, Bosshammer J, Breitenstein S, Brockhausen I, Gudowius P, Herrmann C, et al. Infections with Pseudomonas aeruginosa in patients with cystic fibrosis. Behring Inst Mitt 1997;98: 249-255. [ Links ]
41. Tümmler B, Koopmann U, Grothues D, Weissbrodt H, Steinkamp G, von der Hardt H. Nosocomial acquisition of Pseudomonas aeruginosa by cystic fibrosis patients. J Clin Microbiol 1991;29(6): 1265-1267. [ Links ]
42. Guerrero C, Cesteros R, Miranda A, Mena-salvas A, Blázquez R, Segovia M. Sensibilidad a antimicrobianos de aislamientos clínicos de Pseudomonas aeruginosa en Murcia. Rev Esp Quimioter 2003;16(4): 444-449. [ Links ]
43. Henwood CJ, Livermore DM, James D, Warner M; Pseudomonas Study Group. An-timicrobial susceptibility of Pseudomonas aeruginosa: results of a UK survey and eva-luation of the British Society for Antimicrobial Chemotherapy disc susceptibility test. J Antimicrob Chemother 2001;47(6): 789-799. [ Links ]
44. Gamero Delgado MC, García-Mayorgas AD, Rodríguez F, Ibarra A, Casal M. Sensibilidad y resistencia de Pseudomonas aeru-ginosa a los antimicrobianos. Rev Esp Qui-mioter 2007;20(2): 230-233. [ Links ]
45. Lim KT, Yasin RM, Yeo CC, Puthucheary SD, Balan G, Maning N et al. Genetic fin-gerprinting and antimicrobial susceptibility profiles of Pseudomonas aeruginosa hospital isolates in Malaysia. J Microbiol Immunol Infect 2009;42(3): 197-209. [ Links ]
46. Raja NS, Singh NN. Antimicrobial suscepti-bility pattern of clinical isolates of Pseudo-monas aeruginosa in a tertiary care hospital. J Microbiol Immunol Infect 2007;40(1): 45-49. [ Links ]
47. Christenson JC, Korgenski EK, Daly JA. In vitro activity of meropenem, imipenem, ce-fepime and ceftazidime against Pseudomo-nas aeruginosa isolates from cystic fibrosis patients. Antimicrob Chemother 2000;45(6):899-901. [ Links ]
48. Cobo Martínez F, Bermúdez Ruiz P, Manchado Mañas P. Situación actual de la resistencia de Pseudomonas aeruginosa a los antimicrobianos. Rev Esp Quimioter 2003;16(4):450-452. [ Links ]
49. Manno G, Cruciani M, Romano L, Scapolan S, Mentasti M, Lorini R, Minicucci L. Anti-microbial use and Pseudomonas aeruginosa susceptibility profile in a cystic fibrosis centre. Int J Antimicrob Agents 2005;25(3): 193197. [ Links ]
50. Hill D, Rose B, Pajkos A, Robinson M, Bye P, Bell S et al. Antibiotic susceptabilities of Pseudomonas aeruginosa isolates derived from patients with cystic fibrosis under ae-robic, anaerobic, and biofilm conditions. J Clin Microbiol 2005;43(10): 5085-5090. [ Links ]
51. Obritsch MD, Fish DN, MacLaren R, Jung R. National surveillance of antimicrobial resis-tance in Pseudomonas aeruginosa isolates obtained from intensive care unit patients from 1993 to 2002. Antimicrob Agents Che-mother 2004;48(12): 4606-4610. [ Links ]
52. Blandino G, Marchese A, Ardito F, Fadda G, Fontana R, Lo Cascio G et al. Antimicro-bial susceptibility profiles of Pseudomonas aeruginosa and Staphylococcus aureus iso-lated in Italy from patients with hospital-acquired infections. Int J Antimicrob Agents 2004;24(5): 515-518. [ Links ]
53. Iglesias NG, Marengo JM, Rentería F, Gatti B, Segal E, Semorile L. Tipificación molecular de aislamientos de Pseudomonas aeru-ginosa obtenidos de pacientes con fibrosis quística. Rev Argent Microbiol 2008;40(1): 3-8. [ Links ]
54. Struelens MJ. Molecular epidemiologic ty-ping systems of bacterial pathogens: current issues and perspectives. Mem Inst Oswaldo Cruz 1998;93(5): 581-585. [ Links ]
55. Mahenthiralingam E, Campbell ME, Fos-ter J, Lam JS, Speert DP. Random amplified polymorphic DNA typing of Pseudomonas aeruginosa isolates recovered from pa-tients with cystic fibrosis. J Clin Microbiol 1996;34(5): 1129-1135. [ Links ]
56. Kersulyte D, Struelens MJ, Deplano A, Berg DE. Comparison of arbitrarily primed PCR and macrorestriction (pulsed-field gel elec-trophoresis) typing of Pseudomonas aeruginosa strains from cystic fibrosis patients. J Clin Microbiol 1995;33(8): 2216-2219. [ Links ]
57. Speijer H, Savelkoul PH, Bonten MJ, Stob-beringh EE, Tjhie JH. Application of diffe-rent genotyping methods for Pseudomo-nas aeruginosa in a setting of endemicity in an intensive care unit. J Clin Microbiol 1999;37(11): 3654-3661. [ Links ]
58. Barnini S, Dodi C, Campa M. Enhanced re-solution of random amplified polymorphic DNA genotyping of Pseudomonas aerugi-nosa. Lett Appl Microbiol 2004;39(3): 274-277. [ Links ]
59. Bertrand X, Thouverez M, Patry C, Balvay P, Talon D. Pseudomonas aeruginosa: anti-biotic susceptibility and genotypic characte-rization of strains isolated in the intensive care unit. Clin Microbiol Infect 2001;7(12): 706-708. [ Links ]
60. Leone I, Chirillo MG, Raso T, Zucca M, Savoia D. Phenotypic and genotypic charac-terization of Pseudomonas aeruginosa from cystic fibrosis patients. Eur J Clin Microbiol Infect Dis 2008;27(11): 1093-1099. [ Links ]
61. Sener B, Kóseoglu O, Oz^elik U, Kocagóz T, Günalp A. Epidemiology of chronic Pseudomonas aeruginosa infections in cystic fibrosis. Int J Med Microbiol 2001;291(5): 387-393. [ Links ]
62. Finnan S, Morrissey JP, O'Gara F, Boyd EF. Genome diversity of Pseudomonas aeru-ginosa isolates from cystic fibrosis patients and the hospital environment. J Clin Micro-biol 2004;42(12): 5783-5792. [ Links ]
63. Rómling U, Schmidt KD, Tümmler B. Lar-ge genome rearrangements discovered by the detailed analysis of 21 Pseudomonas aeruginosa clone C isolates found in envi-ronment and disease habitats. J Mol Biol 1997;271(3): 386-404. [ Links ]