Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Salud Uninorte
Print version ISSN 0120-5552On-line version ISSN 2011-7531
Salud, Barranquilla vol.32 no.1 Barranquilla Jan./Apr. 2016
https://doi.org/10.14482/sun.32.1.8479
http://dx.doi.org/10.14482/sun.32.1.8479
Leptospira spp. y leptospirosis humana*
Leptospira spp. and human leptospirosis
Claudia M. Romero-Vivas1
Andrew K. Falconar2
1-2 Grupo de Investigaciones en Enfermedades Tropicales, Departamento de Medicina, Universidad del Norte. Barranquilla (Colombia).
Correspondencia: Claudia Romero-Vivas: Fundación Universidad del Norte, km 5, antigua vía a Puerto Colombia. Tel: (5) 3509478. Fax (5) 3509233. clromero@uninorte.edu.co
Fecha de recepción: 11 de agosto de 2015
Fecha de aceptación: 6 de noviembre de 2015
Resumen
La leptospirosis, la enfermedad bacteriana zoonótica y emergente más importante en el mundo, es causada por las especies patógenas de Leptospira spp. Han sido descritas veinte especies de Leptospira spp.; se ha determinado la secuencia del ADN genómico de algunas cepas patógenas; la función de la mayoría de los genes involucrados en su patogénesis permanece desconocida. La leptospirosis humana presenta un rango de síntomas que van desde una fiebre indiferenciada hasta una ictericia, hemorragia, fallas renales y pulmonares severas. La administración temprana e intravenosa de penicilina G es requerida para reducir las tasas de mortalidad, pero los antibióticos pueden no ser efectivos en la enfermedad pulmonar severa. En las Américas, las áreas de alto riesgo son Brasil, Centroamérica y el Caribe. En Colombia se han realizado pocos estudios. La prueba serológica de oro, la microaglutinación, tiene alta sesibilidad y especificidad cuando se usan baterías de serovariedades locales, pero es serogrupo específica. Las vacunas generan respuestas específicas para la serovariedad usada, pero no previenen la infección o trasmisión. Problemas en el diagnóstico de laboratorio de la leptospirosis conllevan a un subregistro en el número de casos; altas tasas de mortalidad asociadas a fallas renal y pulmonar son resultado de las dificultades en el manejo de los casos.
Palabras clave: Leptospira, clasificación, leptospirosis, epidemiología, presentación clínica, diagnóstico, tratamiento.
Abstract
Leptospirosis, the world's most important emerging bacterial zoonotic disease, is caused by pathogenic Leptospira species.
To review the latest information on Leptospira spp. and leptospirosis.
We reviewed PubMed indexed papers on leptospiral microbiology, epidemiology, clinicalhuman disease, diagnostics, treatment, and disease prevention (vaccines).
Twenty Leptospira species have been described and, although the genomic DNA sequences ofsome pathogenic Leptospira spp. strains have been determined, the functions of most genesinvolved in their pathogenicity remain unknown. Leptospirosis is displayed by a range ofsymptoms from undifferentiated fever to severe jaundice, hemorrhage, renal and pulmonary failures. Pulmonary disease has the highest mortalities. An early intravenous penicillin G therapies is urgently required to reduce the mortality rates, but antibiotic therapy may not be effective in severe pulmonary disease. In the Americas, the highest risk areas are Brazil, Central America and the Caribbean islands. Few studies have however been performed in Colombia. The "gold standard" serological assay, the microscopic agglutination test (MAT), has a high sensitive and specificity when used with appropriate panels of Leptospira spp. serovars and it is serogroup specific. Vaccines, are administered to animals to generate serovar-specific protective responses, but may not prevent infection or transmission. Problems in the laboratory based diagnostics of leptospirosis result in under-reporting of the number of disease cases; the high mortality rates associated with severe renal and pulmonary failures result from difficulties in case management.
Keywords: Leptospira, classification, leptospirosis, clinical presentation, diagnostics, epidemiology, treatment.
INTRODUCCIÓN
La leptospirosis humana, causada por especies patógenas del género Leptospira spp., es la enfermedad bacteriana zoonótica emergente de mayor importancia mundial, con altas incidencia en áreas urbanas y pobres de las zonas tropicales.
En esta revisión se presentan las características de la bacteria, los cambios recientes en la taxonomía genotípica y su asociación con la clasificación fenotípica. Por otro lado, se realiza una descripción de la epidemiología de la enfermedad, su presentación clínica, con énfasis en las Américas y Colombia, diagnóstico, tratamiento sugerido y limitaciones de su uso y prevención (vacunas).
Descripción de la bacteria
El género Leptospira, del griego leptos (delgado) y del latín spira (espiral), comprende bacterias móviles parecidas a sacacorchos y con forma de interrogación; tienen una longitud de 6-20 um y un diámetro de 0,1 um (1). Son bacterias aerobias obligadas que crecen a una temperatura óptima entre 28-30°C y en un medio con pH que oscila entre 7.2 y 7.6, enriquecido con vitaminas, cadenas largas de ácidos grasos y sales de amonio, siendo el medio líquido de cultivo Ellinghausen-McCullough-Johnson-Harris (EMJH) el más usado (1).
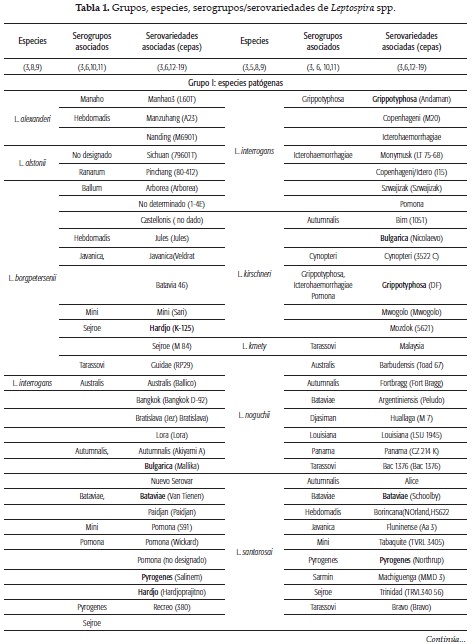
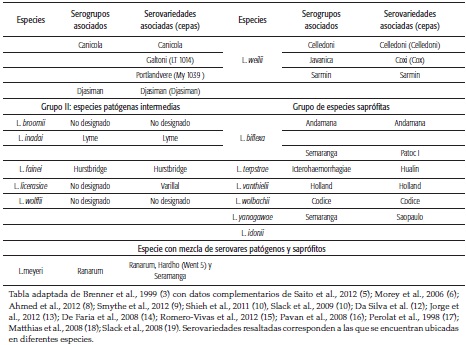
El género Leptospira junto con los géneros Leptonema y Turnerella pertenecen a la familia Leptospiracae del orden Spirochaetales, clase Spirochaetia y filo Spirochaetes (2). Antes de los años 80 este género comprendía las especies L. interrogans y L. biflexa, que se agrupaban en cepas patógenas aisladas de mamíferos y cepas saprófitas, aisladas de aguas frescas y suelos húmedos, respectivamente (3). La diferenciación entre estas dos especies se realizaba de forma fenotípica, basada en el crecimiento de leptospiras saprófitas a 13 °C y en presencia de 8-azaguanina (1). A partir de 1987 la clasificación de este género se basó en la homología del ADN medida por técnicas de hibridación (3,4), técnica estándar para la especiación del género Leptospira; sin embargo, la secuenciación del ARN ribosomal (ARNr) 16S ha sido igualmente usada para este propósito, además de la patogenicidad, virulencia y características de crecimiento in vitro. En la actualidad, el género Leptospira comprende 21 especies, divididas en dos grupos: el grupo infeccioso, dividido en Grupo I (9 especies patógenas) y Grupo II (5 especies patógenas intermedias) y el grupo no infeccioso, que incluye las no patógenas o saprófitas (6 especies, incluyendo la nueva especie L. idonii (5). Una especie adicional, L. meyeri, la componen serovares patógenos y saprófitos (5, 6, 7, 8, 9) (tabla 1).
El genoma de las leptospiras está distribuido en cromosomas circulares: uno grande, el cromosoma I, y otro pequeño, el cromosoma II; con un rango de longitud aproximado entre 3500-4300 y 300-350 kb, respectivamente (20, 21, 22). Las leptopiras saprófitas poseen además un tercer replicón circular denominado p74, que ha sido relacionado con su sobrevivencia (22).
La diferencia en el tamaño del genoma de la especie patógena L. interrogans serovar Copenhageni (4, 627, 366 pares de bases pb) (23) comparada con otra especie patógena, L. borgpetersenii serovar Hardjo (3,931,791 pb) (11), y con la especie saprófita L. biflexa serovar Patoc (3,956,088 pb) (22) reflejaría la información genética adicional requerida por L. interrogans para vivir tanto en el huésped mamífero como en condiciones de vida libre, mientras que la reducción en el tamaño del genoma de la especie L. borgpetersenii evidencia su evolución a un ciclo de trasmisión estricto de huésped a huésped (21).
Se sugiere que los 1,431 genes presentes solamente en las especies patógenas, ya sea en L. interrogans y/o L. borgpetersenii, podrían codificar proteínas asociadas a la virulencia; sin embargo, se desconoce la función en el 62,4 % (893) de ellos (22, 23).
El primer factor genético de virulencia reportado fue el gen de la lipoproteína de superficie Loa22, altamente conservado en las leptospiras patógenas y expresado en la fase aguda de la enfermedad. La pérdida de la expresión de este gen en una cepa mutante de L. interrogans resultó en la atenuación de su virulencia en cobayos y hamsters (24).
Se detectaron cinco genes codificadores de esfingomielinasas; entre ellos el gen sphA y sphH, que codifica la esfingomielinasa C y la SphH, respectivamente, las cuales tienen función de lisis celular de eritrocitos y contribuyen al daño del endotelio de pequeños vasos (25).
Entre los factores putativos de colonización del tejido del huésped están las adhesinas; se han identificado los genes lig (lig A y lig B), que codifican proteínas de superficie que contienen dominios parecidos a las inmunoglobulinas, las cuales se unen a la elastina, tropoelastina, laminina y fibronectina (26).
Genes que codifican proteínas de membrana parecidas a la endostatina humana (proteínas de la familia Len) se unen a la laminina, fibrinógeno y fibronectina (27) y el gen lipL32, que codifica la lipoproteína, que fue considerada de superficie pero que se ha demostrado está ubicada en la subsuperficie (28) LipL32<; esta lipoproteína está altamente conservada en leptospiras patógenas, se une al colágeno I, IV, V, laminina y a la fibronectina dependiente de calcio (29).
Otras proteínas potencialmente involucradas en la patogénesis de esta bacteria están siendo continuamente caracterizadas.
Las lipoproteínas son el mayor componente de la membrana externa de las leptospiras, la cual es rica en lipopolisacáridos (LPS) (30); variaciones en el antígeno O, componente de los LPS de superficie, determinan la diversidad antigénica en todas las especies de Leptospira (31). Mediante el uso de la prueba serológica de absorción de aglutinación cruzada, estas especies han sido categorizadas en serovariedades. La serovariedad, además de ser la unidad básica sistemática, tiene importancia epidemiológica por la asociación que pueda tener con una especie animal con la que haya desarrollado una relación comensal o levemente patógena (32).
Se cuenta con cepas de referencia de alrededor de 300 y 60 serovariedades de leptospiras patógenas/patógenas intermedias y saprófitas, respectivamente (33).
Las serovariedades que presentan aglutinación cruzada han sido agrupadas en 25 serogrupos, que si bien no tienen un valor taxonómico, poseen un valor práctico, ya que los serovares representativos de cada serogrupo son utilizados en la prueba serológica de referencia para el diagnóstico de leptospirosis denominada prueba de aglutinación microscópica (MAT), considerada serogrupo específica (32).
Serogrupos y serovariedades asociados a las 21 especies de Leptospira spp. se presentan en la tabla 1; como fuente de información se tuvo un estudio en el que se representan 228 serovariedades determinadas por la prueba de oro (prueba de absorción de aglutinación cruzada) y realizadas en 1999 (3) y los datos obtenidos de la tipificación a nivel de sero variedad por electroforesis de campo pulsado de 175 aislamientos enviados al Center for Disease Control durante 2000 a 2007 (34).
Epidemiología
Leptospira se ha encontrado infectando un amplio rango de huéspedes animales, especialmente mamíferos y algunos vertebrados de sangre fría (35).
Los reservorios o huéspedes de mantenimiento de las leptospiras son aquellas especies animales infectadas crónicamente en los túbulos renales proximales, a las cuales les causan poco o ningún daño.
Las ratas han sido identificadas como huéspedes de mantenimiento de las serovariedades Icterohaeomorrhagiae y Copenhageni; ratones de Arborea, Ballum y Bin; ganado vacuno de Pomona, Hardjo y Grippotyphosa; cerdos de Pomona, Tarassovi y Bratislava; perros de Canicola y marsupiales de Grippothyphosa (36, 37).
La identificación de huéspedes de mantenimiento y su asociación con las especies animales cobra importancia al estudiar la epidemiología de la trasmisión de la Leptospira spp. en una localidad, con el fin de direccionar las medidas de control.
Animales que actúan como huéspedes de mantenimiento de unas serovariedades pueden ser huéspedes accidentales de otras y sufrir la enfermedad. El humano es un huésped accidental y no se han reportado casos de infección de persona a persona; sin embargo, una excreción de la Leptospira spp. hasta seis semanas después de haberse recuperado de la infección fue reportada recientemente (26).
La leptospirosisi es una enfermedad zoonótica desatendida de origen bacteriano (38). Los factores de riesgo para la infección en humanos incluyen la exposición directa o indirecta a orina o ambientes contaminados con la bacteria, ya sea por actividades relacionadas con la ocupación (ganaderos, agricultores, granjeros, jardineros, carniceros), acuáticas recreacionales o por nivel socioeconómico (pobreza, deficiencia sanitaria (32).
La leptospirosis humana ha pasado de ser una enfermedad zoonótica rural olvidada a una enfermedad emergente, y se presentan epidemias en comunidades urbanas pobres de países en desarrollo asociadas a altas precipitaciones, calentamiento global, deficiencia sanitaria, altas infestaciones de roedoresy presencia de perros callejeros (39-42), que se convierten en un problema de salud pública, principalmente en las zonas tropicales del mundo (43, 44).
Leptospirosis humana
Las infecciones en humanos pueden ocurrir de forma asintomática, o cursar como una enfermedad aguda febril bifásica.
El período de incubación varía entre 2 y 30 días; la fiebre, normalmente de 39 °C, aparece de forma súbita con dolor de cabeza, malestar general y dolor muscular, especialmente en las áreas lumbares y pantorrillas, inyección de la conjuntiva y erupción cutánea; estos síntomas permanecen alrededor de una semana, y se ha detectado leptospiras en sangre.
La fase inmune ocurre en la segunda semana y se detectan anticuerpos en sangre y leptospiras en orina. La enfermedad se autolimita o presenta un segundo pico febril y cualquiera de las siguientes complicaciones: dolor muscular severo, ictericia, falla renal y hemorragias (síndrome de Weil); miocarditis con arritmias y la presentación de una cardiomiopatía (confirmada por aislamiento de la bacteria y por estudios histopatológicos) pueden ser confundidas con cardiopatías por enfermedad de Chagas, común en Latinoamérica (45, 46), meningitis/meningo-encefalitis y disfunciones neurológicas.
Daño y falla renal agudos ocurren hasta en un 87 % de los pacientes (47- 49), y pueden presentarse sin ictericia (50).
Las hemorragias pueden ocurrir como petequias, púrpura, hemorragia de la conjuntiva, hemorragia gastrointestinal y leptospirosis severa con hemorragia pulmonar (LSHP), siendo esta una de las formas severas menos conocidas de la leptospirosis, caracterizada por una hemorragia intraalveolar que puede llevar a una falla respiratoria aguda y puede presentarse en ausencia de ictericia.
La mortalidad por el síndrome de Weil y la LSHP puede alcanzar entre el 10 y el 50 %, respectivamente, y se estima una cifra superior a 500 000 casos severos anualmente (32, 36, 51, 52).
Leptospirosis en las Américas y el impacto de la leptospirosis severa con hemorragia pulmonar (LSHP)
Tres subregiones en las Américas han sido consideradas de alto riesgo para la presentación de brotes de leptospirosis humana, debido a sus características ambientales y humanas: la zona oriental de Brasil, con extensa deforestación, minifundios, migración urbana, ganadería; el Caribe, por su turismo, deforestación y migración urbana, y América Central, por problemas de deforestación y migración (53). Sin embargo, datos sobre la prevalencia de la enfermedad y los años de vida saludable perdidos por incapacidad no han sido estimados todavía, ya que esta enfermedad ha sido incluida progresivamente en la lista de enfermedades de notificación obligatoria en la mayoría de los países de la región a lo largo de la década 2000 - 2010 (consulta de los ministerios de salud de cada país de las Américas).
Según una revisión sobre la tendencia de la incidencia de la enfermedad en el mundo, 12 de los 20 primeros puestos corresponden a países de lasAméricas (ocho en Centroamérica), y Trinidad y Tobago, Barbados y Jamaica ocupan los primeros tres puestos de la región, con una incidencia anual por millón de 120,4, 100,3 y 78 casos, respectivamente (54).
La forma clínica más reconocida de la leptospirosis es la severa, que se presenta con ictericia, esplenomegalia y nefritis, comúnmente conocida como enfermedad de Weil, en honor a Adolf Weil, quien la describió por primera vez en 1886; sin embargo, su forma anictérica es la más frecuente, y se presentó en el 90-95 % de los casos (36).
Según datos divulgados por la Organización Mundial de la Salud (OMS), a través del reporte de la carga epidemiológica de la leptospirosis (55), se ha estimado que en el mundo la incidencia media anual de esta enfermedad es de cinco casos por 100 000 habitantes. África, Pacífico Occidental y las Américas son las regiones con las mayores incidencias medias, correspondiendo a 95,5, 66,4 y 12,5 casos por 100 000 habitantes, respectivamente. Otras fuentes reportan hasta 500 000 muertes anuales en el mundo (42).
Sin embargo, el comité de expertos de la OMS recomienda tomar con cautela estos datos, teniendo en cuenta el número limitado de estudios disponibles para la obtención de los mismos, y el hecho de que esta enfermedad presenta en áreas endémicas altos subregistros, ya que puede ser confundida con patologías de presentación clínica similar, como la influenza, la malaria, el dengue, la fiebre amarilla, el hantavirus, la rickettsiosis, la brucelosis, borreliosis, la hepatitis, la meningitis aséptica y la neumonía (32, 42).
La presentación clínica de las formas severas de enfermedad en las Américas ha sido documentada en su mayoría en Brasil, Perú y Nicaragua, en epidemias ocurridas después de eventos de inundación y predominantemente en áreas urbanas (tabla 2), con presentación de casos de LSHP y en menor número otras formas severas, siendo los hombres los más afectados en su edad adulta; se registra mortalidad a pesar de manejo agresivo con antibióticos y cuidados intensivos. La mayoría de las serovariedades pertenecen a L. interrogans serogrupo Icterohaemorrhagiae.
Los primeros casos de LSHP fueron reportados en Brasil (56) y en Nicaragua (1995) (57); en esta última, la LSHP se presentó con hemorragia pulmonar, hemoptisis y disnea pero sin ictericia ni manifestaciones renales, los pacientes habitaban zonas rurales y se aisló L. interrogans serovariedad Canicola.
En Perú (2003-2004), la LSHP se presentó con hemoptisis y no se reportaron casos clínicos típicos con síndrome de Weil; las serovariedades Icterohaeomorrhagiae y Canicola fueron aisladas (58).
En otros dos estudios realizados en áreas urbanas de Brasil se comparóla LSHP con otras formas severas en la ciudad de Salvador (2003-2005) (59) y la LSHP entre adultos y niños en Sao Paulo (2004-2006) (60).
En el primer estudio, el número de muertes, la hemoptisis y la oliguria fueron predominantes en el grupo de LSHP, y las diferencias con respecto al grupo que presentó otras formas severas fueron significativas. La ictericia y la trombocitopenia se presentaron con porcentajes similares en los dos grupos.
En el segundo estudio se encontró que la ictericia, oliguria y niveles altos de bilirrubina y creatinina (valores no mostrados en la tabla) y la muerte fueron estadísticamente más significativos en adultos que en niños (tabla 2).
La descripción de otras formas severas de leptospirosis humana en las Américas fue realizada en Salvador (Brasil) en 1996 (61), donde la ictericia, oliguria y una marcada trombocitopenia fueron los signos más característicos de esta epidemia, con aislamiento de L. interrogans serovariedad Copenhageni (tabla 2). Inicialmente esta epidemia fue confundida con dengue; sin embargo, la fiebre hemorrágica por Hantavirus, serotipo Seoul, tiene la misma presentación clínica, circula en áreas urbanas y sus reservorios Rattus rattus y R. norvegicus; esta etiología debe ser también incluida en el diagnóstico diferencial.
Los resultados de este trabajo y otro más reciente (62) han permitido concluir que un estado mental alterado, edad superior a 37 años, insuficiencia renal (oliguria) y respiratoria, trombocitopenia (< 70 000 plaquetas / uL), creatinina > 3 mg/dL son predictores de muerte en los casos severos de leptospirosis (61).
Leptospirosis humana en Colombia
El primer registro de leptospirosis humana severa fue reportado en 1966 (63), y la primera epidemia urbana de leptospirosis severa ocurrió en Barranquilla (Colombia) en 1995, durante un período de inundación; cuatro muertes fueron reportadas, y por la ténica de MAT, el serogrupo presuntivo de la epidemia fue el Icterohaemorrhagiae (64, 65).
Estudios de seroprevalencia han sido realizados con la técnica de MAT en sujetos sanos de diferentes áreas de Colombia, con seroprevalencias entre 12.0 % en Urabá (Antioquia) (66) hasta 23.3 % en Cali (67).
La caracterización clínica de la leptospirosis humana en Colombia ha sido realizada en pocos estudios; los datos de vigilancia rutinaria están disponibles apenas desde 2010. El número de casos de leptospirosis registrados en la vigilancia rutinaria del Sistema Nacional de Vigilancia en Salud Pública (Sivigila) aparece desde 2010 (http://www.ins.gov.co/lineasdeaccion/SubdireccionVigilancia/sivigila/Estadísticas)(68). Los entes territoriales con mayor número de casos preliminares reportados son Antioquia y Barranquilla para 2010; Valle y Antioquia para 2011 y Antioquia y Cesar para 2012 a la >semana 38 (68, 69, 70).
En general, las formas anictéricas son las predominantes, y la fiebre, cefalea, mialgias e ictericia son las presentaciones clínicas más frecuentes, y se pueden confundir con dengue; no se ha reportado casos de LSHP, y el serogrupo incriminado en la mayoría de los reportes ha sido el Icterohaemorrhagiae.
En un estudio realizado en el departamento del Atlántico (1999-2004), la prevalencia en humanos fue del 9,7 %, y los síntomas más frecuentes fueron fiebre, mialgias, cefalea e ictericia; el 8,6 % de estos casos presentaron síndrome de Weil, pero no se registraron muertes; la mayoría de los casos se presentaron en hombres; el serogrupo presuntivo predominante fue el Icterohaemorrhagiae (71).
En un segundo estudio realizado en Barranquilla (2007- 2009), la infección fue confirmada en un 12.5 %, la mayoría de los casos sin ictericia (87.5 %), y los síntomas más frecuentes fueron fiebre, cefalea, dolor ocular y náusea/vómito. El 6.3 % desarrolló daño hepático y un caso probable murió con síndrome de Weil. Los serogrupos presuntivos másfrecuentes fueron Australis, Sarmin, Icterohaemorrhagiae y Tarassovi (15).
En otro estudio realizado en Quindío (20052006) se confirmó la infección con Leptospira spp. en el 26.7 % de los casos sospechosos, en su mayoría adultos, y se reportaron 4 muertes relacionadas con alteraciones de la función hepática. Los síntomas más frecuentes fueron fiebre, mialgias, cefalea e ictericia; el serogrupo presuntivo circulante en esta población fue el Icterohaemorrhagiae (72).
Durante 2008 a 2012, 8,33 % (22/264) de los casos sospechosos provenientes de Pereira fueron confirmados por ELISA y MAT, predomiantemente en hombres que viven en áreas urbanas (91 %). De los casos confirmados, el 72 % fue hospitalizado, pero no se registró muertes. Los serogrupos presuntnivos fueron identificados como Australis, Icterohae-morrhagiae, Canicola, Panama, Pomona y Gryppothyphosa (73).
Diagnóstico en humanos
El diagnóstico diferencial de lepospirosis debe incluir enfermedades prevalentes de la localidad. Cuando se presenta una fiebre debe incluirse la malaria, riciketsias, infecciones por arbovirus (dengue, fiebre amarilla, etc.) y el virus de la influenza como posibles agentes etiológicos. En los casos en los que se presente complicación pulmonar debe diferenciarse de infecciones con dengue y hantavirus. Las formas hemorrágicas deben ser diferenciadas de otras fiebres hemorrágicas de origen viral o bacteriano. Sin embargo, en el diagnóstico diferencial, estas patologías son subregistradas o mal diagnosticadas debido a la carencia de laboratorios adecuadamente equipados y personal capacitado.
Se han documentado eventos de coinfecciones de leptospira-dengue, por lo que resultaría posible encontrar pacientes con coinfecciones.
Solo cinco casos de leptospirosis se han demostrado serológicamente en las infecciones con virus dengue (74-77), las cuales no fueron confirmadas por TR-PCR (Transcriptasa Reversa Reacción en Cadena de la Polimerasa) o aislamiento viral, por lo cual los serotipos del virus dengue no fueron identificados.
Diagnóstico serológico
El diagnóstico de las infecciones con Leptospira spp. es usualmente realizado con pruebas serológicas y por aislamiento. La prueba serológica de oro es la microaglutinación (MAT), vista con un microscopio de campo oscuro, en el que los anticuerpos de los sueros de los pacientes aglutinan leptospiras vivas de una batería de serovariedades de referencia (incluyendo idealmente serovariedades caracterizados de la localidad de donde provienen los pacientes) representantes de los principales serogrupos patógenos.
En esta prueba, un caso confirmado se define por la seroconversión o un incremento de cuatro veces o más en el título de anticuerpos de la muestra de la fase convaleciente, comparado con los títulos de la muestra de la fase aguda (36). En caso de disponer de muestras únicas, es un caso probable si el paciente tiene una presentación clínica compatible con la enfermedad y/o tiene un historial epidemiológico.
El punto de corte para los títulos de anticuerpos en la MAT se determina según el área de procedencia del paciente (no endémica o endémica), que varía entre 1>100 (no endémica) o >1:200 o 1:400 o 1:800 (endémica) (30).
El MAT puede ser negativo en muestras únicas colectadas en la fase aguda de la enfermedad o cuando no se disponen de las serovariedades locales. Esta prueba indica presuntivamente los serogrupos circulantes en la población, teniendo en cuenta que pueden ocurrir reacciones cruzadas entre ellos (32); adicionalmente se ha demostrado que el MAT no puede ser usado como predictor confiable de la serovariedad infectante (68).
Otros métodos serológicos incluyen la detección de igM por ELISA; generalmente negativo los cinco primeros días de la enfermedad. Esta prueba es generalmente positiva antes que el MAT (37).
Aislamiento
Otra prueba de oro es el aislamiento de la Leptospira spp. de muestras de sangre, líquido cefaloraquídeo o fluidos corporales durante los primeros 10 días de la enfermedad, o de muestras de orina en la fase inmune de la misma; estas muestras se inoculan en medio de cultivo (el más usado es el Ellinghausen-McCullough-Johnson -Harris (EMJH)), mantenidos a una temperatura entre 28-30 °C.
El crecimiento de las leptospiras es lento y puede tomar hasta cuatro meses; además del cocrecimiento de otras bacterias (37), que hacen a esta prueba insensible y no oportuna para el manejo del paciente.
La utilidad de esta prueba radica en que se puede tipificar el aislamiento obtenido a nivel de serovariedad y posteriormente ser usado en la batería diagnóstica de serovariedades. También es importante, desde el punto de vista de salud pública, porque sirve para identificar la fuente de infección animal, que es un aporte importante para enfocar apropiadas medidas de control.
Detección Directa
Por otro lado, la detección temprana de esta infección puede realizarse mediante la observación directa de la bacteria en las muestras biológicas, usando el microscopio de campo oscuro o mediante el uso de pruebas de reacción en cadena de la polimerasa (PCR).
La primera técnica ha demostrado tener baja sensibilidad y la fibrina en la sangre puede dar falsos positivos (36).
Se han desarrollado pruebas de PCR basados en el gen rrs (79) género específico o PCR, que detectan leptospiras patógenas, y amplificando el gen secY y flaB (80), el gen lipL32 (81) o gyrB (82).
La utilidad de la PCR radica en que permite una detección temprana de la leptospirosis, de modo que el paciente puede recibir una terapia con antibióticos de una manera oportuna; y si se trata de una RCP en tiempo real, aumenta la sensibilidad, detectando exitosa y rápidamente leptospiras en sangre y orina (81).
Comparación de pruebas
En una publicación de revisión (42) se compararon las pruebas diagnósticas más comúnmente usadas en términos de sensibilidad, costos, ventajas/desventajas, y se encontró que la prueba más sensible es la PCR en tiempo real (100 %); pero tiene la desventaja de ser la más costosa (hasta 100 euros), no haber sido ampliamente validada y requerir equipo especializado. La menos sensible fue el cultivo (5-50%), a pesar de ser económica (20 euros). La IgM ELISA comercial es la más costo- efectiva, con una sensibilidad >90 % y un valor entre 9 y 16 euros, pero con la desventaja que llega a ser positiva entre 7 y 10 días después de la presentación de los síntomas, lapso que resulta tardío para el inicio de la terapia con antibióticos.
Tipificación de aislamientos
Tradicionalmente la caracterización a nivel de serovariedad se realiza mediante el uso de la prueba de aglutinación absorción cruzada (1). Sin embargo, técnicas moleculares como la electroforesis de campo pulsado pueden identificar aislamientos de leptospira hasta el nivel de serovariedad e identificar nuevas serovariedades (34, 83, 84), como las tipificadas por primera vez en Colombia en los departamentos de Córdoba y Atlántico (85); con esta técnica, sin embargo, la serovariedad Icterohaemorrhagiae no puede ser diferenciada de la Copenhageni.
Otra técnica que puede identificar hasta el nivel de serovariedad es la repetición en tándem de número variable de multilocus (en inglés Multilocus variable-number tandemrepeat (MVNTR); pero tiene la desventaja de que requiere cebadores específicos para cada especie de Leptospira spp. (86).
Otras técnicas moleculares que tipifican aislamientos a nivel de especie y son usadas en estudios epidemiológicos son: 1) huellas de ADN ribosomal (ribosomal DNAfingerprinting) (87), 2) fragmentos de restricción polimórfica (restriction fragment length polymorphisms (RFLPs) (88), 3) determinación de secuencias y análisis del ADN complementario del gen que codifica la 16S rRNA (5), y 4) tipificación por secuenciación de múltiples loci (multilocus sequence typing (MLST)) (89).
Tratamiento y prevención
El tratamiento de la leptospirosis se basa principalmente en la administración de antibióticos y terapia de apoyo. Si bien ha generado debate el hecho que el uso de antibóticos en pacientes con LSHP no ha reducido la mortalidad (90-94), es aceptado que la terapia temprana con antibiótico disminuye el tiempo de estancia hospitalaria, la leptospiremia y las tasas de mortalidad (47).
La administración por vía intravenosa de la penicilina G es considerada la terapia apropiada para el tratamiento en niños (94), por reducir la magnitud del problema renal y la trombocitopenia (47). Estudios anteriores mostraron que no hubo diferencias significativas en cuanto a la duración de la disfunción orgánica o las tasas de mortalidad de pacientes con leptospirosis severa tratados con ceftriaxone (1g/día/7días) por vía intravenosa comparado con penicilina G (1.5 millones IUs cada 6 horas/7 días) (95) o en pacientes tratados con cefotaxima (1g cada 6 horas, o doxiciclina (200 mg seguido por 100 mg cada 12 horas) o penicilina G (1.5 millones IUs cada 6 horas) (96).
Aparte de la ventaja que tiene usar estos medicamentos alternativos a la terapia con penicilina G en pacientes sensibles a esta última, el amplio espectro de la ceftriaxona y cefotaxima contra otras bacterias Gram negativas y la actividad de la doxiciclina contra las ricketsias son apropiadas en áreas en las que hay cociruclación de estas patologías.
Se debe tener en cuenta la presentación y tratamiento de la reacción de Jarisch-Herxheimer en pacientes tratados con antibióticos (97). La doxiciclina ha sido administrada exitosamente como profilaxis en soldados que viajan a áreas de alto riesgo para la leptospirosis (90) o en su administración masiva a 280 000 personas durante una epidemia en período inundación (98).
Pacientes con daño renal agudo deben recibir una dieta baja en proteínas y alta en carbohidratos y un apropiado manejo con fluidos, dependiendo del grado de deshidratación e hipotensión (99). La falla renal, estado severo, debe ser tratada con hemodiálisis diarias (100), pero la plasmaferesis o hemofiltración son recomendadas como mejores opciones (101).
La miocarditis en pacientes con leptospirosis requiere terapias cardiológicas específicas, mientras que la hemorragia y/o trombocitopenia requiere trasfusiones de sangre o plaquetas (102).
La identificación de pacientes con LSHP es realizada por radiografías de tórax o tomografías computarizadas de alta resolución (103); estos pacientes reciben la ventilación mecánica como terapia de apoyo. Hay evidencias de que el intercambio de plasma y el uso de altas dosis de metilprednisolona puede incrementar las tasas de sobrevivencia en estos pacientes (51), mientras que los pacientes con síndrome de distrés respiratorio agudo (SDRA) han mejorado su pronóstico mediante el uso de ventilación mecánica asistida con un volumen tidal bajo y con terapia de reclutamiento alveolar (103).
Las vacunas preparadas de leptospiras enteras muertas con formalina previenen la enfermedad, pero es importante seleccionar las serovariedades prevalentes de acuerdo con cada región, ya que la protección es específica para la serovariedad empleada, además de ser de corta duración, por lo cual se necesitan varias dosis.
Las únicas vacunas licenciadas se limitan a los humanos, ganado vacuno, porcino y perros (104).
La mayoría de estas vacunas han sido usadas con propósitos veterinarios y deben prevenir el estado portador de estos animales; pero no es el caso de la vacuna con células completas inactivadas de Leptospira interrogans, serovariedad Canicola usada en perros (105).
Si bien no se observó el estado portador en cachorros de perros vacunados con dos dosis de la vacuna bivalente compuesta de Leptospira interrogans, serovariedades Icterohaemorrhagiae y Canicola después de haber sido retados con altas dosis de las dos serovariedades (106), el 12.5 % de los perros adultos desarrollaron el estado portador 14 meses después de haber recibido la segunda dosis de la vacuna (107).
Vacunas tetravalentes que incorporan a las serovariedades de Leptospira interrogans Icterohaemorrhagiae y Canicola, las serovariedades Bratislava y Grippotyphosa (108) o Bratislava y Pomona (109), han sido recomendadas en la administración de vacunas a perros en Europa; mientras que en Estados Unidos recomiendan agregar las serovariedades Grippotyphosa y Pomona (110).
Se ha demostrado que las vacunas tetravalentes para perros protegen contra la infección hasta por 12 meses (111).
Múltiples serovariedades (Pomona, Icterohaemorrgiae, Canicola, Grippotyphosa y Hardjo) han sido incluidas en las vacunas pentavalentes de ganado vacuno y porcino; en este último, la serovariedad Copenhageni ha sido también utilizada reemplazando a la serovariedad Hardjo (112).
La inmunización humana se ha administrado a poblaciones en alto riesgo, pero su aplicación se ha limitado a países como Francia, China, Corea, y en las Américas, en Cuba (113).
Debido a la presentación de reacciones adversas en el sitio de la vacunación, proteínas recombinantes de membrana, lipoproteínas, lipopolisacáridos y ADN han sido evaluados como vacunas candidatas (114-120). Entre estas están las proteínas recombinantes
LIC10325 y LIC13059 (110), LigA (119); la
proteína Lip32 recombinante acoplada con la subunidad B de toxinas bacterianas ha mostrado resultados promisorios (120,121).
Conclusiones
De la revisión realizada sobre diferentes aspectos concernientes a la bacteria Leptospira spp. y la enfermedad que produce se concluye lo siguiente:
La diversidad genética del género Leptospira spp. ha determinado que este género, inicialmente clasificado en dos especies: L.interrogans y L.biflexa, cuenta por ahora con 20 especies, que por su plasticidad genética se agrupan en los clados de leptospiras patógenas, patógenas intermedias y saprófitas, que le permiten a esta bacteria vivir en condiciones de vida libre (saprófitas), adaptarse a vivir en los riñones de animales y vida libre (patógenas, patógenas intermedias).
A pesar de disponer del genoma completo de algunas especies patógenas de Leptospira spp., aún falta por determinar en aproximadamente el 64 % de los genes la función de los que eventualmente pudieran codificar proteínas asociadas a la virulencia.
El número de serovariedades de Leptospira spp. patógena va en incremento, ya que su tipificación se hace posible por el uso de técnicas moleculares rápidas, en comparación con las técnicas serológicas. Este conocimiento permite determinar fuentes de infección, enfocar medidas de control y mejorar la sensibilidad de la prueba serológica de oro, la MAT, usando un panel de aislamientos tipificados del área de donde se obtiene el aislamiento.
El incremento de los eventos de inundación como producto del cambio climático favorece la ocurrencia de epidemias, especialmente en áreas urbanas y pobres, a nivel global y en las Américas en Brasil, Centroamérica y Caribe.
Las infecciones con Leptospira spp. en humanos pueden ser confundidas con influenza, malaria, dengue, fiebre amarilla, hantavirus (pulmonar y hemorrágico), rickettsiosis, brucelosis, borreliosis, hepatitis, meningitis aséptica, neumonía e incluso con la cardiopatía chagásica.
Las tasas de mortalidad debido a la LSHP ahora exceden a la observada con el síndrome de Weil, especialmente en las Américas, donde afecta principalmente a hombres en edad adulta. Los niños con cuadros severos parecidos a los adultos presentan una tasa menor de mortalidad.
Una terapia temprana con penicilina G, cefotaxina, ceftriaxone o doxiciclina puede reducir la severidad de la enfermedad y el número de días de hospitalización, pero hasta ahora no se ha demostrado su efectividad en pacientes con LSHP.
La prueba de oro para el diagnóstico de infecciones con Leptospira spp. es altamente sensible si se usa un panel adecuado de serovariedades; sin embargo, esta prueba es serogrupo específica, y se ha demostrado que no identifica la serovariedad infectante. Además, debido a las reacciones cruzadas entre serogrupos, el diagnóstico es presuntivo.
Por su alta sensibilidad y bajo costo se recomienda el uso de la IgM-ELISA, la cual detecta la IgM incluso antes que la prueba MAT.
La vacunación de perros y otros animales previene la enfermedad pero no previene la infección o trasmisión. La vacuna hasta ahora es específica solamente para las serovariedades utilizadas.
Problemas en el diagnóstico clínico y de laboratorio de la leptospirosis en la mayoría de los países endémicos afectan el reporte y las estadísticas reales de la ocurrencia; por lo cual es una enfermedad olvidada tanto para los tomadores de decisiones en el área de la salud como para los tomadores de decisiones en las agencias financiadoras de la investigación en nuestros países.
Agradecimientos: A Rosmery Llanos por la búsqueda de información en cada uno de los ministerios de salud de los países de las Américas; a Galo Mantilla y a la Dra. Lila Visbal de la Universidad del Norte, por sus comentarios en la sección de leptospirosis humana y tratamiento.
Financiación: Esta revisión se realizó como actividad del proyecto interno de investigación sobre leptospirosis, otorgado por la Dirección de Investigaciones, Desarrollo e Innovación de la Universidad del Norte.
Conflicto de intereses: ninguno.
*Esta revisión se realizó como actividad del proyecto interno de investigación sobre leptospirosis, otorgado por la Dirección de Investigaciones, Desarrollo e Innovación de la Universidad del Norte.
Referencias
1. Faine S, Adler B, Bolin C, Perolat P. A brief history of leptospirosis. En: Faine S, Adler B, Bolin C, Perolat P, editors. Leptospira and leptospirosis. 2a ed. Melbourne: MediSci; 1999. p. 1-9. [ Links ]
2. Levett PN. Systematics of leptospiraceae. Curr Top Microbiol Immunol. 2015;387:11-20. doi: 10.1007/978-3-662-45059-8_2. [ Links ]
3. Brenner DJ, Kaufmann AF, Sulzer KR, Steigerwalt AG, Rogers FC, Weyant RS. Further determination of DNA relatedness between serogroups and serovars in the family Leptospiraceae with a proposal for Leptospira alexanderi sp. nov. and four new Leptospira genomospecies. Int J Syst Bacteriol 1999;49:839-58. [ Links ]
4. Yasuda PH, Steigerwalt AG, Sulzer KR, Kaufmann AF, Rogers F, Brenner DJ. Deoxyribonucleic acid relatedness between serogroups and serovars in the family Leptospiraceae with proposals for seven new Leptospira species. Int J Syst Bacteriol 1987;37:407-15. [ Links ]
5. Saito M, Villanueva SY, Kawamura Y, Iida, KI, Tomida J, Kanemaru T, Kohno E, Miyahara S, Umeda A, Amako K et al. Leptospira idonii sp. nov., isolated from an environmental water in Fukuoka, Japan. Int. J. Syst. Evol. Microbiol 2012, 63, 2457. [ Links ]
6. Morey RE, Galloway RL, Bragg SL, Steigerwalt AG, Mayer LW, Levett PN. Species specific identification of Leptospiraceae by 16S rRNA gene sequencing. J Clin Microbiol 2006;44:3510-6. [ Links ]
7. Levett PN, Morey RE, Galloway RL, Steigerwalt AG. Leptospira broomii sp. nov., isolated from humans with leptospirosis. Int J Syst Evol Microbiol 2006;56:671-3. [ Links ]
8. Ahmed A, Grobusch MP, Klatser P, Hartskeerl RA. Molecular Approaches in the Detection and Characterization of Leptospira. J Bacteriol Parasitol 2012;3:133. doi: 10.4172/2155-9597.1000133. [ Links ]
9. Smythe L, Adler B, Hartskeerl RA, Galloway RL, Turenne CY, Levett PN. Classification of Leptospira genomospecies 1, genomospecies 3, genomospecies 4 and genomospecies 5 as Leptospira alstonii sp. nov., Leptospira vanthielii sp. nov., Leptospira terpstrae sp. nov., Leptospira yanagawae sp. nov., respectively. Int J Syst Evol Microbiol012.doi: 10.1099/ijs.0.047324-0. [ Links ]
10. Shieh W-J, Edwards C, Levett PN, Zaki SR. Leptospirosis. En: Guerrant RL, Walker DH, Wellwe PF, editors. Tropical Infectious Diseases: Principles, Pathogens and Practice. 3rd ed. New York: Saunders, Elsevier; 2011. p. 3037. [ Links ]
11. Slack AT, Khairani-Bejo S, Symonds ML, Dohnt MF, Galloway RL, Steigerwalt AG et al. Leptospira kmetyi sp. nov., isolated from an environmental source in Malaysia. Int JSyst Evol Microbiol 2009;59:705-8. [ Links ]
12. da Silva EF, Félix SR, Cerqueira GM, Fagundes MQ, Neto AC, Grassmann AA et al. Preliminary characterization of Mus musculus derived pathogenic strains of Leptospira borgpetersenii serogroup Ballum in a hamster model. Am J Trop Med Hyg 2010;83:336-7. [ Links ]
13. Jorge S, Hartleben CP, Seixas FK, Coimbra MA, Stark CB, Larrondo AG et al. Leptospira borgpetersenii from freeliving white eared opossum (Didelphis albiventris): First isolation in Brazil. Acta Trop 2012;124:147-51. [ Links ]
14. de Faria MT, Calderwood MS, Athanazio DA, McBride AJ, Hartskeerl RA, Pereira MM et al. Carriage of Leptospira interrogans among domestic rats from an urban setting highly endemic for leptospirosis in Brazil. Acta Trop 2008;108:1-5. [ Links ]
15. Romero Vivas CM, Cuello Pérez M, Agudelo Florez P, Thiry D, Levett P, Falconar Andrew K. Cross sectional study of Leptospira seroprevalence in humans, rats, mice and dogs in a main tropical seaport city. Am J Trop Med Hyg 2012. In press. [ Links ]
16. Pavan ME, Cairó F, Brihuega B, Samartino L. Multiple locus variable number tandem repeat analysis (MLVA) of Leptospira interrogans serovar Pomona from Argentina reveals four new genotypes. Comp Immunol Microbiol Infect Dis 2008;31:37- 45. [ Links ]
17. Perolat P, Chappel RJ, Adler B, Baranton G, Bulach DM, Billinghurst ML et al. Leptospira fainei sp.nov., isolated from pigs in Australia. Int J Syst Bacteriol 1998;48:851-8. [ Links ]
18. Matthias MA, Ricaldi JN, Cespedes M, Diaz MM, Galloway RL, Saito M et al. Human leptospirosis caused by a new, antigenically unique Leptospira associated with a Rattus species reservoir in the Peruvian Amazon. PLoS Negl Trop Dis 2008;2:e213. [ Links ]
19. Slack AT, Kalambaheti T, Symonds ML, Dohnt MF, Galloway RL, Steigerwalt AG et al. Leptospira wolffii sp. nov., isolated from a human with suspected leptospirosis in Thailand. Int J Syst Evol Microbiol 2008;58:2305-8. [ Links ]
20. Ren SX, Fu G, Jiang XG, Zeng R, Miao YG, Xu H et al. Unique physiological and pathogenic features of Leptospira interrogans revealed by wholegenome sequencing. Nature2003;422:888-93. [ Links ]
21. Bulach DM, Zuerner RL, Wilson P, Seemann T, McGrath A, Cullen PA et al. Genome reduction in Leptospira borgpetersenii reflects limited transmission potential. Proc Natl AcadSci USA 2006;103:14560-5. [ Links ]
22. Picardeau M, Bulach DM, Bouchier C, Zuerner RL, Zidane N, Wilson PJ et al. Genome sequence of the saprophyte Leptospira biflexa provides insights into the evolution of Leptospira and the pathogenesis of leptospirosis. PLoS One 2008;13:e1607. [ Links ]
23. Nascimento AL, Verjovski Almeida S, Van Sluys MA, Monteiro Vitorello CB, Camargo LE, Digiampietri LA et al. Genome features of Leptospira interrogans serovar Copenhageni. Braz J Med Biol Res 2004;37:459-77. [ Links ]
24. Ristow P, Bourhy P, da Cruz McBride FW, Figueira CP, Huerre M, Ave P et al. The Omp A like protein Loa22 is essential for leptospiral virulence. PLoS Pathog 2007;3:e97. [ Links ]
25. Narayanavari SA, Sritharan M, Haake DA, Matsunaga J. Multiple leptospiral sphingomyelinases (or are there?). Microbiology2012;158:1137-46. [ Links ]
26. Choy HA, Kelley MM, Chen TL, Moller AK, Matsunaga J, Haake DA. Physiological osmotic induction of Leptospira interrogans adhesion: LigA and LigB bind extracellular matrix proteins and fibrinogen. Infect. Immun 2007;75:2441e2450. [ Links ]
27. Stevenson B, Choy HA, Pinne M, Rotondi ML, Miller MC, Demoll E et al. Leptospira interrogans endostatin like outer membrane proteins bind host fibronectin, laminin and regulators of complement. PLoS One 2007;2:e1188. [ Links ]
28. Pinne M, Haake DA. LipL32 Is a Subsurface Lipoprotein of Leptospira interrogans: presentation of new data and reevaluation of previous studies. PLoS One 2013;8(1):e51025. doi: 10.1371/journal.pone.0051025. [ Links ]
29. Haake DA. Spirochaetal lipoproteins and pathogenesis. Microbiology 2000;146:1491-50. [ Links ]
30. Haake DA1, Zückert WR. The leptospiral outer membrane. Curr Top Microbiol Immunol 2015;387:187-221. doi: 10.1007/978-3662-45059-8_8. [ Links ]
31. Bulach DM, Kalambaheti T, De la Peña Moctezuma A, Adler B. Lipopolysaccharide biosynthesis in Leptospira. J Mol MicrobiolBiotechnol 2000;2:375-80. [ Links ]
32. World Health Organization/International LeptospirosisSociety. Human leptospirosis: guidance for diagnosis, surveillance and control, 2003 [fecha de acceso: 26 de septiembre de 2014]. Disponible en:http://www.med.monash.edu.au/microbiology/staff/ adler/ils. html. [ Links ]
33. Evangelista K, Coburn J. Leptospira as an emerging pathogen: a review of its biology, pathogenesis and host immune responses. Future Microbiol 2010;5: 1413-25.
34. Galloway RL, Levett PN. Application and validation of PFGE for serovar identification of Leptospira clinical isolates. Plos Negl TropDis. 2010;14: e824. [ Links ]
35. Bunnell JH, Hice CL, Watts DM, Montrueil V, Tesh RB, Vinetz JM. Detection of pathogenic Leptospira spp. infection among mammals captured in the Peruvian Amazon Basin Region. Am J Trop Med Hyg 2000;63:255-8. [ Links ]
36. Levett PN. Leptospirosis. Clin Microbiol2001;14:296-326. [ Links ]
37. Bharti AR, Nally JE, Ricaldi JN, Matthias MA, Diaz MM, Lovett MA et al. Peru United States Leptospirosis Consortium, Leptospirosis: a zoonotic disease of global importance. Lancet Infect Dis 2003;3:757-71. [ Links ]
38. Chikeka I, Dumler JS. Neglected bacterial zoonoses. Clin Microbiol Infect 2015 May;21(5):404-415. DOI: 10.1016/j.cmi.2015.04.022. [ Links ]
39. Reis RB, Ribeiro GS, Felzemburgh RD, Santana FS, Mohr S, Melendez AX et al. Impact of environment and social gradient on Leptospira infection in urban slums. PLoS Negl Trop Dis 2008;23:e228. [ Links ]
40. Maciel EA, de Carvalho AL, Nascimento SF, de Matos RB, Gouveia EL, Reis MG et al. Household transmission of leptospira infection in urban slum communities. PLoS Negl Trop Dis 2008;2:e154. [ Links ]
41. Villanueva SY, Ezoe H, Baterna RA, Yanagihara Y, Muto M, Koizumi N et al. Serologic and molecular studies of Leptospira and leptospirosis among rats in the Philippines. Am J Trop Med Hyg 2010;82:889-98. [ Links ]
42. Hartskeerl RA, Collares-Pereira M, Ellis WA. Emergence, control and reemerging leptospirosis: dynamics of infection in the changing world. Clin Microbiol Infect 2011; 17:494-501. [ Links ]
43. Desvars A, Cardinale E, Michault A. Animal leptospirosis in small tropical areas. Epidemiol Infect 2011;139:167-88. [ Links ]
44. World Health Organization. Weekly epidemiological record. 2011 [fecha de acceso: 8 de octubre de 2014]. Disponible en:Disponible en: http://www.who.int/wer/2011/wer8606.pdf. [ Links ]
45. Shah K, Amonkar GP, Kamat RN. Deshpande JR Cardiac findings in leptospirosis. JClin Pathol 2010;63:119-23. [ Links ]
46. Velasco-Castrejón O, Rivas-Sánchez B, Soriano-Rosas J, Rivera-Reyes HH. Severe myocardial damage caused by leptospirosis. Report of a fatal case in Mexico. ArchCardiol Mex 2009;79:268-73. [ Links ]
47. Abdulkader RC, Silva MV. The kidney in leptospirosis. Pediatr Nephrol 2008;23:2111-20. [ Links ]
48. Lombardi R, Yu L, Younes Ibrahim M, Schor N, Burdmann EA. Epidemiology of acute kidney injury in Latin America. Semin Nephrol 2008;28:320-9. [ Links ]
49. Daher EF, Silva GB Jr, Karbage NN, Carvalho PC Jr; Kataoka RS, Silva EC et al. Predictors of oliguric acute kidney injury in leptospirosis. A retrospective study on 196 consecutive patients. Nephron Clin Pract2009;112:25-30. [ Links ]
50. Hurst FP, Neff RT, Katz AR, Buchholz AE, Sasaki DM, Berg BW et al. Acute kidney injury requiring hemodialysis in patients with anicteric leptospirosis. Clin Nephrol 2009;72:186-92. [ Links ]
51. Helmerhorst HJ, van Tol EN, Tuinman PR, de Vries PJ, Hartskeerl RA, Grobusch MP et al. Severe pulmonary manifestation of leptospirosis. Neth J Med 2012;70:215-21. [ Links ]
52. Lehmann JS, Matthias MA, Vinetz JM, Fouts DE Leptospiral pathogenomics. Pathogens 2014 Apr 10;3(2):280-308. doi: 10.3390/pathogens3020280. [ Links ]
53. Hotez PJ, Bottazzi ME, Franco Paredes C, Ault SK, Periago MR. The neglected tropical diseases of Latin America and the Caribbean: a review of disease burden and distribution and a roadmap for control and elimination. PLoS Negl Trop Dis 2008;24:e300. [ Links ]
54. Pappas G, Papadimitriou P, Siozopoulou V, Christou L, Akritidis N. The globalization of leptospirosis: worldwide incidence trends. Int J Infect Dis 2008;12:351-7. [ Links ]
55. World Health Organization. Report of the second meeting of the leptospirosis burden epidemiology reference group, 2011 [fecha de acceso: 25 de septiembre de 2014]. Disponible en:http://whqlibdoc.who.int/publications/2011/9789241501521_eng.pdf. [ Links ]
56. Nicodemo AC, Duarte MI, Alves VA, Takakura CF, Santos RT, Nicodemo EL. Lung lesions in human leptospirosis: microscopic, immunohistochemical, and ultrastructural features related to thrombocytopenia. Am JTrop Med Hyg 1997;56:181-7. [ Links ]
57. Trevejo RT, Rigau Pérez JG, Ashford DA, McClure EM, Jarquín González C, Amador JJ. Epidemic leptospirosis associated with pulmonary hemorrhage Nicaragua, 1995. JInfect Dis 1998;178:1457-63. [ Links ]
58. Segura ER, Ganoza CA, Campos K, Ricaldi JN, Torres S, Silva H et al. Peru United States Leptospirosis Consortium. Clinical spectrum of pulmonary involvement in leptospirosis in a region of endemicity, with quantification of leptospiral burden. ClinInfect Dis 2005;40:343-51. [ Links ]
59. Gouveia EL, Metcalfe J, de Carvalho AL, Aires TS, Villasboas Bisneto JC, Queirroz A et al. Leptospirosis-associated severe pulmonary hemorrhagic syndrome, Salvador, Brazil. Emerg Infect Dis 2008;14:505-8. [ Links ]
60. Spichler A, Athanazio DA, Vilaca P, Seguro A, Vinetz J, Leake JA.Comparative analysis of severe pediatric and adult leptospirosis in Sao Paulo, Brazil. Am J Trop Med Hyg2012;86:306-8. [ Links ]
61. Ko AI, Galváo Reis M, Ribeiro Dourado CM, Johnson WD Jr, Riley LW. Urban epidemic of severe leptospirosis in Brazil. Salvador Leptospirosis Study Group. Lancet 1999;354:820-5. [ Links ]
62. Spichler AS, Vilaca PJ, Athanazio DA, Albuquerque JO, Buzzar M, Castro B et al. Predictors of lethality in severe leptospirosis in urban Brazil. Am J Trop Med Hyg 2008;79:911-4. [ Links ]
63. Bravo C, Restrepo M. Leptospirosis humana en Colombia: Presentación de un caso de fiebre Canpicola. Antioq Méd 1969;9:747-51. [ Links ]
64. Epstein PR, Calix Pena O, Blanco-Racedo J. Climate and disease in Colombia. Lancet 1995;346:1243-4. [ Links ]
65. Pérez García J. Hallazgos histopatológicos en necropsias con leptospirosis. Colombia Med 1997;28:4-9. [ Links ]
66. Agudelo Flórez P, Restrepo Jaramillo BN, Arboleda Naranjo M. Situación de la leptospirosis en el Urabá antioqueño colombiano: estudio seroepidemiológico y factores de riesgo en población general urbana. Cad Saúde Pública 2007;23: 2094-102. [ Links ]
67. Ferro BE, Rodríguez AL, Pérez M, Travi BL. Seroprevalence of Leptospira infection in habitants of peripheral neighborhoods in Cali, Colombia. Biomedica 2006;26:250-7. [ Links ]
68. Sistema Nacional de Vigilancia en Salud Pública (Sivigila). Vigilancia rutinaria, semana 52 del 2010 [fecha de acceso: 13 de octubre del 2014]. Disponible en: http://www.ins.gov.co/lineas-de-accion/SubdireccionVigilancia/sivigila/Estadsticas%20 SIVIGILA/SEMANA% 2052 %20DE%202010.pdf. [ Links ]
69. Sistema Nacional de Vigilancia en Salud Pública (Sivigila). Vigilancia rutinaria, semana 52 del 2011[fecha de acceso: 13 de octubre del 2014]. Disponible en:http://www.ins.gov.co/lineas-de-accion/Subdireccionvgilancia/sivigila/Estadsticas% 20 SIVIGILA/2011%20LEPTOSPIROSIS.pdf. [ Links ]
70. Sistema Nacional de Vigilancia en Salud Pública (Sivigila). Vigilancia rutinaria, semana 38 del 2012 [fecha de acceso: 13 de octubre del 2014 ]. http://www.ins.gov.co/lineasdeaccion/Subdireccionvigilancia/sivigila/Estadsticas% 20 SIVIGILA/2012%20LEPTOSPIROSIS.pdf Año 2012. [ Links ]
71. Macías-Herrera JC, Vergara C, Romero Vivas C, Falconar A. Comportamiento de la leptospirosis en el departamento del Atlántico (Colombia), enero de 1999 a marzo de 2004. Salud Uninorte (Barranquilla, Col) 2005;20:18-29. [ Links ]
72. Sanchez Vallejo G, Gómez Marín J. E., Quintero Álvarez L, Castaño Cotrina MC. Características clínicas y epidemiológicas de la leptospirosis en el departamento del Quindío, 2005-2006. Infect 2008;12:325-31. [ Links ]
73. Ramírez Ramírez MM, León Castañeda OM, Rodríguez Morales AJ. Leptospirosis in an urban setting: cases diagnosed at a private medical center of WesternColombia, 2008-2012. Recent Pat Antiinfect Drug Discov2015;10(1):59-63.
74. Levett PN, Branch SL, Edwards CN. Detection of dengue infection in patients investigated for leptospirosis in Barbados. Am JTrop Med Hyg 2000;62:112-4. [ Links ]
75. Rele MC, Rasal A, Despande SD, Koppikar GV, Lahiri KR. Mixed infection due to leptospira and dengue in a patient with pyrexia. Indian J Med Microbiol 2001;19:206-7. [ Links ]
76. Kaur H, John M. Mixed infection due to leptospira and dengue. Indian J Gastroenterol2002;21:206. [ Links ]
77. Behera B, Chaudhry R, Pandey A, Mohan A, Dar L et al. Coinfections due to leptospira, dengue and hepatitis E: a diagnostic challenge. J. Infect Dev Ctries 2009;4:48-50. [ Links ]
78. Smythe LD, Wuthiekanun V, Chierakul W, Suputtamongkol Y, Tiengrim S, Dohnt MF et al. The microscopic agglutination test (MAT) is an unreliable predictor of infecting Leptospira serovar in Thailand. Am J Trop Med Hyg 2009;81:695-7. [ Links ]
79. Merien F, Baranton G, Perolat P. Comparison of polymerase chain reaction with microagglutination test and culture for diagnosis of leptospirosis. J Infect Dis 1995;172:281-5. [ Links ]
80. Gravekamp C, Van de Kemp H, Franzen M, Carrington D, Schoone GJ, Van Eys GJ et al. Detection of seven species of pathogenic Leptospires by PCR using two sets of primers. J Gen Microbiol 1993;139:1691-1700. [ Links ]
81. Levett PN, Morey R, Galloway RL, Turner D, Steigerwalt AG, Mayer LW. Detection of pathogenic leptospires by real time quantitative PCR. J Med Microbiol 2005;54:45-9. [ Links ]
82. Slack AT, Symonds ML, Dohnt MF, Smythe LD. Identification of pathogenic Leptospira species by conventional or real time PCR and sequencing of the DNA gyrase subunit B encoding gene. BMC Microbiol 2006;6:e95. [ Links ]
83. Herrmann JL, Bellenger E, Perolat P, Baranton G, Saint Girons I. Pulsed field gel electrophoresis of Not I digests of leptospiral DNA: a new rapid method of serovar identification. J Clin Microbiol 1992;30:1696-1702.
84. Galloway RL, Levett PN. Evaluation of a modified pulsed field gel electrophoresis approach for the identification of Leptospira serovars. Am J Trop Med Hyg 2008;78:628-32. [ Links ]
85. Romero-Vivas CM, Thiry D, Rodríguez V, Calderón A., Arrieta G, Mattar S et al. Molecular serovar characterization of Leptospira spp isolates from animals and water in Colombia. Biomedica 2013 Sep;33 Supl 1:179-84. [ Links ]
86. Salaün L, Mérien F, Gurianova S, Baranton G, Picardeau M. Application of multilocus variable number tandem repeat analysis for molecular typing of the agent of leptospirosis. J Clin Microbiol 2006;44:3954-62. [ Links ]
87. Perolat P, Lecuyer I, Postic D, Baranton G. Diversity of ribosomal DNA fingerprints of Leptospira serovars provides a database for subtyping and species assignation. Res Microbiol 1993;144:5-15. [ Links ]
88. Kawabata H, Dancel LA, Villanueva SY, Yanagihara Y, Koizumi N, Watanabe H. flaB polymerase chain reaction (flaB-PCR) and its restriction fragment length polymorphism (RFLP) analysis are an efficient tool for detection and identification of Leptospira spp. Microbiol Immunol 2001;45:491-6. [ Links ]
89. Thaipadungpanit J, Wuthiekanun V, Chierakul W, Smythe LD, Petkanchanapong W, Limpaiboon R et al. A dominant clone of Leptospira interrogans associated with an outbreak of human leptospirosis in Thailand. PLoS Negl Trop Dis 2007;1:e56. [ Links ]
90. Guidugli F, Castro AA, Atallah AN. Antibiotics for treating leptospirosis. Cochrane Database Syst Rev 2000;2:CD001305. [ Links ]
91. Brett Major DM, Coldren R. Antibiotics for leptospirosis. Cochrane Database Syst Rev 2012;2:CD008264.
92. Marotto PC, Ko AI, Murta-Nascimento C, Seguro AC, Prado RR, Barbosa MC et al. Early identification of leptospirosis associated pulmonary hemorrhage syndrome by use of a validated prediction model. J Infect 2010;60:218-23. [ Links ]
93. Seijo A, Romer Y, San Juan J, Prieto R, Nogueras M, De Vedia L, Font Nine L et al. Community acquired pneumonia and pulmonary hemorrhage in leptospirosis in the Buenos Aires metropolitan area. Medicina 2011;71:127-34. [ Links ]
94. Tullu MS, Karande S. Leptospirosis in children: a review for family physicians. Indian J Med Sci 2009;63:368-78. [ Links ]
95. Panaphut T, Domrongkitchaiporn S, Vibhagool A, Thinkamrop B, Susaengrat W. Ceftriaxone compared with sodium penicillin g for treatment of severe leptospirosis. Clin Infect Dis 2003;36:1507-13. [ Links ]
96. Suputtamongkol Y, Niwattayakul K, Suttinont C, Losuwanaluk K, Limpaiboon R, Chierakul W et al. An open, randomized, controlled trial of penicillin, doxycycline, and cefotaxime for patients with severe leptospirosis. Clin Infect Dis 2004;39:1417-24. [ Links ]
97. Faucher JF, Hoen B, Estavoyer JM. The management of leptospirosis. Expert Opin Pharmacother 2004;5:819-27. [ Links ]
98. Dechet AM, Parsons M, Rambaran M, Mohamed Rambaran P, Florendo Cumbermack A, Persaud S et al. Leptospirosis out break following severe flooding: a rapid assessment and mass prophylaxis campaign; Guyana, January-February 2005. PLoS One 2012;7:e39672. [ Links ]
99. Kobayashi Y. Human leptospirosis: management and prognosis. J Postgrad Med 2005;51:201-4. [ Links ]
100. Andrade L, Cleto S, Seguro AC. Doortodialysis time and daily hemodialysis in patients with leptospirosis: impact on mortality. Clin J Am Soc Nephrol 2007; 2:739-44. [ Links ]
101. Cerqueira TB, Athanazio DA, Spichler AS, Seguro AC. Renal involvement in leptospirosis new insights into pathophysiology and treatment. Braz J Infect Dis 2008;12:248-52. [ Links ]
102. Marchiori E, Lourenco S, Setúbal S, Zanetti G, Gasparetto TD, Hochhegger B. Clinical and imaging manifestations of hemorrhagic pulmonary leptospirosis: a state of the art review. Lung 2011;189:1-9. [ Links ]
103. Gomes NP, Menescal ZL, Holanda MA. Protective ventilation and alveolar recruitment maneuver in a patient with leptospirosis induced acute respiratory distress syndrome. J Bras Pneumol 2012;38:140-2. [ Links ]
104. Adler B. Vaccines against leptospirosis. Curr Top Microbiol Immunol 2015;387:251-72. doi: 10.1007/978-3-662-45059-8_ [ Links ]
105. André-Fontaine G, Branger C, Gray AW, Klaasen HL. Comparison of the efficacy of three commercial bacterins in preventing canine leptospirosis. Vet Rec 2003;153:165-9. [ Links ]
106.Schreiber P, Martin V, Najbar W, Sanquer A, Gueguen S, Lebreux B. Prevention of renal infection and urinary shedding in dogs by a Leptospira vaccination. Vet Microbiol 2005;108:113-8. [ Links ]
107. Minke JM, Bey R, Tronel JP, Latour S, Colombet G, Yvorel J et al. Onset and duration of protective immunity against clinical disease and renal carriage in dogs provided by a bivalent inactivated leptospirosis vaccine. Vet Microbiol 2009;137:137-45. [ Links ]
108. Ellis WA. Control of canine leptospirosis in Europe: time for a change? Vet Rec 2010;167:602-5. [ Links ]
109. Arent ZJ, Andrews S, Adamama Moraitou K, Gilmore C, Pardali D, Ellis WA. Emergence of novel Leptospira serovars: a need for adjusting vaccination policies for dogs? Epidemiol Infect 2012;24:1-6. [ Links ]
110. Stokes JE, Kaneene JB, Schall WD, Kruger JM, Miller R, Kaiser L et al. Prevalence of serum antibodies against six Leptospira serovars in healthy dogs. J Am Vet Med Assoc 2007;230:1657-64. [ Links ]
111. Klaasen HL, van der Veen M, Sutton D, Molkenboer MJ. A new tetravalent canine leptospirosis vaccine provides at least 12 months immunity against infection. Vet Immunol Immunopathol 2014 Mar 15;158(1-2):26-9. [ Links ]
112. Martínez R, Pérez A, Quiñones M del C, Cruz R, Álvarez A, Armesto M et al. Efficacy and safety of a vaccine against human leptospirosis in Cuba. Rev Panam Salud Pública 2004;15:249-55. [ Links ]
113. Martins Soto FR, Regina Pinheiro S, Honma Ito F, Maria Moraes Z, Paldes Goncales A, Santos de Azevedo S et al. Evaluation of colostral immunity in swine with commercial antileptospira polyvalent whole bacteria vaccine. Comp Immunol Microbiol Infect Dis 2008;31(4):327-35. [ Links ]
114. Wang Z, Jin L, Wegrzyn A. Leptospirosis vaccines. Microb Cell Fact 2007;6:39. [ Links ]
115. Thongboonkerd V. Proteomics in leptospirosis research: towards molecular diagnostics and vaccine development. Expert Rev Mol Diagn 2008;8:53-61. [ Links ]
116. Ko AI, Goarant C, Picardeau M. Leptospira: the dawn of the molecular genetics era for an emerging zoonotic pathogen. Nat Rev Microbiol 2009;7:736-47. [ Links ]
117. Dellagostin OA, Grassmann AA, Hartwig DD, Félix SR, da Silva ÉF, McBride AJ. Recombinant vaccines against leptospirosis. Hum Vaccin 2011;7:1215-24. [ Links ]
118. Félix SR, Hartwig DD, Argondizzo AP, Silva ÉF, Seixas FK, Neto AC et al. Subunit approach to evaluation of the immune protective potential of leptospiral antigens. Clin Vaccine Immunol 2011;18:2026-30. [ Links ]
119. Coutinho ML, Choy HA, Kelley MM, Matsunaga J, Babbitt JT, Lewis MS. A LigA three domain region protects hamsters from lethal infection by Leptospira interrogans. PLoS Negl Trop Dis 2011;5:e1422. [ Links ]
120. Habarta A, Abreu PA, Olivera N, Hauk P, Cédola MT, Ferrer MF et al. Increased immunogenicity to LipL32 of Leptospira interrogans when expressed as a fusion protein with the cholera toxin B subunit. Curr Microbiol 2011;62:526-31. [ Links ]
121. Grassmann AA, Félix SR, dos Santos CX, Amaral MG, Seixas Neto AC, Fagundes MQ et al. Protection against lethal leptospirosis after vaccination with LipL32 coupled or co administered with the B subunit of Escherichia coli heatlabile enterotoxin. Clin Vaccine Immunol 2012;19:740-5. [ Links ]














