INTRODUCTION
El propósito de esta revisión es describir los mecanismos por los cuales las HSPs participan en el desarrollo neoplásico, ya que los distintos miembros de las familias de HSPs desempeñan un importante papel en el desarrollo tumoral al facilitar el crecimiento autónomo de las células y proporcionar la estabilidad de algunos oncogenes. En el contexto tumoral, las HSPs bloquean vías de muerte celular programada (apoptosis) y promueven la activación de factores que degradan la matriz extracelular. Cabe resaltar que la expresión de las HSPs es bastante heterogénea en los tejidos neoplásicos, y sumado al echo de que no se han desarrollado estudios que evalúen la expresión conjunta de todas las familias de HSPs. Es por ello que conocer el papel de estas proteínas en el desarrollo neoplásico resulta importante, ya que la sobreexpresión de las HSPs en muchos tipos de neoplasias ofrece un espacio para el diseño e implementación de tratamientos que puedan inhibirlas o modificar su expresión. Hasta ahora los ensayos que tienen a las HSPs como objetivo terapéutico han mostrado resultados prometedores para el tratamiento del cáncer basado en la inhibición de estas proteínas.
METODOLOGÍA
Para la realización de este artículo de revisión se hizo una búsqueda de artículos originales y de revisión en las bases de datos de Pub-Med, Science direct y MEDLINE. Las revistas consultadas fueron PNAS, Cell, Nature, EMBO journal, Oncogene, Cancer Research, BioMedcentral, Nature cell Biology, The Japanese Biochemical Society, Cancer Science, Journal in Medicinal chemistry, Journal of Bioscience, Journal of Biological Chemistry, Journal of Gastronenterology and hepatology, Pathobiology, Clinical cancer research, Journal of neuroscience, Journal of clinical hemathopathology, Oncology, Genes and Development, Chemotherapy, Experimental dermatology, Cancer epidemiology, Molecular Pharmaceutics, Cell stress and chaperones, Journal of Mathematical Biology.
Las palabras clave de búsqueda fueron: proteínas de choque térmico, metástasis y cáncer, HSPs e invasividad tumoral, chaperonas de la tumorogénesis, HSPs y migración celular, proteínas de choque térmico y progresión del cáncer, proteoma de células tumorales y metastásica, expresión de HSPs en cáncer.
El número de artículos seleccionados fue de 126 (86 artículos originales y 40 de revisión). Se seleccionaron artículos originales a partir del año 2000; para artículos de revisión no se tuvo en cuenta el año. Se revisaron artículos que mostraran evidencia a favor y en contra del papel de las HSPs en cáncer cuyo contenido describiera un rol tanto básico como clínico.
GENERALIDADES DE LAS HSPS
Actualmente el cáncer constituye una de las principales causas de muerte a nivel mundial, superado tan solo por las enfermedades de origen cardiovascular 1; por tanto resulta muy importante comprender las vías moleculares que facilitan el desarrollo de la célula tumoral. Entre estas vías se encuentran las proteínas de choque térmico (HSPs) o "proteínas de estrés", que hacen parte fundamental del funcionamiento celular normal y tumoral. Las HSPs conforman una gran familia de proteínas y se clasifican de en los siguientes grupos de acuerdo con su peso molecular, que varía entre 10 000 a 150 000 Daltons: pequeñas HSPs (Hsp10, Hsp27), Hsp40, Hsp60, Hsp70, Hsp90 y Hsp110 2. La tabla 1 muestra la clasificación de las familias de las proteínas de choque térmico.
Tabla 1 Clasificación de las familias de las proteínas de choque térmico (HSPs)
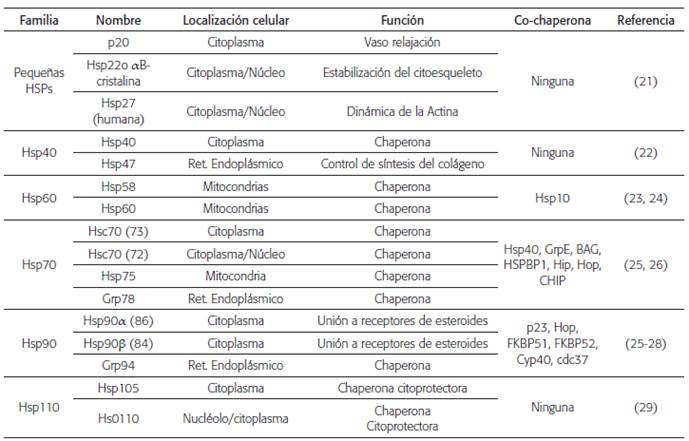
Los números entre paréntesis corresponden a otras denominaciones de las mismas proteínas.
Grp: proteínas relacionadas con glucosa, inducidas por anoxia y deprivación de glucosa.
Estas proteínas fueron descubiertas en 1962 y recibieron la denominación de proteínas de choque térmico por el hecho de que se detectaron inicialmente al generar un estrés térmico en Drosophila 3. En su mayor parte las HSPs son expresadas en forma constitutiva en casi todas las células, mientras que algunas de ellas son inducidas ante la presencia de determinadas agresiones, se sobreexpresan en células sometidas a choque térmico, radiaciones, diversos fármacos, infecciones virales, hipoxia, entre otros, y se restablecen cuando el estrés es eliminado 4-6. Su ubicuidad hizo que inicialmente se las agrupara bajo el nombre genérico de ubiquitinas 7. Constituyen una gran familia de proteínas que se encuentran expresadas en todos los organismos, a lo largo de la escala evolutiva, cumpliendo un papel similar en bacterias, levaduras, plantas y células animales 8; por ejemplo, ayudan al correcto plegamiento de los polipéptidos recién formados y en la adquisición de la estructura terciaria de las proteínas, en la translocación y secreción proteica. Igualmente, participan en la reparación de proteínas anormales o en su degradación vía proteasoma. Están relacionadas con el control del ciclo celular participando en algunas vías de señalización y brindan citoprotección en eventos proapoptóticos y de estrés celular 4,6,8-14. También están involucradas en la presentación de antígenos mediante la transferencia de péptidos antigénicos a las moléculas clase I del complejo mayor de histocompatibilidad (CMH-I). Algunas HSPs secretadas extracelularmente pueden activar a células presentadoras de antígenos, como macrófagos y células dendríticas 15-20.
ESTRUCTURA DE LAS HSPS
La estructura de las HSPs (ver figura 1) está representada por 4 regiones funcionales conservadas: la primera pertenece a un dominio N-terminal (llamado dominio J) característico de la familia de las HSPs, corresponde al sitio de regulación por la actividad del ATP. La segunda porción es una región desordenada rica en Glicina/Fenilalanina, responsable de la flexibilidad de las proteínas, está adyacente al dominio J. La tercer región es un dominio rico en cisteína con repeticiones CXXCXGXG (donde X puede ser cualquier otro aminoácido) de unión al sustrato, está en la región media o central. Por último, la cuarta región corresponde al extremo C-terminal, que permite la dimerización de las HSPs. Estas proteínas se unen a los segmentos hidrofóbicos de los péptidos para poder cumplir su actividad como chaperonas y su unión es dependiente de ATP 10.
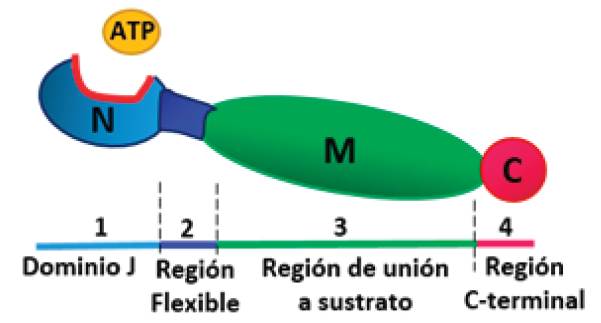
Las HSPs tienen 4 regiones funcionales conservadas. En Azul claro dominio N-terminal (llamado dominio J), En azul la región flexible rica en glicina/fenilalanina, en verde la región M de unión al sustrato y en rojo la región N-terminal. Fuente: Realizada por los autores de la revisión.
Figura 1 Estructura esquemática de las HSPs.
FAMILIA DE LAS HSP PEQUEÑAS
Esta familia presenta un peso molecular entre 15 y 30 KDa, son proteínas ubicuas y altamente conservadas. Se han reportado tres isoformas, aunque su función ha sido poco caracterizada. En general se sobre expresan bajo condiciones de estrés celular y contribuyen a preservar la viabilidad de la célula, manteniendo la conformación nativa de las proteínas citosólicas 30,31.
Hsp22: también conocida como a- B cristalina o Hspβ-8, es codificada por el gen HSPB8, localizado en el cromosoma 12 32, y se encuentra en todas células del cuerpo aunque es particularmente abundante en las células nerviosas. Parece interactuar con la Hsp27 (Hspβ-1) en las células nerviosas, ayudando a organizar la red de neurofilamentos de los axones 33.
Hsp27: es producida por el gen HSPBAP1 del cromosoma 3 y fue originalmente denominada Hspβ-1 o proteína de respuesta a estrés srp-27 34. Se expresa en órganos sensibles a estrógenos como el útero, la vagina y piel. Presenta cambios significativos en su localización y expresión durante las diferentes fases del ciclo menstrual 35. Adicionalmente, se encuentra en el cordón umbilical y en menor proporción en la placenta 36. Participa en termotolerancia, proliferación celular, resistencia a drogas, polimerización de actina y como chaperona 37,38. Se sabe que está involucrada en el transporte del receptor estrogénico desde el citoplasma al núcleo 39.
FAMILIA HSP40
Esta familia es codificada por cerca de 44 genes HSPF1 localizados en los cromosomas 3 y 19 40,41. Contribuyen al plegamiento de proteínas y previenen su agregación; actúan como cochaperonas junto a la Hsp70, actividad que es regulada por la hidrólisis del ATP en su sitio activo. Pueden actuar como chaperonas por sí solas y se encuentran localizadas principalmente en el retículo endoplásmico. Esta familia se clasifica en 3 subfamilias de A-C o tipo I, II y III. La subfamilia A está constituida por las proteínas con los cuatro dominios antes mencionados, tiene actividad chaperona autónoma y puede interactuar o no junto con Hsp70. La subfamilia B contiene proteínas que carecen del dominio rico en cisteínas y la subfamilia C tiene solo el dominio J, que no se sitúa necesariamente en el extremo N-terminal; estas dos últimas subfamilias dependen totalmente de la actividad de Hsp70 22.
FAMILIA DE HSP60
Son una familia de chaperonas mitocondriales codificadas por dos genes HSPD1 localizados en el cromosoma 2 42. Se encuentran localizadas principalmente en la mitocondria, e incluso se han encontrado en la membrana citoplasmática de algunas células. Son responsables del trasporte y plegamiento de proteínas desde el citoplasma hacia la matriz mitocondrial 25.
FAMILIA DE HSP70
Son codificadas por 13 genes localizados en los cromosomas 1, 5, 6, 9, 14 y 21 43,44 y son abundantes en células eucariotas, donde actúan como chaperonas. En cooperación con otras chaperonas, como Hsp40, Hsp90 y Hsp110, se unen a los segmentos hidrofóbicos de los polipéptidos durante la traducción y translocación de los mismos hacia los diferentes compartimentos subcelulares. Se encuentran localizadas en el citoplasma, así como dentro de algunos organelos. Participan en la eliminación de las proteínas dañadas o defectuosas mediante la interacción con el extremo C-terminal de la Hsp70 (Proteína CHIP), que es una E3 ubiquitin ligasa 45.
FAMILIA HSP90
Están codificadas por 17 genes agrupados en 4 clases (HSP90AA, HSP90AB, HSP90B y TRAP, localizados en los cromosomas 1, 3, 4, 6, 11, 12, 13, 15 y 16 46. Se encuentran en el citoplasma, en la superficie celular, e incluso es excretada extracelularmente, y son unas de las proteínas más abundantes de la célula 47,48. Se han encontrado más de 100 proteínas que son reguladas por la Hsp90, dentro de las que se incluyen proteínas tales como Akt, Neu/Her-2 (ErbB2), HIF-1a, Bcr-ABl, Raf-1 y p53 mutado 49. Muchas de estas proteínas son importantes mediadores de la transducción de señales y del control del ciclo celular, por ende, la Hsp90 ha sido involucrada como una de las principales HSPs en el desarrollo y progresión tumoral.
EVENTOS ESENCIALES PARA LA PROGRESIÓN TUMORAL
Las neoplasias se forman mediante una serie de pasos en los que la célula normal pasa a ser una célula transformada. Estos pasos implican cambios morfológicos y moleculares que han sido establecidos en los siguientes 6 eventos: 1) Autosuficiencia en las señales de crecimiento, 2) insensibilidad a la inhibición del crecimiento, 3) evasión de la muerte celular programada, 4) potencial replicativo ilimitado, 5) angiogénesis sostenida y 6) invasión tisular y metástasis 50. Es importante aclarar que todos estos pasos no se cumplen para los tumores no sólidos.
Los aumentos en la expresión de HSPs parecen estar implicados no solo en la mayoría de estas etapas del desarrollo tumoral, sino también en la adquisición de fenotipos fármacoresistentes, en especial cuando las neoplasias son sometidas a terapias citotóxicas y con esto seleccionan las células resistentes.
MECANISMOS MOLECULARES DE LAS HSPS QUE FAVORECEN EL DESARROLLO TUMORAL
Adquisición de un fenotipo maligno/ Autosuficiencia en las señales de crecimiento
Las HSPs se han involucrado como proteínas favorecedoras del proceso de transformación celular durante la oncogénesis por sus efectos sobre rutas anabólicas celulares, como la Hsp27 que interactúa con la proteína-quinasa PKD1. En células PC3 (cáncer de próstata), la proteína PKD1 fosforila a Hsp27 en los residuos de serina 82, y este evento se asocia con el trasporte nuclear del receptor de Andrógenos (AR), resultando en un incremento de la actividad transcripcional del AR, lo cual favorecen el crecimiento tumoral 38. En varios ensayos realizados en células Rat-Myc y HeLa se ha encontrado que la Hsp90 es requerida para estabilizar la actividad de HER2, lo cual sugiere que este mecanismo favorece la actividad de las proteínas que se encuentran ubicadas corriente abajo de esta vía, tales como Akt, c-Src, Raf- 1 y cdk4, las cuales juegan un papel en el crecimiento y supervivencia celular. Así mismo, en células Rat se muestra que c-Myc directamente se une a la región proximal del promotor del gen de Hsp90a e induce una sobreexpresión de la Hsp90a, lo cual desencadena transformación celular. Cuando Hsp90 es inducida a través de c-Myc puede controlar la actividad de múltiples rutas envueltas en transformación celular; esto se demuestra al emplear RNA de silenciamiento (siRNA) para la Hsp90a/ Hsp86a, logrando así una reducción de la transformación de las células HeLa y RatMyc, que son positivas para c-Myc 51. Por otro lado, Hsp90 estabiliza la conformación de proteínas oncogénicas que se generan durante la tumorogénesis, tales como v-Src, Bcr-Abl y p53. Esta actividad fue evaluada en células HL-60/Bcr-Abl y células K562, y se demostró que al emplear un inhibidor específico de Hsp90 (geldanamicina o 17- AAG) se induce la degradación vía proteasoma de Brc-Abl, la acumulación citosólica de citocromo C y activación de las caspasas 9 y 3, lo cual desencadena apoptosis 52. Se debe tener en cuenta que las HSPs pueden proteger a las proteínas celulares, evitando que se desnaturalicen o se pliegen incorrectamente durante la oncogénesis, mediante la conformación de complejos heterogéneos entre múltiples chaperonas (Hsp90, Hop, p23, Hsp70 y Hsp40) y las proteínas celulares, incrementando así la eficiencia del chaperoneo de las HSPs sobre las proteínas oncogénicas 26.
Insensibilidad a la inhibición del crecimiento
Aunque la Hsp70 y Hsp90 se unen a las proteínas supresoras de tumores p53 y Rb10 y se acumulan en células neoplásicas que tienen mutaciones en p53 53, el rol que desempeñan las HSPs en esta etapa parece no ser tan trascendental. Se conoce que la Hsp72 disminuye la senescencia en células neoplásicas al disminuir la actividad de p53/p21 y alternativamente bloquea las señales senescentes reguladas por ERK; estos dos mecanismos activan vías oncogénicas a través de PI3K y Ras 54.
Evasión de la muerte celular programada
La respuesta celular de estrés confiere cito-protección a través de la sobreexpresión de diversas HSPs. Se ha encontrado que la Hsp27 interactúa con el factor de inicio de la traducción 4E (eIF4E), disminuyendo la ubiquitinación y degradación proteasomal de este factor; esta interacción protege el proceso de inicio de la síntesis de proteínas para aumentar la supervivencia celular estableciendo un mecanismo antiapoptótico 55. Hsp70 suprime la apoptosis por la asociación directa con Apaf-1, bloqueando el montaje de un apoptosoma funcional, al prevenir el reclutamiento de caspasas en este complejo 56. Igualmente, Hsp70 inhibe la apoptosis al disminuir los niveles de calcio citosólico y estabilizar los lisosomas, previniendo la liberación de catepsina B de los lisosomas, la translocación de Bax y la liberación de cito-cromo c mitocondrial 57-61. Los anteriores mecanismos fueron demostrados mediante la transfección con cDNA antisentido dirigido contra Hsp70 en células PC3 de cáncer de páncreas, células T Jurkat de leucemia linfoide aguda humana y HT29 de cáncer de colon, líneas celulares que expresan Hsp70 en la membrana del lisosoma. En la línea celular PC3 se incrementó la apoptósis al emplear un oligonucleótido antisentido dirigido contra Hsp70 o al emplear quercetin, un bioflavo-noide que disminuye la expresión de Hsp70, lo cual demuestra la importancia de la Hsp70 como proteína antiapoptótica. Por el contrario, al administrar Hsp70 purificada, en la misma línea celular, se inhibe la apoptosis de forma dosis dependiente 62. Al utilizar xenoinjertos de células KATO, de cáncer de estómago que sobreexpresan Hsp105, en un modelo murino de ratones diabéticos no obesos con inmunodeficiencia severa combinada (NOD SCID) y empleando un siRNA dirigido contra Hsp105, se mostró que la supresión de esta proteína induce muerte celular por apoptosis y, que por el contrario, al incrementar la expresión de esta misma proteína la muerte celular disminuye 63, lo cual sugiere que la sobreexpresión de la Hsp105 ofrece una protección ante la apoptosis en células con transformación maligna. La figura 2 resume los diversos mecanismos antiapoptóticos mediados por las HSPs.
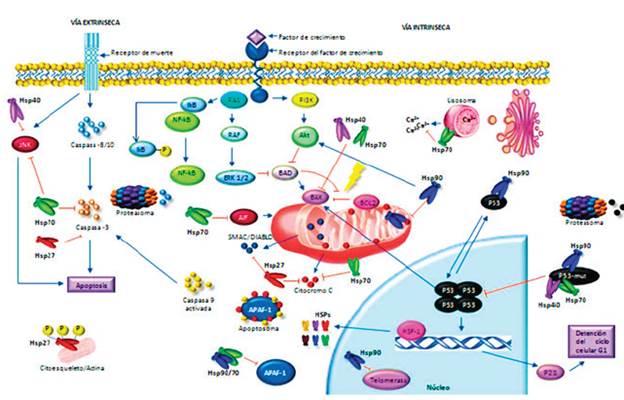
En células neoplásicas la respuesta al estrés celular puede conferir citoprotección mediante la sobreexpresión de las HSPs, entre ellas las Hsp90, 70, 40, 27. Por ejemplo Hsp27 estabiliza el citoesqueleto y bloquea a la caspasa 3. El complejo Hsp70/90 suprime la apoptosis por la asociación directa con Apaf-1, bloqueando el montaje de un apoptosoma funcional. Igualmente, Hsp70 y hsp27 inhiben la apoptosis al atenuar los niveles de calcio citosólico y estabilizar los lisosomas, previniendo la liberación de catepsina B de los mismos, la translocación de Bax, SMAC/DIABLO y la liberación de citocromo c mitocondrial. Otro mecanismo antiapoptótico de la Hsp70 se da mediante el bloqueo de AIF y la caspasa 3. El Complejo Hsp90/70/40 bloquea la actividad de P53. Fuente: Realizada por los autores de la revisión.
Figura 2 Principales mecanismos antiapoptóticos mediados por las HSPs
Evasión de la respuesta inmune
Las células tumorales liberan varios factores que pueden ayudar a la progresión del tumor, contribuyendo directamente al crecimiento neoplásico y/o a la supresión de la inmunidad antitumoral. Se ha demostrado que varios tumores primarios de mama humanos expresan niveles elevados de Hsp27 a nivel intracelular y que adicionalmente estos pacientes tienen altos niveles de Hsp27 en el intersticio y en el plasma al compararlos con los pacientes control 64. Igualmente, se ha descrito que las Hsp27 solubles causan la diferenciación de los monocitos a macrófagos asociados a tumores (TAMs) con fenotipos inmunotolerantes (HLA-DRlow, CD86low, PD-L1high, ILT2high y ILT4high), lo cual crea un estado de anergia ante el tumor. Además, estos TAMs pierden actividad tumoricida, se vuelven extremadamente proangiogénicos 65.
Otro estudio que analizó muestras de cáncer de seno mostró un incremento en la localización nuclear de Hsp90 con una disminución del HLA-1. Esta disociación sugiere un mecanismo de evasión de la respuesta inmune en células tumorales, porque Hsp90 altera la transferencia de péptidos antigénicos al HLA-1, evadiendo la respuesta antitumoral de los linfocitos T citotóxicos 66.
Potencial replicativo ilimitado
Todas las células somáticas poseen puntos de control que limitan el número de divisiones celulares permitidas, y una vez que las células entran a estos puntos de control se inducen rutas de senescencia. Para escapar de este evento y experimentar un crecimiento ilimitado, las células tumorales deben superar el punto en el cual los telómeros se han acortado lo suficiente en los cromosomas como para evitar futuras divisiones celulares exitosas 67. Las HSPs parecen no ser mediadores importantes en el proceso de proliferación. Sin embargo, Hsp90 junto con la proteína p21, contribuyen al ensamblamiento de la telomerasa, y de esta manera a su activación, lo cual evita un acortamiento del telómero en células no senescentes, y por lo tanto la proliferación celular 68.
Angiogénesis
La Hsp90 interactúa con el factor inducido por hipoxia HIF-1 a, el cual se ha asociado con procesos angiogénicos y con el incremento en la radioresistencia en varios tipos de neoplasias, entre los que se encuentran principalmente el cáncer pulmonar, seno y estómago. En células A549 de cáncer de pulmón sometidas a radiación, el mecanismo de la expresión de HIF-1 a implica la síntesis de novo de la proteína HIF-1a a través de PI3K/Akt/ mTOR y la estabilización de HIF-1a mediante la interacción con Hsp90, que se da exclusivamente en células resistentes a la radiación 69. Al emplear el inhibidor de la Hsp90 17-alylamino-17demethoxygeldamanicina (17AAG) se disminuye la expresión del HIF-1 y la interacción entre estas dos proteínas. Lo anterior lleva a una disminución en la supervivencia celular y disminución de la producción de factores angiogénicos. Al aplicar in vivo 17AAG se disminuye el crecimiento tumoral y la angiogénesis 69. En células de cáncer de páncreas humano HPAF-II y L3.6pl se analizaron cambios en la activación de las vías Erk/Akt/HIF-1 relacionadas con Hsp90, y se mostró que al inhibir la Hsp90 con 17-AAG se disminuye la fosforilación del receptor de crecimiento similar a la insulina tipo | (IGF-IR| ), lo cual conduce a inhibición de la actividad de HIF1a y de STAT3/STAT5, que a su vez conduce a una disminución del factor de crecimiento endotelial vascular (VEGF). Igualmente, empleando 17-AAG en un modelo murino con xenoinjertos de las mismas células tumorales se disminuyó el crecimiento tumoral al reducir la fosforilación de STAT3, y a su vez disminuyó la expresión de IGF-IRp y la vascularización en el tejido neoplásico 70. Esto mismo se ha confirmado in vivo en modelos murinos para cáncer gástrico 71.
Invasión tisular y metástasis
Existen varios estudios que involucran a las HSPs en la capacidad de migración celular que es un paso importante durante el desarrollo neoplásico y la metástasis. Al emplear como modelo células de cáncer uterino (HeLa) y de seno (MDA-MB231) que han sido tratadas con el factor de crecimiento epidermal (EGF) se descubrió que durante el proceso de migración la Hsp70 se une y regula la localización de la enzima transglutaminasa tisular (tTG) 72. La actividad de la enzima tTG se ha asociado con la formación de un borde de ataque en el tejido neoplásico, en indiferenciación celular y en la estabilización de la matriz extracelular 73. Al emplear inhibidores de la actividad de Hsp70 se altera la unión de Hsp70 con la tTG y se disminuye la migración celular 72.
La excreción de la Hsp90 es considerado como un factor favorecedor del proceso invasivo y metastásico. Se ha descrito que la Hsp90 puede ser secretada por queratinocitos, células CL1-5 de cáncer pulmonar de células no pequeñas y células MCF-7 de cáncer de seno 74-76. Un modelo que emplea las células de cáncer de colon HCT-8, cultivadas en un medio condicionado por deprivación de suero, mostró un incremento en la secreción de Hsp90a y en la invasión celular 71. Este fenómeno se disminuyó al emplear un anticuerpo anti-Hsp90a, lo cual sugiere que Hsp90a favorece la invasión celular. Igualmente, Hsp90a induce selectivamente la expresión de la integrina aVβ3 mediante la activación de NF-kB. Esta integrina se sobre expresa en el tejido vascular de carcinoma de colon y se ha asociado como factor promotor de la angiogénesis, relacionándose con altos niveles de Hsp90 en el suero de pacientes con cáncer colorrectal 77,78. Un modelo que emplea células de fibrosarcoma muestra que la Hsp90α (pero no la Hsp90α ) secretada a nivel extracelular activa la metaloproteinasa de matriz-2 (MMP-2) y la plasmina, que son moléculas implicadas en la degradación de la matriz extracelular, y al emplear inhibidores de la Hsp90 no permeables a la célula se disminuye la capacidad invasiva y la activación de la MMP-2 y la plasmina 79. También se ha reportado la secreción de la Hsp90 en células de cáncer de colon HCT-8 y su asociación con un incremento en el proceso invasivo ante la deprivación de suero. En este modelo mediante ensayos de ligación por proximidad (Proximity ligation assay) se ha demostrado la unión de Hsp90 con varias proteínas, como Neu, que es también conocido como receptor del factor de crecimiento epidérmico humano 2 (HER2), a CD91α, también conocido como receptor α2-macroglobulina (α2MR), al receptor de apolipoproteína E (ApoER) o receptor relacionado con lipoproteínas de baja densidad (LPR), que es un inhibidor de proteasas como tripsina, plasmina, elastasa de neutrófilos y colagenasa de fibroblastos. Estos complejos entre Hsp90, Neu y CD91α inducen las vías de señalización de ERK, PI3K/Akt y NF-kB, p65, que terminan provocando la expresión de la integrina αV, que ha sido asociada con incremento de la invasividad tumoral tanto en ensayos in vitro como in vivo 80.
La localización de la Hsp90 en la membrana plasmática de células PC3 ha sido relacionada con un mayor potencial metastásico, porque al inhibir la actividad de la Hsp90 mediante el uso de anticuerpos específicos se inhibe la asociación entre la integrina β1, la proteína de adhesión focal FAK y c-Src, que son moléculas relacionadas con movilidad y proliferación celular. También se inhibe la fosforilación de FAK y c-Src, lo cual bloquea la activación de la vía integrina β1/FAK/c-Src/ p38/ ATF2/MMP9 y genera una disminución en el porcentaje de migración celular 81. Estos resultados sugieren un mecanismo por el cual la Hsp90 presente en la membrana citoplasmática incrementa el índice metastásico.
IMPORTANCIA CLÍNICA
HSPs como marcadores diagnósticos y pronósticos
Se ha asociado a la sobre expresión de HSPs con un mal pronóstico en una amplia gama de neoplasias en humanos, entre los que sobresalen el cáncer gastico, pulmonar, hepático, endometrio, ovario, seno, osteosarcomas, leucemia linfoblástica, linfomas, carcinoma prostático y de vejiga 82-89. Aunque los niveles de HSP no proporcionan información a nivel de diagnóstico, los niveles circulantes en sangre de HSPs y de anticuerpos anti-HSPs en pacientes con cáncer pueden ser útiles como marcadores biológicos para establecer el grado de diferenciación, el grado de agresividad y el estado del proceso oncogénico 85,86,90-95. Varias HSPs han sido implicadas en el pronóstico de tumores específicos, más notablemente la Hsp27, cuya expresión se asocia con un mal pronóstico en cáncer de seno, gástrico y hepático 96. Así mismo, las Hsp70 y Hsp90 se correlacionan con un mal pronóstico en cáncer de seno, de endometrio, colorrectal, cuello uterino y leucemias 78,97-99. El incremento en la expresión de las HSPs también puede predecir la respuesta a algunos tratamientos antineoplásicos 69,100. Por ejemplo, Hsp27 y Hsp70 están implicadas en la resistencia a la quimioterapia en el cáncer de seno y leucemia 101.
Las HSPs como abordaje terapéutico contra el cáncer
La implicación de las HSPs en el proceso oncogénico ha planteado el desarrollo de dos estrategias principales para el tratamiento de neoplasias. La primera se basa en la modificación farmacológica de la expresión de HSPs o de su actividad como chaperonas moleculares 63,102-111 y la segunda se fundamenta en el uso de las HSPs como vacunas contra el cáncer, explotando su capacidad para actuar como adyuvantes inmunológicos al presentar péptidos tumorales 112-115. Hasta ahora, solo están disponibles para uso clínico algunos inhibidores farmacológicos de Hsp90, como Geldanamicina y su análogo la 17-alilamino-17-deemethoxygeldanamycin (17-AAG), dos fármacos que actualmente se encuentran con ensayos en fase I y II para probar su actividad contra el cáncer 116-118. Lamentablemente, existen pocos reactivos que inhiben selectivamente la Hsp70 citosólica (Quercetin:3,3,4,5,7-Pentahydro-xyflavone C15H1007 2H2O; Pifithrin a), sin poder inhibir las demás localizaciones. En cuanto a Hsp27 y Hsp70, los oligonucleótidos antisentido contra estas proteínas han demostrado ser útiles contra el cáncer de vejiga para restablecer la apoptosis y retrasar la progresión tumoral 119-122. Estrategias antisentido también se han empleado en el tratamiento de cáncer de ovario 123. Estas estrategias terapéuticas conducen a la degradación de las proteínas sustrato y a la detención del crecimiento tumoral en G1 o G2 y la activación de la apoptosis 124-126. Se usan estos fármacos asumiendo que las células tumorales, en comparación con sus contrapartes normales, exhiben un fenotipo con una dependencia mayor en la acción citoprotectora de las HSPs.
CONCLUSIONES
Los miembros de las distintas familias de HSPs desempeñan un papel esencial en el desarrollo tumoral al facilitar el crecimiento autónomo al brindar estabilidad de oncogenes sobreexpresados o mutados, lo cual bloquea las vías de muerte celular programada (apoptosis) y promoviendo la activación de factores que degradan la matriz extracelular. La sobreexpresión de las HSPs en muchos tipos de cáncer ofrece un espacio para el diseño e implementación de tratamientos que puedan inhibirlas, coadyuvando al tratamiento antineoplásico. Los ensayos realizados hasta ahora muestran resultados prometedores para el tratamiento del cáncer basado en la inhibición de estas proteínas. Sin embargo, cabe resaltar que la expresión de las HSPs es bastante heterogénea y no se ha desarrollado un estudio que evalué la expresión conjunta de todas las familias de HSPs para poder establecer cuáles se sobreexpresan o, por el contrario, cuáles disminuyen, por lo tanto se debe evitar la generalización de los resultados obtenidos.














