INTRODUCCIÓN
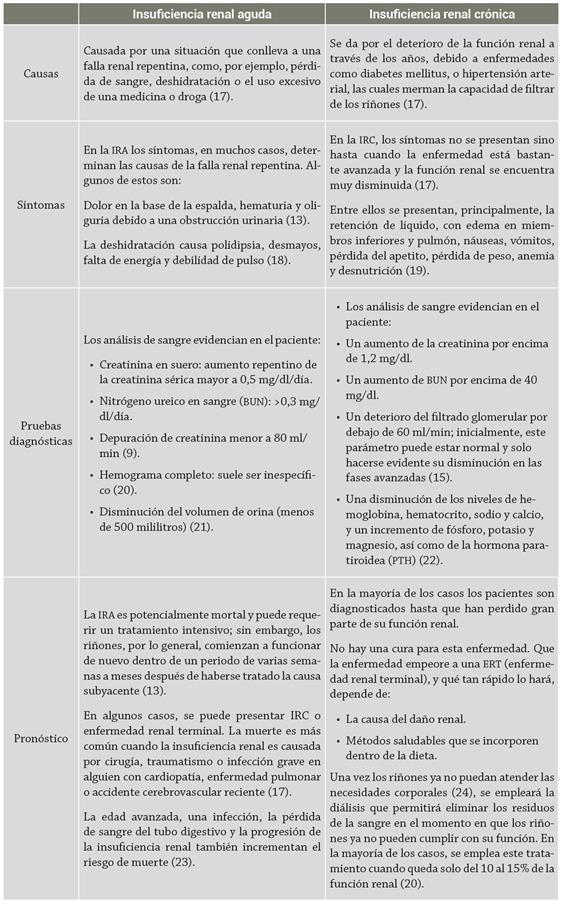
La insuficiencia renal (IR) es una enfermedad caracterizada por una disminución de la función renal 1. Se puede subdividir en insuficiencia renal aguda (IRA) e insuficiencia renal crónica (IRC), de acuerdo con el tiempo de desarrollo de la enfermedad 2. La IRA se caracteriza por una brusca disminución en el filtrado glomerular (FG), con el aumento de la concentración de productos nitrogenados en sangre (azoemia) e incapacidad de mantener la homeostasis hidroelectrolítica, que puede acompañarse de oliguria (diuresis diaria inferior a 400 ml) y suele instaurarse rápidamente 3. Por su parte, la IRC se caracteriza por la presencia de anormalidades en la estructura o en la función renal por más de tres meses y, por lo general, se detecta al utilizar la tasa de filtración glomerular (TFG) estimada 4; esta tasa es igual a la suma de las tasas de filtración de todas las nefronas funcionantes, por lo que es una medida aproximada del número de nefronas íntegras trabajando 5.
El reconocimiento de la IR en las etapas iniciales es fundamental para retardar la cronicidad de la enfermedad. Esto, al tornar posible la recuperación renal y evitar que el individuo se someta a la terapia de sustitución renal 2. En la actualidad, el diagnóstico inicial de la insuficiencia renal suele realizarse por aumento de creatinina sérica 6 evaluation, and management of chronic kidney disease (CKD y la estimación del FG, el cual puede hacerse a partir del aclaramiento de sustancias endógenas (creatinina y/o urea) y exógenas, o mediante ecuaciones estimativas validadas en poblaciones determinadas 7. El aclaramiento de creatinina de 24 horas se ha restringido a situaciones en las que el valor de creatinina sérica está muy influido por factores dependientes del paciente, tales como el peso, la masa muscular, el estado nutricional, las enfermedades crónicas y la dieta 8.
La ausencia de un marcador endógeno de filtrado glomerular preciso, exacto y no invasivo es aún un factor limitante en la evaluación de la función renal 9. Por esta razón, se han investigado nuevos marcadores que permitan detectar de forma precoz la lesión renal y que no se vean influenciados por diferentes factores dependientes del paciente. Este es el caso de la cistatina C 10, una proteína de bajo peso molecular propuesta como marcador de función renal más sensible que la creatinina al detectar de forma precoz alteraciones en la función renal. De hecho, la cistatina C no se modifica por los factores que afectan las concentraciones de la creatinina sérica 11 cystatin C, total and fractionated cholesterol and markers of myocardial necrosis. The glomerular filtration rate (GFR, de ahí la importancia de este biomarcador como un examen de rutina para la determinación temprana de daño renal en poblaciones que se encuentren en riesgo de sufrir una IR 12.
Esta revisión busca proporcionar información actual de los avances de los últimos diez años reportados para mejorar el diagnóstico de enfermedad renal con marcadores como, por ejemplo, la cistatina C, en comparación con otros analitos convencionales utilizados en la práctica clínica.
MATERIALES Y MÉTODOS
La revisión bibliográfica se realizó mediante la búsqueda de información bases de datos como: Google Scholar, ScienceDirect, Sciverse, Scopus, Elsevier, Scielo Embase, Pubmed, NCBI (National Center for Biotechnology Information), OVID y ProQuest. Se utilizaron como palabras clave cistatina C, creatinina, diagnóstico, lesión renal aguda, fallo renal crónico, tasa de filtración glomerular. La búsqueda de artículos se realizó teniendo en cuenta la combinación de las palabras claves y se utilizaron los conectores (Y (AND), O (OR)); se tomaron aquellos artículos que cumplieron con los criterios de inclusión como: artículos en idioma inglés y español, artículos publicados durante los últimos 10 años, relacionados con enfermedad o lesión renal. No se tuvieron en cuenta aquellos artículos que no contaban con la información necesaria o específica para hacer parte de la revisión; como resultado se obtuvieron 75 artículos y se seleccionaron 61.
INSUFICIENCIA RENAL
La IRA es una enfermedad caracterizada por una disminución súbita (horas a semanas) de la función renal y, como consecuencia de esto, retención nitrogenada; la etiología es múltiple, pero para el enfoque diagnóstico usualmente se divide en prerrenal, posrenal e IRA intrínseca 13. En la forma prerrenal, la retención de sustancias nitrogenadas es secundaria a una disminución de la función renal fisiológica, debido a una disminución de la perfusión renal, tal como ocurre en la deshidratación, la hipotensión arterial, la hemorragia aguda, la insuficiencia cardíaca congestiva o en la hipoalbuminemia severa, etc. 7. La insuficiencia renal aguda posrenal es, por lo general, un problema de tipo obstructivo que puede ocurrir en diferentes niveles (uretral, vesical o ureteral), mientras que en la insuficiencia renal intrínseca se presenta daño tisular agudo del parénquima renal y la localización del daño puede ser glomerular, vascular, tubular o intersticial 14. En la actualidad, la morbilidad y la mortalidad de la IRA es elevada. Su incidencia en pacientes hospitalizados es aproximadamente del 5%, y hasta de 30% en admisiones a unidades de cuidados intensivos. La característica fundamental es la elevación brusca de las sustancias nitrogenadas en la sangre (azotemia) y puede acompañarse o no de la disminución de orina (oliguria) 13.
Por otra parte, la IRC es cada vez más reconocida como problema global en salud pública 15. Existe evidencia concluyente de que la IRC puede detectarse mediante pruebas de laboratorio simples, así como de que el tratamiento puede prevenir o retrasar las complicaciones de la función renal disminuida y, de este modo, reducir el riesgo de enfermedades cardiovasculares 16. Este tipo de insuficiencia afecta a cerca del 10% de la población mundial: su incidencia aumenta con la edad, y es de un 20% en personas mayores de 60 años, y de un 35% en mayores de 70. Si bien se puede prevenir, no tiene cura, suele ser progresiva, silenciosa y no presentar síntomas hasta etapas avanzadas 3.
A diario, en los laboratorios clínicos se estima la función renal con diversos biomarcadores que están sujetos a la masa corporal, el consumo de alimentos y otras variables interindividuales, como es el caso de la creatinina y el nitrógeno ureico. También se tienen en cuenta otros marcadores como, por ejemplo, la microalbuminuria y las proteínas en orina de 24 horas. La tasa de filtración glomerular (TFG) se establece por medio de ecuaciones que hacen referencia al volumen de fluido filtrado por unidad de tiempo desde los capilares glomerulares renales hacia el interior de la cápsula de Bowman 25; esta rodea al glomérulo y ambos forman el corpúsculo renal, el lugar dónde se produce el filtrado sanguíneo con el que comienza la formación de la orina 26. El FG constituye el mejor índice de valoración de función renal tanto en individuos sanos como en enfermos, pero esta valoración es muy poco fiable, ya que se deben tener en cuenta diversos factores asociados para su determinación 7, tales como: pacientes con masa muscular alterada (amputados, parálisis), índice de masa corporal extremo (IMC < 18,5 ó > 35 kg/m2) y situaciones que requieren un alto grado de exactitud en la medida del FG, así como posibles donantes de riñón 27.
MARCADORES CONVENCIONALES DE FUNCIÓN RENAL
Creatinina
Es el producto de desecho proveniente de la descomposición natural de lo músculos durante la actividad física; los riñones saludables filtran creatinina de la sangre y la desechan en la orina 28. En pacientes con enfermedad renal aumenta su concentración en la sangre y se usa como marcador del grado de insuficiencia renal. La creatinina es el marcador endógeno de FG más utilizado, a pesar de estar sometido a diferentes fuentes de variabilidad (edad, dieta, sexo y masa muscular) 29, así como a interferencias analíticas tales como suero hemolisado, muestras que han sido almacenadas a temperatura ambiente, muestras recolectadas en tubo con heparina y algunos fármacos que incrementan el valor de creatinina 30. La sensibilidad diagnóstica de la concentración sérica de creatinina para identificar estadios tempranos de disfunción renal es insuficiente, ya que su concentración en suero no se eleva hasta que el FG no está por debajo del 50% del límite superior de referencia 10. Por otra parte, el valor de creatinina calculado a partir de la concentración sérica de creatinina y su excreción en orina de 24 horas es el procedimiento principalmente utilizado para la medida del FG 6. Sin embargo, presenta inconvenientes como, por ejemplo, errores en la recolección de orina de 24 horas y la sobreestimación del FG, debido a la secreción tubular de creatinina 31. Al tener en cuenta estas limitaciones, se han desarrollado ecuaciones para la estimación del FG a partir de la concentración de creatinina sérica y de variables demográficas y antropométricas. Las más conocidas y validadas en distintos grupos de población son la de Cockcroft-Gault (C-G) y la del estudio Modification of Diet in Renal Disease con cuatro variables (MDRD-4), la de Schwartz para la población adulta y la de Counahan-Barratt para la población infantil 32.
BUN
El nitrógeno ureico en sangre, BUN por sus siglas en inglés (blood ureic nitrogen), es otro de los principales marcadores utilizados en la práctica clínica; su valor normal en sangre es de 5-20 mg/ dl. Este valor puede elevarse y generar un indicio del grado de insuficiencia renal, por medio de la medición de los productos de desecho en sangre (urea) 13, que corresponden a la cantidad de nitrógeno que forma parte de la urea plasmática 33. La sangre lleva proteínas a las células de todo el cuerpo; después de que las células usan las proteínas, el producto de desecho restante regresa a la sangre como urea, un compuesto que contiene nitrógeno. Su valor es aproximadamente la mitad del de la urea (BUN = urea/2,14) 3; una ingesta proteica elevada, el aumento del catabolismo proteico, la presencia de sangrado gastrointestinal y los estados de deshidratación son otros factores por los cuales se puede ver elevado el valor de la urea en la sangre 34.
Nuevo biomarcador de función renal: cistatina C
La cistatina C fue descrita por primera vez en 1961. Se halló en líquido cefalorraquídeo y se denominó "proteína Y-traza". Es una proteína no glucosilada con un peso molecular de 13,3 kDa, constituida por una sola cadena de 120 aminoácidos con dos puentes disulfuro 35. Es el producto de un gen de mantenimiento, localizado en el cromosoma 20, lo cual explica su síntesis de forma constante en todas las células nucleadas del organismo y su presencia en casi todos los fluidos biológicos 36.
Tabla 2 Concentración de cistatina C en fluidos corporales adultos
| Fluido corporal | Concentración media (µg/ ml) | Intervalo biológico de referencia (µg/ml) |
|---|---|---|
| Semen | 51.0 | 41.2-61.8 |
| Líquido cefalorraquídeo | 5.80 | 3.20-12.5 |
| Leche | 3.4 | 2.20-3.90 |
| Lágrimas | 2.40 | 1.30-7.40 |
| Saliva | 1.80 | 0.26-4.80 |
| Líquido amniótico | 1.00 | 0.80-1.40 |
| Plasma | 0.96 | 0.57-1.79 |
| Orina | 0.10 | 0.03-0.29 |
Fuente: 55.
Esta proteína pertenece a la familia 2 de la superfamilia de inhibidores de cisteína-proteasas constituida por 11 miembros, de los cuales la cistatina C es el inhibidor endógeno de cisteína proteasa más importante 25. Desempeña una función protectora mediante la inhibición de las catepsinas (B, H, L y S) que intervienen en el metabolismo intracelular de proteínas, el catabolismo del colágeno y la degradación de la matriz celular. Además, se le ha atribuido un papel defensivo en infecciones bacterianas y víricas. Debido a su pequeño tamaño y a que su punto isoeléctrico de 9,3 le confiere una carga positiva al pH fisiológico 10, se filtra libremente por el glomérulo y se reabsorbe en el tú-bulo proximal, donde es catabolizada completamente por las células tubulares, por lo que no retorna hacia el torrente sanguíneo 37; puede considerarse un buen marcador de función renal dado que:
Su producción a nivel celular es constante y su concentración plasmática se mantiene estable.
No se une a proteínas plasmáticas.
Se filtra libremente por el glomérulo.
A diferencia de la creatinina, su concentración plasmática es independiente de factores derivados del paciente 38.
Es por esto que en ausencia de daño tubular, su concentración en orina es muy baja, de 0,03 a 0,3 mg/L 38, debido a sus características fisiológicas y a que su concentración sérica no se afecta significativamente por cambios en la masa muscular, la edad, el sexo y la dieta. Además de que la cistatina C se ha propuesto como marcador de FG desde 1985, diversos estudios sugieren su superioridad frente a la creatinina en la estimación del FG 10, al ser de mayor utilidad en la detección precoz de la enfermedad renal, en especial cuando otras pruebas o parámetros todavía no se alteran, y antes incluso de que aparezcan signos y síntomas. Se utiliza también aisladamente o junto con la creatinina en sangre en las fórmulas de estimación del filtrado glomerular 39, y es de gran utilidad para confirmar la existencia de fallo renal crónico en personas con una tasa estimada de filtrado glomerular cercana a 60 ml/min. Por esta razón es importante que esta prueba se pueda incluir como un examen de rutina para la determinación temprana de daño renal en poblaciones que se encuentren en riesgo de sufrir una lesión renal 40, de modo que sea posible estimar la superioridad de la cistatina C como marcador para calcular la filtración glomerular en comparación con otros analitos convencionales, en busca del menor cambio en la función renal, a fin de estar así en capacidad de intervenir inmediatamente y evitar la progresión en el daño renal 9.
Un nivel sérico elevado de cistatina C se corresponde con una TFG disminuida y, por tanto, con disfunción renal; dado que la cistatina C se produce prácticamente en todas las partes del organismo a una tasa de producción constante, y puesto que se elimina por filtración glomerular, al ser luego reabsorbida y degradada en el riñón 41, la concentración de cistatina C debería permanecer en un estado de equilibrio en la sangre, siempre y cuando los riñones estén funcionando correctamente y la TFG sea normal 42.
Como se ha mencionado, la creatinina actualmente es el marcador endógeno de FG más utilizado a pesar de estar sometido a diferentes fuentes de variabilidad. En esto radica la importancia de incorporar en la práctica clínica un marcador endógeno que no se encuentre influenciado por características propias del paciente, como es el caso de la cistatina C. Además, diversos estudios sugieren su superioridad frente a la creatinina en la estimación del FG por diferentes ventajas que posee frente a la creatinina. Sin embargo, en la actualidad este no se utiliza en la práctica clínica como predictor de insuficiencia renal debido al alto costo del kit comercial. En la Tabla 3 se presentan las principales ventajas y desventajas de la creatinina y de la cistatina C.
INCORPORACIÓN DE LA CISTATINA C EN LA CLÍNICA DIARIA
Existe una amplia evidencia de que los niveles de cistatina C están menos influenciados que la creatinina por la edad, el sexo y la etnicidad, lo que se asocia probablemente a su menor dependencia de la masa muscular que el filtrado glomerular estimado con creatinina 29. Este hecho hace que probablemente el filtrado glomerular estimado con cistatina C sea más exacto que el basado en la creatinina en personas con malnutrición o fallo renal crónico que tienen menos masa muscular 21, tal como se muestra a continuación, en el compendio que se realizó de 13 investigaciones en las que se muestra la efectividad de la cistatina C como marcador de función renal. Sin embargo, la cistatina C tiene también limitaciones. Sus niveles se pueden ver afectados por factores no renales, como, por ejemplo, estados de disfunción tiroidea y el uso de esteroides 10, y sus modificaciones en situaciones de enfermedad aguda no son totalmente conocidos. Además, el costo de su determinación es 10 veces superior al de la creatinina sérica y la ausencia de estandarización de los kits, actualmente comercializados, puede contribuir al rechazo para su uso en la clínica diaria 49.
A continuación, se identifican estudios a nivel mundial, reportados en los últimos seis años, que señalan la utilidad clínica de cistatina C como marcador de IR. En la búsqueda realizada de los artículos de forma ascendente se encuentra que para el 2011 se llevó a cabo un estudio en Brasil denominado "Cystatin c and inflammatory markers in kidney transplant recients", en el cual se evaluó el perfil de cistatina C en 23 pacientes receptores de riñón. Los niveles fueron muy similares a los de creatinina en contraste con otros marcadores, pues estos dos analitos parecen ser buenos predictores de injerto temprano en pacientes con trasplante y se pueden utilizar para establecer acciones que previenen la pérdida funcional del injerto 50. En el 2012, un estudio realizado en Filipinas titulado "Estimatig glomerular filtration rate from serum creatinine and cystatincen", desarrolló ecuaciones de estimación basadas en cistatina C sola y en combinación con creatinina en diversas poblaciones, totalizando 5352 participantes de 13 estudios; estas ecuaciones fueron validadas en 1119 participantes de cinco estudios diferentes en los que se había medido la TFG, y en los que la ecuación de creatinina-cis-tatina C se desempeñó mejor que las ecuaciones que utilizaron solo creatinina o cistatina C 51.
Más adelante, en el 2014, en República Dominicana, se realizó una investigación titulada "Detección de cistatina C sérica en padres hermanos e hijos de pacientes con IRC terminal". En esta participaron un total de 67 colaboradores, entre padres, hermanos e hijos de pacientes con IR terminal. Se evidenció que los niveles de cistatina C sérica normales de la población de estudio estuvieron en el 38.8% de la población, y niveles elevados en el 61.2% (estos últimos se encontraron en mayor porcentaje en el sexo femenino); se reportó, además, una disminución de la TFG calculada por el nivel de cistatina C en un 79.11% de la población, y se obtuvo que 53 de los 67 participantes presentaban una disminución de la TFG estimada por cistatina C 52.
Para el 2015, en México, se realizó un estudio transversal comparativo, en el cual se analizaron 106 muestras de pacientes pediátricos que asistieron a consulta externa para evaluación de la función renal con el uso de TFG, creatinina y cistatina C; en los resultados se evidenció que niveles elevados de cistatina C identifican un mayor número de pacientes con factores de riesgo para IRA en pacientes que tienen pocos signos y síntomas en estadios tempranos de esta enfermedad 12. Al mismo tiempo, en Argentina se realizó una investigación titulada "Cistatina C como predictor de síndrome cardiorrenal y mal pronóstico en pacientes internados por insuficiencia cardiaca aguda y función renal normal", la cual se llevó a cabo con 166 pacientes con diagnóstico de insuficiencia cardíaca aguda sin disfunción renal, a quienes se les midió cistatina C al ingreso. Dicho biomarcador ha surgido como un indicador de función renal alternativo a la creatinina, además es predictor de desarrollar EFR (empeoramiento de desarrollo función renal) durante la internación, y de mayor mortalidad en esta población con insuficiencia cardíaca aguda y función renal conservada al ingreso 53.
En este mismo año se llevó a cabo un estudio de tipo longitudinal observacional en España, con un total de 109 niños pretérmino. En él se determinó la concentración en suero de cistatina C como marcador de la función renal en recién nacidos al comparar los resultados con la creatinina, a fin de observar si este marcador se modifica por alguna patología o por fármacos neurotóxicos; se observó que la cistatina C proporciona una mayor sensibilidad (97%) y especificidad (96%) en comparación con la creatinina en pacientes recién nacidos 29. Para el 2016, en India, se desarrolló una investigación denominada "Diagnostic accuracy of serum cystatin C for early recognition of contrast induced nephropathy in Western Indians undergoing cardiac catheterization", en la cual se compara la efectividad diagnóstica de la cistatina C en pacientes indios con nefropatía sometidos a cateterismo cardíaco. Participaron 253 pacientes y se concluyó que el aumento de este analito a las 24 horas podría usarse como marcador confiable para la identificación de nefropatía inducida por contraste en los pacientes sometidos a cateterismo cardíaco 54.
También en el 2015, en Turquía, se evaluó la insuficiencia renal en pacientes diabéticos tipo 2 con normoalbuminuria o microalbuminuria mediante la detección de cistatina C en suero y TGF urinario. Este fue un estudio transversal con un total de 78 pacientes; se encontró que el nivel sérico de cistatina C es significativamente mayor en pacientes del grupo normoalbuminúrico uno, mientras que los niveles séricos y urinarios de TGF-P1 fueron más altos en el grupo microalbuminúrico dos; el nivel sérico de cistatina C se correlacionó negativamente con TGB en el grupo dos . Finalmente, hubo una correlación negativa entre TFG y cistatina C en todos los grupos de pacientes 18. En el 2017, en México, se realizó una investigación en la que participaron 112 pacientes donantes renales. Se determinó que existe una fuerte correlación entre estimar el FG por ecuaciones basadas sobre cistatina C y la TFG mediante gammagrama DTPA-TC99M 56. En el 2018 se han reportado dos investigaciones con cistatina C, las cuales se llevaron a cabo en España. La primera se denomina "Evaluación de ecuaciones que utilizan cistatina C para estimar filtrado glomerular en adultos sanos candidatos a donantes renales". En este se realizó un estudio transversal en 72 pacientes de ambos sexos candidatos a donantes renales, para los cuales fue necesario la realización de pruebas tales como creatinina y cistatina C. Esta última se analiza mediante un ensayo in-munoturbimétrico, y se determinó tanto que las ecuaciones son favorables como que la cistatina C mejora la especificidad en el diagnóstico, pero con un mayor costo económico 27. El segundo, titulado "Cistatina c frente a creatinina en la determinación del riesgo basada en la función renal", realizó un metaanálisis de 11 estudios de base poblacional; contó con 90.750 participantes y cinco análisis de cohorte con fallo renal crónico. Se concluyó que la cistatina C aumenta la fuerza de disociación entre los riesgos de mortalidad y la enfermedad renal terminal en distintas poblaciones, y que la determinación de cistatina C, sumada a la de creatinina sérica, aumenta la precisión de la estimulación de la tasa de filtración glomerular 1.
Según lo anterior, se evidencia con claridad que la cistatina C tiene mayor utilidad como marcador diagnóstico de IR, ya que los niveles elevados de cistatina C identifican mayor número de pacientes con factores de riesgo para desarrollar IRA en personas que tienen pocos signos y síntomas en estadios tempranos de esta enfermedad. Asimismo, se correlaciona el contraste entre la creatinina y la cistatina C para la estimación de la TFG, ya que la cistatina C, sumada a la creatinina, aumenta la precisión y mejora así la sensibilidad en el diagnóstico.
TÉCNICAS DE CUANTIFICACIÓN DE CISTATINA C
Con respecto a las técnicas de cuantificación de cistatina C, se conoce que el primer método para la determinación de este analito en fluido biológico humano se realizó por inmunodifusión radial, desarrollada por Lofberg y Grubb en 1979. Han sido reportados otros ensayos que usan una variedad de técnicas, entre las que se incluyen el radioinmunoensayo, inmunoensayo enzimático (EIA) y el ensayo inmunoensayo absorbente ligado a enzimas (Elisa) 55. Un importante avance científico condujo al desarrollo de métodos automatizados homogéneos para la determinación de cistatina C 41; estos ensayos comerciales usan tanto anticuerpos mono como policlonales de cistatina C recombinante. El inmunoensayo turbidimétrico potenciado por partículas (Petia) y el inmunoensayo turbidimétrico potenciado por partículas Penia se caracterizan por su alta precisión, sensibilidad, especificidad y rendimiento. La nefelometría detecta inmunoagregados más pequeños que la turbidimetría 56; Penia, por lo general, se considera más sensible y, como tal, se recomienda para la cuantificación de cistatina C en muestras biológicas.
Desafortunadamente, Petia y Penia son sensibles a la interferencia por lipemia, hemólisis y bilirrubinemia 55; estos, junto con la Elisa, son los métodos con mayor frecuencia utilizados para la cuantificación de cistatina C debido a su precisión significativamente más alta 57. Sin embargo, en la actualidad se incluyen dentro de las técnicas biosensores de resonancia de plasmón, las cuales prometen ser técnicas rápidas y económicas de implementación en el diagnóstico convencional 55.
Tabla 4 Técnicas de determinación de cistatina C
| Inmunoensayo absorbente ligado a enzimas | ELISA tipo sándwich es el ensayo más frecuentemente utilizado para la determinación cuantitativa de cistatina C, este método usa dos anticuerpos: El primero es un anticuerpo monoclonal para cistatina C, el segundo es un anticuerpo policlonal biotinilado a cistatina C 57. Este enfoque tiende a tener mayor especificidad dado la naturaleza "sándwich" del ensayo. Desafortunadamente, esta prueba lleva mucho tiempo y es relativamente costosa; aunque los resultados obtenidos por ELISA versus PENIA y PETIA son comparables pero tiene algunas diferencias en el rendimiento analítico (varianza y sesgo) 58. |
| Inmunoensayo nefelométrico potenciado por partículas (PENIA) | Este método se basa en la formación de complejos inmunes (antígeno-anticuerpo complejos) que da como resultado la dispersión de la luz (56). Usando este enfoque, microesferas los anticuerpos anti cistatina C recubiertos se incuban con muestras biológicas que contienen cistatina C. La formación del complejo inmune da como resultado una dispersión de la luz proporcional a la concentración de la muestra. La concentración biológica de cistatina C en la muestra puede derivarse en comparación con una calibración establecida curva 56. |
| Inmunoensayo turbidimétrico potenciado por partículas (PETIA) | Este enfoque inmunológico es similar. Utiliza microesferas recubiertas de anticuerpos contra cistatina C. La formación del complejo inmune da como resultado un cambio en la absorbancia (luz transmitida) dependiendo de la concentración de la muestra genera cambios de absorbancia que se pueden comparar con una curva de calibración usando una concentración cistatina C conocida 59 . |
| Biosensores SPRI | Recientemente se han obtenido biosensores de resonancia de plasmón de superficie (SPRI) utilizados para cuantificar Cistatina C. Este método usa la resonancia de plasmón de un superficie metálica y la generación de campos evanescentes en la exposición a luz láser 55. La unión de partículas biológicas a la superficie del biosensor causa cambios en el campo e intensidad de la luz que llega a la cámara CCD (Un dispositivo de carga acoplada). la concentración de cistatina C puede determinarse simplemente por comparación con un curva de calibración conocida 60. |
Fuente: elaboración propia.
Con respecto a la muestra, se conoce que la cistatina C presenta una estabilidad en suero de dos días a temperatura ambiente, una semana a 4 °C, uno a dos meses a -20 °C, y al menos seis meses a -80 °C (55). No existe uniformidad de conceptos respecto a la estabilidad de la cistatina C en orina. Por una parte, se indica que la estabilidad no es buena debido a su degradación por enzimas proteolíticas; por otra, algunos autores afirman que la cistatina C es estable en orina y no requiere la adición de conservantes 61.
CONCLUSIONES
Se considera que la cistatina C cumple con características que la hacen un biomarcador más útil en la determinación de lesión renal, ya que muestra mayor utilidad diagnóstica que la creatinina sérica para detectar daño renal temprano. Es también una prueba confiable para estimar el FG en personas asintomáticas que presentan cifras de creatinina sérica normales y TFG disminuidas, por lo que puede utilizarse como prueba de rutina en pacientes que tienen factores de riesgo para desarrollar insuficiencia renal. A diferencia de los marcadores de función renal convencionales, la cistatina C demuestra una alta sensibilidad y especificidad porque no depende del sexo ni de la edad, así como tampoco de parámetros no renales. Su medición proporciona una herramienta de diagnóstico precoz y puede ser altamente aplicable como un marcador temprano de enfermedad renal preclínica. En la actualidad, se carece de evidencia científica suficiente que justifique el cambio de las ecuaciones de estimación del FG basadas en la concentración sérica de creatinina por la medida de la concentración sérica de cistatina C en la evaluación de la función renal; por tanto, se hace necesario realizar investigaciones longitudinales para validar la utilidad de este nuevo marcador en la enfermedad renal.
La cistatina C es una prueba automatizada, rápida y no invasiva, características que la hacen una herramienta útil en la práctica clínica. Si bien su costo es una limitante en la actualidad, el beneficio para diagnosticar oportunamente a los pacientes que tienen factores de riesgo y desarrollar así insuficiencia renal, es menor que realizar terapias paliativas tales como la diálisis y el trasplante de riñón, aunque su valor diagnóstico es mucho mayor.