INTRODUCCIÓN
La obesidad es una enfermedad en la que los individuos alcanzan un índice de masa corporal (IMC) igual o superior a 30 kg/m2, debido a una acumulación excesiva de tejido adiposo. En las últimas cuatro décadas, la obesidad ha triplicado su incidencia, al punto que para 2016 el 13 % de la población mundial adulta padecía esta enfermedad 1. La obesidad se encuentra asociada a múltiples desórdenes metabólicos, los cuales han sido identificados como precursores de enfermedades crónicas, cardiovasculares, distintos tipos de cáncer, entre otras 2)(7. Se ha propuesto que un vínculo importante entre la obesidad y sus comorbilidades es la alteración en el funcionamiento del sistema inmune. Dicha desregulación lleva al establecimiento de un ambiente inflamatorio crónico de bajo grado denominado "metainflamación" 8) (10. En esta condición se evidencia la presencia aumentada de macrófagos clásicamente activados (M1), mayor conteo de neutrófilos y de linfocitos polarizados hacia un fenotipo TH1 11-15 CD14(dim. Estas alteraciones a nivel del sistema inmune se reflejan en un incremento en los niveles de mediadores inflamatorios, entre los que se incluyen las citoquinas IL-6, TNF-a, IFN-y, y las proteínas de la fase aguda 14-20.
La obesidad tiene una prevalencia más alta en mujeres que en hombres, por lo que se estima que entre el 18 y el 30 % de las mujeres en edad reproductiva iniciarán la gestación en condiciones de obesidad 21-23. En este sentido, la metainflamación asociada a la obesidad puede generar complicaciones durante la gestación, por lo tanto, para que la gestación sea exitosa, el sistema inmune debe atravesar tres estados inmunológicos diferentes y fluidos: (I) Inicialmente se promueve la inflamación que permite la remodelación de los tejidos maternos durante la implantación 24) (26. (II) Con el establecimiento de la placenta se promueve la tolerancia inmunológica que evita el rechazo fetal y posibilita el crecimiento y desarrollo del feto 26-29. (III) Hacia el final del embarazo se promueve nuevamente la inflamación, que inicia procesos que estimulan la contracción del útero, la expulsión del neonato y rechazo de la placenta 26,30,31. En esta línea de ideas, se ha reportado que el desbalance inmunológico presente en mujeres obesas puede estar relacionado con las complicaciones del embarazo que se observan en estas pacientes, tales como mayor prevalencia de abortos espontáneos y preeclampsia 25,32-34.
Desde el punto de vista inmunológico se ha propuesto que la enzima indolamina -2,3-dioxigenasa 1 (IDO1) cumple dos funciones claves para el éxito del embarazo. Por una parte, participa en el establecimiento de la tolerancia materna frente al feto 35-39, mientras que confiere protección al feto frente a infecciones debido a la actividad antimicrobiana y antiparasitaria de los productos derivados de su actividad catalítica (40,41). Además, IDO1 tiene un papel importante en la regulación del flujo sanguíneo en la placenta y la decidualización, por sus efectos sobre las células del estroma endometrial 37,39. IDO1 es inducida por la señal de IFN-γ, lo cual sugiere que su expresión podría encontrarse alterada en gestantes obesas, contribuyendo a las complicaciones que se observan en estas pacientes. No obstante, hasta el momento se han realizado un número limitado de estudios en los que se evalúa la expresión de IDO1 en gestantes obesas.
Teniendo en cuenta que en mujeres obesas se han reportado complicaciones durante la gestación debido a la desregulación del sistema inmune y que se ha sugerido que IDO1 desempeña un papel clave para el éxito del embarazo, este artículo se propone presentar el estado actual de la investigación en torno al papel que desempeña IDO1 durante la gestación, así como presentar las alteraciones en la expresión de IDO1 que se evidencian en condiciones de obesidad; para finalmente explorar las implicaciones que podría tener la alteración en la expresión de esta enzima en gestantes obesas. Para cumplir con este propósito se revisará el papel que desempeña la enzima IDO1 durante el embarazo en condiciones fisiológicas. A continuación se presentarán las alteraciones en la expresión y función de IDO1 en condiciones de obesidad. Finalmente, se explorarán las posibles alteraciones que presentan la expresión y la función de IDO1 durante el embarazo en gestantes obesas y sus posibles implicaciones sobre el establecimiento de un embarazo saludable.
METODOLOGÍA
Se realizó una búsqueda bibliográfica en los buscadores y bases de datos Embase, Google Scholar, ScienceDirect y PubMed, utilizando el comando de búsqueda ("obesity" OR "overweight" OR "adiposity") AND ("IDO" OR "indoleamine-2,3-dioxygenase" OR indoleamine 2,3 dioxygenase") AND ("pregnancy" OR "gestation") AND "placenta". Se incluyeron 52 artículos publicados entre 1998-2018 que tuvieran como tema principal los términos empleados en la búsqueda, y se excluyeron los relacionados con farmacología, cáncer y trastornos del estado de ánimo.
RESULTADOS
Función de IDO1 durante el embarazo
IDO1 es una enzima citosólica inducida por la citoquina proinflamatoria IFN-y. Esta enzima cataliza la conversión del L- triptófano (Trp) en L- kinurenina. Esta reacción constituye el paso limitante en el catabolismo de este aminoácido, por la ruta de las kinureninas (42-45)3-dioxy-genase (IDO. IDO1 ejerce sus funciones en el establecimiento de la tolerancia inmunológica y la lucha contra infecciones mediante dos mecanismos principales: (I) el consumo del triptófano libre, que limita la proliferación tanto de patógenos como células del sistema inmune y promueve la diferenciación de células T activadas hacia un fenotipo regulatorio (46,47); (II) las kinureninas, inducen apoptosis en diferentes tipos celulares, como células T, células B, macrófagos y células NK (48-50)3-dioxygenase (IDO. Desregulaciones en el nivel y el patrón de expresión de IDO1 durante la gestación han sido asociados con aborto espontáneo recurrente y preeclampsia 51-53.
La evidencia sobre el papel de IDO1 en el embarazo data de 1991, cuando se describió que la actividad de esta enzima era menor en las placentas provenientes de embarazos en los que el feto presentaba restricción de crecimiento intrauterino (IUGR) comparada con embarazos saludables 54. Posteriormente, se encontró que en humanos la razón Kinurenina/Triptófano (Kin/Trp) aumenta progresivamente durante el embarazo, indicando con este cambio que en condiciones fisiológicas la actividad enzimática de IDO1 incrementa a medida que el embarazo progresa 55. La primera evidencia directa del papel funcional de IDO durante la gestación se obtuvo al observar que ratones hembra tratados con el inhibidor de IDO1, 1-metil-triptófano (1MT) presentaban una cantidad promedio de embriones significativamente menor a la observada en hembras control no tratadas. Además, en las hembras tratadas con 1MT se observó que en estados tempranos de la preñez había una infiltración de células mononucleares, acompañada de la presencia de necrosis en los tejidos circundantes al embrión. Finalmente, en estas hembras la gestación terminaba por un deterioro paulatino del embrión causado posiblemente por la inflamación. Posteriormente, en ratones RAG-1-/- carentes de linfocitos se probó que la pérdida fetal observada en las hembras tratadas con 1MT era mediada por el ataque de células T hacia el concepto 36.
Esta evidencia inicial obtuvo soporte al observarse que en condiciones fisiológicas el catabolismo del Trp mediado por IDO1 impedía la deposición de C3b sobre el embrión, y con ello se evitaba el rechazo mediado por células T 56.
Estudios recientes han reportado que ratones gestantes knockout para el gen de IDOl presentan preeclampsia, proteinuria, disfunciones renales, disfunción aórtica endotelial y IUGR; sin embargo, llevan la preñez a término y no se observan diferencias en la fecundidad o pesos placentarios, comparados con los controles 51. En esta línea de ideas, se ha reportado que solo en 30 % de las deciduas provenientes de mujeres con aborto espontáneo recurrente muestran una reducción significativa en la expresión de IDO1 57) 3-dioxygenase (IDO. Teniendo en cuenta esta evidencia, podría pensarse que, si bien IDOl es importante para el establecimiento de la tolerancia materno fetal, la gestación es un proceso complejo cuyo éxito podría depender más del contexto inmuno-lógico que de la expresión y actividad de una única molécula.
Además de su papel en el establecimiento de la tolerancia inmunológica durante el embarazo, en placentas de ratón se ha encontrado evidencia que muestra la inducción de la expresión de IDO1 en casos de infección con Listeria monocytogenes y Toxoplasma gondii, sugiriendo que esta enzima podría desempeñar un papel en la respuesta frente a estas infecciones 40,583-dioxygenase (IDO. Así mismo, la expresión de IDO1 también se ha relacionado con el mantenimiento del tono vascular de la placenta, en tanto que la reducción en su expresión se asocia con preeclampsia y IUGR 37,59,60.
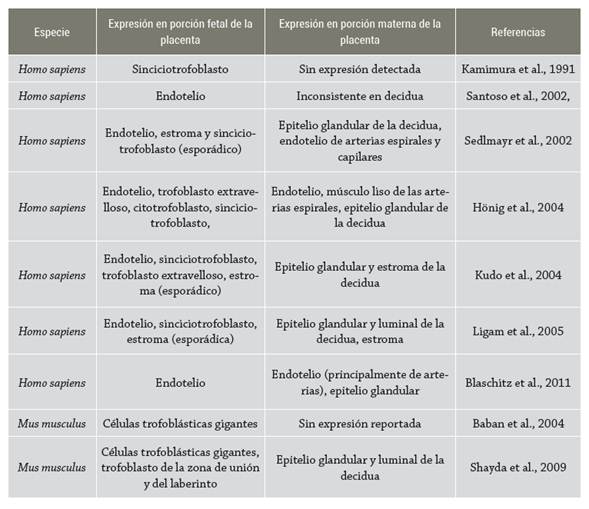
Si bien se tiene conocimiento sobre la importancia que la expresión de IDO1 en placenta tiene para el éxito del embarazo, aún no existe un consenso sobre su localización precisa en la placenta. En humanos se ha reportado que IDO1 incrementa su expresión en la placenta conforme avanza la gestación 61-63, y se ha demostrado la presencia de IDO1 en el endotelio, tanto de las vellosidades coriónicas como de la decidua 62-66. Similar a las observaciones realizadas en humanos, en biomodelos murinos se tiene evidencia de que IDO1 se expresa tanto en la porción materna como en el trofoblasto, el tejido fetal que está en mayor contacto con los tejidos maternos. No obstante, en contraste con las observaciones en humanos, la expresión de IDO1, al parecer, empieza a disminuir después de completar la placentación 67,68; aunque se encuentra por lo menos un reporte que documenta la expresión de IDO1 en placenta tardía en ratones 69 (tabla 1).
En conjunto, la evidencia sugiere que la expresión de IDO1 en la placenta es necesaria para la progresión de una gestación saludable. Además, puede considerarse que la expresión de IDO1 es un proceso dinámico tanto en placentas humanas como murinas.
IDO1 en obesidad
La transcripción de IDO1 es estimulada en respuesta a IFN-y45. Por tanto, es de esperarse que en la obesidad, la metainflamación lleve a un incremento en la expresión de IDO1 asociada al aumento en los niveles de IFN-y que se presentan en esta patología. Se ha reportado que en pacientes obesos se presentan mayores niveles de la razón Kin/Trp consistentes con un incremento en la actividad de IDO1 (70-75). Estos estudios son congruentes con evidencia que muestra una disminución de Trp en el suero de estos pacientes. Además, los estudios indican que la alteración en la expresión de IDO1 asociada a la obesidad permanece aún después que los pacientes reducen su masa corporal, pues en pacientes sometidos a cirugía bariátrica se mantienen aumentados los niveles de la razón Kin/Trp, incluso después de dos años de haber reducido su IMC entre 45 y 37 Kg/m2 (70,71. No obstante, esta evidencia contrasta con los resultados generados en biomodelos murinos con obesidad genética que carecen del gen que codifica para la leptina, en los que no se encontró expresión detectable de IDO1 en el tejido adiposo a pesar de que estos presentaban características inflamatorias y de resistencia a la insulina similares a las observadas en pacientes obesos 76.
Además de estas diferencias entre especies se ha encontrado que la expresión de IDO1 en pacientes obesos podría variar con la edad, pues en adultos se evidencia una razón Kin /Trp aumentada, mientras que pacientes con un rango de edad por debajo de los 18 años no se observa una alteración de esta proporción 73. Esta evidencia es consistente con los niveles bajos de kinurenina que se han observado en pacientes obesos en edad juvenil. Los autores sugieren que esta diferencia puede obedecer a que en pacientes obesos en edad juvenil priman respuestas de tipo TH2 que posteriormente se modifican para dar paso a las respuestas inflamatorias tipo TH1 en las que IFN-y juega un papel clave 73. De igual manera, otro factor que puede influir en la expresión de IDO1 es el tejido en el cual se evalúa su expresión. En este sentido, a pesar de que in vitro se ha establecido que preadipocitos y adipocitos responden a IFN-y incrementando la expresión de IDO1 en condiciones inflamatorias, in vivo se ha observado que las mujeres obesas muestran una mayor expresión de IDO1 en la grasa omental que en la grasa subcutánea en comparación con las mujeres control con un peso normal 72.
A pesar de que se ha encontrado que en humanos obesos la expresión de IDO1 puede verse incrementada, aún no se tiene del todo claro el papel que esta molécula desempeña en esta patología. Por una parte, se ha propuesto que el incremento de los niveles de expresión de IDO1 en la obesidad podría surgir como un mecanismo de compensación que permitiría atenuar los efectos de la inflamación asociados a la obesidad. Por otra parte, se ha sugerido que, por el contrario, en vez de atenuar los efectos de la inflamación causada por la obesidad, IDO1 podría jugar un papel importante como precursor en la ganancia de peso. En este sentido se ha mostrado que ratones suplementados con inhibidores para IDO1 presentan una ganancia de peso menor cuando se les suministra una dieta alta en grasas y carbohidratos. De manera similar, ratones IDO1 -/- sometidos a una dieta alta en grasas muestran una ganancia de peso menor en comparación con los animales del genotipo silvestre. Como explicación a este fenómeno se ha propuesto que las lipoproteínas de baja densidad oxidadas activan los receptores TLR2/4, llevando a un incremento en la expresión de IDO1 que resultaría en la activación del receptor de aril hidrocarburos (AHR) vía kinurenina, promoviendo de esta manera la obesidad y la ganancia de peso por mecanismos desconocidos 77.
En conjunto, esta evidencia sugiere que, aunque es tentadora la idea de considerar la expresión de IDO1 como un elemento característico en la obesidad, factores como la edad, la especie y el tejido en el que se está estudiando influyen en la expresión de esta molécula. Si la alteración en la expresión de IDO1 en pacientes obesos es un mecanismo de compensación para atenuar los efectos de la inflamación o un elemento inicial que promueve la ganancia de peso, es una pregunta que requiere más investigación.
La expresión de IDO1 en gestantes obesas
En mujeres obesas se ha observado prevalencia de complicaciones del embarazo como preeclampsia, aborto espontáneo recurrente, IUGR, entre otras 78-8010% of body mass or 10-20 pounds. Si bien lo más probable es que estas complicaciones tengan su origen en diversos factores, es posible pensar que dado el importante papel que IDO1 ejerce en los procesos de placentación y en el establecimiento de la tolerancia materno-fetal, esta enzima puede estar implicada en las complicaciones observadas en gestantes obesas. Hasta el momento los estudios que evalúan la expresión de IDO1 en la gestación en condiciones de obesidad son escasos. No obstante, en mujeres obesas que se encuentran en la vigésima semana de gestación se presenta una razón Kin/Trp aumentada en comparación con sus contrapartes normopeso, sugiriendo que IDO1 está sobreexpresada en estas pacientes 81.
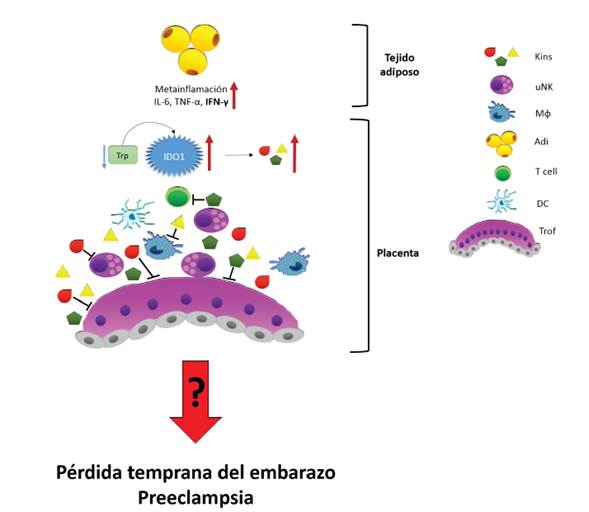
Durante el embarazo, el órgano más importante en la regulación de las interacciones madre-feto es la placenta 82-84. Así mismo, la placenta es el órgano con la mayor expresión de IDO1 61. En condiciones de obesidad se ha reportado que en la placenta se genera un ambiente lipotóxico, mayor proporción de mediadores inflamatorios y activación de rutas inflamatorias 85-87. Por tanto, es posible que en gestantes obesas IDO1 se encuentre sobreexpresada en la placenta. En este sentido, un incremento en la expresión de IDO1 puede llevar a un incremento en las concentraciones de kinureninas que puede causar un efecto citotóxico en distintos tipos celulares 48),(49),(88),(89. En ratones alimentados con una dieta alta en Trp se observaron alteraciones en la morfología placentaria, que fueron atribuidas en parte a la acumulación de kinureninas 90),(91. Es posible que esta acumulación de metabolitos afecte el desarrollo y proliferación tanto del trofoblasto que migra e invade la decidua como de los leucocitos presentes en esta. Los cuales son importantes en la degradación de la matriz extracelular que permite la invasión trofoblástica, la remodelación de los vasos sanguíneos maternos y el establecimiento de la tolerancia materno-fe-tal 92-94) uterine natural killer (NK. También es posible que la degradación excesiva de Trp en la placenta genere una reducción en el Trp que se dispone para la generación de otras moléculas importantes como la serotonina, que se ha demostrado es muy importante en el proceso de desarrollo embrionario 95. Finalmente, lo anterior podría derivar en pérdidas tempranas del embarazo, o en complicaciones como la preeclampsia, debido a una pobre remodelación de las arterias espirales, condiciones que se han observado en gestantes obesas (figura 1).
Fuente: autores
Figura 1 Un exceso de mediadores inflamatorios provenientes del tejido adiposo puede generar una sobreexpresión de IDO1. El aumento en la expresión se puede traducir en un aumento de la actividad de la enzima, y por lo tanto una reducción del triptófano disponible y un aumento de kinureninas con efectos citotóxicos. Estas kinureninas impactan de manera negativa a los leucocitos y células trofoblásticas, entorpeciendo los procesos de migración y remodelación tisular necesarios para una adecuada placentación. Trp: triptófano, Kins: kinu-reninas, uNK: células natural killer uterinas, M*: macrófagos deciduales, Adi: tejido adiposo, T cell: linfocitos T, DC: células dendríticas deciduales, Trof: sinciciotrofoblasto y citotrofoblasto de las vellosidades placentarias.
CONCLUSIONES
Según la evidencia revisada, puede afirmarse que en humanos adultos que padecen obesidad, IDO1 incrementa su nivel de expresión y actividad. Aunque la función de este incremento en la obesidad aún no ha sido establecida, debido al papel clave que se le ha atribuido a IDO1 en el establecimiento de un embarazo saludable, es posible que esta alteración pueda tener un efecto deletéreo sobre el desarrollo del embarazo en gestantes obesas. Por tanto, se hace necesario ampliar la investigación en torno al papel de IDO1 en el embarazo en condiciones de obesidad para determinar si los cambios en su expresión son responsables, al menos en parte, de las complicaciones en el embarazo observadas en gestantes obesas.