INTRODUCCIÓN
La Organización Mundial de la Salud (OMS) define tanto el sobrepeso como la obesidad como una acumulación anormal o excesiva de grasa que puede ser perjudicial para la salud 1. Es así como esta entidad reconoció la obesidad como una enfermedad por primera vez en 1948 al momento de su formación. Las dificultades inherentes a su manejo se deben a la complejidad del entorno médico, epidemiológico, social y político del desarrollo de dicha pandemia 2.
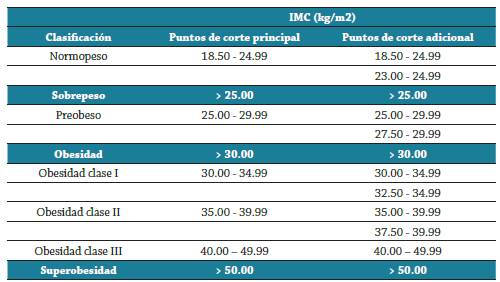
La obesidad se cuantifica con base en la clasificación internacional de adultos del índice de masa corporal (IMC) 3, el cual es un indicador de la relación entre el peso y la talla 1 y se calcula dividiendo el peso en kilogramos por la altura en metros al cuadrado (kg/m2) 4. Utilizando el IMC un individuo se clasifica como normopeso, sobrepeso u obeso; esta última, subclasificada en obesidad clase I, obesidad clase II y obesidad clase III. Actualmente y debido a que desde 1980 esta enfermedad se ha duplicado en todo el mundo 1, se ha propuesto una cuarta clase de obesidad utilizado el término "superobesidad", para caracterizar aquellos adultos cuyo IMC inicia a partir de 50 kg/m2 (5. Tabla 1.
Tabla 1 Clasificación internacional del adulto según el índice de masa corporal
Fuente: Organización Mundial de la Salud y Alpert et al, 2014.
Según los últimos datos reportados por la OMS, a nivel mundial treinta y ocho millones de niños menores de cinco años y trecientos cuarenta millones de niños y adolescentes entre cinco y 19 años presentan exceso de peso. En los adultos las cifras son más elevadas: mil novecientos millones de individuos mayores de 18 años presentan sobrepeso, de los cuales más de seiscientos cincuenta millones son obesos 1.
De acuerdo con las cifras de la Plataforma Mundial de Datos de Salud sobre el IMC, existen grandes variaciones en la prevalencia de la obesidad en los adultos de todo el mundo. En las islas del Pacífico la prevalencia de la obesidad es la más alta a nivel mundial. Nauru es el país que presenta el mayor porcentaje de obesidad 60.7 %, seguido por las islas Cook y Palau; en contraste, solo un 2.1 % de la población de Vietnam es obesa 6.
La literatura especializada reporta variaciones en el grado de obesidad según el grupo étnico/ racial, los comportamientos, los factores de riesgo, la demografía y determinantes sociales como el nivel bajo de la educación e ingresos 3. Esta situación se puede evidenciar en la prevalencia de obesidad en individuos de 20 años en adelante con origen hispánico en los Estados Unidos de América; que para el periodo de 2011 a 2014 reportan que de mayor a menor prevalencia se encuentran: negros no hispánicos, con 48.1 %; hispánicos, con 42.5 %; blancos no hispánicos, con 34.5 %, y los asiáticos no hispánicos, con 11.7 % 7. Por otro lado, el estudio realizado por el centro de control y prevención de enfermedades en el mismo país evaluó la prevalencia de la obesidad entre los niños de edad preescolar de bajos ingresos, la cual aumentó de manera constantemente, pasando de 12,4 % en 1998 a 14,5 % en 2003 y 14,6 % en 2008 8.
Con respecto al género, los estudios han mostrado una tasa de obesidad más alta entre las mujeres 3. Por ejemplo, Mitchell y Shaw han reportado una variación significativa en todo el mundo de la prevalencia estimada de sobrepeso y obesidad en las mujeres de 15 años de edad; en la isla de Nauru la prevalencia es del 93%, en contraste con 3.7 % en Etiopía. Aproximadamente dos tercios de las mujeres en el Medio Oriente y el Norte de África tienen sobrepeso u obesidad, y la mitad de las mujeres de América Central, América del Sur y del Caribe pertenecen a esta categoría 2.
En las naciones latinoamericanas llama la atención la creciente prevalencia de sobrepeso y obesidad 2. Los países con mayor prevalencia de obesidad son: Uruguay, con 28.9 %, Argentina, 28.5 %, México, 28.4 % y Chile, 28.8 % 1.
En respuesta al creciente número de poblaciones con sobrepeso y obesidad en toda América Latina, la Organización Panamericana de la Salud (OPS) ha dirigido programas específicamente a la prevención y el tratamiento de la obesidad, reconociendo su asociación con la pobreza a nivel organizacional 9.
La OMS estipula que los niños obesos y con sobrepeso tienden a seguir siendo obesos en la edad adulta y tienen más probabilidades de padecer a edades tempranas enfermedades no transmisibles; todas estas prevenibles.
Con el objetivo de conocer si existe efecto de la obesidad en el tejido óseo, y específicamente a nivel craneofacial, se realizó esta revisión bibliográfica (figura 1).
EFECTOS DE LA OBESIDAD A NIVEL SISTÉMICO
La obesidad tiene una asociación demostrada con los comportamientos y los resultados de salud; siendo los principales y más reconocidos efectos sistémicos enfermedades como la diabetes mellitus 10,11 y la hipertensión arterial 3. Para la OMS, un IMC elevado es un importante factor de riesgo de enfermedades no transmisibles; entre estas se encuentran las enfermedades cardiovasculares, principalmente las cardiopatías 11,12 y los accidentes cerebrovasculares 13, trastornos del aparato locomotor como osteoartritis 14,15 y algunos tipos de cáncer 16 (endometrio, mama, ovarios, próstata, hígado, vesícula biliar, riñones y colon) 1.
Ádemás, la obesidad está relacionada con varias enfermedades digestivas, como la enfermedad por reflujo gastroesofágico y sus complicaciones (esofagitis erosiva, esófago de Barrett y adenocarcinoma esofágico), pólipos colorrectales, cáncer y enfermedad hepática (por ejemplo, enfermedad hepática grasa no alcohólica, cirrosis y carcinoma hepatocelular) 4. Los hombres con exceso de peso presentan una tasa de mortalidad significativamente más alta por cáncer de colon, recto y próstata 17.
La obesidad tiene implicaciones significativas para la salud reproductiva a lo largo de la vida 18. Varias comorbilidades asociadas con la obesidad se relacionan específicamente con la salud reproductiva de las mujeres y también tienen implicaciones para el cáncer femenino. Se asocia con sangrado uterino anormal, síndrome de ovario poliquístico, edad más temprana de la pubertad, infertilidad y en caso de lograr el embarazo, mayores tasas de aborto espontáneo 2. Las mujeres con localización abdominal de grasa sufren más irregularidades y trastornos del ciclo menstrual, comparadas con mujeres normopeso. Ádemás, presentan mayores problemas durante el embarazo, con un incremento de toxemia e hipertensión arterial 17.
TEJIDO ÓSEO Y OBESIDAD
Biológicamente, la obesidad es la condición por la cual se produce una acumulación de adipocitos en el cuerpo, y derivado de esto se origina una ganancia de grasa corporal. La acumulación se genera por el aumento en la ingesta de alimentos y la disminución del gasto de energía 19. Los adipocitos tienen la capacidad de producir sustancias proinflamatorias, incluyendo citoquinas y quimioquina, dentro de las que cabe destacar el factor de necrosis tumoral alfa (TNF-α) y la inter-leuquina 6 (IL-6) 20. Actualmente se conoce que las citoquinas proinflamatorias, como la leptina, adiponectina, resistina, vaspina, visfatina, quemerina y la apelina 21,22, son mediadores clave en los procesos de reabsorción ósea y la diferenciación de osteoclastos 23.
El tejido óseo es un órgano dinámico que sufre continuamente cambios en su volumen a través de un proceso denominado "remodelación". Este proceso permite la participación de los osteoclastos en la resorción ósea y los osteoblastos en la formación de nuevo hueso 24-26. También se ha establecido que los osteoblastos regulan el reclutamiento y la actividad de los osteoclastos a través del ligando del receptor activador del factor nuclear fi (RANKL) y de la osteoprotegerina (OPG) 27.
RANKL se expresa en la superficie celular de los osteoblastos, este se libera y se une a su receptor RANK, localizado en la superficie de las células precursoras hematopoyéticas, para estimular la diferenciación de los osteoclastos, permitiendo la maduración osteoclástica en presencia del factor de estimulación de colonias de macrófagos (MCSF) 24,27. Por otro lado, OPG actúa como receptor señuelo secretado por los osteoblastos, se une a RANKL e inhibe la activación y diferenciación de osteoclastos y, por tanto, inhibe la resorción ósea 24,27.
La correlación entre la obesidad y el metabolismo óseo se observa al aumentar la masa adiposa en procesos de obesidad clase II y clase III. En esta situación los adipocitos acumulados secretan al torrente sanguíneo leptina, la cual es capturada en receptores de la membrana celular inducidos por citoquinas. Estos receptores presentan tres conformaciones: largo, corto y liposoluble. El receptor para la leptina que se encuentra en el hipotálamo se llama OB-R y es de conformación larga 28,29.
En los huesos, la leptina actúa por dos vías diferentes. De forma periférica directamente sobre los osteoblastos y de forma central a través del hipotálamo, suprimiendo los mismos, logrando así inhibir la formación y resorción ósea 30. Adicionalmente y con receptores especiales, la leptina puede alcanzar diferentes sistemas endocrinos por vía sanguínea, modulándolos. Un ejemplo de esto es que actúa en receptores OB-R de la piel, el hígado, las gónadas y la tiroides 31.
EFECTOS POSITIVOS DE LA OBESIDAD SOBRE EL TEJIDO ÓSEO
Basados en que los adipocitos y los osteoblastos son derivados de la misma célula madre mesenquimal 32, y gracias a que la leptina modula el gasto energético, el apetito y las funciones endocrinas 23, entre 1983 y 1993 diferentes autores estudiaron y publicaron sobre el efecto protector que ejerce la obesidad sobre el hueso, argumentando los efectos beneficiosos que tiene el aumento de la grasa corporal sobre el mismo 33-37.
Para demostrar estos efectos positivos se llevaron a cabo diferentes experimentos que soportaban el hecho de que con la obesidad se aumenta la grasa corporal, la masa ósea y el IMC 23. Es así como se da paso a dos hipótesis.
La primera sostiene que la leptina media el efecto de la grasa corporal, induciendo osteogénesis en el tejido óseo. Para probarlo utilizaron ratones obesos con deficiencia de leptina, la cual se les administró de forma periférica, y se observó que se estimulaba el crecimiento óseo y la formación de cortical; adicionalmente se disminuyó la ingesta de alimentos y el peso corporal 38.
La segunda hipótesis se basa en que los efectos favorables de la obesidad sobre la masa ósea implican la inhibición de los efectos de la leptina en el sistema nervioso central. Con este fin se estudiaron ratones obesos con deficiencia de leptina y deficiencia del receptor OB-R. Este estudio concluyó que a los 3 meses la masa ósea se incrementó, y además se presentó hipogonadismo y hipercortisismo 38.
En publicaciones recientes se evalúa también cómo individuos con osteoporosis se benefician de la obesidad. Aunque los efectos de la leptina cambian con la edad, el sexo y ubicación del tejido óseo, estudios en adultos mayores en los que se aumenta la masa ósea evidencian beneficios como un menor riesgo de fractura. Lo anterior debido a que la carga mecánica a la que se somete el hueso hace que se logre mayor formación y menor resorción ósea 39. Estudios en ratones macho a los que se les administra leptina muestran un incremento en la resistencia mecánica del hueso. Se continúa afirmando que se disminuye el riesgo de fracturas como consecuencia de la formación de panículos adiposos que amortizan el hueso durante una caída 40. Es por esto que al aumento del IMC se asocia con una mayor masa ósea.
EFECTOS NEGATIVOS DE LA OBESIDAD SOBRE EL TEJIDO ÓSEO
La investigación científica también muestra que la obesidad afecta negativamente el metabolismo óseo a través de varios mecanismos. El primero de ellos se produce a partir de agentes inhibidores de la adipogénesis, como TNF-α, la interleuquina 1 beta (lL-1fi) y la IL-6, que estimulan la diferenciación de los osteoblastos y, a su vez, los inhibidores de osteoblastogénesis aumentan la generación de adipocitos 23,24. Clínicamente se evidencia cuándo la masa ósea disminuye a causa de la obesidad y se presenta un aumento en la generación de adipocitos a expensas de la generación de osteoblastos 23,24.
El segundo mecanismo es la disminución de la osteoblastogénesis de médula ósea con el envejecimiento, el cual se acompaña generalmente con el aumento de la adipogénesis ósea. Durante esta etapa de la vida se puede alterar el equilibrio entre el tejido óseo y el tejido adiposo 23.
El tercer mecanismo se presenta cuando con la obesidad se aumenta la leptina y se disminuyen los receptores OB-R. El efecto negativo se produce a través del sistema nervioso simpático, y el mecanismo por el cual actúa depende de múltiples factores: inicialmente está la resistencia a la leptina a nivel hipotalámico, debido a altos niveles de leptina circulante; también la composición hormonal de la médula ósea por la infiltración de grasa de la misma 41.
El cuarto mecanismo está relacionado con el aumento del estrés oxidativo y una elevada producción de citoquinas proinflamatorias en un individuo con osteoporosis. El incremento de estas proteínas en la circulación sanguínea y en el tejido óseo promueve la actividad de los osteoclastos y la resorción ósea a través de la modificación sistema RANK/RANK-L/OPG. Por otra parte, la excesiva secreción de leptina y/o disminución de la producción de adiponectina por los adipocitos puede afectar de forma directa la formación de hueso o alterar indirectamente la resorción ósea, a través de la producción de citoquinas proinflamatorias hasta regularlas 23.
Los niveles en sangre de adiponectina, hormona secretada por los adipocitos, tienen propiedades antinflamatorias, y se ha demostrado que disminuye en individuos con obesidad 23.
El quinto y último mecanismo se presenta cuando un individuo tiene un alto consumo de grasa que puede interferir con la absorción intestinal de calcio. En este individuo se reduce la disponibilidad de calcio para la formación de hueso, y como consecuencia se presentan efectos adversos sobre la mineralización ósea. Esta reducción de la absorción intestinal de calcio se atribuye a una condición denominada "hipercalciuria", que se caracteriza por la acumulación de jabones de calcio creados por un aumento de ácidos grasos libres. Estos jabones de calcio no pueden ser absorbidos y son insolubles, por lo cual se genera una deficiencia de calcio potencialmente disponible en todo el cuerpo. Estudios en biomodelos muestran una reducción significativa en las propiedades del hueso trabecular, pero no en las propiedades óseas corticales 23.
A este último efecto, se le suma el hecho de que con investigaciones en humanos se ha demostrado que los individuos con sobrepeso y obesidad tienden a tener concentraciones más bajas de vitamina D circulante. La vitamina D es un regulador clave de los niveles de calcio y fósforo en el cuerpo, y su deficiencia conduce a una deficiencia en estos otros minerales. La deficiencia de calcio puede a su vez conducir a una pobre mineralización y remodelado óseo y, por tanto, los efectos de la mala absorción de calcio en el intestino puede resultar como mecanismo por el cual las dietas altas en grasas y la obesidad pueden inhibir la mineralización, así como promover una mayor resorción ósea 42.
EFECTO CRANEOFACIAL DE LA OBESIDAD
La pandemia mundial de la obesidad ha generado interés en la relación entre la obesidad durante la infancia, la adolescencia y los patrones de crecimiento 43-45. Para mostrar el efecto que la obesidad genera a nivel craneofacial diferentes estudios han utilizado un método que se denomina "cefalometría", en el cual por medio de la radiografía lateral de cráneo se obtiene una imagen de los tejidos duros y blandos de la cabeza y el cuello; sobre esta imagen es posible establecer puntos anatómicos. A partir de estos puntos se pueden medir distancias y establecer si los tejidos tienen variaciones o no, a través del tiempo 46.
En 2002, Ohrn y sus colaboradores realizaron un estudio con el objetivo de establecer si las dimensiones del complejo craneofacial se reducirían en adolescentes obesos en comparación con adolescentes sanos. Como resultado encontraron que los adolescentes obesos suizos tienen crecimiento craneofacial temprano, y aunque no se obtuvieron resultados estadísticamente significativos utilizando la cefalometría, se encontró que la longitud mandibular en mujeres aumentó 6 milímetros y en los hombres 8.7 milímetros 47 (figura 2A).
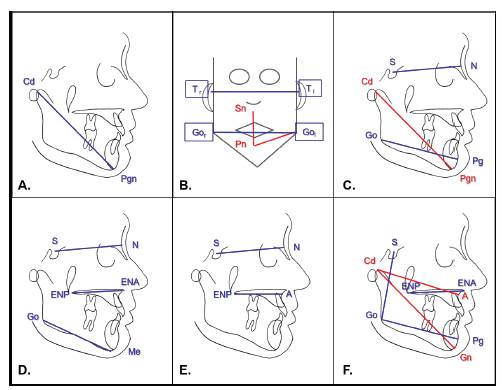
Figura 2 Medidas cefalométricas y antropométricas. A: Longitud mandibular medida de condilion (Cd) a prognation (Pgn). B: Base del cráneo medida intertraguion (Tr a Tl), altura del tercio inferior medida de sub nasal (Sn) y pogonion (Pn), longitud del cuerpo mandíbula medida de pogonion (Pn) a gonion (Go), ancho mandibular medida intergonial (Gor a Gol). C: Base de cráneo medida de silla (S) a nasion (N), longitud de la mandíbula medida de condilion (Cd) a pogonion (Pgn), rama mandibular medida de gonion (Go) a pogonion (Pg). D: Base de cráneo medida de silla (S) a nasion (N), longitud del maxilar medida de espina nasal anterior (ENA) a espina nasal posterior (ENP), mandíbula medida de gonion (Gn) a menton (Mn). E: Base de cráneo medida de silla (S) a nasion (N), longitud del maxilar medida de subnasal (A) a espina nasal posterior (ENP). F: Longitud mandibular medida de condilion (Cd) a gnation (Gn), longitud del cuerpo mandibular medida de gonion (Go) a pogonion (Pg), longitud del maxilar medida de espina nasal anterior (ENA) a espina nasal posterior (ENP), longitud del tercio medio facial medida de condilion (Cd) a subespinal (A), altura facial posterior medida de silla (S) a gonion (Go).
Para 2004, Ferrario y sus colaboradores estudiando los tejidos blandos buscaron establecer las coordenadas tridimensionales faciales de tejido blando con tecnología no invasiva. Con este fin utilizaron digitalizadores computarizados y establecieron puntos antropométricos. Encontraron que las mujeres adolescentes blancos del norte de Italia que son obesos tienen aumento en la base del cráneo, la altura del tercio inferior, la longitud del cuerpo mandíbula y que tanto los hombres como las mujeres tienen aumento en el ancho mandibular 48 (figura 2B).
Sadeghianrizi y sus colaboradores en 2005 investigaron sobre la morfología craneofacial en adolescentes obesos y los compararon con adolescentes normales. Utilizaron cefalometría con digitalizador electrónico en línea, con un microordenador, y como resultado obtuvieron que los adolescentes obesos suecos tienen perfiles rectos, y se evidenció que hay un aumento en la dimensión de base de cráneo, la longitud de la mandíbula y su rama 49) (figura 2C).
En 2010, Lee y sus colaboradores exploraron las diferencias en las estructuras craneofaciales y la obesidad entre pacientes australianos y hongkoneses con apnea obstructiva del sueño (AOS). Basados en antropometría, cefalometría manual y digital obtuvieron como resultado que los pacientes australianos tienen un mayor sobrepeso y los pacientes hongkoneses tienen mayor restricción ósea craneofacial y AOS más severa. Por otro lado, los pacientes de ambas etnias presentaron aumentó de la dimensión de base de cráneo, la longitud del maxilar y la mandíbula 50 (figura 2D).
Giuca y sus colaboradores en 2013 se plantearon como objetivo analizar estructuras esqueléticas y parámetros enzimáticos en sujetos jóvenes italianos obesos en comparación con los de sujetos normopeso del mismo país. Realizaron cefalometría, laboratorio hormonal y análisis enzimáticos. Como resultado se obtuvo que los pacientes obesos tuvieron aumento de los niveles de leptina e insulina y se disminuyeron los niveles de hormona folículo estimulante, hormona luteinizante y el factor de crecimiento insulínico tipo 1. Además, se evidenció aumento en el ángulo intermaxilar y la dimensión de la base de cráneo y la longitud del maxilar 51 (figura 2E).
Por último, Olszewska en 2017 se planteó como objetivo evaluar si el sobrepeso u obesidad influyen en la morfología craneofacial de pacientes adolescentes polacos con ortodoncia. Basado en mediciones cefalometrías concluyó que los pacientes con exceso de peso presentan longitud mandibular aumentada en mujeres de 5.4 milímetros y en los hombres de 5.66 milímetros, lo cual concuerda con lo reportado por Ohrn y colaboradores. Adicionalmente, estos adolescentes presentaron aumentó en la longitud del cuerpo mandibular, la longitud del maxilar y la longitud del tercio medio facial. Exclusivamente en hombres se observó un aumento en la altura facial posterior. Respecto a las dimensiones sagitales, las adolescentes mostraron una posición prognática de ambos maxilares, mientras que los hombres solo mostraron esta característica en la mandíbula; para la dimensión vertical se encontró que estos pacientes tienen aumento en la altura facial total 52 (figura 2F).
CONCLUSIONES
La obesidad es una pandemia difícil de ignorar; para la población en desarrollo es uno de los problemas de salud pública más graves del siglo XXI. El impacto que la globalización y la rápida transición socioeconómica tienen en la nutrición, nos hace sospechar que el exceso de peso, alcanzará en pocos años efectos morfológicos fácilmente identificables en el componente óseo de la población. Es debido a esto que se hace necesario que el profesional de la salud comprenda tanto los efectos positivos como negativos que se presentan sobre el tejido óseo. Adicionalmente, es importante que se reconozca, maneje y se planteen tratamientos basados en todos estos efectos.
Gracias a esta revisión se reconoce que las alteraciones en los mecanismos biológicos que regulan el crecimiento y desarrollo craneofacial en individuos obesos pueden resultar en un patrón de crecimiento facial modificado. Es así que se plantea en un futuro que la investigación en obesidad sea un tópico de prioridad global. Es preciso que se realicen estudios sobre el efecto morfológico a nivel craneofacial que tiene la obesidad en adolescentes del continente americano, y específicamente en pacientes hispanos. No solo por el aumento de la obesidad en estas poblaciones, sino por el progresivo incremento que se presenta actualmente en la obesidad infantil.