INTRODUCCIÓN.
El descubrimiento de la penicilina en 1928 por el científico Alexander Fleming dio inicio a la llamada era antibiótica y significó para el hombre uno de los avances más importantes que han ocurrido en la medicina humana 1. La penicilina comenzó a ser comercializada en la década de los 40, sin embargo, su producción a nivel industrial y en el mercado común inició en 1946, y desde ese entonces se han desarrollado decenas de antibióticos tanto naturales como sintéticos, los cuales han logrado disminuir las tasas de mortalidad ocasionadas por infecciones microbianas como la tuberculosis y la neumonía 2. Es de suma importancia mencionar que anterior al inicio de la era antibiótica se desconocía el termino "resistencia antibiótica", sin embargo, para ese entonces Alexander Fleming había advertido sobre la resistencia a la penicilina observada en Escherichia coli, pero no fue escuchado 3,4, años más tarde, en la década de los 60 se encontró que más del 80 % de las cepas de Staphylococcus aureus aisladas en la comunidad y en los hospitales eran resistentes a la penicilina 5, dejando claramente en evidencia este fenómeno. En la actualidad se sabe que esta resistencia no hacía parte del genoma de estas bacterias, y por el contrario, se basa en un mecanismo de resistencia enzimático adquirido por medio del intercambio de genes entre bacterias, hoy más conocido como "transferencia horizontal de genes" (THG); un claro ejemplo es evidenciado por la adquisición de betalactamasas plasmídicas de clase A, denominadas de amplio espectro, como TEM-1, TEM-2 y SHV-1, responsables de la resistencia a aminopenicilinas y car-boxipenicilinas, y de la sensibilidad disminuida o intermedia a ureidopenicilinas 6.
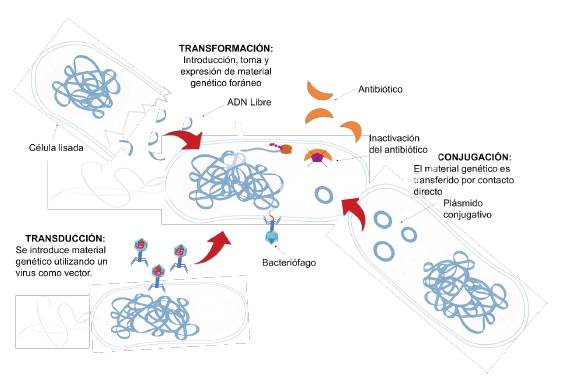
La THG sucede en el medio ambiente 7, así como en animales 8 y el hombre 9, y se convierte en un punto crucial para poder entender el origen y el aumento de la resistencia bacteriana. Los principales mecanismos involucrados en el intercambio de material genético comprenden la conjugación, transformación y transducción 10 (figura 1). El proceso de conjugación utiliza pequeños segmentos de ADN extracromosómico llamados "plásmidos"; estos se encuentran presentes en la mayoría de bacterias y algunos de ellos poseen genes asociados a mecanismos de resistencia antibiótica que pueden ser transmitidos entre bacterias 11. También existe un mecanismo de transferencia entre bacteriófagos (virus que infectan bacterias) y bacterias llamado "transducción"; mediante este mecanismo los fagos inyectan su material genético en las células bacterianas 10. Por último, las bacterias poseen la capacidad de captar ADN foráneo, que se encuentra principalmente en el medio ambiente e incorporarlo a su ADN; en algunos casos este material genético podría contener genes asociados a mecanismos de resistencia a los antibióticos provenientes de bacterias ambientales 10.
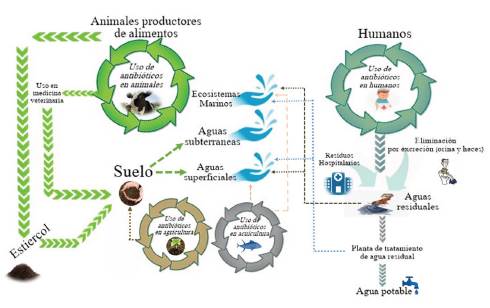
Por otro lado, el uso excesivo de antibióticos en la medicina humana y veterinaria, la agricultura y la acuicultura 12, sumado al déficit de las plantas de tratamiento de aguas residuales para la eliminación de bacterias y compuestos antibióticos 13, han permitido la llegada de estos compuestos al medio ambiente (figura 2), lo cual ha ocasionado un aumento de la resistencia bacteriana, debido en gran parte a la presión selectiva que ejercen los antibióticos sobre los microorganismos 14. Cabe mencionar también que el déficit en el tratamiento de aguas residuales permite la interacción entre bacterias patógenas y bacterias ambientales presentes en el suelo y en ecosistemas acuáticos 15,16; además, la continua exposición del hombre y los animales a estos ecosistemas ha provocado a lo largo del tiempo un cambio en su microbiota intestinal 17,18, lo que permitiría una mayor diseminación de la resistencia a los antibióticos.
El objetivo de esta revisión es mostrar el papel que cumple el medio ambiente, el hombre y los animales en la aparición y diseminación de la resistencia a los antibióticos.
RESISTENCIA ANTIBIÓTICA EN EL SUELO
El suelo es considerado el biomaterial más complejo del planeta, donde se encuentran dos componentes: el biótico y el abiótico, que al interaccionar entre sí dan lugar a una heterogeneidad física y biológica. En este sentido, la microbiota del suelo es responsable de muchos de los procesos bioquímicos esenciales para la vida humana (crecimiento de las plantas, productos para la salud humana y protección de las aguas subterráneas), sin embargo, los suelos también contienen patógenos humanos y son una fuente de resistencia bacteriana a los antibióticos 19.
La concentración de antibióticos en ambientes naturales como el suelo se encuentra entre unos pocos nanogramos y cientos de nanogramos por kg 20. Las altas concentraciones de estos compuestos han sido reportadas en suelos influenciados por actividades antrópicas, tales como efluentes de los hospitales, aguas residuales, ganadería, entre otros (figura 2) 20. Además, un alto porcentaje de antibióticos de uso en humanos y veterinarios es excretado sin alteración, lo que contribuye a su liberación en la biosfera 21. Estas altas concentraciones de antibióticos en el suelo son debidas no solo a su continua liberación, sino también a su persistencia en el mismo 20. En este sentido, los estudios realizados por Schlüsener y Bester (2006) concluyeron que la vida media en el suelo de antibióticos tales como Eritromicina, Roxitromicina, Oleandomicina, Salinomicina, Tiamulina y Tilosina fue en promedio de 20, >120, 27, 5, 16 y 8 días, respectivamente, y que cuanto mayor sea el tiempo de la persistencia de la forma activa de los antibióticos en el suelo, así serán afectadas las poblaciones bacterianas, en especial en la adquisición de resistencia 22. Por su parte, Pan y Chu (2016) mediante el estudio de la degradación de antibióticos en suelos esterilizados y no esterilizados, y bajo condiciones aerobias y anaerobias determinaron que la persistencia de los mismos no solo depende de las propiedades fisicoquímicas del antibiótico y el suelo, sino además de la aireación y las actividades microbianas presentes en este último 23.
Por otro lado, es claro que la transferencia de genes bacterianos no solo se produce en el intestino humano y animal sino en toda la biosfera, en especial en sitios ricos en nutrientes como lo es el suelo influenciado por las raíces de las plantas, zona conocida como la rizósfera 24,25. Se cree que la frecuencia de la transferencia de resistencia en microorganismos del suelo es baja, debido a que la falta de nutrientes ejerce un factor de control sobre la densidad y actividad microbiana. Sin embargo, como consecuencia de las rizodeposiciones de las plantas en la rizósfera, esta es considerada una zona privilegiada para la transferencia de genes 24. En la rizósfera la biomasa y la actividad de los microorganismos aumentan como resultado de la exudación de compuestos orgánicos por parte de las plantas que son utilizados por las bacterias como fuentes de carbono 25,26. La rizósfera es colonizada por bacterias altamente competitivas capaces de producir diversas sustancias antibióticas; lo que explica, de alguna manera, la detección y aislamiento de bacterias de esta zona con capacidad de resistir a múltiples antibióticos 25,26.
La utilización de estiércol y lodos como fertilizantes, junto con el uso de aguas regeneradas, puede contribuir tanto a la entrada de antibióticos (figura 2) como de genes de resistencia en el suelo 20. Además de seleccionar mutantes resistentes y favorecer la adquisición de determinantes de resistencia por elementos de transferencia genética, la contaminación por antibióticos puede enriquecer la población de microorganismos intrínsecamente resistentes y reducir la población susceptible, que podría ocasionar alteraciones en el funcionamiento de los ecosistemas 27,26.
El estudio de las bacterias que habitan en el suelo se ha realizado por más de un siglo, la mayor parte de su diversidad sigue sin describirse, solo alrededor del 1 % de los organismos del suelo son actualmente cultivables 28,19. Sin embargo, se estima que en el suelo existen entre 107-109 bacterias por gramo; entre las que se encuentran entre 4000 y 10 000 especies que interactúan con una multitud de compuestos químicos producidos por otros microorganismos, plantas, animales, así como derivados de procesos abióticos 29. Debido a la exposición a estos compuestos químicos ambientales, no es sorprendente que las bacterias hayan desarrollado maquinarias complejas para detectar, responder y metabolizar diversas moléculas con actividad antimicrobiana 29, promoviendo así la adquisición o evolución de elementos de resistencia altamente específicos 30.
Aunque el fenómeno de la resistencia antimicrobiana es antiguo, no hay duda de que la presión selectiva de hoy en día está moldeando su forma actual, grado de movilidad y frecuencia alélica 31). En este sentido, Riesenfeld et al. (2004) mediante estudios de metagenómica demostraron que las bacterias del suelo albergan genes de resistencia a los antibióticos con una diversidad genética considerablemente mayor a la que había sido reportada utilizando técnicas de aislamiento in vitro32. Sin embargo, es necesario tener en cuenta que aunque se detecten genes de resistencia en bacterias que habitan en el suelo, muchos de ellos se pueden encontrar en forma de genes de protoresistencia o silentes, que poseen el potencial de convertirse en genes de resistencia por mutación y/o cambios en la expresión 31. Además, la transferencia horizontal de genes aumenta sustancialmente los riesgos epidemiológicos asociados con la resistencia a los antibióticos, ya que los genes de resistencia a antimicrobianos pueden transferirse bidireccionalmente de bacterias no patógenas a patógenas 21. Por tanto, es necesario tener en cuenta que la transferencia de genes de resistencia no solo ocurriría en un solo sentido, es decir, de bacterias resistentes que afectan al hombre a las que habitan en el suelo, sino que además estas últimas podrían transferir las múltiples capacidades de resistencia a bacterias capaces de afectar al ser humano. Actualmente la preocupación pública se ha centrado en el aumento del número de bacterias resistentes a los antibióticos en el medio ambiente, lo que aumentaría el potencial de transferencia de resistencia a las bacterias patógenas humanas 19. En este sentido, mecanismos de resistencia antimicrobiana detectados en patógenos de entornos clínicos tales como las quinasas modificadoras de aminoglucósidos y la maquinaria biosintética alternativa del peptidoglicano, que confiere resistencia a la Vancomicina, probablemente tienen su origen a partir de bacterias productoras de antibióticos que viven en el suelo, las cuales participan en el intercambio genético con diversos géneros bacterianos por conjugación 33,34,30.
D'Costa et al. (2006) mediante el estudio de resistencia contra antibióticos naturales, semisintéticos y sintéticos de 480 cepas del género Streptomyces aislados del suelo concluyeron que, sin excepción, cada una de las cepas analizadas presentaron resistencia a siete u ocho antibióticos en promedio, con dos cepas que eran resistentes a 15 de 21 medicamentos. Además, se observó cepas capaces de resistir antibióticos de origen sintético (Trimetroprima), de uso reciente (Daptomicina) y semisintético (Rifampicina) mediante diversos mecanismos 30; lo que demuestra que el potencial de resistencia a los antibióticos que poseen los microorganismos que habitan en el suelo ha sido subestimado. Además, D'Costa et al. (2011) mediante un estudio con metagenó-mica detectaron una colección muy diversa de genes que codifican la resistencia a los antibióticos betalactámicos, tetraciclinas y glicopéptidos a partir de un ADN de 30 000 años de antigüedad recuperado de sedimentos del permafrost del Pleistoceno tardío. Además, los autores detectaron el gen de la resistencia a la Vancomicina (vanA), con características similares a las reportadas en la actualidad; lo que pone en evidencia que la resistencia a los antibióticos es un fenómeno natural anterior a la presión selectiva moderna del uso clínico de antibióticos 35.
En consecuencia, el concepto de resistencia a los antibióticos se basa en el entendimiento de que las actinobacterias habitantes del suelo y otras bacterias ambientales son prolíficas productoras de compuestos antimicrobianos y, por tanto, para ser viable, la producción de antibióticos debió evolucionar junto con los mecanismos de resistencia para la autoprotección. Por consiguiente, el concepto de resistoma no solo se limita a los genes que confieren resistencia a los patógenos en la clínica, sino también a las especies no patógenas del medio ambiente 31. En este sentido, los genes de resistencia asociados a microorganismos del suelo se consideran el reservorio para los microorganismos clínicamente relevantes, que lo adquieren mediante transferencia horizontal 21. De modo que los elementos móviles (plásmidos, transposones e integrones) que transportan genes de resistencia son prevalentes en las bacterias transmitidas por los alimentos, tales como los vegetales, y por tanto representan fuentes potenciales de genes de resistencia para el microbioma humano 31,36.
Por tanto, se puede concluir que el suelo participa de dos maneras para contribuir con el fenómeno de la resistencia: por un lado, la presión selectiva desencadenada por la entrada y persistencia de antibióticos al suelo mediante actividades antrópicas es, sin duda, una fuerza motriz significativa para la proliferación de la resistencia antimicrobiana; por otra parte, como se mencionó anteriormente, cada vez más existen evidencias que indican que los microorganismos que habitan en el suelo pueden contribuir significativamente a la propagación mundial de la resistencia a los antimicrobianos. Aunque en las últimas décadas el conocimiento de la resistencia antimicrobiana en microorganismos que habitan el suelo ha tenido grandes avances, el suelo aún es considerado un reservorio inexplorado de resistencia antimicrobiana; por lo tanto, es necesario seguir investigando para establecer los mecanismos exactos de transferencia de genes de resistencia entre bacterias del suelo y aquellas con potencial de causar enfermedades al hombre (patógenas y oportunistas), y de esta manera poder medir el impacto que estos tendrán en los sistemas de salud mundiales.
RESISTENCIA EN ECOSISTEMAS ACUÁTICOS
El papel que cumplen los ecosistemas acuáticos en la presencia y aumento de la resistencia bacteriana puede ser estudiado en tres ámbitos diferentes: el impacto de actividades antropogénicas sobre estos ecosistemas; la biodiversidad microbiana presente en estos ambientes, y por último la microbiota de peces y animales acuáticos.
Los ecosistemas acuáticos son el sumidero de un gran número de antibióticos. El uso indiscriminado de antibióticos por parte del hombre en la medicina humana y veterinaria, así como también en la agricultura y acuicultura 37, son los principales problemas que acrecientan esta situación (figura 2). La presencia de antibióticos en estos ecosistemas ejerce una presión selectiva sobre las bacterias, y ocasiona un aumento en la población de bacterias resistentes y la disminución de la población sensible. Por ejemplo, Nonaka et al. (2007) encontraron un aumento de la población de bacterias resistentes a la Oxitetraciclina en sedimentos de agua de mar de un sitio de acuicultura a lo largo de la costa del mar Interior de Seto (Japón) después de haber recibido terapia con Oxitetraciclina 38.
La presencia de microrganismos resistentes se extiende desde las aguas residuales domésticas y empresariales hasta los efluentes de las plantas de tratamiento de aguas residuales, ríos y mares 39, y en algunas ocasiones los microorganismos son capaces de llegar al agua potable gracias a la formación de biopelículas en las tuberías 12.
Algunos estudios demuestran la presencia de estos microorganismos en las diferentes matrices ambientales; por ejemplo, Ojer-Usoz et al. (2014) evaluaron la presencia de Enterobacterias productoras de betalactamasas de espectro extendido en 21 depuradoras de aguas residuales de Navarra (norte de España), donde se aislaron 185 bacterias resistentes a la Cefpodoxima, con un alto predominio de Escherichia coli; el 86.5 % fueron confirmadas por métodos fenotípicos y mediante reacción en cadena de la polimerasa (PCR) determinaron el predomino del gen blaCTx-M, seguido de blaTEM, blaSHV y blaOxA 40. Así mismo, Kittinger et al. (2016) en el río Danubio en Europa detectaron la presencia de 35 enterobacterias productoras de betalactamasas de espectro extendido, correspondientes a 17 Escherichia coli, 13 Klebsiella pneumoniae y 5 Enterobacter spp., de igual forma, detectaron la presencia de una Klebsiella pneumoniae con Carbapenemasas NMD-1 y dos enterobacterias con KPC-2 41.
Sin embargo, el fenómeno de resistencia antibiótica no solo se debe a las actividades antropogéni-cas; algunos mecanismos de resistencia antibiótica también han sido detectados en zonas menos perturbadas por el hombre; por ejemplo; Calisto Ulloa et al. (2018) detectaron la presencia de Escherichia coli productoras de betalactamasas de espectro extendido en muestras de agua de mar próxima a las bases antárticas 42; además, Miller et al. (2009) detectaron bacterias resistentes a varios antibióticos provenientes del agua de mar cerca de la estación Palmer, Antártida 43. La presencia de bacterias resistentes en zonas de escaso o nulo impacto antropogénico pone de manifiesto el papel de la biodiversidad microbiana presente en estos ambientes.
Los ecosistemas acuáticos albergan un sinnúmero de seres vivos, y un gran porcentaje de ellos son bacterias; gracias a esta característica son considerados reservorios de bacterias resistentes y genes asociados a resistencia antibiótica 44. Liu y Pop (2008) proporcionaron una base de datos que contiene más de 13 000 genes asociados a resistencia antibiótica, que en su gran mayoría son relacionados a genomas bacterianos 45. Las bacterias ambientales presentes en los ecosistemas acuáticos aportan un gran porcentaje de ellos, y su constante interacción con bacterias patógenas provenientes de las aguas residuales permite la transferencia horizontal de genes; por ejemplo, el gen CTX-M, presente de forma natural en la bacteria Kluyvera spp., que codifica para una betalactamasa de espectro extendido, es muy similar al encontrado en bacterias de importancia clínica 16, también se atribuye el origen del gen qnrA a la bacteria ambiental Shewanella spp., distribuida principalmente en aguas marina y agua dulce 39. Schwartz et al. (2003) mediante PCR detectaron en aguas superficiales las secuencias del gen AmpC correspondiente a una betalactamasa de clase C 46; este gen se encuentra presente de forma intrínseca en numerosas bacterias como Pseudomonas aeruginosa, Aeromonas spp., Klebsiella spp. entre otras. La principal importancia de este gen radica en que las bacterias que posean este tipo de enzima AmpC pueden generar resistencia a todos los betalactámicos, incluyendo los carbapenémicos 47, antibióticos utilizados como última opción terapéutica en el tratamiento de infecciones causadas por bacterias multirresistentes, pudiendo así afectar drásticamente la salud del hombre y los animales.
La microbiota de los peces y de otros animales acuáticos es de vital importancia para comprender el fenómeno de resistencia microbiana. Aunque estos microorganismos cumplen un papel fundamental relacionado con el metabolismo e inmunidad de estos animales, también mantienen una exposición constante a los antibióticos y una interacción con bacterias ambientales; lo que aumenta la probabilidad de transferencia de material genético asociado a resistencias antibióticas 48, y por lo tanto pueden volverse resistentes. En peces y otros animales han sido detectadas un sinnúmero de bacterias resistentes a los antibióticos, y un gran número de ellas son asociadas con enfermedades en el hombre; por ejemplo, en muestras de branquias e intestino de peces se han identificado bacterias de la familia Enterobacteriaceae con alta frecuencia de resistencia a la ampicilina, estreptomicina y tetraciclina 49. Así mismo, se han detectado en heces fecales de pingüinos la presencia de bacterias resistentes a varios antibióticos 43.
Por otro lado, la migración de aves acuáticas y otros animales permite la expansión de la resistencia, al actuar como reservorios de bacterias resistentes; por ejemplo, Middleton y Ambrose (2005) analizaron heces frescas de Branta canadensis (Ganso canadiense) y examinaron los perfiles de resistencia de Enterococcus spp. y Escherichia coli. Sus resultados mostraron un porcentaje mayor al 95 % de resistencia a la penicilina g, ampicilina y cefalotina en aislados de Escherichia coli y una frecuencia alta de resistencia en los aislados de Enterococcus spp. a cefalotina, estreptomicina y sulfatiazol 50.
Como se ha visto, el estudio de la resistencia en los ecosistemas acuáticos es un punto crucial para comprender este fenómeno; sin embargo, es un campo que requiere mayor exploración, de tal forma que nos permita determinar el verdadero impacto de las actividades antropogénicas, y el papel de las bacterias ambientales, y la microbiota de peces y otros animales en la persistencia y aumento de la resistencia microbiana.
RESISTENCIA ANTIBIÓTICA EN EL HOMBRE
La resistencia antibiótica en el hombre puede ser abordada desde diferentes perspectivas. La primera se enfoca en el uso y consumo de antibióticos en la medicina humana; una segunda perspectiva, y quizás la más importante, se basa en el daño ocasionado en la salud del ser humano, y la tercera perspectiva, hace hincapié en la importancia de los ambientes clínicos como un sitio predilecto para la transferencia de material genético asociado a resistencias antibióticas.
La resistencia antibiótica es un fenómeno que ocurre de forma natural en el medio ambiente; sin embargo, el hombre ha contribuido desde hace muchos años a su aumento. El uso irresponsable e irracional de estos compuestos en la medicina humana pone en riesgo su eficacia 51, obligando al desarrollo de nuevas moléculas; no obstante, los altos costos para el desarrollo de un antibiótico y el bajo retorno económico han generado un desinterés por parte de las compañías farmacéuticas 51.
El uso masivo de antibióticos en la medicina humana representa un problema en el mundo; por ejemplo, Van Boeckel et al. (2011) reportaron un incremento del 35 % a nivel mundial en el consumo de antibióticos entre 2000 y 2010 52; de igual forma, en Latinoamérica, Wirtz et al. (2010) documentaron el aumento en el consumo de antibióticos entre 1997 y 2007 en países como Perú, Venezuela, Uruguay y Brasil 53. En la Unión Europea, el Centro Europeo para la Prevención y el Control de las Enfermedades (ECDC) reportó un aumento gradual del consumo de antibióticos entre 2004 y 2008 2, y en un estudio más reciente, Klein et al. (2018) determinaron entre 2000 y 2015 un aumento del 65 % en el consumo de antibióticos 54. Sin lugar a dudas, el consumo de antibióticos va en aumento con el transcurrir de los años, convirtiéndose en una amenaza creciente para el sistema de salud.
El consumo excesivo de antibióticos ha contribuido a la evolución de la resistencia (figura 3), y ha ocasionado un aumento en el número de muertes asociadas a infecciones por microorganismos resistentes; por ejemplo, en Europa y Estados Unidos se ha calculado un número aproximado de 25 000 y 23 000 muertes por año, respectivamente 55. Además, la resistencia antibiótica puede ser considerada un problema de salud pública; se estima que un aumento constante de la resistencia para 2050 provocaría la muerte de 10 millones de personas cada año 56.
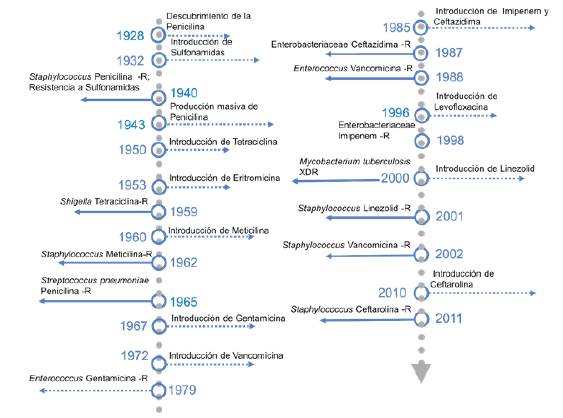
Fuente: Ronield Fernandez.
Figura 3 Evolución de los antibióticos y su resistencia. R: resistente; XDR: extremadamente resistente
El consumo excesivo de antibióticos como Trimetoprim-Sulfametoxazol en infecciones urinarias 57 y Oxacilina para el tratamiento de las septicemias ha contribuido a la aparición de cepas resistentes de Escherichia coli y Staphylococcus aureus, respectivamente 58. Los antibióticos betalactámicos son quizás los fármacos de mayor uso a nivel mundial 52; están indicados para el tratamiento de infecciones microbianas causadas tanto por bacterias Gram positivas como Gram negativas. Esta situación ha provocado un aumento en los porcentajes de resistencia antibiótica; por ejemplo, para 2002 en España se mantenía un porcentaje de resistencia a penicilina por parte de Staphylococcus aureus alrededor de un 90 % 59 y un porcentaje del 68 % para la resistencia a Meticilina (Oxacilina) 60.
La incorporación de antibióticos como Vancomicina y Linezolid para el tratamiento de infecciones causadas por Staphylococcus aureus meticilino-resistente (SARM) es una clara evidencia de que los fármacos betalactámicos han perdido su efectividad 61; no obstante, como una medida para contrarrestar esta problemática, recientemente se han incorporado al mercado dos cefalosporinas de quinta generación (Ceftarolina y Ceftobiprol) 62; sin embargo, cepas de SARM con resistencia a Ceftarolina han sido aisladas en Europa, Asia y Estados Unidos 63.
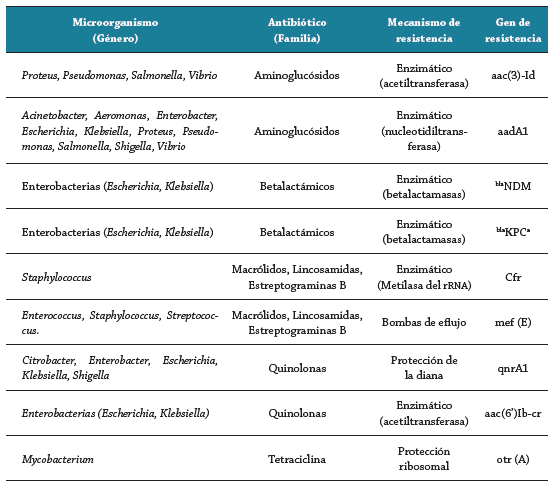
El consumo elevado de carbapenemicos como Meropenem en las unidades de cuidado intensivos 64, y la consecuente aparición de microorganismos como Klebsiella pneumoniae capaces de producir betalactamasas de espectro extendido (BLEEs) y carbapenemasas tipo NDM-1, ha obligado a la reintroducción de un antiguo fármaco como la Colistina 65; de igual forma la presencia de Pseudomonas aeruginosa y Acinetobacter baumanii resistente a múltiples fármacos, ha reevaluado el uso de este fármaco 66. Una información más detallada de los mecanismos de resistencia presentes en diferentes microorganismos de interés clínico se muestra en la tabla 1.
Tabla 1 Ejemplos de genes de resistencia adquiridos por microorganismos de interés clínico. Adaptación de Van Hoek et al. 67
El creciente aumento de bacterias resistentes a los antibióticos ha ocasionado que los tratamientos contra enfermedades como la gonorrea y la tuberculosis hayan perdido efectividad; por ejemplo, la infección por Mycobacterium tuberculosis es considerada una amenaza para la salud mundial, debido a sus altas tasas de resistencia, y ocasiona aproximadamente 150 000 muertes cada año 68. Esta situación se ve acrecentada en los ambientes clínicos, catalogados como reservorios de bacterias multirresistentes y ambiente predilecto para la transferencia horizontal y vertical de genes asociados a resistencia antibiótica. Cada año son aislados un gran número de microorganismos asociados a las principales infecciones nosocomiales, como bacteriemias, neumonías asociadas a ventilación mecánica e infecciones asociadas a sondaje uretral, de los cuales un porcentaje significativo muestra perfiles de resistencia elevados que dificultan su tratamiento 69. Pseudomonas aeruginosa y Acinetobacter baumanii son algunos de los microorganismos más aislados de infecciones nosocomiales y con altas tasas de resistencia antibiótica 70. Además, se debe tener en cuenta que las infecciones por microorganismos multirresistentes en pacientes hospitalizados no solo constituyen una complicación de salud, también son la principal causa de estancias hospitalarias prolongadas, lo cual genera aumento en los costos médicos y probabilidades de muerte 71.
En la actualidad se establece una diferencia entre microorganismos aislados de la comunidad y en hospitales; se cree que estos últimos presentan un perfil de resistencia mucho más elevado y tienen potencial para causar un mayor daño en la salud humana. Algunos microorganismos aislados de hospitales muestran resistencia a un gran número de antibióticos; por ejemplo, en un estudio realizado en un hospital de Cartagena (Colombia) entre 2005 y 2008 reportó porcentajes de resistencia en Escherichia coli de un 81 %, 55,9 %, 52,6 %, 47,1 % y 63 % para Ampicilina, Cefuroxima, Ciprofloxacina, Gentamicina y Trimetoprim/Sulfametoxazol, respectivamente 72. Además, es de gran importancia mencionar que el uso de algunos antibióticos puede ocasionar resistencia a otros, incluso en aquellos que utilizan modos de acción diferente; a este fenómeno se le conoce como "resistencia cruzada" 12.
Por último, la formación de biopelículas en grifos y material de cirugía por algunos microorganismos, como por ejemplo, Acinetobacter baumanii73, y el no cumplimiento de las normas de bio-seguridad como el lavado de manos y el uso de barreras primarias como los guantes por parte del personal médico y de enfermería es una de las principales causas en la transmisión de bacterias resistentes en los ambientes hospitalarios 74.
RESISTENCIA ANTIBIÓTICA EN ANIMALES
Aunque el desarrollo de la resistencia antibiótica se ha atribuido principalmente al incorrecto uso de antibióticos en la medicina humana, su uso en el ámbito veterinario y en animales productores de alimento cada vez demanda mayor importancia. Así como en la medicina humana, en el ámbito veterinario también existe un uso irracional e irresponsable de los antibióticos; situación que puede contribuir al aumento de la resistencia antibiótica 75; sin embargo, el principal problema que acrecienta este fenómeno radica en el uso excesivo de estos compuestos de manera profiláctica en la cría de animales productores de alimentos 76. El uso de toneladas de antibióticos con este fin podría modificar la microbiota intestinal de los animales, lo cual ocasiona un alto predominio de bacterias resistentes 77. La eliminación de estas bacterias junto con las cantidades no metabolizadas de los antibióticos por medio de las heces y la orina de los animales permitiría que llegasen a los suelos y otros ecosistemas, y encontrarían en el medio ambiente un lugar predilecto para la interacción con bacterias ambientales y la transferencia de material genético asociado a resistencias antibióticas 78.
La microbiota presente en la piel y en el tracto intestinal de los animales constituye un factor importante para el aumento de la resistencia bacteriana. El estudio de la microbiota presente en animales productores de alimentos, como vacas y cerdos, requiere un análisis más profundo, ya que la carne y los productos lácteos pueden verse contaminados durante la matanza y el ordeño 79; además, el estiércol utilizado como fertilizante en los suelos puede ser fuente de contaminación de verduras crudas 79. Algunos estudios han mostrado que existe una mayor frecuencia de bacterias portadoras de genes de resistencia a los antimicrobianos en cerdos en comparación con el ganado vacuno y ovino 80,81. Por ejemplo, seis genes de resistencia a la Tetraciclina (tet(O), tet(Q), tet(W), tet(M), tet(B) y tet(L)) fueron detectados en las lagunas de aguas residuales provenientes de criaderos porcinos en Estados Unidos (82); de igual forma, en Gran Bretaña se analizó el perfil de resistencia de Escherichia coli aisladas de cerdos sanos antes de su sacrificio. Los resultados arrojaron altos porcentajes de resistencia a antibióticos como Tetraciclina, Sulfonamida y Estreptomicina 80. En otro estudio, Binh et al. (2010) detectaron la abundancia de los genes de resistencia sul1, sul2 y blaTEM en 15 instalaciones de producción porcina 83.
Con el fin de disminuir el impacto del uso de antibióticos en animales en Europa, después de 2005 fue prohibido el uso de antibióticos como promotores del crecimiento en animales de engorde. Algunos de los estudios que contribuyeron a la aprobación de esta normativa, incluyen los realizados por Aarestrup et al., (2001) y Klare et al. (1999), en los que lograron determinar la disminución de la resistencia en Enterococos aislados de animales observados después de la prohibición de varios promotores de crecimiento 84,85. No obstante, la implementación de normas que permitan regular el uso de estos compuestos sigue siendo una tarea para muchos países en el mundo. Por ejemplo, en China se cree que aproximadamente 105 mil toneladas de los antibióticos producidos al año son utilizados como promotores de crecimiento animal; de igual forma, en 2012 en Estados Unidos se emplearon aproximadamente 6 mil toneladas de antibióticos para el engorde animal 86.
El uso de antibióticos en el ámbito veterinario también se ha visto disminuido después de que se publicaran en diciembre del 2000 en Alemania directrices obligatorias para el uso de antibióticos en animales 87; sin embargo, algunas de estas directrices no se cumplen totalmente, principalmente en países donde no hay una estricta vigilancia.
El uso excesivo de antibióticos en animales contribuye al aumento de la resistencia antibiótica y puede afectar drásticamente la salud del hombre. La presión selectiva que ejercen los antibióticos sobre las bacterias presentes en animales y el suelo permite el aumento de bacterias resistentes, y por medio del consumo de agua y alimentos contaminados éstas pueden llegar al hombre y causar enfermedades.
CONCLUSIÓN
La resistencia antibiótica es un fenómeno que sigue en aumento. El uso irracional de los antibióticos en los diferentes ámbitos sigue siendo aún la principal causa de este problema a nivel mundial; sumando a ello, la baja rentabilidad económica para el desarrollo de nuevos antibióticos que acrecienta esta situación.
El consumo continúo de antibióticos por el hombre y animales ha convertido el medio ambiente en un sumidero de estos compuestos, ya que el suelo y los ecosistemas acuáticos se convierten en su destino final. La exposición de bacterias ambientales a compuestos antibióticos provenientes de las actividades antrópicas y los fenómenos naturales que ocurren en el suelo y los ecosistemas acuáticos, como la transferencia de material genético entre las bacterias, podrían aumentar el porcentaje de las poblaciones bacterianas resistentes en estos ambientes, generando así un riesgo para la salud del hombre y animales.
Una mayor investigación se requiere en cuanto a los procesos de remoción de los antibióticos en las plantas de tratamiento de aguas residuales; de tal forma que los nuevos conocimientos puedan ser empleados para el desarrollo de mecanismos más eficientes en la eliminación de estos compuestos, y finalmente esto contribuya a disminuir la interacción entre las bacterias presentes en el ambiente y los antibióticos.
Indudablemente, los fenómenos naturales que ocurren en el suelo y los ecosistemas acuáticos no pueden ser controlados por el hombre; sin embargo, eliminando, mejorando o reduciendo algunas actividades antrópicas se podría disminuir el impacto de los antibióticos en estos medios naturales, reduciendo con ello los efectos que el fenómeno de resistencia genera en los sistemas de salud del todo el mundo.
Sugerencias
Se deben incluir más estudios reportados en Colombia, que en los últimos años grupos como GRE-BO (Bogotá), CIDEIM (Cali), GRUPO GERMEN (Medellín), LAB GENÉTICA BACTERIANA (Bogotá) han intensificado sus esfuerzos para indicar la epidemiologia molecular de la circulación de patógenos multirresistentes.
Con relación a la anterior sugerencia realizada por alguno de los pares, se ha tomado en cuenta y se han incluido algunos pocos artículos de trabajos realizados en Colombia; sin embargo, el objetivo final del artículo no se basa en mostrar datos epidemiológicos del comportamiento de la resistencia bacteriana en Colombia, sino explicar cómo las actitudes o actividades del hombre son un factor de riesgo para el aumento de la resistencia bacteriana.