INTRODUCCIÓN
El envejecimiento es un proceso biológico, universal, individual, asincrónico y natural que provoca cambios morfofisiológicos en los sistemas corporales. Se ha señalado que modificaciones en los sistemas músculo-esquelético, nervioso y sensorial (visual, vestibular y propiocepción) provocan importantes modificaciones sobre habilidades motoras necesarias para la ejecución de actividades funcionales como el equilibrio y la marcha 1,2. Estos cambios y sus consecuencias han sido fuertemente asociados con un aumento en el riesgo de sufrir caídas 3. Una caída se define como un evento súbito e inesperado que precipita al individuo al suelo en contra de su voluntad, transformándose en un importante problema de salud pública por su alta frecuencia en la población mayor 4. Las caídas representan altos costos económicos para los países, y provocan importantes consecuencias en salud, como aumento del número de hospitalizaciones, fracturas, discapacidad, deterioro funcional e incluso la muerte 5. Alrededor de un tercio de los adultos mayores sufre al menos una caída cada año, y la incidencia se incrementa con el aumento de la edad 5. Además, las caídas tienen un impacto a nivel psicológico y social, pues provocan miedo a caer, pérdida de confianza, restricción de las actividades de la vida diaria 5 y deterioro en la calidad de vida 6. Por lo tanto, el entendimiento de los cambios morfofisiológicos que sufre el adulto mayor por el envejecimiento son de relevancia para la planificación de programas de prevención y promoción de la salud integral en esta población.
CAMBIOS MÚSCULO-ESQUELÉTICOS
Como uno de los órganos más grande del cuerpo, que comprende aproximadamente el 40 % del peso corporal, el músculo-esquelético es esencial para todas las actividades de la vida diaria 7. La capacidad de los adultos mayores para mantener la funcionalidad depende en gran medida de su función muscular (fuerza y potencia muscular) 8. La masa y fuerza muscular disminuyen significativamente con la edad 9,10, si bien ambas condiciones están estrechamente relacionadas, los conceptos actualmente utilizados para explicar cada uno de estos fenómenos son diferentes.
DINAPENIA
En 2008 se propuso el término "dinapenia" para referirse a la pérdida de fuerza y potencia muscular relacionada con la edad 11. Estudios muestran que la dinapenia se relaciona con aumento en el riesgo de discapacidad física, bajo rendimiento físico e incluso la muerte en adultos mayores 11-13.
La fuerza muscular alcanza su punto máximo durante la tercera década de vida, sin embargo, a partir de los 40 años se observa un acentuado descenso en mujeres y hombres, respectivamente 14. Estudios previos han reportado que el descenso de la fuerza ocurre principalmente en musculatura antigravitatoria como extensores de rodilla y plantiflexores de tobillo 15, músculos que intervienen directamente en la ejecución de actividades motrices básicas como mantener la posición bípeda y el equilibrio frente a perturbaciones 3,16.
El deterioro de la fuerza se ha asociado con cambios específicos en el funcionamiento y morfología de la fibra muscular 9. Investigaciones reportan modificaciones en el ángulo de penación (ángulo de la fibra en relación con el eje de generación de fuerza) determinando torques musculares ineficientes que afectan negativamente el rendimiento muscular durante la contracción 17,18 . Por otra parte, la edad avanzada se asocia con una expresión reducida de proteínas regulatorias como la tropomiosina y troponina, lo cual podría afectar, por lo tanto, la generación de fuerza muscular, induciendo mayor riesgo de caídas y peor equilibrio 19.
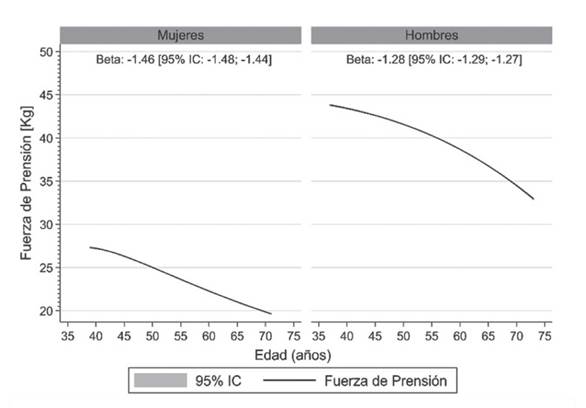
La fuerza máxima de los músculos flexores de los dedos, músculos de la zona tenar e hipotenar de la mano disminuyen con la edad, afectando la fuerza de prensión manual 20,21. En general, a partir de los 40 años y, por cada 5 años de incremento en la edad, la fuerza de prensión manual disminuye 1.4 y 1.2 Kg en hombres y mujeres respectivamente (figura 1). La fuerza de prensión manual hoy en día se considera un indicador de la fuerza general y óptimo desempeño en el desarrollo de las actividades de la vida diaria, como la marcha y el equilibrio 22,23.
Datos presentados como promedio (línea negra) y sus intervalos de confianza del 95% (95% IC) (área gris). El valor beta es el promedio estimado de reducción de la fuerza de prensión manual por cada 5 años de incremento en edad en mujeres y hombres. Figura elaborada en base a datos extraídos de UKBiobank; base de datos que incluye más de 500 000 personas21.
SARCOPENIA
La sarcopenia ha sido definida por el Grupo de Trabajo Europeo sobre Sarcopenia en Personas Mayores (EWGSOP) en 2010 como un síndrome geriátrico caracterizado por una progresiva y generalizada pérdida de masa muscular asociada a la edad, lo que provoca aumento en el riesgo de padecer discapacidad, deterioro en la calidad de vida y muerte 24,25. Desde 2016 fue reconocida como una enfermedad muscular con un código diagnóstico 26,27, mientras que en 2018, nuevamente a través de una actualización de los conceptos el EWGSOP-2 determinó la evaluación y detección de la sarcopenia mediante un algoritmo basado en criterios diagnósticos, entre los que están la disminución en la velocidad de la marcha, la fuerza de prensión manual y la disminución de la masa muscular apendicular 28,29.
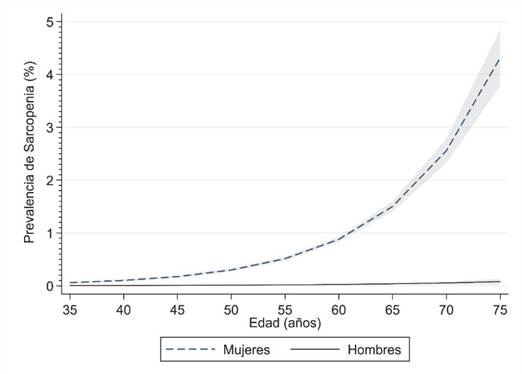
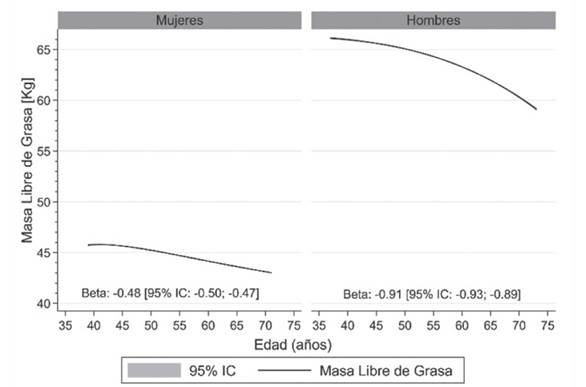
La prevalencia de sarcopenia aumenta más drásticamente en mujeres que en hombres (figura 2), lo cual se explica por las marcadas diferencias que existen en la fuerza muscular y, particularmente en la masa libre de grasa (figura 3).
Datos presentados como prevalencia (%). Figura elaborada en base a datos extraídos de UK Biobank; base de datos que incluye más de 500.000 personas21. La prevalencia de sarcopenia se incrementa conforme avanza la edad en ambos géneros.
Datos presentados como promedio (línea negra) y sus intervalos de confianza del 95% (95% IC) (área gris). El valor beta es el promedio estimado de reducción de la masa libre de grasa por cada 5 años de incremento en edad en mujeres y hombres. Figura elaborada en base a datos extraídos de UK Biobank; base de datos que incluye más de 500 000 personas21.
Originalmente se pensó que la sarcopenia explicaba en gran medida la dinapenia observada en adultos mayores, sin embargo, datos longitudinales han sugerido que otros factores fisiológicos juegan un papel importante en la debilidad muscular 11,30,31.
En general, la masa muscular disminuye en promedio de 0,4-0,8 kg por década después de los 30 años, siendo mayor esta pérdida en hombres (1 %) que en mujeres (0,5 %) 32. Además existe una disminución de aproximadamente un 40 % en el área de sección transversal muscular entre los 20 y 80 años 33. No obstante, esta reducción se acompaña de un aumento e infiltración de estructuras no contráctiles como grasa y tejido conectivo 34,35.
Estudios realizados en el músculo soleo de ratas envejecidas y en los músculos recto femoral y bíceps braquial de adultas mayores mostraron disminución en la masa y tamaño de fibras tipo II, específicamente en el tipo IIb 36,37. Funcionalmente, las fibras tipo II se clasifican como fibras de contracción rápida, adaptadas para realizar metabolismo anaeróbico y con baja capacidad de resistencia a la fatiga, por lo que su reducción en músculos de personas mayores podría ocasionar respuestas más lentas y menor capacidad de realizar actividades funcionales de larga duración, propiciando una caída 9. Se ha observado también que la longitud de la fibra muscular es más corta en adultos mayores, lo cual altera las relaciones longitud-tensión y fuerza-velocidad específicas del músculo 38.
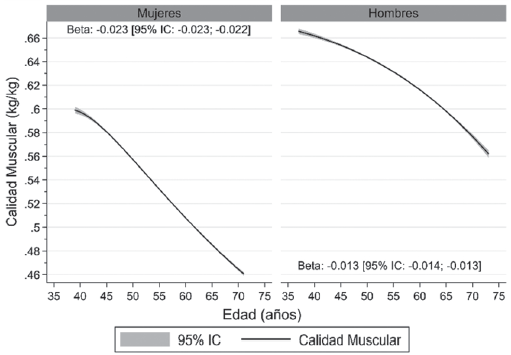
Finalmente, otro parámetro que disminuye drásticamente con la edad es la calidad muscular (figura 4).
Datos presentados como promedio (línea negra) y sus intervalos de confianza del 95% (95% IC) (área gris). El valor beta es el promedio estimado de reducción de la calidad muscular por cada 5 años de incremento en edad. Figura elaborada con datos extraídos de UK Biobank; base de datos que incluye más de 500 000 personas21.
Este término se ha utilizado para describir aspectos micro y macroscópicos de la arquitectura y composición muscular 21. La calidad muscular se determina como la razón entre la fuerza muscular y masa libre de grasa; siendo una de las formas más comunes de expresarla dividir la fuerza de prensión manual por la masa libre de grasa 21. Este indicador se ha relacionado con efectos adversos para la salud de los adultos mayores, tales como aumento del riesgo de fracturas, caídas, limitación funcional y muerte prematura 39-41.
OTROS CAMBIOS MÚSCULO-ESQUELÉTICOS
La capilarización de las fibras musculares esqueléticas disminuye conforme aumenta la edad, lo que podría ocasionar un menor aporte de oxígeno y nutrientes hacia músculos periféricos, además de una menor capacidad oxidativa 42. Todo lo mencionado se traduce en una desventaja muscular para aprovechar el oxígeno suministrado, lo que conlleva a una fatiga anticipada y, por lo tanto, a un menor control muscular voluntario.
A nivel neurofisiológico, se ha informado una reducción de la excitabilidad cortical y espinal, mientras que las unidades motoras disminuyen alrededor de un 30 % entre los 60 y 70 años 43. Con el envejecimiento, las unidades motoras experimentan ciclos de desnervación - reinervación, lo cual genera alteraciones en los componentes pre y postsinápticos de la unión neuromuscular, con consecuentes modificaciones de los receptores postsinápticos de acetilcolina, y por lo tanto, alteración de la secuencia funcional del proceso de contracción muscular 44,45. Todos los cambios, finalmente, se traducen en la pérdida de fuerza muscular y en un impulso nervioso perturbado capaz de ocasionar deterioro de la movilidad, pérdida de equilibrio y caídas 46.
Con respecto al tejido conectivo, el envejecimiento ha mostrado cambios en su estructura asociados preferentemente a factores degenerativos. Se ha observado que los tendones de sujetos de edad avanzada presentan una mayor rigidez, y con ello, menor capacidad elástica, principalmente debido a disminución en la cantidad de colágeno, lo que se traduce en modificaciones de la función biomecánica de las articulaciones 47,48. Estudios realizados en el tendón calcáneo sugieren que con el envejecimiento se reduce su capacidad de deformación, pudiendo provocar modificaciones en la articulación de tobillo y en el patrón de la marcha 49.
Desde hace décadas el envejecimiento se ha asociado con fragilidad ósea, principalmente debido a los cambios generados en la arquitectura trabecular y porosidad cortical 25. Las osteonas presentes en la corteza ósea disminuyen con la edad, induciendo fragilidad, osteoporosis, caídas y fracturas 50. En el adulto mayor la fractura más frecuente ocurre en la articulación coxofemo-ral, debido a variaciones en las propiedades histológicas del cuello femoral, tales como adelgazamiento cortical y pérdida de hueso esponjoso 51,52, ocasionando un alto nivel de morbilidad, mortalidad y discapacidad 51. También se ha reportado que el envejecimiento se acompaña de disminución en la modulación osteoblástica, lo que influye negativamente sobre la densidad mineral ósea y explica las altas tasas de fracturas ocurridas por caídas en el adulto mayor 52.
CAMBIOS EN EL SISTEMA NERVIOSO CENTRAL
Las estructura y función de células y componentes cerebrales muestran un fuerte descenso funcional con el envejecimiento 53. Los cambios generados en el sistema nervioso central podrían asociarse a la aparición de déficit cognitivos y motores, los cuales han mostrado una fuerte asociación con la capacidad funcional de los adultos mayores 53.
Uno de los principales cambios en el sistema nervioso asociados al envejecimiento es la disminución en la neurogénesis 54. Dicho proceso se ha observado principalmente en el giro dentado y región ventricular en estudios post mortem practicados en ratas, primates y humanos adultos mayores 54. A su vez, también se ha reportado disminución evidente en otras áreas cerebrales, como el núcleo estriado, hipotálamo y corteza cerebral, lo que puede ocasionar aparición de enfermedades neurodegenerativas, que influyen directamente sobre la habilidad de mantener el control postural, equilibrio y velocidad de la marcha 55.
Estudios imagenológicos han señalado que el volumen cerebral se reduce con la edad, mostrando una disminución de un 16 % del volumen cerebral total 56. La literatura ha establecido una relación entre volumen cerebral y deterioro del rendimiento físico debido principalmente al rol de la corteza motora primaria, la que producto del envejecimiento ocasiona enlentecimiento y desaceleración de los movimientos voluntarios que a diario realiza el adulto mayor 57. Así también, la atrofia del área somatosensorial puede estar relacionada con un menor equilibrio y un aumento de las caídas 58.
Sumado a lo anterior, al estudiar la activación de la corteza cerebral en respuesta a actividades motoras simples y complejas, se ha encontrado que los adultos mayores presentan mayor activación de estructuras como el tálamo, cerebelo, corteza motora y área somatosensorial 59. Estos cambios estructurales y neurobioquímicos podrían representar mecanismos compensatorios debidos a la necesidad de cumplir y ejecutar las actividades que se demandan. Del mismo modo, se ha descrito que al instante de ejecutar una tarea motora, los adultos mayores activarían conjuntamente más estructuras corticales y subcorticales, como el lóbulo cerebeloso anterior y la corteza premotora 60, mostrando por lo tanto que, pueden realizar actividades motoras, pero requieren una actividad cerebral adicional para desempeñar gestos motores de igual magnitud que los adultos jóvenes.
En relación a la sustancia gris, su volumen disminuye en áreas motoras, sensoriomotoras, ganglios basales (globo pálido principalmente), cerebelo y corteza prefrontal 58,61. Este hallazgo se ha asociado con deterioro de características espaciales y temporales de la marcha (amplitud, velocidad del paso y cadencia) y el equilibrio, lo que provoca deterioro en habilidades motoras básicas que propician una caída 58.
Se ha observado que la sustancia blanca también se modifica con la edad, disminuyendo su volumen de manera más acelerada que la sustancia gris; esto, principalmente, por el deterioro de la milenina y axones mielinizados 61,62. La estructura subcortical más afectada por los cambios en la vaina de mielina es el cuerpo calloso, lo que provoca déficit en la eficiencia de la comunicación interhemisférica, y enlentecimiento del impulso nervioso, aumentando de este modo la dificultad para realizar actividades que requieren coordinación bilateral como la marcha y la mantención del equilibrio 63.
El cerebelo también sufre modificaciones asociadas al envejecimiento. La corteza cerebelosa disminuye en un 28 %, acompañada de reducciones de la sustancia gris y sustancia blanca (12 y 26%, respectivamente) 63,64. Anatómicamente, el cerebelo se compone del lóbulo anterior, posterior y floculonodular; de estos, el lóbulo anterior ha mostrado reducciones significativas (cercanas al 40 %) en su volumen y espesor celular al ser el principal encargado de la mantención del control motor, tono muscular y la marcha, por lo que sus alteraciones también podrían ocasionar pérdidas de equilibrio y caídas 64.
Finalmente, el envejecimiento ocasionaría cambios en la fisiología cerebral, con consecuente disminución en la cantidad de neurotransmisores liberados, principalmente la acetilcolina, serotonina y norepinefrina 53,65, neurotrasnmisores asociado con efectos directos sobre funciones motoras y aprendizaje motor. Se ha reportado además reducción en la liberación de dopamina por el cuerpo estriado, lo cual se asocia con mayores oscilaciones antero-posteriores del cuerpo, lo que altera el equilibrio y aumentan el riesgo de padecer una caída 66.
CAMBIOS EN LOS SISTEMAS SENSORIALES
El envejecimiento se ha asociado a un deterioro progresivo de los sistemas sensoriales que contribuyen en el control postural (sistema visual, vestibular y propioceptivo) 67.
SISTEMA VISUAL
Diversos autores señalan que el sistema más solicitado por el adulto mayor para controlar la postura es la visión 68. La función visual empeora progresivamente después de los 50 años, ocasionando hipersensibilidad al contraste de colores, pérdida de agudeza visual, mayor tendencia a deslumbramientos, déficit en la percepción de profundidad y acomodación del cristalino 69.
Además de los cambios refractivos relacionados con la edad, las personas mayores son particularmente susceptibles a desarrollar patologías oculares como cataratas (50-60 %), glaucoma (10-15 %) y degeneración macular (5-8%) 67,70. Esto conlleva a deficiencia visual y pobre feedback del medio circundante, lo que disminuye la habilidad para evitar obstáculos. Se ha mostrado que los adultos mayores evidencian un deterioro en la capacidad para percibir profundidades, lo que se transforma en importantes factores de riesgo intrínsecos para sufrir una caída, principalmente por el deterioro en la capacidad de percibir elementos presentes en el piso, tales como alfombras, escaleras o desniveles 69,71.
SISTEMA VESTIBULAR
Generalmente, las disfunciones del sistema vestibular son asociadas a cambios fisiológicos producto del envejecimiento 72,73. El sistema vestibular detecta la posición y movimientos que realiza la cabeza en relación con el cuerpo y el espacio 74. Se encuentra constituido por utrículo, el sáculo y los conductos semicirculares. Los primeros son estructuras encargadas de detectar la posición lineal de la cabeza con respecto a la gravedad, mientras los conductos semicirculares otorgan información de los cambios angulares que se ejecutan 74. Estudios anatómicos en adultos mayores mostraron depósitos de carbonato de calcio en los canales semicirculares y desgaste uni- y bilateral de las células ciliadas del laberinto 75. Asimismo, se ha observado que los individuos de mayor edad muestran disfunción coclear y sacular 76. Estos cambios se han asociado fuertemente a padecimiento de caídas, debido a la estrecha relación del sistema vestibular con la mantención del equilibrio y la aparición de vértigo 57,58.
PROPIOCEPCIÓN
Con el aumento de la edad se produce un deterioro de la actividad propioceptiva, que se relaciona con la pérdida del control postural 3. La cinestesia (sensación de movimiento), posición articular y control de la fuerza son los aspectos que componen las funciones de la propiocepción, y conjuntamente son de gran importancia en el desarrollo de actividades motoras funcionales en el adulto mayor 67,77. Con la edad se ha descrito un déficit en la cinestesia y, particularmente, en la posición articular, la cual se perturba en ciertas articulaciones, como tobillo, rodilla y cadera, provocando disminución de la estabilidad postural y contribuyendo al aumento del riesgo de caídas 78,79.
Se reconocen tres tipos de propioceptores: a) los husos musculares, ubicados dentro del músculo; b) el órgano tendinoso de Golgi (OTG), ubicado dentro de los tendones; c) mecanorreceptores, ubicados en las articulaciones y en tejidos conectivos periféricos 80. En relación al OTG existe escasa literatura actualizada que señale las modificaciones que sufre debido al envejecimiento, sin embargo, se ha documentado un descenso en el número de receptores, lo cual se traduce en una errada interpretación de la tensión generada por el tendón al momento de realizar contracción muscular 81. Esta sensación distorsionada que asciende al sistema nervioso central provoca un mal procesamiento de la información y, por lo tanto, una respuesta muscular ineficiente, condicionando actos motores inestables. Además, estos cambios provocan un bajo desempeño motor que limita la funcionalidad del adulto mayor 82.
También se reconoce la existencia de una serie de receptores periféricos denominados mecanorreceptores, cuya función es proporcionar un feedback de los cambios mecánicos y la posición que experimentan las articulaciones 82. La literatura señala que el envejecimiento disminuye la cantidad y densidad de mecanorreceptores, principalmente Meissner, Paccini y Ruffini generando una baja percepción a estímulos vibratorios 83. Esta disminución afecta directamente la función de las articulaciones e indirectamente a las respuestas musculares.
Finalmente, estudios han mostrado que el envejecimiento genera cambios sobre el huso muscular, particularmente una disminución en el diámetro y número total de fibras intrafusales, aumento del espesor capsular y disminución de la sensibilidad 84,85. Estos cambios afectan la sensación, percepción y ejecución de los movimientos corporales, y alteran algunas funciones motrices, como el equilibrio estático y dinámico, condición que se transforma en un factor de riesgo para padecer caídas.
CONCLUSIÓN
Los adultos mayores presentan cambios morfofisiológicos producto del envejecimiento, los cual se transforman en factores determinantes en el riesgo de caídas. Entre estos cambios destacan la reducción en número y tamaño de la fibra musculares, pérdida de fuerza muscular, disminución del volumen cerebral, modificaciones en la liberación de neurotransmisores, déficit visual-vestibular y reducción del número de órganos propioceptivos como el huso muscular y mecanorreceptores, entre otros. La combinación de estas alteraciones se traduce en una mayor vulnerabilidad del adulto mayor frente a perturbaciones tanto en actividades estáticas como dinámicas. Por lo tanto, se recomienda que en las estrategias de prevención de caídas se incorporen actividades que incluyan la estimulación multicomponente con el fin de evitar el deterioro funcional e incluso la discapacidad.
Finalmente, conocer que los adultos mayores tienen factores de riesgo para sufrir caídas debido a los cambios anatomofisiológicos ayuda a los profesionales de salud a dirigir las intervenciones y planes de tratamiento, enfocándose también en la prevención y, particularmente, en la educación de factores intrínsecos, en donde dentro de estos últimos, la calidad de las viviendas y el entorno juegan un rol fundamental para disminuir la prevalencia de caídas.