INTRODUCCIÓN
Los tumores del estroma gastrointestinal (GIST) continúan siendo las neoplasias mesenquimales más frecuentes, representando entre el 1 y 3 % de los tumores malignos del tubo digestivo 1. La frecuencia de ocurrencia es 6.8 a 14.5 casos por millón al año 2,3. Las localizaciones más usuales de los GIST son: estómago (51 %), intestino delgado (36 %), colon (7 %), recto (5 %) y esófago (1 %) 2,3. Su histogénesis probable es atribuida a las células intersticiales de Cajal 3,4. En la inmunohistoquímica expresa positividad para las proteínas CD117 (c-KIT), PDGFRA y DOG-1 4. El tratamiento de primera línea consiste en la extirpación quirúrgica, asegurando márgenes de resección libres de tumor para reducir el riesgo de recurrencia local 3. Las mutaciones activas de c-KIT (un receptor para el factor de crecimiento epidérmico) ha convertido al GIST en un verdadero paradigma en los objetivos de la terapia molecular mediante el uso de inhibidores de la tirosina cinasa como imatinib en el tratamiento adyuvante 5-7, los cuales mejoran el pronóstico de pacientes con GIST metastásico 8,9.
Se ha identificado que cerca del 10-30 % de los GIST tienen un curso clínico maligno 3; por ello, el uso de los criterios histopatológicos como la delimitación tumoral, pleomorfismo, necrosis y anaplasia son usados en la mayoría de los tumores para clasificarlos como benignos o malignos. Sin embargo, en el caso de los GIST, esta delimitación es más difícil de precisar y se basa en otros criterios para una adecuada clasificación de los tumores, estableciendo el pronóstico y tratamiento apropiados.
Este reporte de caso presenta un GIST gástrico gigante con criterios histopatológicos de alto riesgo y destaca los principales sistemas de clasificación para la estimación de progresión a malignidad.
REPORTE DE CASO
Paciente masculino de 67 años de edad, procedente del área rural, se presenta a la sala de emergencias por hematemesis y melenas en múltiples ocasiones durante más de 15 días, asociado con pérdida de peso subjetiva y sensación de masa en el abdomen, niega otros síntomas asociados. Se documentó en el historial médico un antecedente de hipotiroidismo en tratamiento con levo-tiroxina 50 mcg/día. Al examen físico, se observa al paciente en regulares condiciones generales, con palidez mucocutánea marcada y con los siguientes signos vitales: frecuencia cardiaca: 85 latidos por minuto; frecuencia respiratoria: 17 respiraciones por minuto; tensión arterial: 110/70 mmHg; temperatura: 37° C. A la exploración física del sistema gastrointestinal se encuentra una masa palpable en la región epigástrica, prominente, no dolorosa, inmóvil. Sin otros hallazgos notables al examen físico. En los exámenes de laboratorio, el recuento sanguíneo reveló anemia (hemoglobina 5.5 g/dl), con unos glóbulos blancos de 4.200/μL, neutrófilos polimorfonucleares 61.7 %, linfocitos 32.1 %, monocitos 6.2 % y plaquetas de 261,000/μL. Se hospitaliza y el mismo día se realizó una endoscopia de vías digestivas altas, con el hallazgo de una lesión submucosa de aproximadamente 5,5 cm, el cual se biopsia para estudio. No se encontraron lesiones en el duodeno. Además, se realizó una tomografía axial computarizada (TAC) abdominal que muestra una masa voluminosa de 20x10x6 cm de diámetro que depende de la pared del estómago. El examen microscópico reveló un tumor fusocelular mesenquimatoso, probable GIST; se realiza tinción de inmunohistoquímica para ser confirmado. En el tercer día de hospitalización, el paciente presentó un nuevo episodio de hemorragia gastrointestinal grave, tratado con omeprazol intravenoso, transfusión de sangre de 3 UI de glóbulos rojos. Se practicó cirugía de emergencia, debido al compromiso hemodinámico y control del sangrado. El procedimiento quirúrgico consistió en gastrectomía subtotal, gastroyeyunostomía más omentectomía, derivación gastrointestinal en Y de Roux y anastomosis termino-terminal del intestino delgado (figura 1). En el postoperatorio, el paciente es trasladado a Unidad de Cuidados Intensivos con soporte inotrópico con Dobutamina a 0.25 mcg/kg/min. Posteriormente, debido a la evolución clínica favorable, alrededor del séptimo día, se da egreso de la clínica, con cita de control en un mes, con cirugía oncológica. El paciente asiste con el informe histopatológico del producto de gastrectomía; el cual reporta a nivel macroscópico una masa gigante de 20x10x6 cm de ubicación mural y ulcerada. La lesión se extiende a lo largo de la curvatura menor que obstruye casi toda la luz gástrica. A nivel microscópico, el tumor se desplaza desde la mucosa hasta la serosa y se asocia con la invasión de la lámina propia y angioinvasión (figura 2). Se caracteriza por células poco diferenciadas y fusadas distribuidas en un patrón estoriforme en un estroma con áreas mixoides en las cuales las células exhiben pleomorfismo considerable, fenotipo epitelioide y células multinucleadas gigantes (figura 2). El índice mitótico fue <5 mitosis en 50 campos de alto poder (CAP), áreas de necrosis no fueron documentadas, con márgenes de resección libres de tumor. Debido a las características histopatológicas del tumor; El médico Patólogo consideró como impresión diagnóstico un GIST, un tumor neuroendocrino, un carcinoma poco diferenciado y un linfoma anaplásico dentro de los diagnósticos diferenciales. Se utilizaron las tinciones inmunohistoquímicas para células epiteliales, neuroendocrinas, linfoides y estromales. Las tinciones mostraron positividad para DOG-1, CD-117 y la coexpresión de CD-34 (figura 2). Los marcadores policlonales CKAE1/AE3, CK7, CK20, CD56, cromogranina, CD45, CD20 y CEA fueron negativos. El diagnóstico histopatológico definitivo fue un GIST con alto riesgo de progresión a malignidad debido al tamaño del tumor, la infiltración de la mucosa y angioinvasión (figura 2). En la disección no se documentaron ganglios linfáticos regionales. Debido a los hallazgos histopatológicos, el médico oncólogo decidió el tratamiento adyuvante con imatinib 400 mg dosis/día. Hasta la fecha continúa en tratamiento con médico tratante.
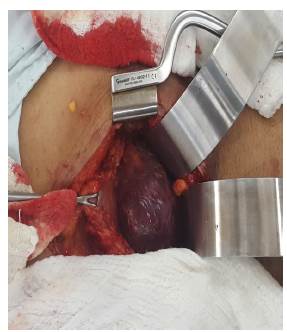
Fuente: los autores.
Figura 1 Se observa el GIST en el procedimiento quirúrgico como una masa gigante de 20x10x6 cm de localización mural sobre la curvatura menor gástrica
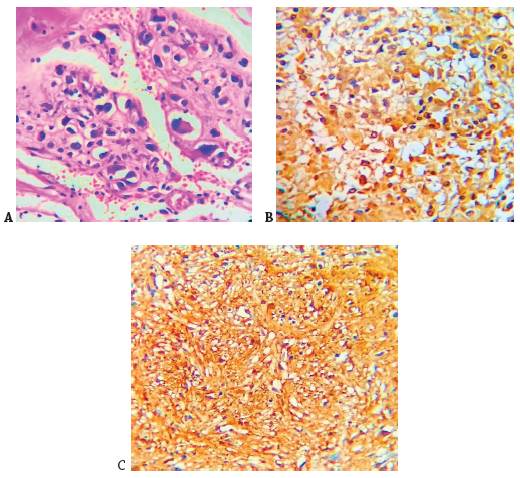
Fuente: los autores.
Figura 2 (A) En la tinción de hematoxilina y eosina (H&E) se observa células tumorales que invaden la lámina propia y la ulceración de la mucosa. Nótese ampliación a 40X. (B) En la tinción de Inmunohistoquímica hay expresión intensa para CD117. Las células tumorales son positivas para c-KIT. (C) El marcador DOG-1 es fuertemente positivo para las células tumorales difusas.
DISCUSIÓN
Los GIST son la proliferación mesenquimal más frecuente, cuya histogénesis es dependiente de las células intersticiales de Cajal 3,4. El tumor GIST es una neoplasia rara, con una frecuencia de ocurrencia de 6.8 a 14.5 casos por millón de personas al año 2,3. Las localizaciones más comunes de los GIST son: estómago (51 %), intestino delgado (36 %), colon (7 %), recto (5 %) y esófago (1 %) 2,3. En Colombia se han documentado algunos casos de GIST en recto 10, duodeno 11 y gástrico 12. Por su parte, Vargas et al.13 y Oliveros-Wilches et al.14 han presentado algunas series de casos de GIST gástricos.
Su comportamiento biológico es bastante heterogéneo, su espectro abarca desde pequeñas lesiones asintomáticas benignas hasta sarcomas metastásicos, que son fatales 15. En el GIST gástrico se ha identificado mutaciones en el exón 11 del gen KIT y el exón 18 del gen PDGFRA, que han sido asociados al comportamiento y predictores de la respuesta terapéutica. En ese sentido, se ha detectado la mutación en el exón 11 el gen KIT en el 67-75% de los casos, siendo relacionada con pobre pronóstico. Sin embargo, se ha demostrado que el GIST inhibidores de la tirosin kinasa como el imatinib en el 83.5 % 16. Además, las mutaciones en el gen PDGFRA ocurren principalmente en tumores gástricos y casi exclusivamente en el exón 18, seguidas de pocas mutaciones en el exón 12 y el exón 14. La mutación con más frecuencia en el exón 18 es una sustitución de un solo nucleótido conocido como Asp842Val (D842V), que es resistente a los inhibidores de la tirosinacinasa 16.
Dado el patrón de crecimiento intramural del tumor, se hace evidente cuando alcanza un tamaño significativo, manifestándose como masa palpable, hemorragia gastrointestinal, obstrucción y perforación que ocasionan verdaderas emergencias quirúrgicas y amenazan la vida del paciente 17,18, tal como sucedió en el caso presentado, el paciente consultó por hematemesis y melenas. Debido al tamaño tumoral y la ulceración, que provocan una hemorragia de vías digestivas altas con requerimiento de hemoderivados y procedimiento quirúrgico de emergencia.
La determinación de malignidad en este grupo de tumores es compleja. Por ende, se ha propuesto el uso de diferentes criterios para tratar de predecir el comportamiento biológico del tumor. En términos generales, los tumores más grandes ubicados en el intestino delgado y con recuentos mitóticos altos son más agresivos 19 (Tabla 1). Del mismo modo, los criterios del consenso del NIH-GIST 20, utilizan dos factores; tamaño tumoral e índice mitótico, para estratificar el riesgo de recurrencia tumoral (Tabla 2). Algunos autores han planteado ciertos marcadores histológicos convencionales de malignidad, como el pleomorfismo, la angioinvasión y la hipercelularidad, para predecir el comportamiento agresivo 21; sin embargo, a nivel microscópico, se ha considerado que la invasión de la lámina propia de la mucosa es un hallazgo altamente sugestivo de malignidad 22. Aunque en la literatura se han reportado casos de GIST gástrico gigante con ruptura espontánea y sangrado gastrointestinal 23-25, los autores no han destacado la descripción de la angioinvasión y la infiltración de la lámina mucosa propia como criterios de alto riesgo. En este reporte de caso, se documentó un tumor gástrico mayor de 10 cm, con ulceración y afectación histológica de la lámina propia asociado a angioinvasión. En general, además del tamaño, estos criterios permitieron su clasificación como GIST de alto grado, por lo que el médico tratante indicó terapia adyuvante con imatinib.
Tabla 1 Riesgo de progresión en GIST según localización del tumor, tamaño del tumor e índice mitótic.
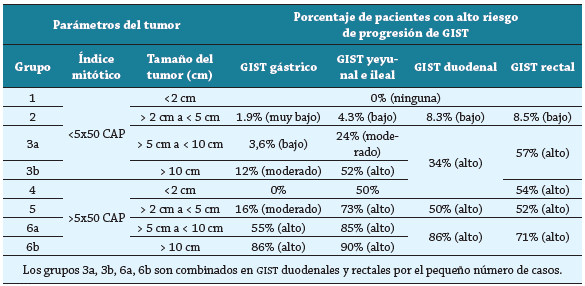
El riesgo de enfermedad progresiva es definido como la posibilidad de metástasis o muerte. CAP: campos de alto poder.
Tomado y adaptado de Miettinen et al. 19.
Tabla 2 Criterios de Fletcher-NIH para la evaluación de riesgo
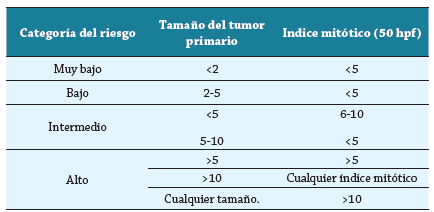
El riesgo de definido como la pos.al. 20. La invasión de la lámina propia y la angioinvasión se han propuesto como factores adicionales de alto riesgo 22.
Con la aparición de los inhibidores de la tirosina cinasa, los GIST se redefinieron en términos histológicos, inmunofenotípicos y perfil mutagénico. Desde entonces, la investigación básica y clínica ha aumentado el conocimiento sobre el GIST, permitiendo el avance de las terapias dirigidas y demostrando el papel del imatinib en el GIST de alto riesgo 7,26. El ensayo clínico aleatorizado EORTC comparó el tratamiento adyuvante con imatinib versus observación después de la cirugía R0/R1 para GIST. Los resultados respaldan la recomendación de prescribir imatinib solo en pacientes con GIST de alto riesgo 27. En este ensayo, los pacientes con GIST de riesgo bajo a intermedio no obtuvieron un beneficio adicional con imatinib en comparación con placebo.
CONCLUSIONES
El tumor GIST es una patología rara, pero con un potencial maligno notable. Aunque clínicamente puede imitar otras neoplasias gastrointestinales y presentarse como emergencia quirúrgica e inestabilidad hemodinámica por la hemorragia de vias digestivas altas, como en el caso presentado, el GIST tiene características histopatológicas y moleculares distintivas. El reconocimiento de los criterios histopatológicos de alto riesgo, como el tamaño del tumor, el índice mitótico, la ubicación, la invasión de la lámina propia, la angioinvasion y la ruptura, son esenciales para la clasificación de los tumores, así como para establecer el pronóstico y tratamiento más apropiado (la resección quirúrgica y terapia adyuvante con imatinib) en tumores de alto riesgo.















