INTRODUCCIÓN
La preeclampsia es la complicación médica más común del embarazo, caracterizado por hipertensión arterial, proteinuria, anomalías en la coagulación 1,2 y disfunción hepática 3. Su frecuencia es mayor en primigestantes jóvenes y de mayor edad, hipertensas previas y diabéticas 4,5. Su etiología es compleja, en la cual participan factores genéticos y ambientales 6,7. Se calcula que cada año mueren alrededor de 50 000 mujeres a nivel mundial por causa de la preeclampsia, que afecta entre 3-10 % de los embarazos, siendo la principal causa de muerte materna en el mundo 8. En Colombia, la hipertensión gestacional y la preeclampsia producen el 19 % de las defunciones maternas 9.
En las primigestantes se asocia a complicaciones como desprendimiento placentario, falla renal aguda, accidente cerebro vascular, coagulación intravascular diseminada, retardo del crecimiento intrauterino, parto pretérmino y muerte materna 10. Si consideramos que en Colombia la mortalidad materna es 10 veces mayor que la observada en Estados Unidos (10 x 100.000), alcanzando una tasa de 130 muertes x 100 000 recién nacidos vivos 11, el impacto económico y social en nuestro país es de gran importancia, lo que justifica continuar investigando las posibles causas y factores asociados a la preeclampsia en nuestras gestantes.
Desde el punto de vista fisiopatológico, la preeclampsia se caracteriza por una invasión anormal del citotrofoblasto en las arterias espirales durante la placentación, y en una disfunción endotelial 12 que se evidencia por un estado de estrés oxidativo, disminución en la actividad del óxido nítrico sintetasa endotelial, aumento en las concentraciones de homocisteína circulante, dislipidemia y una mayor expresión de marcadores del daño endotelial 13; también ocurre elevación de las resistencias vasculares sistémicas, activación de la cascada de la coagulación e incremento de la agregación plaquetaria, por lo que se considera como una enfermedad del endotelio vascular materno 14.
Diversos estudios han demostrado que la hiperhomocisteinemia es un factor de riesgo para el embarazo, y se ha relacionado con malformaciones congénitas, desprendimiento de la placenta, abortos repetitivos y el desarrollo de preeclampsia 15,16,17. El déficit de folatos es un factor de riesgo importante para el feto por la disminución en el nivel de nucleótidos y el aumento de la homocisteína plasmática 18. Los niveles elevados de homocisteína producen el daño endotelial a través de un mecanismo oxidativo, porque el grupo sulfidrilo de la homocisteína al oxidarse forma aniones superóxidos y peróxido de hidrógeno implicados en la lesión endotelial directa, debido a que incrementan la oxidación de lipoproteínas de baja densidad (LDL) y, por tanto, su captación por parte de los macrófagos en la pared vascular, estimulando la formación de la placa aterosclerótica, que a su vez estimula la generación de peróxido de oxígeno, llevando a la agresión endotelial sostenida 19, con liberación de citoquinas proinflamatorias y mediadores de la cascada de la coagulación. Las vitaminas B6, B12 y B9 (ácido fólico) son coenzimas en el metabolismo de la homocisteína, por lo tanto, sus niveles están relacionados con el nivel de homocisteína; una investigación demostró que 2/3 de las hiperhomocisteinemia se deben a niveles disminuidos de ácido fólico y vitamina B12 20. El objetivo de este estudio fue establecer la relación entre los niveles de homocisteína y el desarrollo de hipertensión gestacional durante el tercer trimestre de la gestación.
METODOLOGÍA
Población objeto de estudio
Se realizó un estudio descriptivo y prospectivo de corte transversal con datos cuantitativos, teniendo en cuenta la evolución del embarazo durante el tercer trimestre. La población diana fueron 88 mujeres gestantes a partir de la semana 24, de cualquier edad, raza y estrato socioeconómico que acuden a la consulta de obstetricia en clínicas de las ciudades de Santa Marta y Barranquilla (Colombia). Participaron 47 mujeres gestantes con tensión arterial normal y 41 con preeclampsia que firmaron un consentimiento informado y respondieron a un cuestionario que incluyó antecedentes personales, familiares y tipo de alimentación. Los datos de la tensión arterial (TA) e índice de masa corporal (IMC) se obtuvieron de la historia clínica. La edad gestacional se determinó mediante las ecografías obstétricas realizadas en el control prenatal. Todas las gestantes tomaban ácido fólico. No ingresaron al estudio gestantes con diagnóstico previo de hipertensión arterial, diagnóstico previo de colagenopatías, nefropatía crónica, embarazo múltiple, embarazo molar, tiroidopatía, epilepsia, antecedente personal de abortos recurrentes, y mujeres que se encuentran medicadas con cualquiera de estos medicamentos: Clorpromazina, ácido Valproico, Hidralazina, Amoxicilina, Propanolol, Estreptomicina, Procainamida, Interferón, Quinidina, Sulfadoxina, Di-lantin, Pirimetamina, Metotrexato, óxido nitroso, Carbamazepina, Fenitoina.
Medición de Homocisteína
La muestra de sangre venosa fue tomada en ayunas con los procedimientos estandarizados globalmente. Se tomaron 10 cc de sangre periférica y se extrajo el suero mediante centrifugación. La medición de los niveles de homocisteína plasmática se realizó mediante inmunoensayo de fluorescencia polarizada comercializado y distribuido por ABBOT laboratorios empleando un analizador IMx-System, en un laboratorio clínico de tercer nivel de la ciudad de Cartagena (Colombia). Los niveles normales de homocisteína fueron determinados por el Health and Nutrition Examination Survey (NHANES III) entre 1991 y 1994 en una población de 8086 participantes con concentraciones de folatos, vitamina B12 y creatinina plasmática normales. El valor normal de homocisteína es de 3,3 a 7,2 μmol/L en mujeres entre 12 y 19 años y de 4,9 a 11.6 μmol/L en mayores de 60 años; la hiperhomocisteinemia se inicia con 10,4 μmol/L en menores de 60 años. El valor normal en varones también varía con la edad y la hiperhomocisteinemia se inicia con 11,4 μmol/L en menores de 60 años 20.
Análisis estadístico
Para conocer si los valores en la concentración de homocisteína se ajustaban a la normalidad, se realizó la prueba de Kruskal-Wallis (K-W). Se evaluó el riesgo de preeclampsia y antecedentes familiares por medio de tablas de contingencia 2x2, test de Chi cuadrado de Pearson y análisis multivariado. Se utilizó el modelo de correlación de Pearson y se compararon medias por medio de la prueba t de Student y ANOVA de un factor. Todos los análisis se realizaron con el paquete estadístico SPSS 17 para Windows. INC.
RESULTADOS
Características generales de la población analizada
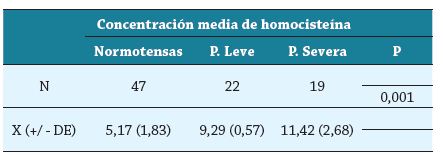
La población general, en la que participaron 47 (53.4 %) normotensas y 41 (46.6 %) pre eclámpticas, tenía un promedio de edad de 25,93 años (mínima 13, máxima 40); las relaciones de TA e IMC entre los grupos se muestran en la tabla 1. No se encontró diferencia estadísticamente significativa en el promedio de edad entre casos (preeclampsia) y controles (normotensas), pero sí hay diferencias significativas entre casos y controles con relación a la TA, IMC y niveles de homocisteína. Las diferencias estadísticamente significativas en los niveles de homocisteína entre normotensas y preeclámpticas leves y severas se muestran en la tabla 2 y en la figura 1.
Tabla 1 Valores promedios de Homocisteína, tensión arterial e IMC entre los grupos
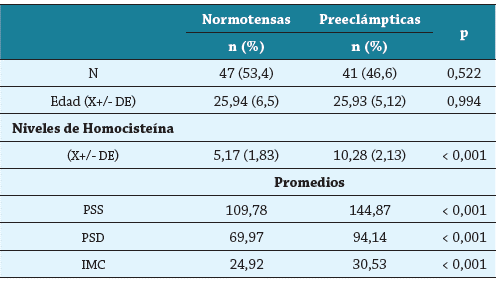
DE: desviación estándar. PSS: presión sanguínea sistólica. PSD: presión sanguínea diastólica. IMC: índice de masa corporal.
Correlación entre los niveles de homocisteína con IMC e hipertensión
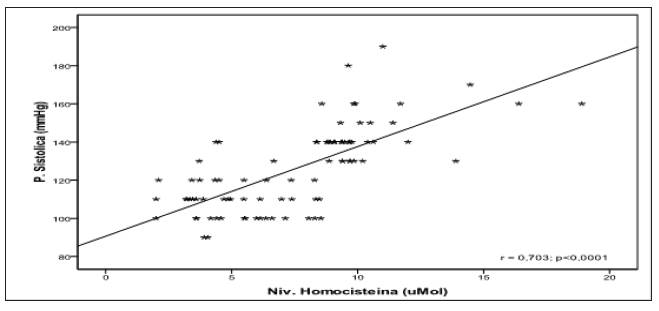
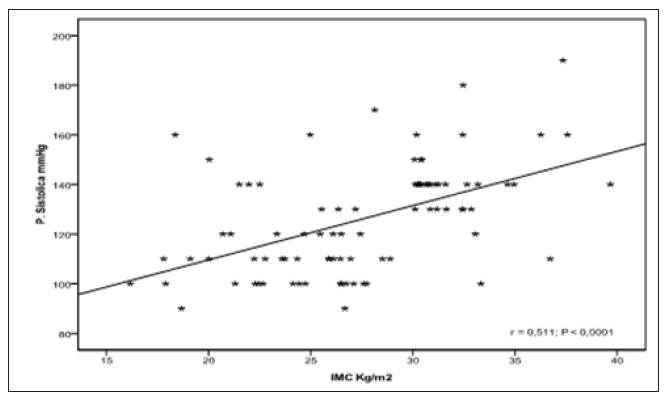
Para realizar este análisis, se utilizó el índice de correlación de Pearson. Se correlacionaron los valores absolutos de los niveles de homocisteína (μmol/L) con el índice de masa corporal (kg/m2) y los valores de presión sanguínea sistólica. Se halló correlación estadísticamente significativa entre los niveles de homocisteína y el índice de masa corporal (IMC), entre homocisteína y presión sanguínea sistólica (PSS) y entre los valores de IMC y PSS (figuras 2, 3 y 4).
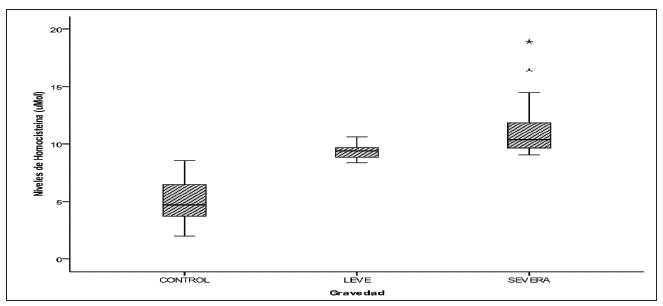
Figura 1 Medias de los niveles de homocisteína (μMol/L) en grupo control y preeclámpticas leves y severas
Asociación entre preclamsia y antecedentes familiares
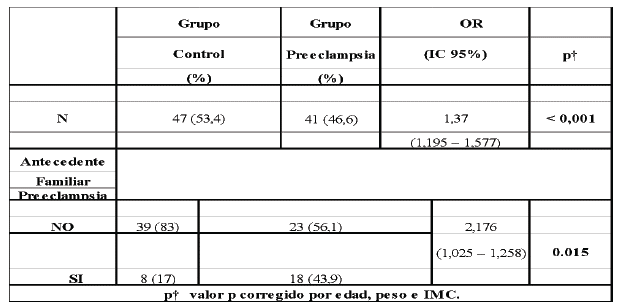
Para realizar este análisis se utilizó la variable dicotómica antecedentes familiares con preeclampsia hasta segundo grado de consanguinidad y se comparó con los casos y controles por medio el test de Chi cuadrado de Pearson. El análisis de Chi cuadrado sugiere que poseer un miembro familiar hasta el segundo grado de consanguinidad representa un riesgo significativo para desarrollar preeclampsia (OR=3,815; IC 95 %: 1,433-10,159; p=0,006).
Asociación entre los niveles de homocisteína con preeclampsia y antecedentes familiares
Para comprobar si la asociación encontrada por el test de Chi cuadrado era cierta, se realizó un modelo de regresión logística múltiple enfrentando las variables dependientes antecedentes familiares, casos y controles con la covariable de niveles de homocisteína. Para evitar sesgos, este modelo fue controlado por las variables edad, peso e IMC.
La regresión logística indica una asociación entre preeclampsia y niveles de homocisteína; pacientes con niveles elevados de homocisteína presentan un riesgo de 1,372 de desarrollar preeclampsia (IC95 % 1,195-1,577; p<0,001). De igual manera, los niveles elevados de homocisteína representan un riesgo para preeclampsia significativamente mayor en el grupo que presenta antecedentes familiares en comparación con el grupo que no tiene antecedentes; el valor OR para este grupo es 2.176 a un nivel de significancia estadística p = 0,015 con intervalos de confianza al 95 % de 1,025 - 1,258. Por tanto, los niveles de homocisteína elevados y los antecedentes familiares pueden ser considerados como factores de riesgo para la preeclampsia en la población estudiada (tabla 3).
DISCUSIÓN
En este estudio encontramos la media de los niveles de homocisteína incrementados en los casos de preeclampsia, lo cual indica que la hiperhomocisteinemia está relacionada con la hipertensión gestacional. Nuestros datos son consistentes con los reportados por otros 17,21. Mujawar y col hallaron diferencias en la concentración media de homocisteína entre normotensas y preeclámpticas con una significancia menor 0,0001 en una población de 50 casos y 50 controles; concluyen que la homocisteína es un riesgo para preeclampsia y la enfermedad cardiovascular; conclusión respaldada por los resultados obtenidos en nuestro estudio 22.
Por otro lado, las gestantes preeclámpticas, comparadas con las normotensas, mostraron incremento significativo en el IMC. El IMC es un parámetro relacionado con el grado de obesidad, y es considerado factor de riesgo para la eclampsia 23,24. Nuestros datos sugieren que un aumento en los niveles de homocisteína puede relacionarse con obesidad, aumento de la respuesta inflamatoria y elevación de la presión sanguínea debida a los cambios metabólicos inducidos por estrés oxidativo 25. La correlación obtenida entre hipertensión y concentración de homocisteína, IMC e hipertensión y concentración de homocisteína e IMC respaldan este planteamiento. Con relación a la asociación hallada entre niveles elevados de homocisteína y severidad de la enfermedad, podemos inferir que esto obedece a la pérdida de la función endotelial debido a la hiperhomocisteinemia. Se considera que la homocisteína incrementa el estrés oxidativo 19,25, y esto conduce a un desbalance de factores que regulan la función del endotelio vascular, trayendo como consecuencia la aparición de fenotipos bioquímicos asociados a la preeclampsia, como el incremento de citoquinas proinflamatorias, activación de proteínas del choque térmico, aumento del infiltrado leucocitario, formación de ateromas y aumento de la presión sanguínea, elementos que inducen a la exacerbación y severidad de la enfermedad 26,27. Es posible que en nuestras gestantes la hipertensión resulte como consecuencia del aumento en los niveles de homocisteína; hipótesis respaldada por la relación estadísticamente significativa demostrada en los resultados, por lo que hay que considerar estos factores en el control de toda gestación. Además, los valores de homocisteína obtenidos en este estudio en las gestantes normotensas tienen un promedio de 5,17 μmol/L con desviación estándar (DE) de 1,83, que nos ofrece un rango de 3,34 a 7 μmol/L, que concuerda perfectamente con los resultados de normalidad del estudio NHANES III. En las preeclámpticas leves, el promedio fue de 9,29 μmol/L, con un rango entre 8,72 y 9,86 (DE 0,57)), que son valores intermedios entre la normalidad y la hiperhomocisteinemia. En las severas, el promedio fue de 11,42 μmol/L (DE 2,68), superando el valor de 10,4 μmol/L, característico de la hiperhomocisteinemia. El análisis de estos resultados sugiere que hay un aumento paulatino de los niveles de homocisteína que se inicia al comienzo del tercer trimestre en la gestante predispuesta a la preeclampsia, por lo tanto, este estudio debe realizarse a toda gestante en este periodo de la gestación como un tamizaje del embarazo de alto riesgo.
El padecimiento de una enfermedad compleja, en un grupo familiar, sugiere una fuerte participación de la interacción gen-ambiente. En nuestra población, los antecedentes familiares pueden ser considerados como factor de riesgo para la preeclampsia. Los niveles elevados de homocisteí-na significativamente mayor en el grupo que presenta antecedentes familiares, en comparación con el grupo que no presenta antecedentes (OR =2.176; IC95% de 1,025 - 1,258; p=0,015), sugiere que genes heredados tienen un papel en el desarrollo de la enfermedad. Diversos estudios en diferentes poblaciones han encontrado asociación entre los niveles altos de homocisteína con polimorfismos genéticos; por ejemplo, se han publicado asociación entre hiperhomocisteinemia y polimorfismos en el gen que codifica para la Metilentetrahidro-folato-reductasa (MTHFR), enzima importante en la ruta metabólica de la homocisteína implicada en el incremento de los niveles de homocisteína y desarrollo de la preeclampsia 28,29. Serrano y col. en un estudio de casos y controles con 884 gestantes (322 afectadas y 522 controles) hallaron que la condición homocigótica en el alelo Asp298 del gen eNOS (Sintetasa de óxido nítrico endotelial) representa un riesgo para preeclampsia de 4,6 (IC95 %= 1.73-12.22). De igual manera, encontraron que el haplotipo Asp298-786C-4b incrementa el riesgo de padecer la enfermedad (OR, 2.11 [95 % CI, 1.33 to 3.34]), llegando a la conclusión que el polimorfismo Glu298Asp y el haplotipo Asp298-786C-4b del gen eNOS son factores de riesgo para la preeclampsia 30.
Es posible que nuestra población posea variantes polimórficas de los genes MTHFR y eNOS que induzcan aumento en los niveles de homocisteína y, por tanto, incrementan el riesgo etiológico de la enfermedad. Esto sugiere que existe un papel importante de factores genéticos en el desarrollo de preeclampsia que puede ser transmitido a través de las generaciones de parentesco, señalando que el antecedente familiar es un factor que debe ser considerado en el control prenatal. Es pertinente mencionar que en el embrión el desarrollo de la placenta está orientado por genes paternos (mecanismo de impronta genómica), y en la población de estudio se encontró dos gestantes con preeclampsia fecundadas por el mismo individuo. Investigaciones recientes han identificado modificaciones epigenéticas y microARN (miARN) en el genoma del trofoblasto implicadas en el desarrollo de la hipertensión gestacional y otras enfermedades del embarazo 31. Se ha reportado que la hipometilación de los genes RUNX3 , LINE-1 y HSD11B2 previene la activación del receptor de mineralocorticoides en la placenta; la hipermetilación del gen ADORA2B se ha relacionado con hipoxia, preeclampsia y aumento de la sensibilidad a contaminantes atmosféricos; la hipermetilación del gen BVS está implicada en el desarrollo placentario y la hipermetilación del gen MMP-9 en la invasión de las células trofoblásticas; con respecto a los miARN también se han descrito relacionados con la preeclampsia, como el aumento del miR-218-5p, que juega un papel en el desarrollo normal de la placenta; la disminución del miR-34a-p, que inhibe la migración de las células del trofoblasto; el aumento del miR-517-5p, que altera la expresión del gen MMP-2, y la migración de las células trofoblásticas 32. También hay otras hipótesis sobre la etiología de la preeclampsia con respecto a las vesículas extracelulares (VE), que es un medio de comunicación intercelular que interviene en procesos fisiológicos y fisiopatológicos al transportar moléculas como lípidos, ARN y proteínas. En la gestación, el trofoblasto genera VE, que circula en sangre, líquido amniótico y orina, transportando HLA-G y la fosfatasa alcalina placentaria (PLAP-1), además de otras. Las VE pueden cruzar la membrana placentaria, ejerciendo una comunicación fetomaterna constante, regulando el endometrio, la remodelación de las arterias espirales e interviene en la regulación inmunitaria; se han reportado variaciones en el número, en el contenido y función bioactiva de las VE en preeclampsia y otras complicaciones del embarazo 33.
CONCLUSIONES
Se halló correlación estadísticamente significativa entre los niveles de homocisteína y el índice de masa corporal (IMC), entre homocisteína y presión sanguínea sistólica (PSS) y entre los valores de IMC y PSS.
La diferencia significativa en la media de la concentración de homocisteína entre casos y controles y la severidad de la enfermedad permiten concluir que la homocisteína es una variable para tener en cuenta en un programa de tamizaje para la preeclampsia.
Se observó correlación entre la concentración de homocisteína, hipertensión e índice de masa corporal.
Se encontró que los antecedentes familiares son un factor de riesgo para preeclampsia en nuestra población. Los niveles elevados de homocisteína significativamente mayor en el grupo que presenta antecedentes familiares, en comparación con el grupo que no presenta antecedentes, sugieren que genes heredados poseen un papel en el desarrollo de la enfermedad.