INTRODUCCIÓN
La enfermedad de Von Hippel-Lindau (VHL) es un síndrome neoplásico, autosómico dominante 1-7. Fue descrito por primera vez por Von Hippel en 1911 y posteriormente, en el año 1926, por Lindau 1,3-5,8. En 1964, Melmon y Rosen acuñaron el nombre de esta patología y sus criterios diagnósticos 3-5,9,10. Este síndrome se caracteriza por una mutación germinal del gen VHL en el cromosoma 3 (3p25-3p26), predisponiendo al desarrollo de neoplasias y quistes benignos y malignos muy vascularizados en diferentes órganos 1,2,4,6,7,11. El gen VHL, identificado en 1993 por Zbar et al. 12, es un gen supresor tumoral que codifica para la proteína VHL. Esta proteína tiene actividad E3 ubiquitina ligasa y generalmente inhibe la vía de la tumorigénesis mediada por el factor inducible por hipoxia (HIF en inglés) 13. La formación de neoplasias y vasos sanguíneos se debe a la inactivación de la proteína VHL, que da como resultado el fracaso de la degradación y ubiquitinización del HIF. La acumulación del HIF crea un estado de pseudohipoxia, el cual provoca la activación de genes relacionados con la eritropoyesis, angiogénesis y metabolismo celular, lo que induce al desarrollo de tumores altamente vasculares 1-4.
La enfermedad de VHL tiene una prevalencia de 2 a 3 por 100 000 personas 2 y una incidencia reportada que varía de 1 de cada 36 000 3,4,14-17 a 1 en 45 000 nacidos vivos 6. El 80 % de los casos se hereda como una mutación de la línea germinal 1,4,7,18, y el 20 % a una mutación de novo, sin antecedentes familiares 1,3-5,16,18. Las primeras manifestaciones ocurren en la segunda década de la vida 6,7 y casi el 50 % de los pacientes son sintomáticos 6,7. La edad de presentación sintomática se encuentra entre 18 y 30 años 18,19, dependiendo de la neoplasia que desarrolla el paciente 20. Más del 90 % de los pacientes han desarrollado los síntomas antes de los 65 años 9,18,21,22. Los portadores del gen VHL (ver figura 1) totalmente asintomáticos son aproximadamente el 4 % 19.
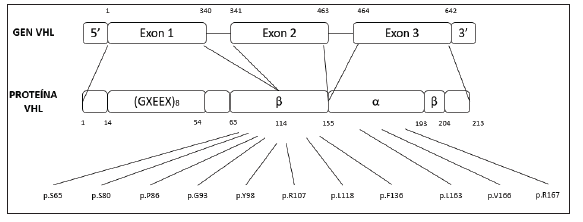
Figura 1 Estructura del gen y la proteína de von Hippel-Lindau. Tomado de Dandanell M, Friis-Hansen L, Sunde L, Nielsen FC, Hansen TVO. Identification of 3 novel VHL germ-line mutations in Danish VHL patients. BMC Med Genet. 2012 Jul;13:54.
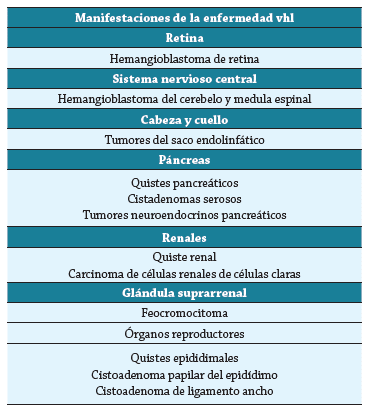
Las localizaciones más frecuentes de los tumores son retina, sistema nervioso central (SNC), cabeza y cuello, páncreas, riñón, glándula suprarrenal y órgano reproductor 4-7,14-16. Los tumores del sistema nervioso central constituyen una de las causas principales de muerte 4,6,7,14, junto con el carcinoma de células claras de riñón (CCR) 4,7,14. La expectativa de vista para la entidad está entre los 40 y 52 años 4,6. Esta revisión narrativa de la literatura describe las principales manifestaciones endocrinas en la enfermedad de VHL.
CLASIFICACIÓN
La enfermedad de VHL se clasifica en 2 tipos teniendo en cuenta presencia o ausencia de feo-cromocitoma 2,23. El tipo 1 tiene mayor prevalencia de hemangioblastoma de retina, del SNC y CCR. En algunos pacientes pueden presentarse neoplasias o quistes pancreáticos, excepto los feocromocitomas 1,3,19,23,24. Algunos autores han propuesto un tipo 1B, en pacientes con bajo riesgo para feocromocitoma y CCR 18. En el tipo 2, el feocromocitoma es la principal característica. Este se subclasifica en tipo 2a, que se asocia con un bajo riesgo de CCR y alto riesgo para feocromocitoma; tipo 2B tiene mayor riesgo de CCR y alto riesgo para feocromocitoma; y el tipo 2C presenta solo alto riesgo para feocromocitoma 1,3,8,12,14,18,23 (ver tabla 1). Además, se ha descrito la policitemia de Chuvash, también conocida como eritrocitemia familiar tipo 2, entidad poco frecuente con policitemia como único hallazgo 3,8,12.
DIAGNÓSTICO CLÍNICO
Los criterios clínicos son importantes en el diagnóstico de la enfermedad de VHL. En pacientes con la presencia de una sola entidad neoplásica, como hemangioblastoma (HB) SNC/retiniano, CCR, feocromocitoma o tumor pancreático, se debe descartar antecedente familiar de VHL 1,2,4,23.
Si no hay antecedentes familiares, deben presentarse dos o más neoplasias 3,9,14,23,25,26, pero, cuando están presentes se puede hacer el diagnóstico al encontrar una sola neoplasia relacionada con el síndrome 5,9,12,14,25 (ver tabla 2).
La infrecuente presencia de quistes pancreáticos múltiples hace sospechar una mutación en VHL. Ahora bien, como los quistes renales y epididimarios son frecuentes en la población general, no se recomienda utilizar su presencia como evidencia para sospechar este síndrome 9,14. Se debe considerar un diagnóstico de enfermedad de VHL en todos los casos de HB retinianos, del SNC, feocromocitoma familiar o de inicio temprano y CCR 20.
La mayoría de los pacientes son diagnosticados después de la detección de tumores del SNC 4, sin embargo, el diagnóstico es un desafío en pacientes con aparición neoplásica de novo y sin antecedentes familiares 6. Las tasas de detección de mutaciones de VHL en pacientes con antecedentes familiares de VHL es de casi el 100% 6,25, pero algunos pacientes sin antecedentes familiares pueden provocar mosaicismos de la enfermedad, debido a que no todos los tejidos portan la mutación y pueden dar negativo 25. En la tabla 3 se describen las indicaciones para las pruebas genéticas 18. En la tabla 4 se presentan las diferentes manifestaciones de la enfermedad de VHL.
MANIFESTACIONES EN LA GLÁNDULA SUPRARRENAL
Los feocromocitomas son característicos en la enfermedad de VHL tipo 2 12,14,19,21,24. Son tumores neuroendocrinos usualmente benignos de la médula suprarrenal productores de cateco-laminas, derivados de células cromafines que surgen de la médula suprarrenal, mientras que los paragangliomas de los paraganglios 21,24,27-29 se han asociado con HB y CCR 20.
Esta neoplasia se presenta entre el 10-30% de los pacientes con VHL 7,12,14,18. En un meta-análisis se encontró una frecuencia en VHL de 19.4 % (95 % CI=15.9-23.6 %). Sin embargo, esto depende del tipo de VHL. Se encontró que 60 % de los pacientes con VHL tipo 2 tenían feo-cromocitoma, y se podía distribuir su frecuencia según el subtipo así: 58 % tipo 2A, 50 % tipo 2B y 84%en el tipo 2C 30. Los paragangliomas se presentan en aproximadamente el 12 % 19,31. Surgen con mayor frecuencia en la médula suprarrenal y aproximadamente el 16 % son bilaterales y multifocales 6,7,14,25. Tiene una incidencia de 2 a 9.1 por 1 000 000 de adultos 32. Se presenta en personas más jóvenes comparado con los feocromocitomas aparentemente esporádicos 33. La edad de presentación usual es en menores de 30 años 1,5,14. En el metaanálisis previamente mencionado se encontró que en el 59.5% de los pacientes con VHL y feocromocitoma estos tumores eran bilaterales en el 59.5% y 58.3% de los casos ocurrían en hombres. El riesgo de malignidad es bajo, se ha observado en 1-5% en feocromocitoma asociado con VHL 6,7,18,24. El único indicador de malignidad es el desarrollo de metástasis 8.
Las manifestaciones clínicas del feocromocitoma tienen un amplio espectro, desde una entidad asintomática hasta una sintomatología inespecífica que simulan muchas entidades clínicas (particularmente enfermedades asociadas con una mayor actividad simpática) 25,34,35. Esta variabilidad en la clínica del paciente se debe a que la secreción de catecolaminas puede ser intermitente 6,36. Las manifestaciones clínicas son variables e incluyen la tríada clásica de cefalea, palpitaciones y diaforesis. Se han asociado con menor frecuencia otros síntomas inespecíficos, como náuseas, vómitos, palidez, ansiedad y ataque de pánico, taquicardia, 9,18,19,25,37 y estreñimiento 27,38. En la mayoría de los pacientes, la hipertensión es el primer síntoma 9. Esta neoplasia puede debutar con crisis hipertensivas en niños menores de 10 años 6. La hipertensión arterial puede predisponer al paciente a la aparición de miocardiopatía hipertensiva y el desprendimiento de retina 8. Otras complicaciones pueden ser infarto agudo de miocardio, arritmias, accidente cerebrovascular, miocardiopatía de Takotsubo 39, miocarditis adrenérgicas, insuficiencia cardíaca y crisis hipertensivas 8,18,21,40. Sin embargo, en la enfermedad de VHL los feocromocitomas pueden ser asintomáticos hasta en el 35 % de los casos, tener menos síntomas y cursar sin hipertensión 33,41. Si se compara con la neoplasia endocrina múltiple tipo 2, en la que la presencia de síntomas e HTA llega al 60 %, en VHL solo llega hasta el 30-35% de los casos 33.
El diagnóstico de feocromocitoma se realiza mediante la confirmación bioquímica del exceso de catecolaminas y la localización anatómica por imagenología 6,7,14,19,25. Se recomiendan pruebas bioquímicas y se realizan antes de proceder a las pruebas de imagen 31. El diagnóstico bioquímico se realiza mediante la medición de metanefrinas totales y diferenciadas libres en plasma o en orina de 24 horas 7-9,14,18,19,34,42, con excepción de las neoplasias con tamaño menor de 1 cm que no liberan catecolaminas y los que únicamente son productores de dopamina 31,42. En VHL es frecuente que la presencia de feocromocitomas no tengan evidencia de sobreproducción de catecolaminas 41,43, y cuando la tienen expresan diferencialmente normetanefrina 33.
El diagnóstico radiológico se realiza principalmente mediante TAC o IRM. En RM, el feocromocitoma es hiperintenso en T2, similar a la del LCR 8,19,24,44. La hiperintensidad en T2 y T2 con saturación grasa se conoce como "el signo de la bombilla" 45. Se prefiere el uso de RM debido a que no requiere bloqueo adrenérgico antes de la inyección de gadolinio 6,7, y en particular porque estos pacientes requieren seguimiento imagenológico continuo y se exponen a menor radiación. La gammagrafía con metaiodobencilguanidina (MIBG) es útil para localizar el tumor 7,14,19,24,46 e identificar metástasis ocultas 18. Sin embargo, tiene menos utilidad en enfermedad de VHL y difícilmente hay disponibilidad para su realización. En la enfermedad de VHL se prefiere el uso de tomografía por emisión de positrones (PET) marcada con 18F-fluoro-2-desoxi-d-glucosa (18F-FDG) o idealmente con 18F-3,4-dihidroxifenilalanina (DOPA). Están indicados en lesiones incidentales con alta sospecha de feocromocitoma con resultados no concluyentes en las pruebas bioquímicas, para evaluar multifocalidad e identificar los sitios de metástasis. El PET-18F-FDOPA se recomienda para identificar paragangliomas de la base del cráneo y del cuello y para los feocromocitomas no metastásicos. 31,42,47,48. El PET con 18F-FDOPA tiene una especificidad de 95-100 % para feocromocitoma, debido a que no capta el tejido suprarrenal sano y el PET-FDG permite una mejor detección de feocromocitomas múltiples 48.
En pacientes menores de 10 años se sugiere seguimiento con RM una vez al año, especialmente en aquellos con antecedentes familiares de VHL tipo 2 12,20. Debido a la alta recurrencia y desarrollo tumoral de diversas entidades neoplásicas, se sugiere realizar un seguimiento bioquímico e imagenológico 18,49.
La intervención quirúrgica mínimamente invasiva laparoscópica con abordaje retroperitoneal es el tratamiento de elección para la resección del feocromocitoma 6,8,14,47,50,51. En pacientes con enfermedad de VHL y feocromocitomas, la intervención temprana con cirugía suprarrenal con preservación cortical permite disminuir la recurrencia e independencia de los corticoides a largo plazo 14. Previo a la intervención quirúrgica es importante localizar neoplasias adicionales 9,14,50 y realizar un adecuado manejo preoperatorio mediante una combinación de bloqueo alfa y posteriormente beta adrenérgico para prevenir y disminuir las complicaciones graves de la hipersecreción de catecolaminas, como crisis hipertensivas y arritmias intraoperatorias 8,25,47,52. Posterior a la intervención, los pacientes con bloqueo adrenérgico son monitorea-dos por riesgo de desarrollar hipotensión e hipoglucemia 6.
Finalmente, el feocromocitoma metastásico es infrecuente en el VHL pero el 5% de los pacientes pueden fallecer por el exceso de catecolaminas 33.
MANIFESTACIONES PANCREÁTICAS
Aproximadamente el 35-93 % de los pacientes con enfermedad de VHL presentan lesiones pancreáticas 3,7,14,25. Las principales lesiones que se presentan son los quistes múltiples benignos, cistoadenomas serosos y tumores neuroendocrinos pancreáticos (TNP) 1,3,7,16 e incluso tumores metastásicos 3, siendo más frecuentes las lesiones quísticas 3,5,16,18.
Los quistes pancreáticos y los cistadenomas serosos tienen una prevalencia del 17-56 % 14. Los quistes suelen ser múltiples y asintomáticos; en el 12 % de los pacientes suele ser la única manifestación 6,7,18 y raramente deterioran la función pancreática 5,12. Los TNP se presentan entre el 15-56 % 6,7,14, el 53 % son múltiples 3, son más comunes en la cabeza y el proceso unciforme del páncreas. 18. La mayoría miden menos de 3 cm y su crecimiento es lento 16. Cuando los TNP tienen un tamaño mayor de 5 cm pueden corresponder a tumores malignos y se presentan a menudo como metástasis comparados con tumores de 2-3cm 3,4. La edad promedio de presentación de TNP es de 35 años 1,14,16,18 y para los quistes pancreáticos es de 37 años 14.
Las lesiones pancreáticas con frecuencia son asintomáticas y son detectadas de forma incidental en estudios imagenológicos de rutina que se realizan en pacientes con diagnóstico confirmado de enfermedad de VHL 3,7,16 y rara vez constituyen el tumor primario de presentación 4. Los quistes en su mayoría son asintomáticos, no funcionales 14,18,25 y se encuentran con frecuencia en el cuerpo del páncreas 9. Los cistoadenomas también suelen ser asintomáticos 8, pero algunos pacientes manifiestan dolor abdominal 9,18. Los quistes y cistoadenomas pueden provocar deficiencia exocrina o endocrina al reemplazar el tejido pancreático 6,7. Cuando son lesiones quísticas extensas que remplazan la mayoría del tejido pancreático, pueden provocar insuficiencia pancreática y diabetes mellitus 3,18. Los quistes pueden ser sintomáticos cuando generan compresión del intestino o conducto biliar 6,7,9. Los TNP a menudo son no funcionales y asintomáticos, pero pueden ser metastásicos en el 8 % de los casos 6,7, lo cual conduce a una supervivencia promedio de 1-3 años 6. Sin embargo, los TNP sintomáticos pueden provocar dolor abdominal, ictericia, pancreatitis o sangrado gastrointestinal 18,24.
La TC y RM abdominal son usadas para diagnosticar las lesiones pancreáticas. La TC abdominal se usa con frecuencia para vigilar las lesiones simples y complejas teniendo en cuenta los síntomas, crecimiento y componente sólido de la lesión 6. Los quistes pancreáticos son hipodensos y los cistoadenomas serosos muestran una lesión multiquística con aspecto característico en racimo de uvas en TC. Estas lesiones quísticas benignas suelen tener múltiples quistes (>6 quistes de 2 cm) 18. En RM, este grupo de quistes son hipointensos en T1 e hiperintensos en T2 18,53. Cuando hay múltiples quistes pancreáticos simples y que están estrechamente unidos, puede ser difícil diferenciarlos del cistoadenoma seroso 18. Los cistoadenomas serosos aparecen como masas encapsuladas circunscritas, hipointensas en T1 e hiperintensas en T2, con septos radiales 53.
Los TNP usualmente son hipodensos o isodensos en TC simple con una captación intensa en la fase arterial y en RM son hipointensos en T1 e hiperintensos en T2 18. La tomografía por emisión de positrones (PET) con Galio 68 se ha considerado en aquellos tumores no visibles en TC 6,7,18 y en lesiones metastásicas 6. Además, se ha sugerido el uso de ecografía endoscópica y gammagrafía con receptores de somatostatina como estudios adicionales 1,4,7,14 cuando existe dificultad en el diagnóstico 4,18. Se recomienda el monitoreo con RM y pruebas bioquímicas anuales para TNP <1cm 3.
No se sugiere tratamiento en quistes asintomáticos, y la descompresión quirúrgica laparoscópica se recomienda en quistes o lesiones pancreáticas que causan síntomas obstructivos 3,4,6,53. En TNP con alta probabilidad de metástasis se sugiere la enucleación o resecciones pancreáticas selectivas 6. La intervención quirúrgica puede ser apropiada para los TNP cuando el tamaño es >3cm o >2cm para lesiones en la cabeza del páncreas, mutación VHL del exón 3 18,20,25,53 y el tiempo de duplicación del tumor (<500 días) 24,53. La técnica quirúrgica de elección para los TNP es la pancreatectomía distal o de Whipple 1.
CONCLUSIONES
La enfermedad Von Hippel-Lindau es un síndrome genético caracterizado por el desarrollo de neoplasias benignas y malignas en diferentes órganos. Los feocromocitomas y tumores pancreáticos son las manifestaciones endocrinas más importantes en la enfermedad de Von Hippel-Lindau y pueden asociarse con una morbilidad y mortalidad significativa. Esta entidad requiere un trabajo multidisciplinario para lograr una detección temprana que permita el manejo oportuno y mayor supervivencia en los pacientes con VHL. En Colombia se requieren estudios adicionales de esta enfermedad para establecer su incidencia, prevalencia y tasa de complicaciones dada la ausencia de publicaciones en el tema.