INTRODUCCIÓN
Los probióticos se conocen como suplementos, productos o preparados que contienen cepas de microorganismos vivos 1. Estos han ganado gran atención en los últimos años debido a que se ha documentado que modifican la microbiota mediante diferentes mecanismos de acción 2. Los probióticos han sido usados principalmente para el tratamiento de alergias, enfermedades del sistema inmunológico y enfermedades del sistema digestivo 3 y se ha reportado que interactúan con el huésped y la microbiota del huésped para activar vías de señalización, lo cual a su vez modifica el comportamiento de la integridad de la barrera intestinal y el sistema inmunológico 4. La microbiota intestinal es un verdadero ecosistema necesario para la absorción de nutriente y mantenimiento de la homeostasis, compuesta por múltiples microorganismos, aproximadamente 1014 bacterias, y se incluyen bacterias, arqueas, hongos, protistas y virus 10; los cuales se adquieren durante el nacimiento en el paso por el canal del parto y la lactancia materna a través de la leche y el contacto con la piel 12. El equilibrio se alcanza aproximadamente a los 2 años y solo se afecta temporalmente por la ingesta de bacterias patógenas 10. Los principales microorganismos identificados en la microbiota son Firmicutes, Bacteroides, Proteobacterias, Actinobacterias y Fusobacterias 11.
El uso de alimentos y bebidas fermentados han acompañado el desarrollo de la humanidad desde hace aproximadamente 14 000 años 5. En la época moderna, Elie Metchnikoff recibió el Premio Nobel junto, con Paul Erlich, por su trabajo en inmunidad 6. Metchnikoff atribuyó la longevidad al consumo habitual de aquellos lácteos, que contenían lactobacilos, y explicó que "reducirían las toxinas producidas por las bacterias intestinales, promoviendo la salud y prolongando la vida" 8. Durante el siglo XX se suspendió la ingesta de dichos alimentos, lo que se asoció a problemas gastrointestinales e inmunológicos de la actualidad 1. Hoy en día las guías nutricionales conocidas a nivel mundial recomiendan el uso de los probióticos. Según la Asociación Científica Internacional para los Probióticos y Prebióticos, el espectro de los productos y preparaciones que pueden considerarse como probióticos es muy amplio, del cual hay nueva evidencia de alta calidad con respecto a las diferentes cepas, sus indicaciones y cantidades necesarias.
En condiciones de homeostasis, las células del organismo coexisten en equilibrio con los microorganismos presentes. Se ha denominado eubiosis el estado en el cual la microbiota está perfectamente equilibrada para mantener la salud del hospedero, impidiendo el paso de microorganismos patógenos e inhibiendo su proliferación en la mucosa intestinal 13 y disbiosis al estado en el cual los microorganismos patógenos superan la barrera creada por la microbiota y aumentan su proliferación 11.
El interés sobre el estudio de los probióticos se ha incrementado gracias al descubrimiento de sus efectos benéficos sobre la microbiota y también sobre la regulación de procesos inmunológicos y metabólicos 7. Siendo este último el foco de investigación en el que se ha ahondado en el conocimiento de su efecto en patologías relacionadas con disbiosis, enfermedades atópicas, multifactoriales y con bases genéticas 8. En la actualidad, los probióticos surgen como una herramienta terapéutica útil, sin embargo, no es claro en cuáles patologías se ha demostrado su acción, su mecanismo de acción, la forma terapéutica de administración y si existe evidencia sobre la salud infantil 9. Teniendo en cuenta lo anterior realizamos una revisión narrativa con búsqueda sistemática de la literatura con el objetivo de recopilar información sobre los mecanismos de acción y efectos benéficos de los probióticos en las enfermedades elegidas en población infantil.
MATERIALES Y MÉTODOS
Diseño del estudio: Siguiendo los criterios de la declaración de PRISMA, se realizó una búsqueda sistemática sobre los mecanismos de acción y la evidencia actual que tienen los probióticos sobre la salud infantil. La pregunta PICO se formuló teniendo en cuenta reportes en los que se analizará población menor de 18 años de edad, con la intervención orientada al mecanismo de acción y efectos benéficos de los probióticos en enfermedades más comunes, que reten tratamientos comparados con manejo estándar o de la enfermedad o usen placebo y reporten desenlace de la enfermedad. Teniendo en cuenta esto se planteó la pregunta ¿cuáles son los mecanismos de acción y efectos benéficos de los probióticos en las enfermedades elegidas comparadas el manejo estándar o placebo en menores de 18 años?
Estrategia de búsqueda: La búsqueda se realizó en las bases de datos MEDLINE, con los siguientes términos (MeSH). La estrategia incluyó las siguientes palabras (diarrhea and probiotics) and (children or pediatrics), (antibiotic-associated diarrhea and probiotics) and (children or pediatrics), (necrotizing enterocolitis and probiotics) and (infant or newborn), (infant colic and probiotics) and (children or pediatrics), (atopic dermatitis and probiotics) and (pregnancy or newborn), (asthma and probiotics) and (children or pediatrics). Los criterios de selección incluyeron artículos originales, metaanálisis, revisiones sistemáticas, ensayos clínicos y revisiones de tema que reportan mecanismos de acción o protocolos de manejos de las enfermedades seleccionadas con probióticos, publicados en idioma inglés y español, realizado entre 1994 a junio de 2020 y artículos disponibles a texto completo. Los criterios de exclusión fueron artículos duplicados, publicados en otros idiomas diferentes del inglés o español, estudios en líneas celulares y/o resúmenes, y publicaciones que no respondían la pregunta de investigación.
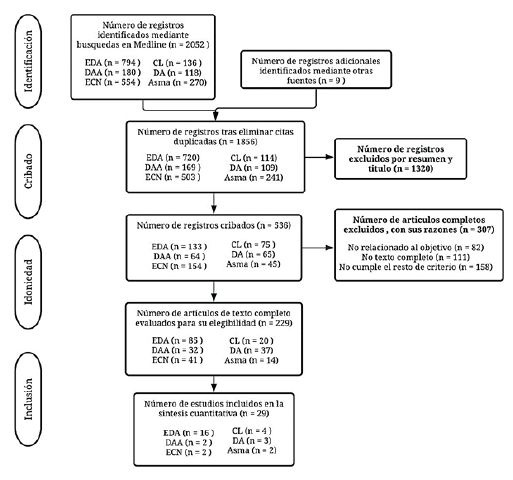
Recolección y extracción de datos: Se realizó la búsqueda de acuerdo con la estrategia de selección, con un total de 2052 artículos. Los investigadores seleccionaron los artículos cribados sucesivamente de acuerdo con los criterios establecidos (figura 1). El estudio fue aprobado por el Comité de Ética institucional.
RESULTADOS
Los mecanismos de acción de la microbiota pueden dividirse en 4 (figura 2):
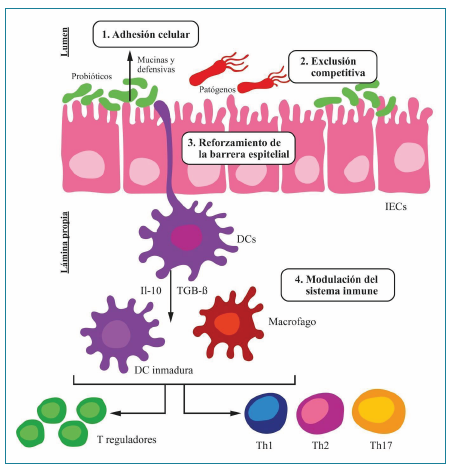
Figura 2 Mecanismos de acción de los probióticos. En la imagen se representa los mecanismos de acción de la microbiota 1. Adhesión celular, representada por mucinas y defensinas. 2. Exclusión competitiva. 3. Reforzamiento de la barrera epitelial. 4. Modulación del sistema inmunológico. DC: Célula dendrítica. IEC: Células epiteliales intestinales.
Mecanismo 1: Colonización bacteriana
La unión de los diferentes tipos de bacteria a la mucosa se convierte en el factor determinante para que exista una colonización adecuada del tracto gastrointestinal 14-15; esto se debe a que las bacterias que poseen mayor capacidad de unión son las que finalmente se van a establecer como flora nativa 14-15. Es por esta razón que las bacterias han desarrollado diferentes mecanismos para unirse con mayor efectividad a las células del huésped. Entre los más ampliamente distribuidos está la producción de adhesinas, las cuales reconocen varios componentes en el huésped, tales como proteínas de la matrix extracelular, receptores de adhesión y glicoproteínas asociadas a la membrana celular 14-15.
Otra forma de adhesión empleada por las bacterias es el Pili, estructura presente principalmente en bacterias Gram negativas 15. Este es un organelo con forma de pelo que sobresale en la superficie bacteriana cuya función principal es brindarle la capacidad a la bacteria de unirse a una superficie 16. Está formado principalmente por cientos de copias de la proteína Pilin, y posee varios factores bacterianos con propiedades adhesivas, lo que le permite reconocer varias clases de moléculas del huésped, entre las cuales se encuentran las proteínas transmembranales, como cadherinas e integrinas 14-16, y las proteínas de la matriz extracelular, como el colágeno y la fibronectina, asegurando, de esta forma la unión del microorganismo a las células del huésped 15-16 (figura 2.1).
Mecanismo 2: Bloquear los efectos patógenos de la bacteria
Los probióticos inhiben o disminuyen el crecimiento de otras bacterias mediante la exclusión competitiva (EC), modificación del ambiente bacteriano y secreción de bacteriocinas 17-19. La EC consiste en que las bacterias deben competir por los receptores ubicados en la célula del intestino del huésped para adherirse a la mucosa y atenuar la colonización de bacterias patógenas 17 (figura 2.2).
Adicionalmente, cambian el medio ambiente produciendo ácido láctico y ácido acético, lo que disminuye el pH intracelular del enterocito 17-19. Las principales bacterias que son eliminadas por el ácido láctico son el Helicobacter pylori, la Escherichia coli, la Listeria monocytogenes y la Salmonella sp 19. Otra forma como los probióticos bloquean los efectos de patógenos es por la producción de bacteriocinas, péptidos antibacterianos sintetizados en el ribosoma, que inhiben el crecimiento de los patógenos entéricos mediante la formación de poros en la membrana citoplasmática de la bacteria y agregación de péptidos, además de la disminución de la síntesis de la pared celular 17-18.
Mecanismo 3: Reforzamiento de la barrera Intestinal
La barrera intestinal es un mecanismo de defensa físico entre el medio ambiente externo y el sistema inmune del huésped; por lo tanto, la funcionalidad y la integridad de esta barrera son claves para mantener la permeabilidad de nutrientes, de las moléculas beneficiosas y proteger al huésped de patógenos. Estas características son determinadas por complejos de proteínas de uniones estrechas (TJS), situadas entre célula y célula de las células epiteliales intestinales, son proteínas transmembrana que en su porción extracelular interactúan con TJs vecinas y en su dominio intracelular conectan con el citoesqueleto celular 20. Cuando se altera la expresión o la localización de estas proteínas, la funcionalidad de esta barrera física se ve comprometida 14,21-22.
Otra defensa física es la capa de moco, que contiene péptidos antimicrobianos e IgA secretora; cuando se altera la barrera, las bacterias y los alimentos pueden llegar hasta la submucosa e inducir una respuesta inflamatoria, lo que puede dar lugar a trastornos como la enfermedad inflamatoria intestinal 14,21.
El aumento de la expresión de genes implicados en la señalización de TJs es un mecanismo posible para reforzar la barrera intestinal. Se ha descrito que los probióticos reparan la función de la barrera justo después del daño, aumentando la expresión de ARNS mensajeros y proteínas de las uniones estrechas (ZO-1 y ZO-2), y la activación de la vía de señalización AKT; esto lleva a la estabilización de las TJs y reparación y reforzamiento de la barrera 21-22 (figura 2.3).
Además, existen otras formas mediante las cuales se produce el reforzamiento y reparación de la barrera; por ejemplo, péptidos secretados por ciertas bacterias (Lactobacillus rhamnosus GG), p40 y p75 han mostrado capacidades para prevenir la apoptosis celular inducida por citoquinas mediante la activación de la proteína quinasa B (PKB/Akt) y la inhibición de la proteína quinasa activada por mitógenos p38 21.
Mecanismo 4: Modulación del sistema inmune
La microbiota intestinal es importante para la homeostasis del intestino, y tiene un papel fundamental sobre la tolerancia a antígenos en la lámina propia; está infiltrada por linfocitos, macrófagos y células dendríticas 23-25. El tracto gastrointestinal es la estructura anatómica estimulada masivamente por antígenos de todo tipo; debido a esto se le ha acuñado el término de "respuesta inflamatoria fisiológica" 26,27 (figura 2.4).
La interacción de la microbiota con el huésped comienza en las células de paneth, células epiteliales del yeyuno-íleon, colon y estómago, permitiendo la liberación de diferentes quimiocinas encargadas de propiciar una respuesta inflamatoria adecuada 28 algunas de estas moléculas proinflamatorias agonizan los receptores tipo toll (TLR); su expresión en los diferentes sitios, tanto transmembranales como intracelulares, esta regulada con mayor frecuencia por el factor de transcripción kappa-beta (NF-kB), como resultado, el paso a la inmunidad adaptativa con la activación de células T reguladoras 30.
Las células dendríticas son las responsables de sostener una respuesta inflamatoria eficaz contra la noxa 31, junto a la producción de citoquinas como la IL2 , IL12 , INF- gama que van a llevar a la diferenciación TH1; en este punto de la cascada inflamatoria se ha estudiado más la relación de los probióticos con la disminución de la inflamación y sus efectos benéficos sobre la injuria intestinal, debido a que la flora comensal, y sobre todo algunos probióticos, han inducido una vía de respuesta inflamatoria diferente mediada por TNF-B y IL-10 32, las cuales estimulan la diferenciación de linfocitos T reguladores, generando la inhibición de la diferenciación para respuesta inflamatorio tipo TH1 y TH17, desviando la cascada inflamatoria hacia la respuesta tipo TH2, siendo menos agresiva y, por lo tanto, disminuye las secuelas producto de respuestas inflamatorias más agresivas 33 (figura 3).
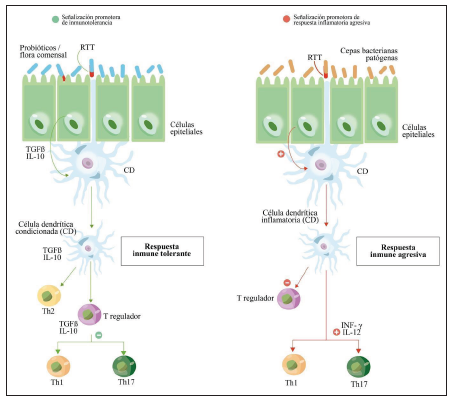
Figura 3 Papel de los receptores tipo toll-like en el desarrollo de respuestas inmunes y sus rutas de diferenciación. Adaptado y reproducido con permiso de Cambridge University Press. Carolina Gómez-Llorente, Sergio Muñoz and Ángel Gil. Role of Toll-like receptors in the development of immune tolerance mediated by probiotics 33
Los TLR son proteínas transmembrana y están distribuidos en la bicapa lipídica y en la membrana de los endosomas, compuestas por 11 moléculas, las cuales se clasifican por su tipo de ligando: los TLR 14,15,17-19,23 se unen a PAMPS relacionados con las superficies bacterianas, mientras que los TLR 12,16,21-22 son intracelulares y se unen a ácidos nucleicos de patógenos 33-34. La relación de 2 receptores tipo TLR en estudios in vitro y animales sugiere acción antiinflamatoria, mediado por un mecanismo de tolerancia cruzada 31-35. Esto es dado por la unión del TLR4 a su ligando, el LPS, el cual induce respuesta inflamatoria; adicionalmente, la gran mayoría de bacterias posee este PAMP en su superficie 34-35. Vos y cols, en su estudio en leucocitos humanos, evidenciaron una hiporreactividad de la cascada inflamatoria luego de la primera exposición a LPS; esta fue mediada por TNF alfa e IL-10 36; en el caso del receptor tipo 9, Hall y cols. Afirmaron que este tipo de receptor es fundamental para mantener la homeostasis del intestino, por medio de la inducción de la diferenciación de linfocitos T a T-reguladores, además de la regulación a la baja de moléculas como el interferón gama y la IL17 36. La modulación inmunitaria efectuada por los probióticos, más que un mecanismo de acción intrínseco, es una respuesta fisiológica compleja mediada por la inmunidad innata y adaptativa 14.
APLICACIONES CLÍNICAS
Enfermedad diarreica aguda
En Colombia, se estima que la enfermedad diarreica aguda (EDA) produce 1,3 millones de muertes anuales en niños menores de cinco años 37, por lo cual han generado interés los probióticos gracias a su papel contra los agentes enteropatógenos y modificando la flora colónica 38. A continuación se presentan los metaanálisis encontrados sobre la efectividad de los probióticos en la gastroenteritis aguda:
Saccharomyces boulardii
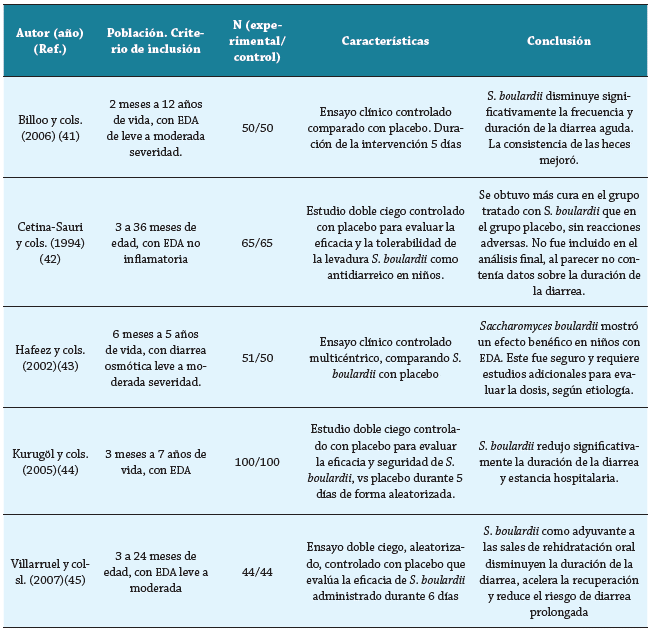
S. boulardii es una cepa de levadura considerada probiótico no patógeno, descubierta en 1920 por el biólogo francés "Henri Boulard" 39. De acuerdo con la búsqueda se encontraron estudios de Szajewska y cols. Analizaron 5 ensayos controlados aleatorios (ECA), con un total de 619 pacientes, entre los 2 meses y 12 años, con una dosis diaria de 250 hasta 750 mg, durante 5 a 6 días, y otras características se muestran en la tabla 1. Se comparó el uso de S. boulardii con placebo, y demostró un beneficio clínico terapéutico moderado en EDA, principalmente menor duración de la diarrea, con diferencia de medias ponderadas de 1,1 días (IC 95 %: -1,3 a -0,8). Los estudios incluidos fueron homogéneos (X2= 0,69, I2 = 0 %). No se demostró ningún efecto adverso severo 36-41.
Bacillus clausii
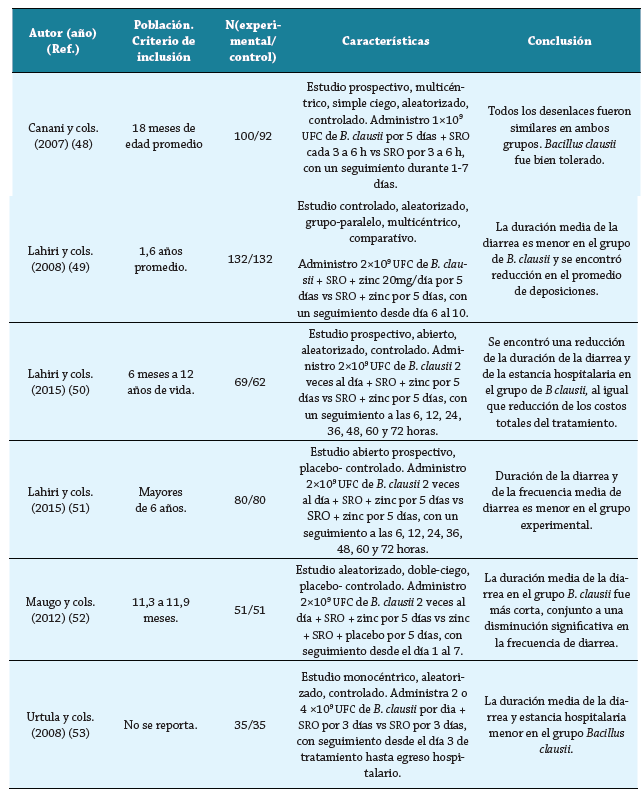
Es una bacteria Gram positiva, con la capacidad de estimular la actividad inmune y sobrevivir al tránsito gástrico y colonizar el intestino 46. Ianiro G. y cols. realizaron una revisión sistemática y metaanálisis de ECA para evaluar la eficacia del Bacillus clausii en el manejo de la diarrea aguda infantil 47; solo 6 ensayos cumplieron criterios de elegibilidad 48-53. Para el desenlace duración de la diarrea, el grupo control, con 441 participantes (sales de rehidratación oral [SRO], con y sin sulfato de zinc, vs. el grupo experimental, de 457 participantes (1 o 2 dosis diarias de B. claussi de 1-2X109 hasta 4x109 unidades formadoras de colonias (UFC) con SRO, con y sin sulfato de zinc). La tabla 2 resume las características de los estudios incluidos en la revisión, publicados entre 2007 y 2015. Se encontró una reducción significativa en la duración de la diarrea; diferencia de medias fue de -9,12 horas (IC 95 %: -16,49 a -1,75), además con una heterogeneidad leve (I2 = 63,4%, test de Cochrane, p = 0,02) 46. En tres ensayos clínicos se demostró el acortamiento de la duración de hospitalización; diferencia de medias fue de -0,85 días (IC 95%: -1,56 a -0,15) en pacientes que recibieron B. claussi comparado con SRO con zinc y este (I2 = 71,3 %, test de Cochrane, p = 0,03) 50,52-53. Por consiguiente, el B. claussi podría representar una opción terapéutica eficaz en la diarrea aguda infantil, con un buen perfil de seguridad 47-53. Otros estudios han demostrado evidencia controversial.
Lactobacillus rhamnosus GG (LGG)
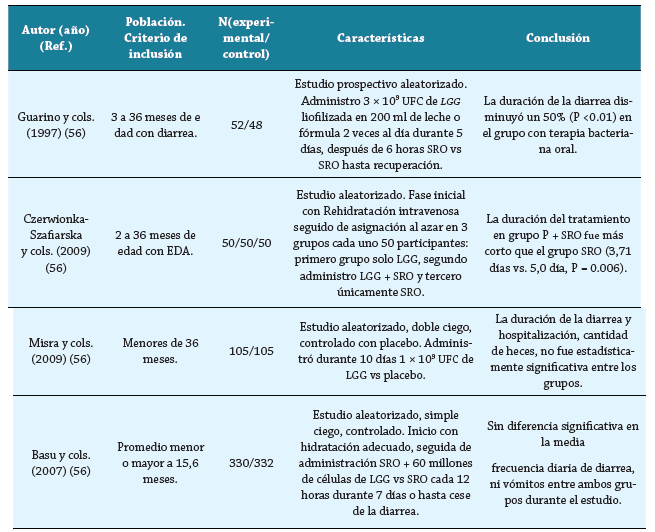
Es una bacteria productora de ácido láctico perteneciente a la microbiota intestinal, actualmente usada para prevenir el crecimiento de enteropatógenos y se ha visto su utilidad en EDA 54-55. Szajews-ka H. y cols. evaluaron el uso de LGG y SRO en niños con EDA 56, incluyeron 18 ECA que cumplieron con los criterios de elegibilidad, 15 estudios mostraron una reducción en el tiempo de la diarrea (n = 3820) con diferencia de medias de (20,4 horas) -0,85 días (IC 95 %: -1,15 a -0,56) en el grupo que recibió LGG, con una alta heterogeneidad entre los ensayos (X2= 1131,57; I2= 99 %, P<0,00001). A la vez realizó un análisis por subgrupos de acuerdo con la dosis mínima efectiva diaria en 2 grupos, el primero con LGG >1010 UFC diarias en 11 ECA (n = 2764), con una diferencia de medias de -0,83 días (IC 95 %: -1,17 a -0,49), y el segundo análisis (tabla 3) con una dosis menor LGG <1010 UFC diarias en 4 ECA (n = 1056), con una diferencia media de -0,92 días (IC 95%: -1,83 a -0,02) el grupo que recibió LGG. Al realizar una prueba entre los subgrupos no se encontró diferencia significativa (P = 0,90). Así mismo, observo una reducción en el tiempo de hospitalización en el grupo de LGG, -1,22 días (IC 95%: -2,33 a -0,10) (I2= 99%) 56.
Diarrea asociada a antibióticos (DAA)
Un 5 al 20 % de los cuadros diarreicos se asocia a la toma previa de antibióticos; bien sea por su efecto tóxico directo o alteración de la microbiota intestinal, consiguiente a la colonización del Clostridium difficile 57. Un estudio realizado por Goldenberg y cols. con evidencia de moderada calidad analizó 22 estudios (n = 3898) entre 0 a 18 años de vida 58. Se evaluó la eficacia y seguridad para prevenir DAA usando Bacillus spp., Bifidobacterium spp., Clostridium butyricum, Lactobacilli spp., Lactococcus spp., Leuconostoc cremoris, Saccharomyces spp., Streptococcus spp., solos o combinados contra placebo en niños que recibían antibiótico. La incidencia de DAA en el grupo de probióticos fue 8 % vs. 19 % del grupo placebo, con RR: 0,46 e IC 95 %: 0,35 a 0,61; además se detectó una heterogeneidad significativa (I2 = 55%, P = 0,0009). Ninguno de los 16 ensayos (n = 2455) informó eventos adversos serios (EAS) atribuibles a los probióticos. Szajewska y cols. también compararon la efectividad de S. boulardii contra placebo, para prevenir DAA en niños y adultos, 1076 pacientes en cinco estudios cumplieron los criterios de elegibilidad; se demostró que S. boulardii reduce el riesgo de DAA del 17,2 al 6,7 % con un RR: 0,43 (IC 95%: 0,23 a 0,78). Sin embargo, es significativamente heterogéneo: X 2 = 10 y P <0,04 59.
La enterocolitis necrosante (ECN) es la inflamación del intestino delgado y colon de los neonatos, más frecuente en prematuros y/o con bajo peso al nacer, y alcanza una incidencia del 20% 60. El desarrollo de la ECN aún no es claro, sin embargo, unas teorías son colonización con microbiota inadecuada, fenómenos de hipoxia e isquemia, función de barrera intestinal deficiente y respuesta inmunorreactiva excesiva 61. Thomas y cols. analizaron la incidencia de ECN en lactantes que nacieron con muy bajo peso suplementados con probióticos y la evaluación individual de cada probiótico 58. Los resultados arrojaron que una menor cantidad de lactantes desarrollaron ECN estadio >2 en el grupo suplementado con probióticos comparado con el grupo control, con diferencia estadísticamente significativa, dada por un RR de 0,57 con un IC del 95 %: 0,43 - 0,74 (P<0.0001). Adicionalmente, en el análisis de subgrupos por probióticos, los ensayos con combinación de especies de Bifidobacterium y Lactobacillus mostraron una disminución significativa en la incidencia de ECN estadio >2, RR correspondiente a 0,41, con un IC de 95 % 0,25 - 0,66 (P = 0.0003). La mortalidad relacionada con ECN no alcanzó significancia estadística; por otro lado, en el grupo de mortalidad por todas las causas mostró significancia estadística comparada con el grupo control con un RR 0,72 e IC de 95 % 0,57 a 0,92 (P=0.009), heterogeneidad I 2 = 22,88 %, test de Cochrane (p =0,24) 62. Los probióticos surgen como una nueva estrategia para el tratamiento de la ECN; sin embargo, aún se requieren estudios adicionales para unificar el probiótico ideal a las características individuales de cada paciente para lograr resultados satisfactorios.
Cólico del lactante
El cólico del lactante (CL) es un desorden gastrointestinal funcional de la infancia, describe un conjunto de síntomas que incluye el llanto persistente e irritabilidad en el niño lo que causa angustia y agotamiento en los padres 63. La prevalencia a nivel mundial es alrededor del 20 %. Con una etiología de esta condición sigue siendo incierta; sin embargo, se han propuesto factores comporta-mentales, dietarios y gastrointestinales, entre ellos la alteración de la microbiota intestinal 64-65.
Sung y cols. describieron la disminución en la duración del llanto (descrito en minutos por día) y éxito al tratamiento definido como disminución del tiempo de llanto en más del 50 % a los 21 días de iniciado el tratamiento con probióticos. Analizaron 4 estudios que evaluaban el mismo probiótico, Lactobacillus reuteri DSM17938 a la misma dosis (0.2 x 108 UFC por gota, 5 gotas por día durante 21 días); el grupo probiótico demostró una reducción significativamente mayor en la duración del llanto a los días 7 y 21 días vs. Placebo, con una diferencia media de -21.0 minutos por día el día 7 (IC 95 %: -42.0 a -0.05) y -25.4 minutos por día en el día 21 (IC 95 %: -47.3 a -3.5); asimismo, a los 21 días de tratamiento el grupo probiótico mostró un éxito de 66 % y radio de incidencia (RI) para tratamiento exitoso de 1,71 ( IC 95%: 1.35- 2.15), logrando un mayor beneficio en niños alimentados con leche materna exclusiva 66. Respecto a prevención en CL se ha encontrado una diferencia a favor de los probióticos (Lactobacillus reuteri ATCC 55730, L. reuteri DSM17938 y Lactobacillus paracasei ssp. paracasei and Bifidobacterium animalis ssp. lactis) de -32,57 minutos por día (IC 95 %: -55,60 a -9,54) en el metaanálisis con heterogeneidad alta 67.
Dermatitis atópica
La dermatitis atópica (DA) afecta al 15-20 % de los niños y con una prevalencia en aumento en países industrializados 68. La relación entre la composición de la microbiota intestinal y DA ha sido el blanco de tratamiento en la actualidad 69. Pelucchi y cols. analizaron si el uso de probióticos durante el embarazo y la vida temprana disminuye la incidencia de DA en bebés y niños pequeños en 18 ECA. Con evidencia de alta calidad demostraron que el uso de diferentes lactobacilos y bifido-bacterias, entre ellos LGG, L. reuteri, L. acidophilus, Bifidobacterium lactis y animalis, disminuyeron la incidencia de DA, dado por un RR 0,79 e IC del 95%: 0,71 a 0,88; los estudios incluidos fueron homogéneos (I2 = 24%, p = 0,201) 70. Por otro lado, Kalliomáki y cols. mostraron que con la administración prenatal de LGG ATCC 53103 1x1010 UCF diariamente durante 4 semanas antes de la fecha de parto estimada y durante los 6 primeros meses del puerperio reduce la incidencia de DA en niños en riesgo durante los primeros 2 años de vida. Los resultados mostraron que en el grupo placebo, 25 de 54 niños desarrollaron DA, sin embargo en el grupo probiótico fueron solo 14 de 53 niños los que presentaron DA, con un RR correspondiente a 0,57 e IC 95 % de 0,33 a 0,97 71.
La relación entre la microbiota y el desarrollo del asma es poco concisa e incompleta. Se ha postulado a los probióticos como inmunomoduladores de la enfermedad alérgica 72. Wei X y cols. analizaron la asociación entre la suplementación con probióticos durante el embarazo o durante la infancia temprana y la incidencia del asma; se incluyeron 19 ECA que cumplieron criterios de elegibilidad, para un total de 5157 pacientes de mujeres embarazadas y niños sanos < 1 años de edad; 1 estudio fue exclusivamente de suplementación probiótica materna, 8 postnatal y 10 combinados, de los cuales 10 ensayos usaron cepas de Lactobacillus, 1 de Bifidobacterium, 6 una composición de probióticos y 2 con cepas de Lactobacillus separadas de Bifidobacteirum vs. placebo durante 3 - 24 meses a dosis diaria entre 108 a 1011 UFC 73. En primer lugar, no se demostró disminución en la incidencia de asma en el grupo de probióticos comparados con placebo, RR 0,94 e IC 95 % de 0,82 a 1,09; asimismo, respecto a la incidencia de sibilantes, RR de 0,97 e IC95 % 0,88 a 1,06, es decir, el uso de probióticos durante el embarazo o infancia no se asocia a un menor riesgo de asma o sibilancias en lactantes 73. Se requieren estudios adicionales para evaluar la severidad o la disminución de crisis en niños con asma suplementados con probióticos.
DISCUSIÓN
Los probióticos son microorganismos, principalmente bacterias, que tienen varias funciones beneficiosas y son una nueva herramienta terapéutica para el cuidado de la salud infantil. Los probióticos han sido registrados como productos, medicamentos o alimentos, que no siempre garantizan la eficacia, ya que su efecto depende de diferentes variables, como la cepa usada, la indicación y las dosis administradas. Con la presente revisión sistemática se buscó los mecanismos de acción de los probióticos, plasmar la evidencia actual y asociación entre el uso de estos y las enfermedades comunes de la población infantil.
Los mecanismo de acción identificados incluyen: 1) La colonización bacteriana por medio de las adhesinas, 2) bloqueo los efectos de las bacterias patógenas mediante la exclusión competitiva y secreción de bacteriocinas, 3) reforzamiento de la barrera intestinal dada por complejos de proteínas transmembranas, y 4) modulación del sistema inmune.
Las tres patologías más discutidas revisadas en los estudios incluidos en esta revisión sistemática son la enfermedad diarreica aguda, enterocolitis y cólico del lactante. En Colombia, la EDA produce 1,3 millones de muertes anuales en niños menores de cinco años. Se demostró un beneficio clínico moderado de menor duración de la diarrea con el uso de S. boulardii, con diferencia de medias ponderada de 26,4 horas (1,1 días) (IC 95 %: -1,3 a -0,8), con Bacillus clausii , una diferencia de medias de -9,12 horas (0,38 días) (IC 95%: -16,49 a -1,75) y con LGG de 20,4 horas (-0,85 días) (IC 95%: -1,15 a -0,56) vs. placebo.
Por otro lado, llama la atención que Thomas y cols. analizaron la incidencia de ECN en lactantes que nacieron con muy bajo peso suplementados con probióticos y la evaluación individual de cada probiótico, lo cual demostraron una disminución en el desarrollo de enterocolitis en los lactantes suplementados con de Bifidobacterium y Lactobacillus vs. el grupo control, con diferencia estadísticamente significativa, dada por un RR de 0,57 con un IC del 95%: 0,43 - 0,74 (P<0.0001). Respecto a prevención en CL se ha encontrado una diferencia a favor de los probióticos de -32,57 minutos por día (IC 95%: -55,60 a -9,54).
A pesar de la asociación observada en la mayoría de las investigaciones revisadas, las cepas usadas deben identificarse adecuadamente tanto a nivel género, especie y cepa, al igual que especificar las cantidades administradas en las presentaciones de la industria farmacéutica. Por otro lado, existe un debate con respecto al nivel de costo efectividad, evidencia, heterogeneidad de los estudios y desenlaces para la toma de decisiones clínicas 75. Sin embargo, es necesario recalcar la necesidad de impulsar la investigación para poder generar nuevos estudios y definir claramente el beneficio del uso y la elección de un probiótico de acuerdo con la edad, tipo de enfermedad, cepa, dosis y duración de los diferentes probióticos a estudio.
CONCLUSIONES
Los probióticos son un nuevo blanco terapéutico para mejorar la salud infantil; por esta razón se ha despertado un gran interés en el uso de estos microorganismos en pediatría. El uso de probióticos en diarrea y DAA reducen la duración de la diarrea y el tiempo de hospitalización. Así mismo, han mostrado buenos desenlaces en enterocolitis necrosante con una disminución significativa de la mortalidad. Evidencia de alta calidad muestra sus beneficios en el cólico del lactante, impactando significativamente en las horas de llanto. Se requieren más estudios en otro tipo de enfermedades, como estreñimiento, algunos procesos alérgicos e inflamatorios. Finalmente, los estudios previamente expuestos ofrecen un panorama prometedor, pero la elección de un probiótico debe ser individualizado de acuerdo con la edad, el tipo de enfermedad, la cepa, la dosis y la duración de los diferentes probióticos a estudio, cada uno con sus múltiples mecanismos de acción pueden impactar de manera diferente y traducirse en eficacia clínica.