INTRODUCCIÓN
Se habla de la diabetes mellitus (DM) como un problema de salud mundial, la cual es causada por una alteración metabólica que se caracteriza por hiperglucemia crónica (concentración excesiva de glucosa en la sangre), debida en algunos casos a un defecto en la secreción de insulina 1. Además, se asocia con daño, disfunción y falla de varios órganos y sistemas, especialmente riñones, nervios, corazón, vasos sanguíneos y en gran importancia el sistema visual 1. Para el 2014 se tenía que en Latinoamérica el 9.3 % de hombres y el 8.1 % de mujeres presentaban DM, siendo los países con mayor prevalencia Guyana, Surinam, Chile y Argentina 2. En Colombia, para 2015 fueron reportados 920 494 casos de diabetes mellitus, para una prevalencia de 1.9 casos por 100 000 habitantes y de 2.1 casos por 100 000 afiliados 3. En contraste, para 2020 se encontró que 3 de cada 100 colombianos presenta DM, sin embargo, el número puede ser mayor, debido a que muchos individuos no saben que padecen esta patología, y a partir de esta se pueden desencadenar alteraciones oculares, como lo es el ojo seco. La enfermedad de ojo seco (EOS) se define como una condición inflamatoria causadas por diferentes etiologías y que alteran la unidad funcional lagrimal (UFL), y por esta razón afecta negativamente la visión, ya sea por daños estructurales o funcionales 2. En las últimas décadas se ha abordado la relevancia de la lágrima a través de análisis experimentales, que han demostrado que existe un complejo molecular donde lípidos, proteínas, genes, etc., pueden inferir en la condición ocular y sistémica.
Por lo anterior, este articulo pretende brindar información sobre la relación que existe entre el ojo seco y la DM, en especial la tipo 2. Esto con el fin de ser utilizada por el profesional de la salud en búsqueda de etiologías causantes de ojo seco y generar un panorama de los posibles eventos biológicos relacionados entre diabetes y ojo seco. Asimismo, entendiendo la relación entre ojo seco y DM, el profesional de la salud podría implementar análisis glicémicos a partir del fluido lagrimal, realizar seguimiento de la DM a partir de la evaluación de funciones oculares, en las que la glicemia juega un papel importante.
Diabetes mellitus
La diabetes mellitus (DM) es una enfermedad sistémica debido a una alteración metabólica que tiene como resultado un exceso de glucosa en la sangre. Se puede catalogar la diabetes en dos tipos principalmente: tipo 1 (existencia de un defecto en la producción de insulina) y tipo 2 (incapacidad para utilizar correctamente la insulina) 4.
A su vez, hay múltiples rutas metabólicas alteradas relacionadas con el estado de la hiperglucemia, las cuales son determinantes en el inicio y progresión de la enfermedad. Por esto, se puede llegar a encontrar a nivel sistémico complicaciones microvasculares, que generan morbilidad y mortalidad asociada a la enfermedad, entre ellas la denominada neuropatía diabética 5.
En la diabetes de tipo 2 se pueden encontrar múltiples manifestaciones, no obstante, estas varían en cada persona, e incluso las personas no llegan a presentar ninguna de estas manifestaciones. Entre los síntomas más comunes están: infecciones frecuentes que no se resuelven fácilmente, niveles elevados de azúcar en la sangre y orina, poliuria, polidipsia, polifagia, irritabilidad, cambios del estado de ánimo, piel seca, cansancio, pérdida de sensibilidad en extremidades y visión borrosa 6.
A medida que evoluciona la enfermedad suelen aparecer neuropatías autonómicas, como pueden ser gastropatía, enteropatía, disfunción eréctil, hipotensión ortostática y denervación cardíaca. Se habla de la cardiopatía isquémica y la insuficiencia cardíaca como las patologías derivadas de control y seguimiento más complejo, además, estas llegan a facilitar la aparición de hipertensión arterial 7.
Desde el punto de vista fisiopatológico de la DM, se pueden encontrar diversos eventos biológicos que van desde la genética, epigenética y eventos moleculares y celulares que contribuyen a su aparición. Desde la genética, existe evidencia, que sugiere mutaciones en genes relacionados con el metabolismo de la glucosa, así como cambios en la actividad de factores de transcripción, como lo es "forkhead box protein O" (FOXO), factor de transcripción que contribuye a la regulación hormonal, señalización neuronal, producción lipídica y a la respuesta inflamatoria y vascular 8-10.
Por otro lado, existe una fuerte evidencia, de que factores como la obesidad, consumo de cigarrillo y poca actividad física pueden regular eventos epigenéticos que favorecen el desarrollo de la DM 11-13, es así que Jia et al. describieron modificaciones en la histona H3, la actividad de ciertos miRNAs, y cambios en la expresión del factor de crecimiento transformante β1 (TGF- β) asociado a nefropatía diabética 14,15. De modo que estos cambios podrían conducir a una desregulación de eventos, como la inflamación, estrés oxidativo, disfunción mitocondrial y finalmente apoptosis que conlleva a la falla de las células pancreáticas 16,17.
El sistema visual requiere de una actividad biológica intrínseca adecuada para llevar a cabo su función. Por consiguiente, algunos estudios respaldan que cambios en la actividad hormonal, metabólica e inflamatoria conducen a posibles afectaciones de manera negativa para la salud visual 18-20, tal es el caso de la presentación de trastornos de la superficie ocular en individuos con DM 21,22.
El globo ocular puede llegar a sufrir daños por la DM, como es el caso de los microvasos de la retina, en el que principalmente las células endoteliales pueden verse afectadas por la hiperglicemia; entre dichos cambios se describen la disfunción endotelial, y por ende, la expresión de moléculas, como la molécula de adhesión vascular (VCAM) y la molécula de adhesión intercelular (ICAM), que favorecen procesos de angiogénesis y la activación de la cascada de coagulación 23, que resultan finalmente en la formación de áreas pequeñas de isquemia retiniana y que llegan a convertirse en retinopatía diabética (RD), siendo la tercera causa de ceguera en el mundo. A su vez, se habla de otras patologías derivadas, como es la catarata diabética, glaucoma neovascular, infecciones recurrentes en los párpados, cambios en la agudeza visual y enfermedad de ojo seco.
Enfermedad de ojo seco
La película lagrimal es una estructura húmeda que cubre toda la superficie ocular y puede disminuir con los años; está compuesta por 2 capas: lipídica (producida por las glándulas de Meibomio y lípidos de la película lagrimal) y muco-acuosa (conformada por la mucina, agua y electrolitos que aporta las células caliciformes y la glándula lagrimal respectivamente) (Figura 1), las cuales contribuyen a la reducción de la evaporación, función antimicrobiana, hidratación y adherencia; además son sustancias fundamentales ante determinadas trastornos oculares que se pueden asociar a la pérdida de homeostasis de dichas moléculas. Por otra parte, la película lagrimal puede alterarse por la constante exposición de la superficie ocular al ambiente, lo que da lugar a déficits de la lágrima 24.
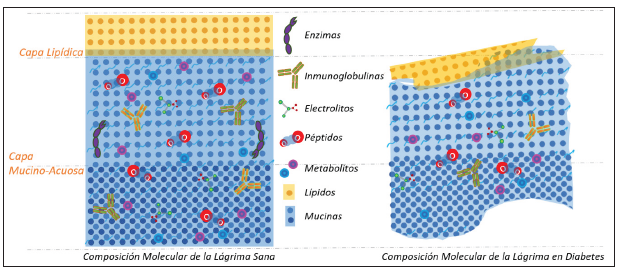
Fuente: elaboración propia en BioRender.
Figura 1 Capas de la película lagrimal. Recientes estudios sugieren que la película lagrimal (PL), presenta una capa externa compuesta por lípidos que brindan la estabilidad lagrimal y una capa más interna (mucinoacuosa) compuesta por una variedad de mucinas, proteínas y electrolitos.
La lágrima hace parte de los fluidos biológicos corporales y está compuesta por una amplia gama de moléculas tales como las proteínas, péptidos, electrolitos, enzimas, inmunoglobulinas, lípidos y metabolitos, que necesitan un equilibrio para garantizar una función adecuada y para mantener la integridad biofísica de la película lagrimal. En consecuencia, las alteraciones en su equilibrio generan cambios en la homeostasis de la superficie ocular, manifestando diversas afecciones, como ojo seco, blefaritis, entre otras 24.
Gracias a la composición molecular del fluido lagrimal se ha propuesto la presencia de ciertos biomarcadores, tanto para enfermedades oculares como sistémicas. Se han obtenido ventajas en la lágrima mediante la aplicación de técnicas en biología celular y molecular para la identificación y expresión diferencial de diversas moléculas (genes, factores de transcripción, metabolitos y proteínas) que presentan un rol importante en patologías oculares, como ojo seco, conjuntivitis alérgica, glaucoma, queratocono y enfermedades sistémicas como diabetes, cáncer y neurodegeneración 24,25.
De acuerdo con lo anterior, se puede hablar de la EOS como una alteración de la (UFL); además se cataloga como una condición inflamatoria crónica en la que el imbalance de la respuesta inmunológica modula el daño en la superficie interpalpebral, presentando molestias que afectan negativamente la visión, ya sea por daños u otros problemas fisiológicos. La UFL juega un papel regulador en la secreción y formación de la película lagrimal además mantiene la fisiología normal de la superficie ocular (compuesto por córnea, conjuntiva, glándula lagrimal, glándula de Meibomio, párpados, nervios sensoriales y motores); además, las fibras nerviosas son importantes en el mantenimiento de la función normal de la córnea y la integridad de la UFL 26.
Entre los factores de riesgo para padecer EOS se encuentran actividades diarias que disminuyan la cantidad de veces que se parpadea, como el uso de computadoras, estudiar u otra actividad de concentración, también el uso de lentes de contacto, enfermedades del tejido conectivo, el trasplante de médula ósea, la radioterapia, DM, dieta baja en omega 3, deficiencia de vitamina A, uso de medicamentos y cirugía refractiva 3.
La prevalencia de aparición aumenta de forma dramática con la edad, lo que va de la mano con el aumento de la población adulta mayor, por lo que es una causa importante de morbilidad ocular a nivel mundial. Un resumen global de la información disponible sugiere que la prevalencia se oscila entre 5-30 % de la población por encima de los 50 años de edad 27.
Ojo seco y su asociación con diabetes
Es importante conocer que la diabetes, especialmente la tipo 2 genera varias afecciones oculares. Manaviat et al. informaron que la prevalencia de EOS era del 54,3 % en pacientes con DM tipo 2 y que la tasa de morbilidad era mucho más alta que en sujetos no diabéticos 28, en consecuencia, las alteraciones en la superficie ocular suelen ser comunes en individuos con DM (tabla 1).
De igual manera, Machín (2017) sugirió que en la DM tipo 2, las estructuras oculares más afectadas debido a esta patología sistémica son la glándula lagrimal (76.1 %) y en segundo lugar la conjuntiva (60.4 %), que han demostrado una gran prevalencia de disfunción en la producción lagrimal 29 (Figura 2). Además, se ha descrito la existencia de un alto porcentaje de prevalencia de DM en mujeres y personas mayores de 50 años, no obstante, se menciona que en muchos casos no se suele relacionar la edad ni el género, con la prevalencia de DM 2. De acuerdo con lo anterior, las personas con DM tienen más probabilidades de sufrir la enfermedad de ojo seco, especialmente aquellas que no están adheridas a un tratamiento, lo cual induce un incremento en la glucemia que da como resultado una repercusión mayor en las glándulas implicadas en la producción de lágrimas 29.
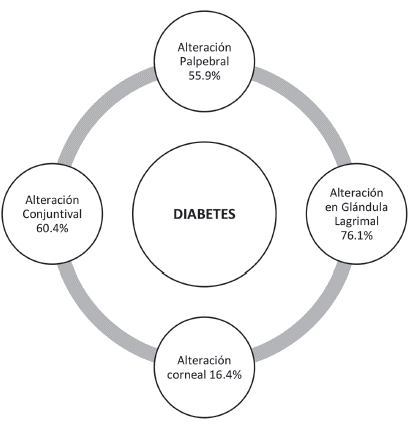
Figura 2 Porcentajes estimados de las estructuras oculares afectadas por la diabetes de acuerdo con Machín, 2017 29
Los pacientes diabéticos se quejan con frecuencia de síntomas típicos del ojo seco, como ardor y sensación de cuerpo extraño. Los hallazgos clínicos más frecuentes y medibles son: la secreción lagrimal reducida, la inestabilidad de la película lagrimal y la reducción de la sensación corneal. La afectación de las demás estructuras son determinantes en la etiología del ojo seco, ya que van a causar un aumento en la osmolaridad de la lágrima e inflamación de la superficie ocular, lo cual se produce por causa de la inflamación en la glándula lagrimal reduce la estabilidad y equilibrio de la lágrima, lo cual disminuye la protección natural de la superficie ocular 30.
Uno de los hallazgos clínicos oculares, en relación con la DM, es la pérdida de la sensibilidad corneal; esto asociado a la hiperglicemia crónica, que aumenta los productos finales de glucosilación avanzada (AGE, en sus siglas en inglés), promueve el daño en el nervio trigémino e induce cambios en las fibras nerviosas A-8 y C que puede resultar en alteraciones en el proceso de reparación epitelial 31. En efecto, Sahin et al. encontraron en un grupo de individuos con DM que la histéresis corneal disminuyó significativamente comparado con un grupo control 32. Lo cual podría ser tenido en cuenta durante el diagnóstico y seguimiento de la DM. En consecuencia, estudios como el de Hager et al. y Abusharha et al. sugieren que la evaluación corneal y lagrimal sean medidores clínicos de la severidad o progresión de la DM 33,34.
Por otro lado, se ha encontrado que la diabetes mellitus llega a reducir la capa lipídica. Según Han et al. esto se debe a una identificación de insulina en la película lagrimal y la presencia de receptores de esta y factor de crecimiento insulina-like-1 (IGF-1) en la superficie ocular humana 35. También es relevante conocer que algunos factores de crecimiento previamente identificados como promotores del crecimiento epitelial (factores de crecimiento epidérmico y nervioso) comparten mecanismos similares de transducción de señal con insulina. En adición, el estudio realizado por Zhang et al. encontró que los patrones del proteoma lagrimal de los pacientes diabéticos son muy diferentes en el número y la intensidad que la de los sujetos sanos y que las alteraciones en las lágrimas diabéticas se correlacionaron con la duración de la enfermedad diabética 36.
Es importante resaltar que los lípidos que mantienen a la superficie ocular sana derivan tanto de la capa lipídica de la lágrima como de las glándulas de meibomio (GM), siendo estas última un target para la glucosa 37. Las GM están reguladas mediante la participación del sistema nervioso autónomo como somatosensorial, y existe evidencia de que son susceptibles a cambios en la expresión de hormonas, neuromediadores y además de la glucosa 38, por ejemplo, Wu et al. encontraron la presencia de disfunción de glándulas de Meibomio (DGM) en individuos con DM y dicha disfunción se relacionó con los niveles elevados de HbA1C y la duración de la DM 39. Por otro lado, en modelo murino diabético, Guo et al. encontraron una mayor pérdida de acinos de las glándulas de meibomio (GM), activación de vías de señalización inflamatoria y de estrés oxidativo, que posterior al tratamiento con metformina dichos cambios en las GM se redujeron 40.
Lo anterior pone de manifiesto que el abordaje de un paciente diabético desde la medicina preventiva podría ser más que una detección temprana de retinopatía diabética, sino que la inclusión de un análisis de las estructuras de la superficie ocular podría relacionarse con el estado metabó-lico del individuo.
Por tal razón, varias investigaciones no solo han considerado la película lagrimal, como un fluido interesante para evaluar algunos biomarcadores de la DM, sino que ponen énfasis en algunas alteraciones que se pueden presentar en la superficie ocular y que contribuyen al desarrollo de ojo seco 19. En este sentido, análisis invitro han demostrado que distintos tipos celulares en la superficie ocular requieren de una actividad metabólica de glucosa adecuada, y al generar cambios en dicha condición contribuyen a distintivas vías de señalización celular que favorecen el estrés oxidativo, desregulación de la actividad del óxido nítrico, disfunción mitocondrial e inflamación ocular, eventos biológicos que se presentan en la DM 41,42.
De igual manera, en la diabetes, el daño a la microvasculatura que alimenta la glándula lagrimal junto con la neuropatía autónoma de la glándula lagrimal, que ocurren al principio de la diabetes, pueden contribuir a una función deficiente de la glándula. Lo anterior es respaldado por investigaciones como la de Misra et al., en la que demostraron que la actividad autonómica que propicia una adecuada producción lagrimal se ve disminuida en presencia de neuropatía diabética y que los niveles glicémicos elevados podrían contribuir a dicha falla en la producción lagrimal 43.
Asimismo, la presencia de la neuropatía llega a ocasionar disminución de la sensibilidad corneal, la cual es una manifestación clínica de la queratopatía diabética. Se puede decir que esta patología causa lesiones en la membrana epitelial corneal, cambios en la composición de la densidad y morfología celular corneal, y alteración en la expresión del proteoma lagrimal, lo cual ocasiona pérdida de la homeostasis de la película lagrimal, lo que puede conducir a EOS 18,26. Además, la reducción de la sensación corneal también puede expresar una reducción de la frecuencia de parpadeo y un aumento de la evaporación de las lágrimas 44.
Por otra parte, analizando otro estudio de Machín, evidencia que a los 30 años la producción lagrimal comienza a disminuir progresivamente hasta que llega a un punto crítico a los 45 años y es insuficiente a los 60 en situaciones o requerimientos normales; por dicha razón, se vuelve aún más común encontrar en personas diabéticas la presencia de ojo seco 29. En complemento, Zhang et al. demostraron que la diabetes modifica la secreción del fluido lagrimal, lo que sugiere que el control autónomo de la función de la glándula lagrimal puede verse comprometido por la neuropatía en pacientes con DM 36. También se puede hablar de que uno de los factores que influyen en la deficiencia del componente acuoso y lipídico de la película lagrimal relacionada al envejecimiento son los andrógenos que actúan en el tejido de la glándula lagrimal (por lo que las mujeres tienen un mayor riesgo al presentar bajos niveles de andrógenos) y sobre los receptores de la glándula de Meibomio. Lo anterior ha llamado la atención, ya que autores como Navarro et al. han sugerido una relación entre la deprivación de andrógenos y su rol en enfermedades metabólicas como la diabetes 45.
Interesantemente, Yazdani et al. describen en su estudio que existe una correlación entre los niveles de hemoglobina glicada (HbA1C) y la presencia de enfermedad del ojo seco reportada en un cuestionario de sintomatología ocular. Los autores reportaron que individuos con DM tipo 2 presentaron una mayor sintomatología (P=0,001) con respecto a los de tipo 1 (55 y 27 %, respectivamente) 46. De igual forma, Pellerano et al. determinaron la relación entre los niveles de insulina y su control, en la que la cantidad de lágrima disminuyó con el aumento de los niveles de la HbA1C respecto a la sintomatología ocular. Se reportó un incremento asociado al aumento de los niveles de Glicemia Basal (p=0.001) y HbA1C 47.
Sin embargo, Zhang et al. Sugieren que los pacientes diabéticos no dependientes de la insulina están correlacionados con la disfunción de la película lagrimal, por lo que son personas susceptibles a presentar ojo seco, relacionado con prueba de rompimiento lagrimal invasiva alterada 36. Tal como lo demuestran otras investigaciones, en las que en individuos con DM tipo 2 se encuentran alteraciones en la estabilidad lagrimal, aumento de la osmolaridad lagrimal, disfunción de meibomio y alteraciones en el espesor de la capa lipídica 48-50.
Tabla 1 Estructuras del Segmento que se afectan en la diabetes y que contribuyen en el ojo seco
| Descripción | Ref | |
|---|---|---|
| Película lagrimal | ||
| Muco-acuosa | Contiene mucopolisacáridos que son responsables de mantener una tensión superficial estable. Al producirse acúmulos mucosos y destrucción de células muco-secretantes por aumento de la osmolaridad lagrimal, la tensión superficial se eleva y, por lo tanto, se inhibe la humectabilidad del epitelio. La deshidratación producida en la capa mucosa generará destrucción del mucus, que eleva más la tensión superficial y potencia el desequilibrio osmolar. | 51 |
| Electrolitos y sales | En pacientes diabéticos existe desequilibrio de electrolitos en magnesio, calcio y fósforo en las lágrimas de los diabéticos que pueden afectar el buen funcionamiento del sistema ocular y favorecer la aparición de complicaciones oculares. | 52 |
| Lípidos | Función antimicrobiana de los lípidos de la lágrima y los lípidos meibomianos pueden fortalecer la defensa innata de la superficie ocular contra diferentes patógenos; ha tenido gran importancia en la búsqueda de bio- marcadores de alteraciones oculares como el ojo seco. También se puede ver alterado por disfunción de GM | 39,49 |
| Glándula lagrimal | ||
| Los receptores activados por proliferadores de peroxisomas (PPAR, PPARy) desempeñan un papel dominante en la regulación de las vías de señalización metabólica e inflamatoria en las superficies oculares y en las glándulas lagrimales. La baja expresión de PPARy es muy relevante para la disfunción de la glándula lagrimal en condiciones de estrés por desecación y diabetes. | 53 | |
| Capa epitelial | Se requiere que exista una correcta humectación del epitelio. Esta se puede afectar por afección en la tensión superficial, obstrucción/daño de glándulas excretoras y/o aumento de osmolaridad en la película lagrimal. | 51 |
| Células caliciformes | La capa mucinosa es producida principalmente por estas células. El daño a la microvasculatura genera alteraciones en las células. En algunos estudios se menciona que el ojo seco ocasiona una reducción de estas células. | 54 |
| Córnea | ||
| Nervios corneales | El factor de crecimiento nervioso y los esfingolípidos son claves para la salud neuronal, además de la formación de mielina; sin embargo, su producción se puede afectar en pacientes hiperglucémicos. Asimismo, las anomalías del plexo nervioso corneal se han asociado con estados inflamatorios diabéticos. | 26,31,55 |
| Células epiteliales | Se requiere que exista una correcta humectación del epitelio. Esta se puede afectar por afección en la tensión superficial, obstrucción/daño de glándulas excretoras y/o aumento de osmolaridad en película lagrimal. De igual manera, se postulan cambios en la arquitectura celular y molecular del tejido corneal. | 31,51 |
| Párpados | ||
| Reflejo de párpadeo (RP) | Estos reflejos son estimulados tanto por la región frontal mesial como por el área motora, a partir de una estimulación eléctrica, mecánica, acústica, térmica, química o magnética aplicada sobre la cara que enviará un estímulo al nervio supraorbital (NESO) del trigémino que generará el parpadeo. El tiempo entre parpadeos es mayor en los pacientes diabéticos, lo que resulta en una disminución de la frecuencia de parpadeo y, por ende, en una tinción superficial corneal. | 56-58 |
| Descripción Regulación nerviosa | ||
| Esta se produce por la vía aferente del V nervio craneal (NC), mientras que la respuesta eferente se genera por el VII NC, siendo este el que regula la composición de la lágrima y mantiene un equilibrio adecuado en los componentes acuoso, mucinoso y lipídicos en su porción parasimpática, mientras que las terminaciones motoras son responsables de la distribución hidromecánica de la película en conjunto con el III NC. | 59 | |
| En resumen, en caso de un ojo seco se produce una estimulación de los nervios corneales, lo que genera los síntomas característicos de la patología y hay un aumento del parpadeo y aumento de la tasa de parpadeo. | ||
Las lágrimas contienen una variedad de sustancias, incluyendo proteínas, lípidos, mucinas, sales y otras moléculas orgánicas, y se cree que las proteínas lagrimales tienen funciones claves en la protección de la superficie ocular 30. En complemento de lo anterior, Bing et al. en análisis de identificación de proteínas lagrimales de pacientes con DM y ojo seco, en comparación con el grupo control, encontraron un aumento en la expresión de proteínas relacionadas con la apoptosis, la inmunidad y la inflamación 60. En adición, el grosor de los lípidos lagrimales (especialmente la capa lipídica de la película lagrimal), la estabilidad, la sensibilidad corneal y la cantidad de lágrimas disminuyeron significativamente en pacientes con DM 35. Tomado en cuenta lo anterior, es posible pensar que el análisis del lipidoma lagrimal podría ser una estrategia de diagnóstico temprana en aquellos individuos que presenten DM.
Impacto del tratamiento antidiabético sobre la superficie ocular
Respecto a la terapia farmacológica existe una fuerte evidencia donde se demuestra el efecto que tienen algunos fármacos antidiabéticos orales sobre la superficie ocular. Por ejemplo, en un modelo animal diabético se demostró que posterior al uso de metformina, la vía de señalización MAPK mejoró su actividad, y esto se relacionó a una reducción en la expresión de mediadores inflamatorios y estrés oxidativo junto con la restauración de la morfología de las GM 40.
Por otro lado, recientes investigaciones que han descubierto los mecanismos biológicos asociados al desarrollo de neuropatía diabética y ojo seco ponen en evidencia posibles opciones terapéuticas que mejoran la condición ocular. En efecto, Ajith sugiere un efecto terapéutico del ácido alfa lipoico (ALA) sobre el ojo seco y la retinopatía diabética, lo anterior gracias a la reducción de marcadores inflamatorios como la metaloproteinasa 9 (MMP-9), y promueve la actividad antioxidante sobre la superficie ocular 61.
De igual manera, Hao y Ning evaluaron la actividad de un agonista del receptor del péptido 1 similar al glucagón (GLP-1RA) sobre la hiperglicemia, el control de peso e interesantemente sobre las estructuras de la superficie ocular, induciendo dicho agonista una mejora en la estabilidad de la película lagrimal 62. En consonancia con dicha propuesta terapéutica, McLaughlin et al. describen el uso de Naltrexona como bloqueador del factor del crecimiento opiode (OGF en sus siglas en ingles) para el tratamiento de ojo seco diabético que conlleva a una mejoría en la sensibilidad y reepitelización corneal 63.
A pesar de que gran parte de los estudios farmacológicos que abordan ojo seco y diabetes están en desarrollo experimental, podrían ser una promesa en un futuro muy cercano como una terapia que incluiría un abordaje mucho más específico en la enfermedad.
Futuras perspectivas
Conociendo que existe una relación entre la enfermedad de ojo seco y diabetes, en especial en las mujeres y personas mayores de 50 años, es importante para el profesional de la salud realizar una adecuada intervención en esta enfermedad, haciendo un diagnóstico diferencial en estos individuos.
El tema de los biomarcadores en los últimos años ha recobrado una gran importancia; esto sumado a que las nuevas técnicas de diagnóstico han permitido comprender los aspectos biológicos que intervienen en la diabetes y cómo estos pueden afectar la homeostasis de la superficie ocular, han surgido investigaciones en las que se busca evaluar los niveles de glicemia a partir de fluido lagrimal y otros marcadores de la enfermedad a partir de esta película, que servirá no solo para determinar el estado metabólico en los pacientes, sino para establecer grados de asociación entre la diabetes y el ojo seco. Un ejemplo de lo anterior es la aplicación de la ciencia ómica y la secuenciación de última generación a la investigación ocular y sistémica 64-67, con el objetivo de comprender la relación de la superficie ocular, su importancia en enfermedades tan relevantes como lo es la DM.
Se espera que este artículo genere interés y ayude a la continua exploración de este tema o de temas relacionados, como por ejemplo, la exploración de los biomarcadores de la película lagrimal en población diabética o explorar estas dos enfermedades en diferentes tipos de poblaciones, para seguir así profundizando la correlación entre estas dos.
CONCLUSIÓN
Debido a la alta prevalencia de la diabetes tipo 2 y las afecciones que genera, especialmente oculares, se debe tener en cuenta los múltiples factores de riesgo, entre los cuales se destacan los niveles de estrógeno, que hacen más propensas a las mujeres y a personas mayores de 50 años, y ocasionan en esta población daños en las estructuras oculares que degradan la calidad visual y originan patologías como la enfermedad de ojo seco, que tiene repercusiones en la calidad de vida en general, ya que puede perjudicar el bienestar emocional, la productividad en el lugar de trabajo y otras actividades cotidianas; por lo que se requiere una detección y revisión constante en la calidad e integridad de la unidad funcional lagrimal para reducir el riesgo de sintomatología.















