INTRODUCCIÓN
El dolor es definido por la Asociación Mundial para el Estudio del Dolor (IASP) como "Una vivencia sensitiva y emocional desagradable asociada, o semejante a ésta, con una lesión tisular real o potencial" 1. Sin embargo, esta interpretación es subjetiva debido a la inmadurez del recién nacido, que determina una disminución en la capacidad de controlar y expresar el dolor verbalmente, lo cual genera un sufrimiento adicional, dificulta su identificación, evaluación y manejo 2,3.
Los recién nacidos a menudo son sometidos a intervenciones dolorosas. Aquellos nacidos entre las 25 y 42 semanas de gestación experimentan un promedio de 14 procedimientos dolorosos por día durante las primeras 2 semanas de vida, en los que en la mayoría de los casos no se implementan las medidas analgésicas necesarias 4,5.
Los recién nacidos son más sensibles a estímulos nociceptivos, desarrollan respuestas fisiológicas, conductuales, hormonales y metabólicas secundarias que pueden generar efectos adversos a corto y largo plazo 2,6. Por lo que un tratamiento insuficiente del dolor, puede conllevar a un aumento de la morbimortalidad, alteraciones en el comportamiento y del desarrollo neurológico 7,8.
Es por lo anterior que el objetivo general de este artículo es realizar una revisión de la literatura sobre la identificación, clasificación y manejo del dolor en recién nacidos.
MATERIALES Y MÉTODOS
Se realizó una revisión de la literatura teniendo en cuenta la estrategia PICO y como tema principal "Dolor en recién nacidos", fisiopatología, mecanismos de evaluación y terapias existentes para el manejo de este. Se realizó una búsqueda en las bases de datos de ciencias médicas Pubmed, LILACS, Google Scholar (en búsqueda de literatura colombiana) y la Biblioteca Virtual en Salud (BVS), donde se establecieron los siguientes términos MESH de búsqueda: (Pain OR Pain management OR Practice Guidelines) AND (Children OR Newborn OR Preterm infant) en inglés y (Dolor OR Manejo de dolor OR Guías de práctica clínica) AND (Recién nacidos OR Neonatos OR Infantes OR Niños) en español.
En general, la búsqueda se realizó entre septiembre de 2020 a enero de 2021, se limitó a documentos de texto completo, idioma inglés o español, y publicados en el periodo comprendido entre 2000-2020. Con respecto a la búsqueda inicial de la literatura, se identificaron 83 documentos, entre artículos de revisión, series de casos y guías de manejo, que fueron evaluados a través de los criterios de calidad según el tipo de estudio en las listas de chequeo de equator network (PRISMA, SPIRIT, AGREE) y, para la revisión final de este texto, se tomaron 44 artículos que cumplían con los criterios de elegibilidad; así mismo, se incluyeron 6 artículos previos al período de tiempo estipulado, que fueron relevantes para la revisión por ser los pioneros en la creación de las escalas de medición del dolor. Durante la revisión de la literatura no se identificaron artículos repetidos entre las diferentes bases de datos.
CLASIFICACIÓN DEL DOLOR
Existen múltiples formas de clasificar el dolor, las más representativas son: según su temporalidad, fisiopatología, localización e intensidad.
Según su temporalidad el dolor se clasifica en:
Agudo: tiene una duración corta, menor de seis meses y se limita en el tiempo, se produce ante una lesión tisular causada por un estímulo nociceptivo, disminuye progresivamente hasta desaparecer una vez se produce la curación de la lesión subyacente y puede estar acompañado de reflejos protectores 9,10.
Crónico/prolongado: tiene una duración mayor de seis meses, no se limita en el tiempo, se prolonga más allá de la curación de la lesión que lo originó o se asocia a una afección crónica. Su intensidad, etiología y el patrón de evolución son muy variables, no tiene una acción protectora y está influenciado por factores psicológicos, ambientales y afectivos 9,10.
Según su fisiopatología
Nociceptivo: causado por la activación de los nociceptores en respuesta a un estímulo. Suele haber relación directa entre la intensidad y la gravedad de la agresión. Se divide en somático y visceral10.
Neuropático: originado por un estímulo directo del sistema nervioso central o una lesión de los nervios periféricos, no se relaciona con la estimulación de las terminales nerviosas sensitivas y suele acompañarse de disestesias y parestesias. Puede ser desproporcionado respecto al estímulo que lo produce y suele aparecer sin que haya una causa identificable 10.
Según su localización
Somático: es producido por la excitación anormal de nociceptores somáticos superficiales o profundos (piel, sistema musculoesquelético o vasos). Es localizado, punzante, se irradia siguiendo trayectos nerviosos, cuanto mayor es la intensidad y duración de la estimulación, más difuso es el dolor 10,11.
Visceral: es producido por la excitación anormal de nociceptores viscerales, secundario a lesiones de órganos internos. Es profundo, continuo, mal localizado, suele irradiarse y ocasiona dolor en regiones superficiales distales a la víscera de la cual se origina 9,11.
Según la intensidad
Leve: no interfiere con la capacidad para realizar las actividades diarias Moderado: interfiere con las actividades habituales Severo: interfiere incluso con el descanso 9.
PERCEPCIÓN DEL DOLOR EN NEONATOS
El desarrollo de la maduración nociceptiva del dolor es un proceso que inicia desde la gestación. Durante la sexta semana de gestación se inician las conexiones entre las neuronas sensoriales y las células del asta dorsal de la médula espinal; a las veinte semanas ya están presentes los receptores sensoriales en las superficies cutáneas y mucosas, en la semana 24 se completan las conexiones sinápticas entre la médula, tronco cerebral, tálamo y corteza y, finalmente, en la semana 30 las vías de dolor que llevan la información al tronco encefálico y el tálamo, ya cuentan con la mielinización definitiva y hay una maduración total de la corteza 2,12.
En los recién nacidos hay menos discriminación entre los estímulos nocivos y no nocivos, los campos receptivos de las neuronas del asta dorsal son grandes, por lo tanto, los estímulos periféricos pueden excitar un mayor número de neuronas centrales. Además, las vías inhibitorias descendentes y las redes inhibitorias en el asta dorsal no están completamente maduras en el desarrollo temprano; es por esto que, en lugar de que los recién nacidos sean menos sensibles a los estímulos dolorosos, como se podría pensar, el exceso relativo de mecanismos excitadores y la maduración tardía de los mecanismos inhibidores, producen respuestas reflejas más generalizadas y exageradas a estímulos de menor intensidad durante el desarrollo temprano 13,14.
EVALUACIÓN DEL DOLOR
El dolor se puede identificar a través de 4 tipos de alteraciones: comportamentales, fisiológicas, bioquímicas y psicológicas, las cuales se pueden evaluar mediante escalas 15.
Para obtener una medida adecuada y objetiva del dolor en recién nacidos a término y pretérmino, existen diversas escalas fáciles de usar e interpretar; estas se clasifican según el número de indicadores que evalúan en unidimensionales (utilizando un solo indicador para la evaluación del dolor) y multidimensionales (proporcionan una evaluación más integral teniendo en cuenta aspectos tanto fisiológicos y conductuales). La elección de la escala que debe utilizar el profesional de salud depende de factores como la edad gestacional, el tipo de estímulo doloroso, el uso de sedantes y el entorno del recién nacido 2,16 (ver Cuadro 1).
Cuadro 1 Escalas de evaluación del dolor unidimensionales y multidimensionales
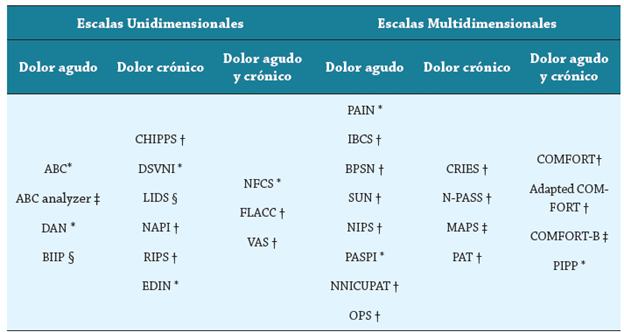
*Escalas para lactantes nacidos a término y pretérmino solamente.
†Escalas comunes para lactantes nacidos a término, pretérmino y niños.
‡Escalas para bebés nacidos solo a término.
§Escalas solo para lactantes pretérmino.
Fuente: elaboración de los autores con base en la referencia 16.
A continuación, se describen las características de las escalas validadas más utilizadas en el ámbito clínico:
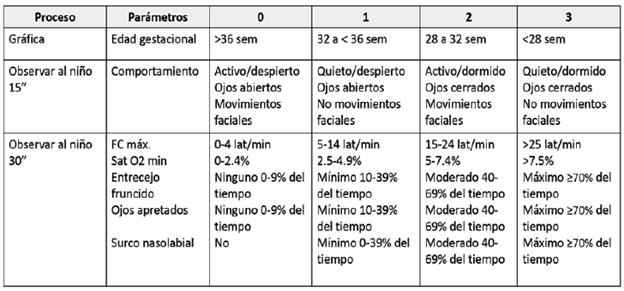
PIPP (Premature Infant Pain Profile): escala de valoración del dolor para recién nacidos pretérmino y a término, ha sido validada para evaluar dolor postoperatorio y evaluar la eficacia de la sacarosa en intervenciones no farmacológicas. Tiene en cuenta: edad gestacional, indicadores de conducta, desarrollo y fisiológicos, cada parámetro recibe una puntuación de 0 a 3. Valores ≤ 6 indican que no existe dolor o hay presencia de un dolor mínimo, de 6 a 12 dolor moderado y ≥ 12 dolor intenso 17. (Ver Cuadro 2)
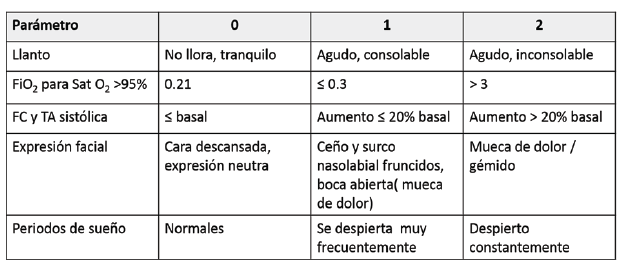
CRIES (C: crying; R: Requires increased oxygen administration; I: Increased vital signs; E: Expression; S: Sleeplessness) 18: se recomienda para valorar el dolor postoperatorio en recién nacidos a término y pretérmino desde las 32 semanas. Valora los parámetros fisiológicos y comportamentales del acrónimo dándoles una puntuación de 0, 1 o 2, con una puntuación máxima de 10 puntos 2. Un valor de 0 indica que no hay dolor < 2, dolor leve; 2 a 4, dolor leve a moderado, y mayor de 4, dolor moderado a intenso. Si la puntuación es > 5, se debe considerar la administración de analgesia 19. (Ver Cuadro 3)
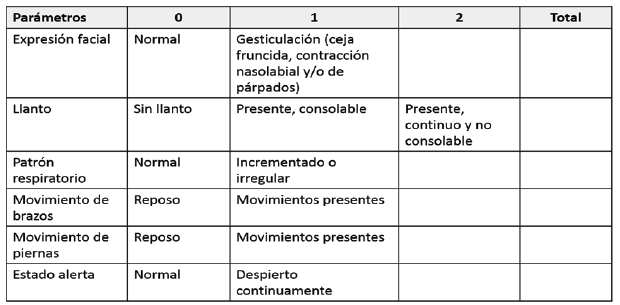
NIPS (Neonatal Infants Pain Scale): útil para valorar el dolor en el recién nacido pretérmino y a término secundario a un procedimiento doloroso (p. ej. punción de talón), incluye cambios en la expresión facial, llanto, patrón respiratorio, movimientos de extremidades y el estado al despertar 20. Cada parámetro recibe una puntuación de 0 o 1, excepto al llanto, que puede puntuar 0, 1 o 2. Su puntuación máxima es de 7 y se interpreta así: dolor leve, 0 a 3 puntos; dolor moderado, 4 a 6 puntos, y dolor intenso si la puntuación es de 7 21. (Ver Cuadro 4)
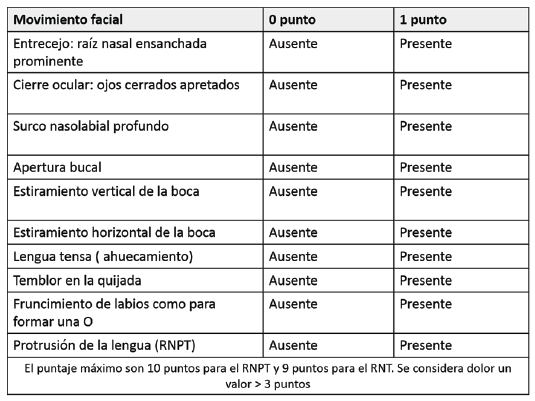
NFCS (Neonatal Facial Coding System) 22: se utiliza para valorar el dolor en recién nacidos durante los procedimientos dolorosos; no se recomienda su uso en pacientes sedados. Tiene en cuenta 10 parámetros comportamentales faciales; la presencia de un parámetro indica 1 punto y su ausencia 0 puntos. El puntaje máximo es de 10 para el recién nacido pretérmino y 9 para el recién nacido a término. Se considera dolor cuando se obtiene un valor > 3 puntos 19. (Ver Cuadro 5)
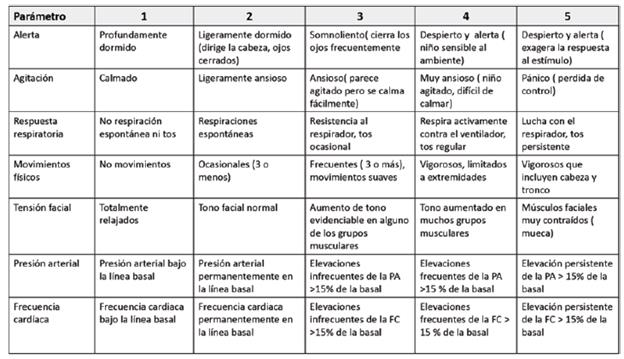
COMFORT: recomendada en pacientes sometidos a ventilación mecánica, permite evaluar el grado de sedación; tiene en cuenta 8 parámetros comportamentales y fisiológicos que se puntúan de 1 a 5, los cuales son: estado de alerta, agitación, reacción respiratoria, llanto, movimientos generales, tono muscular, expresión facial, presión arterial y frecuencia cardíaca. Se interpreta así: sedación excesiva, 8 a 16 puntos; sedación adecuada, 17 a 26 puntos; y sedación insuficiente, 27 a 40 puntos. De esta escala se crearon 2: la COMFORT adaptada que no tiene en cuenta la presión arterial invasiva y se puede utilizar en recién nacidos prematuros de menos de 35 semanas de edad gestacional, y la COM-FORT-B, que mantiene únicamente los indicadores comportamentales 19,16,23. (Ver Cuadro 6)
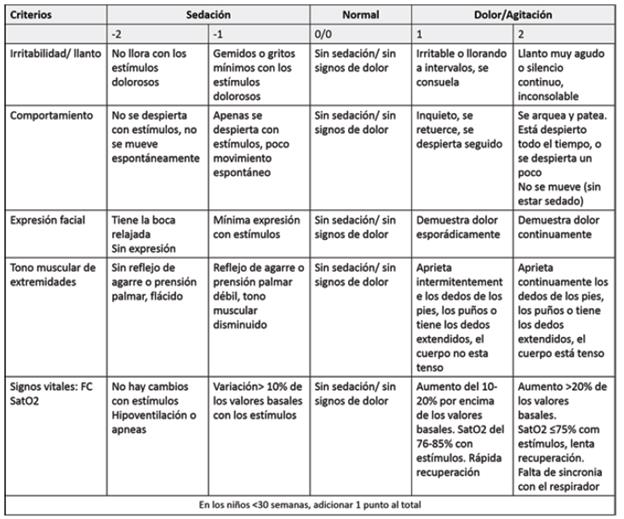
N-PASS (Neonatal Pain and Sedation Scale): evalúa los niveles de dolor, agitación y sedación en un recién nacido crítico con dolor agudo y/o continuo. Está compuesta de dos mediciones (dolor y sedación), cada una utiliza 5 parámetros conductuales y fisiológicos. El puntaje de dolor/agitación se evalúa mediante observación sin intervención, y el de sedación sí requiere estimulación; a cada parámetro se le asigna un puntaje de 0 a 2 (en dolor) o 0, -1 o -2 (en sedación); tiene una puntuación máxima de 10 y en pretérminos 11. En cuanto al dolor, los valores < 3 indican implementar medidas no farmacológicas, y > 5, implementar medidas farmacológicas 24,3. (Ver Cuadro 7)
TRATAMIENTO DEL DOLOR
La Academia Americana de Pediatría (AAP) y la Asociación de Anestesistas Pediátricos de Gran Bretaña e Irlanda (APA) recomiendan para el manejo del dolor asociado a procedimientos incluir estrategias tanto farmacológicas como no farmacológicas 3.
TRATAMIENTO NO FARMACOLÓGICO
Tiene como objetivo realizar intervenciones de tipo ambiental, conductual e incluso nutricional, con el fin de incrementar la comodidad, estabilidad, reducir el grado de estrés y de dolor en el recién nacido 25,26. (Ver Cuadro 8)
Cuadro 8 Tratamientos no farmacológicos implementados en recién nacidos

Fuente: elaboración por los autores.
Control del ambiente
Se deben prevenir o limitar los estímulos dolorosos, evitar múltiples extracciones de sangre, agruparlas para una sola intervención; se debe preferir la extracción de sangre venosa sobre la punción arterial o de talón debido a que estas últimas son más dolorosas 2. Se debe mantener un ambiente agradable, con reducción máxima del ruido y luz, evitar cambios de temperatura y respetar los momentos de sueño y alimentación 27,25.
Contacto piel a piel: produce analgesia a través de la activación del sistema modulador endógeno del dolor, debido a una estimulación somatosensorial que genera un aumento en la liberación de gastrina, insulina y hormona de crecimiento por el sistema parasimpático 3. Además, la colecistoquinina se libera cuando el recién nacido se expone al olor de la madre, mecanismo por el cual produce un efecto analgésico 28,29. Se recomienda aplicar esta técnica 30 minutos antes del procedimiento doloroso, logrando así una disminución del 35 % en el dolor y una disminución del 88 % en la duración del llanto 30,31.
Swaddling: envolver al neonato en mantas es una práctica que se utiliza para simular el entorno del útero y generar así un efecto de analgesia. En 2016 se realizó un ensayo controlado aleatorizado (EÇA) en Hong Kong, para evaluar la viabilidad y eficacia de envolver como medida para controlar el dolor durante los procedimientos, y se describió una reducción significativa en el puntaje de la escala PIPP. Se considera que esta técnica puede llegar a contribuir en el control del dolor asociado a procedimientos menores 32.
Posición flejada o contención: consiste en la sujeción manual de la cabeza del bebé y flexión de los miembros 30. Esta maniobra genera una menor percepción del dolor por la saturación de los sentidos, siendo un método no farmacológico eficaz y útil 33.
Masajes: generan saturación de las vías sensoriales, disminuyendo las señales de dolor que se envían al sistema nervioso central 34. En varios estudios se ha descrito su efecto analgésico; dos ECA informaron que un masaje en las extremidades superiores disminuyó significativamente las respuestas al dolor durante la punción venosa en recién nacidos pretérminos y a término, sugiriendo que un masaje suave antes de una inyección en la extremidad es seguro y puede disminuir el dolor 35,36.
Métodos nutricionales
Lactancia materna: se asocia a un efecto analgésico a través de la liberación de colecistoquinina 28,37. Zurita Cruz et al., realizaron un estudio en el que asignaron de manera aleatoria a 144 recién nacidos a lactancia materna, sustituto de la leche o sin analgesia (grupo control) durante la vacunación, e informaron que los pacientes que recibieron leche materna presentaron menor dolor y una reducción del 50 % en el tiempo medio de llanto en comparación con el sustituto de leche o los controles 38. Así mismo, Erkul et al., asignaron al azar a 100 recién nacidos a lactancia materna o control previo a la vacunación, identificaron puntuaciones de dolor y frecuencia cardiaca más bajas, menor duración del llanto y una saturación de oxígeno media más alta en el grupo de lactancia materna 39.
Succión no nutritiva: se ha asociado con la activación de los nervios sensoriales que pueden conducir a la liberación de colecistoquinina interactuando con los opioides endógenos y producir analgesia 40. Un estudio de casos y controles realizado en 2013 sugirió una eficacia similar a la lactancia materna en la analgesia durante una punción venosa 41.
Otras intervenciones
Soluciones orales dulces: constituyen el manejo no farmacológico más estudiado en neonatos; existen más de 150 artículos publicados sobre esta técnica, de los cuales 100 incluyen sacarosa 42. Stevens et al., realizaron 3 estudios de revisión sistemática y metaanálisis para determinar la eficacia, el efecto de la dosis y la seguridad de la sacarosa para aliviar el dolor de los procedimientos en los recién nacidos: la sacarosa redujo consistentemente las respuestas conductuales (duración del llanto, acciones faciales y puntajes de escalas multidimensionales de dolor) a procedimientos nocivos en comparación con placebos, no tratamiento o soluciones menos dulces, incluida la leche materna 43,44,45.
El mecanismo de acción se asocia con la acción de opioides endógenos, con un inicio de acción a los 10 segundos de administrada, pico de acción a los 2 minutos que se sostiene de 5 a 10 minutos. Se debe tener precaución en recién nacidos <32 semanas evitando múltiples dosis. Contraindicada en pacientes con síndrome de intestino corto, enterocolitis necrotizante, fístula traqueo esofágica no reparada o alteraciones en la deglución 30.
La dosis ideal aún no está establecida; se ha demostrado eficacia en dosis de 0.1 ml a 0.2 ml. Según la edad gestacional corregida, el grupo de interés de dolor neonatal de Ottawa recomienda en menores de 28 semanas, 0.1ml (dosis máxima diaria 1.2ml); de la semana 28-31, 0.3ml (dosis máxima diaria 3.6ml); de la semana 32-35 0.5ml (dosis máxima diaria 5ml), y desde las 36 semanas, 0.5-1 ml (dosis máxima 6 ml) 45,46.
TRATAMIENTO FARMACOLÓGICO
Debe ser individualizado, teniendo en cuenta la edad gestacional cumplida del paciente, su estado clínico, la eficacia, el perfil de seguridad del medicamento y la experiencia del profesional de la salud en la utilización del fármaco; deben asociarse a medidas no farmacológicas para optimizar su acción 2.
Está indicado en dolor leve-moderado (toma de sangre de talón, punciones venosas, lumbares y vesicales) y moderado-severo (postquirúrgico, intubación orotraqueal), con estricta vigilancia en pacientes pretérmino, ya que tienen un aumento en la vida media de los fármacos con tiempos más prolongados de eliminación 47.
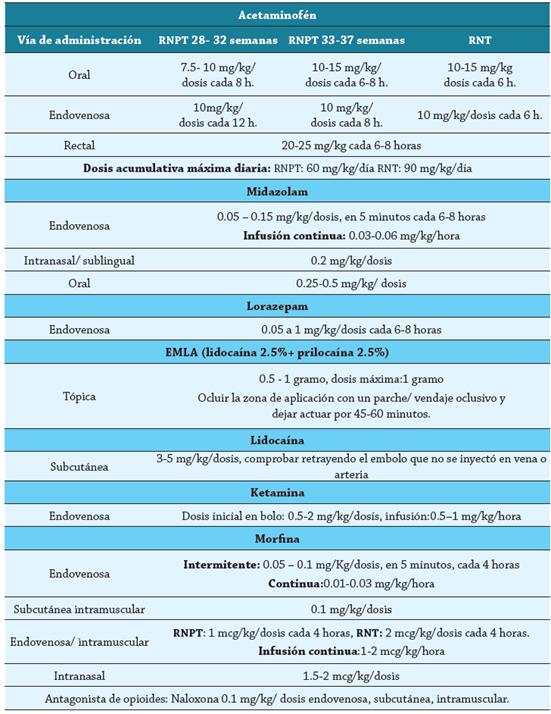
Existen dos grupos principales de fármacos: los no opiáceos/no sedantes, indicados en dolor de menor intensidad, y los opiáceos, reservados para dolor de mayor intensidad 47. Las dosis recomendadas de los principales medicamentos, disponibles en Colombia, se evidencian en el cuadro 9.
OPIOIDES
Brindan analgesia para el dolor moderado-severo y sedación en todos los grupos etarios. Tienen una ventana terapéutica amplia, atenúan las respuestas de estrés fisiológico y en los estados post quirúrgicos permiten una disminución en los requerimientos inotrópicos 3,48.
Los más utilizados son la morfina y el fentanilo; ambos presentan un perfil de analgesia similar, sin embargo, la morfina brinda mayor sedación y menor probabilidad de presentar tórax en leño. Su uso prolongado está asociado a tolerancia y dependencia, por lo tanto, se deben suspender de manera gradual 3,48.
Morfina: Opioide más usado para lograr analgesia; se puede administrar de forma intermitente para controlar dolor en procedimientos invasivos o en infusión continúa en pacientes que están bajo ventilación mecánica o en estados posquirúrgicos. Produce sedación y analgesia mediante un efecto inhibitorio por hiperpolarización de la membrana y bloqueo de la liberación del neurotransmisor 3,48.
Su inicio de acción por vía endovenosa es de 6-30 minutos y su vida media varía según la edad gestacional: en recién nacidos pretérmino es de 6 a 12 horas y en recién nacidos a término de 4.5 a 13 horas; su metabolismo es hepático y su excreción renal (ajustar dosis en función de estos últimos). Las reacciones adversas más conocidas son hipotensión, bradicardia, depresión respiratoria, y cuando se asocia a benzodiacepinas, miosis, íleo y retención urinaria. Su antídoto es la naloxona 3,48.
Fentanilo: Comparte su mecanismo de acción con la morfina; se recomienda evitar su administración conjunta. Proporciona analgesia rápidamente con escasos efectos hemodinámicos sobre el recién nacido; sin embargo, su uso no se encuentra altamente respaldado en grandes estudios multi-céntricos 49.
Su inicio de acción es casi inmediato si se administra de forma endovenosa, de 7-8 minutos de forma intramuscular y de 5 minutos intranasal. Metabolismo hepático y excreción renal 49. Las reacciones adversas más frecuentes son laringoespasmo, tórax en leño, depresión respiratoria, bradicardia y retención urinaria. Su antídoto es la naloxona 3,48.
TERAPIAS NO OPIÁCEAS
Paracetamol: Es un inhibidor de la ciclooxigenasa, realiza bloqueo de la síntesis de prostaglandinas a nivel central. Indicado para el manejo del dolor leve-moderado, se usa en conjunto con otros medicamentos no opiáceos en estados post quirúrgicos 49. Tiene un amplio perfil de seguridad, un inicio de acción menor de 1 hora si se administra por vía oral y de 5 a 10 minutos por vía endovenosa, vida media de 3.5 horas en los recién nacidos a término y 5.7 horas en los pretérmino 17,49.
La dosis recomendada varía según la vía de administración y la edad gestacional. Es de resaltar que el aclaramiento en los recién nacidos es más lento en comparación con niños mayores, así las dosis se pueden administrar con intervalos más prolongados 3,48.
Sus principales efectos secundarios son toxicidad hepática (dependiente de la dosis administrada), disminución de la frecuencia cardiaca y ocasionalmente hipotensión. Se puede ver afectado su metabolismo en pacientes con insuficiencia hepática, renal y en usuarios de inductores enzimáticos como rifampicina, fenobarbital, fenitoína, etc. 3,48.
BENZODIACEPINAS
Activan los receptores del ácido gamma aminobutírico A (GABA-A); sin embargo, más que analgesia, proveen sedación y relajación muscular, lo que favorece su uso en procedimientos no invasivos como la realización de imágenes diagnósticas y para generar control sobre la actividad motora en procedimientos invasivos. Sus principales efectos adversos son: mioclonías, sedación excesiva, depresión respiratoria e hipotensión ocasionalmente3,48.
Midazolam: es la benzodiacepina más utilizada en las unidades de cuidado neonatal, principalmente en requerimientos de ventilación mecánica o manejo de dolor en procedimientos invasivos. Existen revisiones que no encuentran diferencias significativas entre el uso de este agente versus el uso de los opiáceos en ventilación mecánica; resaltando también los eventos adversos que se han atribuido a su uso como hemorragia intraventricular, leucomalacia periventricular e inclusive muerte 49. Adicionalmente, una revisión de Cochrane encontró datos insuficientes para promover el uso de midazolam endovenoso como sedante en las UCIN dadas las preocupaciones en cuanto a su perfil de seguridad 50.
Tiene un inicio de acción endovenoso de 1-2 minutos y por vía oral de 10-20; en recién nacidos pretérmino tiene una vida media de 4-6 horas, e inclusive hasta de 22 horas, por lo que se ha contraindicado su uso en estos pacientes 3.
OTROS SEDANTES
Propofol: es un anestésico, sin efecto analgésico, utilizado para la inducción o el mantenimiento anestésico. No se ha estudiado suficientemente en recién nacidos; sin embargo, algunos estudios reportan tiempos de intubación más cortos asociados a su uso, aunque con alto riesgo de acumulación y neurotoxicidad secundaria, por lo que su uso se debe realizar con precaución 3,48,49.
Ketamina: es un anestésico disociativo entre el sistema límbico y la vía talamocortical que proporciona analgesia, amnesia y sedación. Los estudios con respecto a su uso son limitados, requiere monitorización continua durante su administración. Se caracteriza por aumentar la presión arterial, frecuencia cardiaca y gasto cardiaco, con una mínima repercusión respiratoria y sobre el flujo sanguíneo cerebral, por lo que se recomienda en pacientes inestables con hipotensión que requieren intubación orotraqueal de urgencia o ECMO 3,48.
ANESTÉSICOS LOCALES
Lidocaína: inhibe la transmisión axonal al bloquear los canales de iones de sodio; su uso se encuentra autorizado en niños por la FDA (US Food and Drug Administration). Su inicio de acción varía entre 30-60 segundos y proporciona anestesia por 1 a 2 horas; se debe usar por vía subcutánea exclusivamente, evitando vías arteriales o venosas, y ante sospecha de toxicidad por vía de administración errónea, se debe vigilar presencia de convulsiones, arritmias y bloqueos auriculo-ventriculares 3,48.
ANESTÉSICOS TÓPICOS
Bloquean el inicio y la conducción del impulso nervioso al disminuir la permeabilidad de las membranas neuronales frente al sodio. Se administran sobre la piel intacta al momento de someter el paciente a procedimientos superficiales como extracción de sangre venosa, arterial y punción lumbar; su efecto se consigue a la hora de aplicada la solución y se mantiene hasta 2 horas posterior a su aplicación. No se recomienda en recién nacidos pretérmino de menos de 32 semanas, ni en recién nacidos a término menores de 14 días de vida 3,48.
El agente más comúnmente usado es el EMLA (Eutectic Mixture of Local Anesthetic), que contiene lidocaína al 2.5 % y prilocaína al 2.5 % 0.5-2 gramos. Sus reacciones adversas son eritema, edema, convulsiones, bradicardia, hipotensión y apneas. Entre las precauciones y contraindicaciones están la metahemoglobinemia secundaria a la prilocaína y erupciones transitorias en la piel, con una mayor precaución en pretérminos por su piel más delgada con una mayor permeabilidad y mayor riesgo de absorción. No administrar concomitante con paracetamol, fenobarbital, difenilhidantoína, nitroprusiato de sodio ni antiarrítmicos de clase III 3,48.
CONCLUSIÓN
Los recién nacidos son más sensibles a estímulos nociceptivos y tienen la capacidad de desarrollar diferentes respuestas frente al dolor; por lo tanto, el manejo del mismo debe ser parte esencial de sus cuidados básicos.
Existen escalas unidimensionales y multidimensionales para valorar objetivamente el dolor en esta población con el fin de establecer oportunamente un manejo integral basado en medidas farmacológicas y no farmacológicas.
El manejo del dolor debe ser dirigido según el tipo de estímulo doloroso al cual vaya a ser expuesto el recién nacido, recomendaciones expuestas a lo largo del texto.
Todos los profesionales de la salud involucrados en el manejo de recién nacidos deben conocer el abordaje de este tema, para contribuir así en la disminución de los efectos adversos tanto físicos, cognitivos y conductuales que genera.