Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería e Investigación
Print version ISSN 0120-5609
Ing. Investig. vol.25 no.3 Bogotá Sep./Dec. 2005
José Luis Agudelo,1 Consuelo Montes de C.2
1 Ingeniero químico, Grupo Catálisis Ambiental, Sede de Investigación Universitaria-SIU, Universidad de Antioquia, e- mail: cmontes@udea.edu.co
2 Ph D. Departamento de Ingeniería Química, Grupo Catálisis Ambiental, Sede de Investigación Universitaria-SIU, profesora titular, Universidad de Antioquia, email: josel@rocketmail.com
RESUMEN
Se estudió la deshidratación catalítica de etanol a etileno en fase gaseosa sobre HMOR (Si/Al = 6.5), HZSM-5 (Si/Al = 29), Cu-HZSM-5 (Si/Al = 98) y Fe-HZSM-5 (Si/Al = 151); a presión atmosférica y en un intervalo de temperaturas entre 120-300°C. Los catalizadores soportados en HZSM-5 fueron activos a temperaturas por encima de 260°C, obteniéndose conversiones superiores al 60%. El etileno fue el producto predominante en la deshidratación. La presencia de cobre en la zeolita HZSM-5 incrementó levemente la actividad catalítica a alta temperatura, mientras que con la adición de hierro la conversión de etanol disminuyó. La zeolita HMOR fue activa a temperaturas menores de 200°C, pero se desactivó rápidamente a 240°C debido a la formación de coque.
Palabras clave: deshidratación catalítica, etanol, etileno, HMOR, HZSM-5, Cu-ZSM-5, Fe-ZSM-5.
ABSTRACT
Catalytic dehydration of ethanol to ethylene on HMOR (Si/Al = 6.5), HZSM-5 (Si/Al = 29), Cu-HZSM-5 (Si/Al = 98) and Fe-HZSM-5 (Si/Al = 151) was studied at atmospheric pressure and 120oC - 300ºC. ZSM-5 supported catalysts were active at temperatures over 260ºC, achieving more than 60% conversion. Ethylene was predominantly produced as a dehydration product. Incorporating Cu did not significantly improve catalytic activity compared to HZSM-5. H-MOR was very active at low temperatures but deactivated rapidly at 240ºC, most probably due to coke formation.
Keywords: catalytic dehydration, ethanol, ethylene, HMOR, HZSM-5, Cu-ZSM-5, Fe-ZSM-5.
Recibido: mayo 12 de 2005
Aceptado: septiembre 9 de 2005
Introducción
El etileno es una materia prima importante en la industria química ya que se utiliza para la obtención de gran variedad de compuestos esenciales para la vida moderna. El etileno se produce principalmente por la vía petroquímica (Le Van Mao et al., 1989), pero debido a que las reservas de petróleo cada vez son menores, el desarrollo de rutas alternativas para preparar etileno sigue siendo de gran interés (Winter y Eng, 1976; Tsao y Reilly, 1978; Coutinho y Cabral, 1981; Phillips y Datta, 1997). El etileno también se obtiene por deshidratación catalítica de etanol acuoso procedente de la transformación fermentativa de biomasa a partir de recursos naturales renovables (Winter y Eng, 1976; Tsao y Reilly, 1978; Coutinho y Cabral, 1981; Le Van Mao et al., 1987; Le Van Mao et al., 1989; Le Van Mao et al., 1990; Phillips y Datta, 1997). La deshidratación catalítica heterogénea de etanol para producir etileno se ha estudiado con diferentes catalizadores. Algunos trabajos y patentes reportan la alúmina como uno de los materiales de mejor desempeño para esta reacción (Winter y Eng, 1976; Tsao y Reilly, 1978; Tsao y Zasloff, 1979; Winnick, 1980; Shinohara et al., 1997; Bakoyannakis et al., 2001; Doheim y El-Shobaky, 2002; Doheim et al., 2002). Sin embargo, cuando se usa alúmina se suelen requerir altas temperaturas y el material se desactiva por la formación de coque (Pargal y Kanga, 1964; Tsao y Reilly, 1978; Phillips y Datta, 1997). Adicionalmente, varias zeolitas (principalmente la HZSM-5) y/o modificaciones de estas con metales (Cu, Zn, Mn, cationes La/Ce) y agentes superacídicos como el ácido trifluorometanosulfónico (Chang y Lang, 1977; Tsao y Reilly, 1978; Valladares et al., 1980; Chen y Reagan, 1981; Coutinho y Cabral, 1981; Oudejans et al., 1982; Pearson, 1983; Jacob et al., 1987; Le Van Mao et al., 1987; Le Van Mao y Dao, 1987; Le Van Mao, 1989; Le Van Mao et al., 1989; Bun et al., 1990; Nguyen y Le Van Mao, 1990; Le Van Mao et al., 1990; Phillips y Datta, 1997; Lin y Ko, 2000) se han utilizado para la deshidratación del etanol a diferentes condiciones de reacción. Incluso, existen reportes de zeolitas naturales que han mostrado relativa actividad para la deshidratación de etanol (Rodríguez et al., 1993). En general, se prefiere el uso de zeolitas, ya que poseen sitios bien caracterizados, pudiéndose controlar la cantidad y la fortaleza ácida (Phillips y Datta, 1997). Algunos óxidos de metales de transición (Shinohara et al., 1997a; Shinohara et al., 1997b; Golay et al., 1998; Golay et al., 1999a; Golay et al., 1999b; El-Katatny et al., 2000; Zaki, 2005) (sencillos y mixtos) y otros materiales, tales como sales de plata o potasio del ácido tungstenofosfórico (Haber et al., 2002), silicatos de niobio (Brandao et al., 2002), aglomerados halúricos de varios metales (Kamiguchi y Chihara, 2003), entre otros, también se han estudiado para esta reacción. En algunos de los reportes mencionados, la deshidratación del etanol se ha usado como reacción prueba para determinar la acidez y establecer las características intrínsecas de los catalizadores (Shinohara et al.,1997a; Shinohara et al., 1997b; Lin y Ko, 2000).
Diferentes factores influencian la conversión y la distribución de productos en la deshidratación catalítica de etanol. Se acepta que los catalizadores de naturaleza ácida son selectivos hacia los productos de deshidratación, es decir, el etileno y el dietil éter; mientras que los de naturaleza básica tienden a ser selectivos hacia la deshidrogenación formando acetaldehído (Shinohara et al., 1997). Para los ácidos, a baja temperatura se suele favorecer la formación de dietil éter, en tanto que a temperaturas altas se produce el etileno como producto principal. Cuando se usan zeolitas, los sitios ácidos Bronsted y Lewis juegan un papel determinante en el mecanismo de reacción. Phillips y colaboradores (Phillips y Datta, 1997) plantearon un mecanismo simultáneo para la síntesis de etileno y dietil éter con HZSM-5. Además, el contenido de agua en la alimentación es también un factor importante, ya que puede mejorar la estabilidad del catalizador al modular la acidez y atenuar reacciones colaterales como las de oligomerización del etileno dentro de los canales de la zeolita. La constante de velocidad de reacción es bastante sensitiva a cambios en la relación Si/Al para HZSM-5 rica en silicio (Si/Al > 140) (Phillips y Datta, 1997). El efecto de pretratamiento y/o modificación previa de los catalizadores se discuten en varios reportes (Pargal y Kanga, 1964; Le Van Mao et al., 1987; Le Van Mao et al., 1989; Le Van Mao et al., 1990; Doheim y El-Shobaky, 2002; Doheim et al., 2002;). El objetivo de este trabajo es comparar la actividad de HMOR (Si/Al = 6.5) y HZSM-5 (Si/Al = 29) en la reacción de deshidratación de etanol y el efecto de la modificación de HZSM-5 con Cu y Fe. Se hace énfasis en el efecto de la temperatura de reacción, con miras a desarrollar un catalizador para la producción de etileno que opere a condiciones moderadas.
Experimentación
Los catalizadores Cu-ZSM-5, Fe-ZSM-5 y HZSM-5 utilizados en este trabajo para la reacción de deshidratación de etanol se encontraban disponibles en el Grupo Catálisis Ambiental, y su preparación y caracterización fue reportada previamente (Villa et al., 2005). El catalizador HMOR se preparó a partir de Na-MOR comercial (Zeolyst) intercambiada con 100 mL de solución 1M de NH4Cl por gramo de zeolita, bajo agitación y reflujo durante 24 horas a 80ºC. El sólido obtenido se filtró y se lavó hasta prueba negativa de cloruros. Luego se secó en estufa a 120ºC durante la noche y posteriormente se calcinó en mufla a 500ºC durante cuatro horas, obteniéndose la zeolita mordenita ácida (HMOR).
La actividad catalítica para la deshidratación de etanol se realizó a presión atmosférica entre 120-260 ºC usando un reactor tubular lecho fijo, construido en vidrio pyrex. Los catalizadores se empastillaron y tamizaron hasta un diámetro de partícula entre 0.18 < dp < 0.25 mm. En el caso de HMOR el catalizador se mezcló con carburo de silicio con el fin de obtener una altura de lecho adecuada para asegurar comportamiento de flujo tipo pistón. El etanol líquido (pureza > 96%) se alimentó al reactor mediante una bomba peristáltica, se vaporizó a 95ºC y se mezcló con una corriente de nitrógeno seco como gas de arrastre. La mezcla de reacción resultante contenía 3.7% de etanol. La velocidad espacial fue 30000 h-1, calculada asumiendo una densidad del catalizador de 0.5 g/cm3. Se usaron 180 mL/min de flujo total y 0.18 g de catalizador en todas las corridas. Para el seguimiento de la reacción se utilizó un analizador de gases FTIR marca GASMET, modelo TEMET, con una temperatura de celda de 120ºC y una celda de 2L y paso óptico de 240 cm. La conversión se calculó con base en la disminución del etanol y la selectividad con base en la aparición del etileno.
Resultados y discusión
Caracterización de catalizadores
La carga de metal y la relación Si/Al obtenidos por análisis químico, así como el área superficial BET de los catalizadores utilizados se presentan en la Tabla 1. El análisis de difracción de rayos X realizado a los catalizadores utilizados mostró concordancia entre los picos característicos de los patrones para la estructura MFI. Además, no se observaron otras fases o impurezas.
Según se reportó previamente (Villa et al., 2005) el análisis UV-Vis para el catalizador Cu-ZSM-5 mostró bandas entre 550-1.000 nm asociadas con transiciones d-d de complejos de Cu(II) y bandas entre 200-238 nm atribuidas a complejos CuI(H2O)n. El catalizador Fe-ZSM-5 exhibió una banda de absorción intensa a 250 nm debida a la transferencia de carga de Fe3+ de especies aisladas en coordinación octahedral. También fue evidente un hombro cerca de 330 nm característico de Fe3+ octahedral presente en pequeños aglomerados.
Deshidratación de etanol
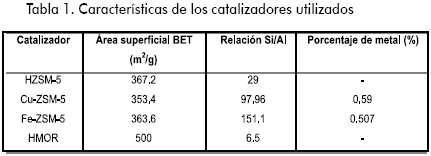
La conversión de etanol a etileno vs temperatura con los diferentes catalizadores utilizados se presenta en la Figura 1, observándose que a mayor temperatura de reacción, mayor es la actividad catalítica. HZSM-5 fue activa por encima de 250ºC, alcanzando conversiones superiores a 60%. En cuanto a la selectividad, en la Figura 2 se observa que el principal producto de deshidratación para todos los catalizadores es el etileno, ya que se alcanzan selectividades cercanas a 90%.
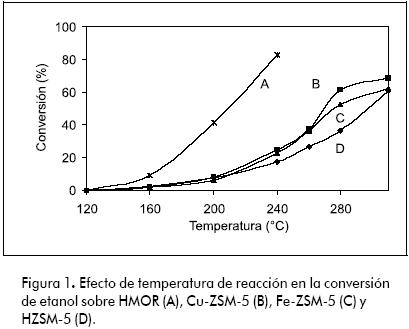
La adición de cobre incrementó levemente la conversión y la selectividad a altas temperaturas. Con respecto a HZSM-5, se observa un incremento de 10% en conversión y de 50% en la selectividad a 260ºC (ver figuras 1 y 2). Bun y colaboradores (Bun et al., 1990) encontraron que el intercambio iónico de CuII en Na-ZSM-5 incrementa la actividad para la oxidación de etanol. En ausencia de oxígeno, hallaron que el principal producto de la conversión de etanol fue el etileno.
Por otro lado, resulta evidente que la incorporación de Fe a la estructura de HZSM-5 no tuvo un efecto significativo sobre la actividad catalítica. Mohamed (2003) reportó que el carácter ácido debido a los iones de hierro, así como el estado de coordinación, la localización y la dispersión de estos en la estructura de la zeolita, determinan marcadamente sus propiedades catalíticas. Además, reportan que los aglomerados de óxidos de hierro son causantes de que el catalizador sea inactivo para varias reacciones. Especies de este tipo se identificaron en las muestras Fe-ZSM-5 de este estudio por medio de UV-Vis (Villa et al., 2005).
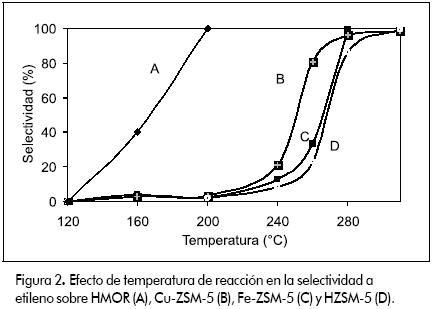
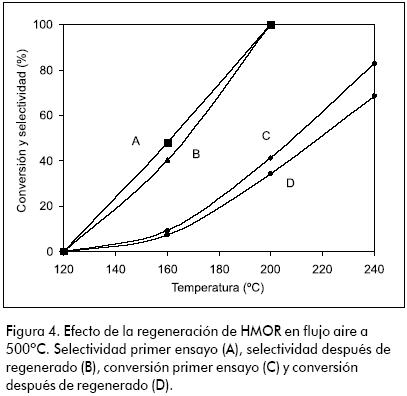
La zeolita HMOR presenta actividad a baja temperatura. Se obtuvo conversión de 35% y 100% de selectividad a 200ºC. Estos valores son superiores a los demás catalizadores evaluados. Como se puede apreciar en la Figura 3, la conversión desciende de 80% a 20% en casi seis horas. Después de reacción, el catalizador adquirió un color negro típico de la formación de coque. Aguayo y colaboradores (Aguayo et al., 2002) realizaron un estudio detallado de la desactivación de HZSM-5 en la producción de hidrocarburos a partir de etanol acuoso y afirmaron que la deposición de coque en los catalizadores depende de parámetros tales como: el tiempo de reacción, velocidad espacial y composición de la alimentación (particularmente del contenido de agua), entre otros. Oudejeans y colaboradores (Oudejeans et al., 1982) reportaron la desactivación por formación de coque de una mordenita desaluminizada usada para la producción de compuestos aromáticos a partir de etanol acuoso y atribuyen la dramática desactivación a la estructura de poro seudounidimensional de la HMOR que conduce a bloqueo de poro y a problemas difusionales por las moléculas más grandes formadas en los sitios activos. En dicho estudio, las diferencias observadas entre la actividad de HZSM-5 y HMOR concuerdan con el incremento de la fortaleza ácida tipo Bronsted, HMOR < HZSM-5, a su vez debido al correspondiente incremento en la relación Si/Al. Phillips y Datta (1997) asociaron la formación de coque en HZSM-5 al estancamiento molecular dentro de los canales de la zeolita que se presenta cuando la velocidad de difusión hacia afuera es menor que la velocidad de producción, lo cual facilita la oligomerización del etileno. En el presente estudio, aunque la mordenita pierde actividad cuando se incrementa la temperatura, esta se restaura casi completamente calcinando la muestra de HMOR usada en flujo de aire a 500ºC (ver Figura 4). Con esto se logra remover los compuestos carbonáceos depositados en el catalizador (este recupera su color original y su actividad). La regeneración del catalizador se puede realizar también con H2 o un gas inerte según se ha propuesto (Phillips y Datta, 1997; Aguayo et al., 2002).
Conclusiones
Bajo las condiciones experimentales de este trabajo se encontró alta selectividad para la deshidratación catalítica del etanol a etileno. Con HZSM-5 se obtienen conversiones de 60% por encima de 260ºC. La incorporación Cu a la zeolita HZSM-5 incrementó la actividad catalítica a alta temperatura, mientras que con Fe la actividad disminuyó. La zeolita HMOR fue activa a temperaturas menores de 200ºC pero se desactiva rápidamente a 240ºC debido a la formación de coque. No obstante, el material se recupera por tratamiento de la muestra desactivada en condiciones oxidantes.
Agradecimientos
Este proyecto se realizó gracias a los aportes del programa Jóvenes Investigadores de COLCIENCIAS y a la Universidad de Antioquia.
Bibliografía
Aguayo, A.T. et al., Catalyst deactivation by coke in the transformation of aqueous ethanol into hydrocarbons. Kinetic modelling and acidity deterioration of the catalyst., Ind. Eng. Chem. Res., Vol. 41, 2002, pp. 4216-4224. [ Links ]
Bakoyannakis, D. et al., The effect of preparation method on the catalytic activity of amorphous aluminas in ethanol dehydration., J. of Chem. Technol. and Biotechnol, Vol. 76, 2001, pp. 1159-1164. [ Links ]
Brandao, P. et al., Dehydration of alcohols by microporous niobium silicate AM-11., Catalysis Letters, Vol. 80, Nos. 3-4, 2002, pp. 99-102. [ Links ]
Bun, S. et al., Ethanol conversion over ion-exchanged ZSM-5 zeolites., Applied Catalysis, Vol. 59, 1990, pp. 13-29. [ Links ]
Chang, C. D. y Lang, W.H., Process for manufacturing olefins., US patent 4,0,25,575, May. 24, 1997. [ Links ]
Chen, N. Y. y Reagan, W.J., Hydrocarbon manufacturing from alcohol., US patent 4,278,565, Jul. 24, 1981. [ Links ]
Coutinho, P.H.D.A. y Cabral, J.A.R., Process for obtaining gaseous streams rich in ethane., US patent 4,251,677, Feb. 17, 1981. [ Links ]
Doheim, M. M. y El-Shobaky, H.G., Catalytic conversion of ethanol and iso-propanol over ZnO-treated Co3O4/Al2O3 solids., Colloids and Surfaces A: Physicochemical and Engineering Aspects, Vol. 204, 2002a, pp. 169-174. [ Links ]
Doheim, M.M., Hanafy, S.A. y El-Shobaky, G.A., Catalytic conversion of ethanol and iso-propanol over Mn2O3/Al2O3 system doped with Na2O., Materials letter, Vol. 55, 2002b, pp.304-311. [ Links ]
El-Katatny, E. A. et al., Recovery of ethene-selective FeOx/Al2O3 ethanol dehydration catalyst from industrial chemical wastes., Applied Catalysis A: General, Vol. 199, 2000, pp. 83-92. [ Links ]
Golay, S. et al., Influence of the catalyst acid/base properties on the catalytic ethanol dehydration under steady state and dynamic conditions. In situ surface and gas-phase analysis., Chemical Engineering Science, Vol. 54, 1999a, pp. 3593-3598. [ Links ]
Golay, S., Doepper,R. y Renken, A., In-situ characterization of the surface intermediates for the ethanol dehydration reaction over y-alumina under dynamic conditions., Applied Catalysis A: General, Vol. 172, 1998, pp. 97-106. [ Links ]
Golay, S., Doepper, R. y Renken, A., Reactor performance enhancement under periodic operation for the ethanol dehydration over y-alumina, a reaction with a stop-effect., Chemical Engineering Science, Vol. 54, 1999b, pp. 4469-4474. [ Links ]
Haber, J. et al., Potassium and silver salts of tungstophosphoric acid as catalysts in dehydration of ethanol and hydration of ethylene., Journal of Catalysis, Vol. 207, 2002, pp. 296-306. [ Links ]
Jacobs, J., Jacobs, P.A. y Uytterhoeven, J.B., Process for obtaining ethylene from ethanol., US patent 4,670,620, Jun. 2, 1987. [ Links ]
Kamiguchi, S. y Chihara, T., Catalytic dehydration of alcohol to olefin and ether by halide cluster of Nb, Mo, Ta and W possessing an octahedral metal core., Catalysis Letters, Vol. 85, Nos. 1-2, 2003, pp. 97-100. [ Links ]
Le Van Mao, R. et al., Ethylene from ethanol over zeolite catalysts., Applied Catalysis, Vol. 34, 1987a, pp. 163-179. [ Links ]
Le Van Mao, R. y Dao, L. H., Ethylene light olefins from ethanol., US patent 4,698,452, Oct. 6, 1987. [ Links ]
Le Van Mao, R., Catalytic conversion of aqueous ethanol to ethanol., US patent 4,873,392, Oct. 10, 1989. [ Links ]
Le Van Mao, R., Nguyen, T.H. y Mclaughlin, G.P., The Bioethanol-to-Ethylene (B.E.T.E.) process., Applied Catalysis, Vol. 48, 1989, pp. 265-277. [ Links ]
Le Van Mao, R., Nguyen, T.M. y Yao, J., Conversion of ethanol in aqueous solution over ZSM-5 zeolites. Influence of reaction parameters and catalyst acidity properties as studied by ammonia TPD technique., Applied Catalysis, Vol. 61, 1990, pp. 161-173. [ Links ]
Lin, H. y Ko, A., Alcohol dehydration over ZSM-5 type zeolite, montmorillonite clays and pillared montmorillonite., Journal of Chinese Chemical Society, Vol. 47, 2000, pp. 509-518. [ Links ]
Mohamed, M.M., Catalytic properties of Fe ion-exchanged mordenite toward the ethanol transformation: influence of the preparation., Journal of Molecular Catalysis A: Chemical, Vol. 200, 2003, pp. 301-313. [ Links ]
Nguyen, T.M. y Le Van Mao, R., Conversion of Ethanol in Aqueous Solution over ZSM-5 Zeolites. Study of the Reaction Networ., Applied Catalysis, Vol. 58, 1990, pp 119-129. [ Links ]
Oudejans, J. C., Van Den Oosterkamp, P.F. y Van Bekkum, H., Conversion of Ethanol over H-ZSM-5 in the presence of water., Applied Catalysis, Vol. 3, 1982, pp. 109-115. [ Links ]
Pargal, H.K. y Kanga, S.H., Deterioration in the activity of activated alumina during the dehydration of ethanol to ethylene., Chemical Age of India, Vol. 15, No. 1, 1964, pp. 117-123. [ Links ]
Pearson, D.E. Process for catalytic dehydration of ethanol vapor to ethylene., US patent 4,423,270, Dic. 27, 1983. [ Links ]
Phillips, C. B. y Datta, R., Production of ethylene from hydrous ethanol on HZSM-5 under mild conditions., Ind Eng. Chem. Res. Vol. 36, 1997, pp. 4466-4475. [ Links ]
Rodríguez Fuentes, G. et al., Procedimiento para la obtención de un catalizador ácido de clinoptilolita o heulandita natural modificada., patente cubana CU 22083 A1, Mar. 30, 1993. [ Links ]
Shinohara, Y. et al., A computational chemical investigation of the dehydration and dehydrogenation of ethanol on oxide catalysts., Journal of Chemical Software, Vol. 4, No.3, 1997. pp. 89. [ Links ]
Shinohara, Y.et al., Study of the interaction of ethanol with the Bronsted and Lewis acid sites on metal oxide surfaces using the DV-Xα method., Journal of Chemical Software, Vol. 4, No. 41, 1997, pp. 1-12. [ Links ]
Tsao, U. y Reilly, J. W., Dehydrate ethanol to ethylene., Hydrocarbon Processing, Feb., 1978, pp. 133-136. [ Links ]
Tsao, U. y Zasloff, H.B., Production of ethylene from ethanol., US patent 4,134,926, Ene. 16, 1979. [ Links ]
Valladares Barrocas, H., De Castro, J.B. y Coutinho, R., Process for preparing ethane., US patent 4,232,179, Nov. 4, 1980. [ Links ]
Villa, A.L., Caro, C.A. y Montes, C., Cu- and Fe-ZSM-5 as catalysts for phenol hydroxylation., Journal of Molecular Catalysis A: Chemical, Vol. 228, 2005, pp. 233-240. [ Links ]
Winnick, C. N., Catalytic process for dehydration of alcohols., US patent 4,207,424, Jun. 10, 1980. [ Links ]
Winter, O. y Eng, M., Make ethylene from ethanol., Hydrocarbon Processing, Nov., 1976, pp. 125-133. [ Links ]
Zaki, T., Catalytic dehydration of ethanol using transition metal oxide catalysts., Journal of colloid and Interface Science, Vol. 284, 2005, pp. 606-613. [ Links ]














