Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería e Investigación
Print version ISSN 0120-5609
Ing. Investig. vol.25 no.3 Bogotá Sep./Dec. 2005
Carlos Alberto Guerrero Fajardo,1 Sandra Escobar C,2 Diego Ramírez N3
1 Químico, profesor del Departamento de Química, Universidad Nacional de Colombia, Bogotá, D.C., e-mail: caguerrerofa@unal.edu.co
2 Ingeniera química de la Universidad Nacional de Colombia, Facultad de Ingeniería.
3 Ingeniero químico de la Universidad Nacional de Colombia, Facultad de Ingeniería.
RESUMEN
En este artículo se presenta el diseño conceptual de una alternativa complementaria de la solución al manejo de las aguas asociadas de producción dentro de un marco ambiental y técnico factible, cuyo fin es la recuperación de la sal de mayor porcentaje, mediante un proceso de cristalización fraccionada tipo I. Para plantear y analizar la alternativa de trabajo con las aguas asociadas de producción provenientes de las estaciones La Gloria, La Gloria Norte y Morichal, pertenecientes a la Asociación Casanare, dado que las anteriores producen un efluente con alto contenido de sales, la propuesta está enfocada al tratamiento del 30% del volumen de agua asociada producida, esperada para el año 2000 (1.239 m3/día) en los campos de estudio. El proceso permite recuperar un 92% de NaCl presente, equivalente a 0.918 Ton/h, con una pureza del 97%. Para garantizar la calidad del producto final y aprovechar las facilidades del campo, se proponen sistemas de aireación y evaporación previos a la etapa de cristalización.
Palabras clave: agua, salinidad, cristalización.
ABSTRACT
This article describes a conceptual design for handling an oilfield’s industrial wastewater; its objective was to use type-1 fractioned crystallisation within a feasible environmental and technical framework for obtaining the highest percentage of salt. La Gloria, La Gloria Norte and Morichal (all belonging to the Casanare department association) stations were used for planning and analysing this handling alternative as they produce high salt-containing industrial effluent. This alternative was focused on treating 30% of the total volume of the associated water so produced. This volume is expected to be 1,239 m3/d in 2000 in the oilfields being studied here. The process allows 92% retrieval from present NaCl (0.918 Ton/h), having 97% purity. Evaporation and aeration systems should be set prior to the crystallisation stage as a means of guaranteeing final product quality and making good use of the field’s facilities.
Keywords: water, salinity, crystallisation.
Recibido: noviembre 16 de 2004
Aceptado: septiembre 14 de 2005
Introducción
Las aguas asociadas de producción se pueden definir como el fluido que además del gas puede acompañar al petróleo durante la etapa de explotación (Avellaneda, 1960). Desde el punto de vista físico-químico, se caracteriza principalmente por su alta salinidad, llegando a ser hasta tres veces más salina que el agua de mar.
En la actualidad su manejo se enfoca a dos procesos principalmente, ósmosis inversa e inyección, siendo este último el más difundido en el ámbito mundial. Si ha existido un estudio del proyecto de inyección detallado, cuyo resultado es su factibilidad para inyectar el total de agua producida, esta alternativa se convierte en la medida más efectiva desde el punto de vista ambiental, a pesar del alto costo de adecuación. Sin embargo, la inyección no debe tomarse como una regla general de manejo, ya que su comportamiento está influenciado por muchas variables, entre las que están principalmente la permeabilidad de la formación y la compatibilidad iónica y mecánica entre el agua de formación y el agua de inyección.
Un aspecto clave en el estudio de tratamientos y disposición de agua asociada en superficie es la disminución en la carga iónica del agua a disponer, mediante la precipitación de las sales presentes por medio de un proceso que implica operaciones unitarias de aireación, evaporación y cristalización, con el fin de obtener un producto de alta pureza (Fitch,1970; Meyer,1949; Slater,1989). La etapa de aireación está basada en un proceso de oxidación total, el objetivo es reducir la carga de DBO5 y oxidar el hierro disuelto junto con otros elementos de menor proporción. La segunda etapa es la de evaporación, en donde el diseño del equipo se fundamenta en los principios de calor radiante y se caracteriza por la utilización de los gases de combustión del gas natural. La última etapa es la de cristalización fraccionada con el fin de separar desde la solución la sal de mayor porcentaje, el NaCl en este caso (Carvajal,1986). Su diseño se basa en estudios cinéticos del comportamiento del cristal para soluciones con elevada concentración de NaCl.
El resultado que se espera de este proceso es el de obtener un producto de unas especificaciones comercialmente aceptables, que traiga beneficios económicos, los cuales puedan contrarrestar en algún porcentaje los costos elevados del proceso de inyección y de esta forma ser complementario a este. Además, facilidades como el gas producido en el campo petrolero reducen ampliamente los costos energéticos para la adecuación del sistema propuesto.
Parte experimental
Identificación del sistema.
Se concluye que los principales iones constituyentes son: Na+, Ca++, K+, Mg++ y Cl-, por presentar una mayor proporción comparada con los restantes (Tabla 1).
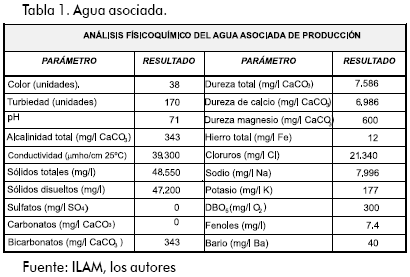
Por lo tanto, este análisis preliminar establece el siguiente sistema: NaCl – CaCl2 – KCl – MgCl2 – H2O (Asarsson, partes I y II,1950).
Curvas de densidad y temperatura de ebullición v.s porcentaje de agua evaporada.
El objetivo principal es establecer el comportamiento de la precipitación de sales presentes para un determinado porcentaje de agua evaporada.
El procedimiento experimental es:
- Establecer volumen inicial y pesarlo. Se trabaja con muestras de 3 L de agua asociada.
- Llevar el volumen establecido a temperatura de ebullición con agitación.
- Tomar muestras de la solución en ebullición en una probeta de 10 ml, previamente calentada y pesada; se pesa a temperatura ambiente. Esta densidad se refiere a la del agua obtenida por diferencia entre el peso de la probeta vacía con tapa y la probeta llena de agua destilada hasta ebullición. Esta se pesó a temperatura ambiente.
- Evaluar en esta muestra los componentes principales del sistema seleccionado, mediante los análisis descritos en la Tabla 2.
- Se regresa el contenido de la probeta al recipiente y se repite el proceso hasta llegar al 10% de agua evaporada.
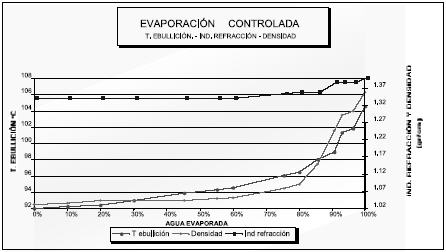
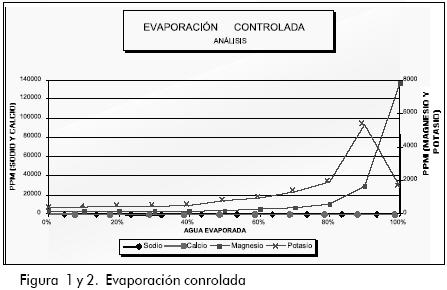
El procedimiento de evaporación se repitió varias veces, con el fin de obtener reproducibilidad en los datos; a continuación, se observan los más representativos de esta etapa. Figuras 1 y 2.
El análisis de los resultados obtenidos es el siguiente:
- Entre el 80% y 92% de agua evaporada se presenta el mayor aumento en los valores de las propiedades físicas medidas. De igual forma, hay un incremento de la concentración de las sales analizadas que influye en el comportamiento de las propiedades descritas.
- El ion sodio presenta un máximo de concentración entre el intervalo de 91% a 93%; su descenso brusco después de este valor asegura el comienzo de su cristalización. El resto de componentes permanecen en solución, incrementando su concentración.
- Las propiedades medidas tienen un comportamiento de estabilidad en el anterior intervalo que ratifica el posible inicio de la cristalización del cloruro de sodio, ya que al existir menos cantidad de sales solubles la presión de vapor aumenta y la temperatura de ebullición disminuye. De igual forma, existe una velocidad de precipitación que compensa la pérdida de solvente y, por lo tanto, la densidad tiende a estabilizarse.
- El inicio de la cristalización en el intervalo de 91% a 93% es debido a la sobresaturación de la solución con respecto a la sal (NaCl) que precipitó.
Caracterización del precipitado vs el porcentaje de agua.
El objetivo de esta etapa es la determinación cualitativa y cuantitativa de la sal o mezcla de sales que precipitan a un determinado porcentaje evaporado de agua.
El procedimiento utilizado es similar al anterior, con la diferencia de que en cada punto en que se recoge la muestra del sobrenadante, se retira el precipitado formado mediante una precipitación en caliente (vacío) y se analiza. La Tabla 3 presenta los resultados más representativos.
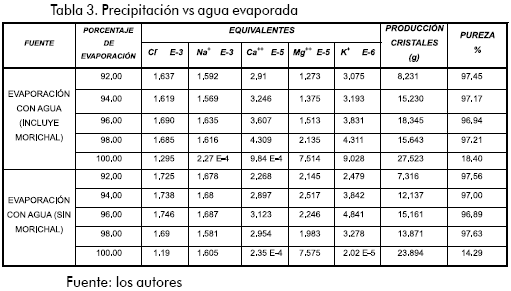
- Cabe resaltar que durante el proceso de evaporación controlada se presentó turbiedad del agua, producto de la floculación del hierro, causada principalmente por fenómenos de interacción química y electrostática.
Para manejar esta situación se realizó una filtración a través de un filtro membrana de 0.45 µm, cuando transcurría una evaporación del 60% del agua a agitación constante. Esta condición de operación se estableció de acuerdo con un informe de literatura especializada, el cual establece una concentración de 0.8 M (46.760 ppm) de NaCl para lograr la máxima floculación de hierro (Sholkovitz,1981).
Ruta de cristalización.
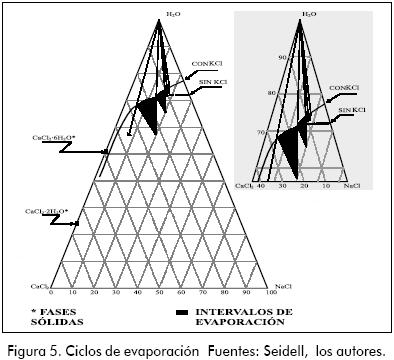
Para establecer la ruta de cristalización es indispensable disponer del diagrama de fases del sistema NaCl – CaCl2 – H2O. En la Tabla 4 se muestran los datos de solubilidad del sistema de estudio, y en la Figura 3 se muestra el diagrama de fases.
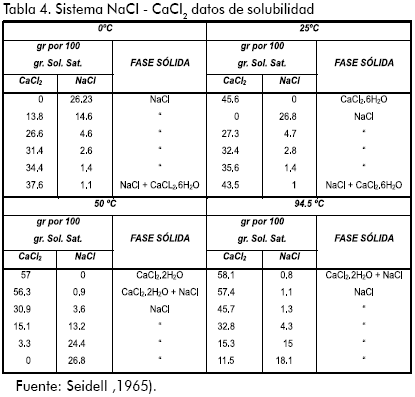
Este diagrama de fases permite clasificar el sistema como uno de tres componentes tipo I con existencia de hidratos.
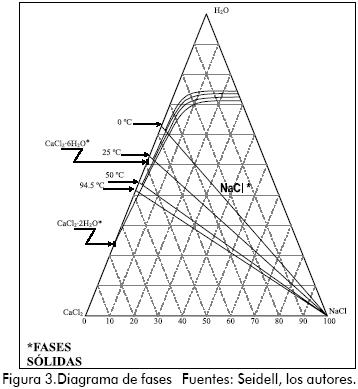
Clasificación de los sistemas de fases:
Los sistemas de cristalización fraccionada comprenden solutos que están para ser separados, y un solvente desde el cual son selectivamente cristalizados. A los primeros se les llama sales, y al último agua.
Tres tipos básicos son reconocidos:
- Tipo I: solutos que cristalizan sin formar soluciones sólidas o compuestos entre ellos mismos (sales dobles). Estospueden, sin embargo, formar compuestos con el solvente (hidratos).
- Tipo II: solutos que cristalizan como compuestos (sales dobles).
- Tipo III: solutos que cristalizan en soluciones sólidas. Estos requieren de un análisis complejo, donde los métodos de separación son análogos a aquellos para extracción sólida – líquida.
Sistemas tipo I.
Las soluciones graficadas a lo largo de la curva a(1) – b(1) están saturadas con respecto al componente A; aquellas a lo largo de b(1) – c(1) con el componente B. Los sistemas dibujados dentro de los límites S – a(1) – b(1) – c(1) consisten de una solución insaturada y no contienen fase sólida. Los sistemas graficados fuera de estos límites comprenden solución saturada y cualquiera de las fases sólidas. Figura 4.
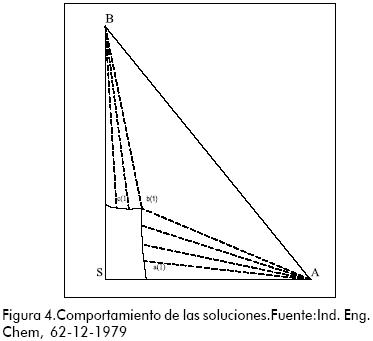
Cualquier mezcla de A y B que tenga una razón A/B diferente de aquella del punto b(1) puede ser separada a T(1) en una mezcla de solución y una cosecha de cristales A o B, cualesquiera esté en exceso, ya sea por adición o evaporación del solvente.
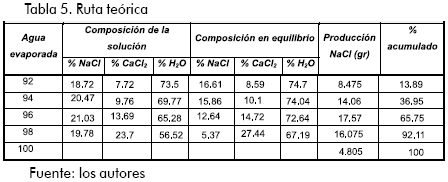
Para evaluar el comportamiento de las etapas previas, se desarrolló un seguimiento gráfico en la curva de solubilidad del sistema, obteniéndose el peso de los cristales formados por cada intervalo, mediante balance de masas. (Ver Tabla 5 y Figura 5).
Balance de materia
Primera etapa. Partiendo de la composición mostrada en la Tabla 1 y el volumen de la muestra, las composiciones de partida fueron:
- Peso total de la muestra: 3.069 g
- NaCl: 6.099 g
- CaCl2: 2.327 g
- H2O: 2.983 g
- Impurezas: 1.74 g
En la Figura 3 se observa la influencia de este cuarto componente sobre la curva de solubilidad del sistema NaCl – CaCl2 – H2O.
Según esta Figura, la composición del punto de saturación tiene las siguientes coordenadas:
- H2O: 76%
- NaCl: 17%
- CaCl2: 7%
Partiendo de las composiciones iniciales, la cantidad de agua que debe retirarse será de: 2.710.7 g, que equivale al 90.87% del agua inicial.
Segunda etapa. Para un 98% de agua evaporada a 50ºC, la composición de la solución es:
- H2O: 56.52%
- NaCl: 19.78%
- CaCl2: 23.70%
La composición de la solución en equilibrio es la siguiente:
- H2O: 67.19%
- NaCl: 5.37%
- CaCl2: 27.44%
Por lo tanto, la cantidad de agua retirada es de 2.923.34 g
Tercera etapa. La producción de cristales de NaCl es de 56.18 g, que equivale a un 92% de recuperación. De acuerdo con los resultados cuantitativos y cualitativos obtenidos previamente, la pureza máxima del NaCl es de 97%. Suponiendo que las impurezas presentes en el producto son principalmente CaCl2, el licor madre contiene 21.584 g de CaCl2, 59.66 g de H2O, 4.805 g de NaCl y 1.74 g de impurezas. En base libre de agua su composición es:
- CaCl2: 76.73%
- NaCl: 17.08%
- Impurezas: 6.19%
Desde esta última corriente, empezaría un nuevo proceso de cristalización fraccionada, enfocado a la descontaminación del cloruro de calcio
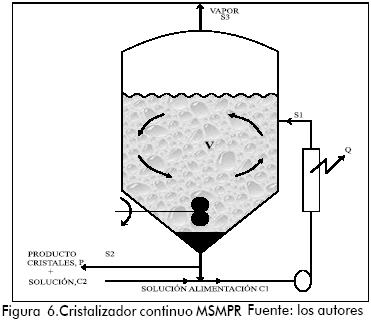
Suspensión mezclada con remoción de producto mezclado (MSMPR)
Balance de masa.
Teniendo presentes los métodos para producir la sobresaturación necesaria en los procesos de cristalización, se ha optado por un solo tipo de equipo: por evaporación.
Los balances de masa para soluto y solvente, aplicados al esquema, toman la forma:
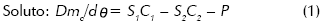
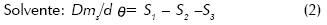
Mc y Ms son las masas de soluto y solvente en el equipo; C1 es la concentración de la alimentación y C2 la concentración de saturación a la salida; S1 y S2 son los flujos másicos de solvente de entrada y salida; S3 es el flujo másico de vapor; P es la producción de cristales.
Considerando estado estacionario:


Definiendo las variables Mt, masa de cristales por unidad de volumen de suspensión; Q2, el flujo volumétrico de suspensión en la descarga y e la fracción de volumen de solución a volumen de suspensión, se tiene,


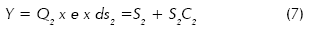
Siendo dc la densidad de los cristales y ds la de solución:
Si se define a como la razón del solvente evaporado respecto al solvente alimentado, S3/S1, y empleando las relaciones para Mt y e, se llega a:
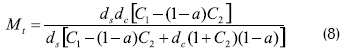
Esta ecuación puede resolverse para una temperatura de operación dada y una razón de evaporación conveniente. Las variables C2 y ds pueden expresarse en función de la temperatura:
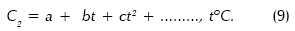
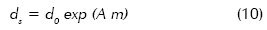
d0, la densidad del agua pura, y el parámetro A son funciones polinomiales de t:
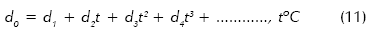
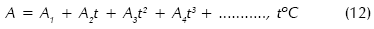
Y m es la fracción de peso en soluto:

Balance de energía:
Involucra cambios de calor sensible de la solución para alcanzar la temperatura de operación especificada y los calores latentes de cristalización y evaporación (Mc Cabe, 1981).
Considerando un estado estacionario, el calor suministrado a un equipo de evaporación es:
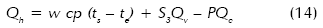
Donde w es el flujo másico de solución, Cp su calor específico, te y ts son las temperaturas de entrada y salida del equipo, Qc es el calor de cristalización y Qv el calor de vaporización, ambos por unidad de masa.
Balance de población:
Los balances de masa y energía no dan información sobre la distribución del tamaño de los cristales (DTC), importante característica que debe considerarse en el diseño de un cristalizador. Durante la cristalización se forman continuamente cristales con su consiguiente crecimiento, estableciéndose una distribución de partículas de diferentes tamaños y edades, la cual depende directamente de las velocidades de nucleación y crecimiento. Como se anotó en el capítulo anterior, la DTC puede lograrse mediante el uso del concepto de balance de población (Perry, 1992).
Para esta distribución, la masa total de cristales por unidad de volumen de suspensión Mt se obtiene como:
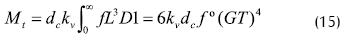
donde, kv es un factor de forma volumétrico y la fracción acumulativa de masa de cristales de tamaño menor o igual a L:
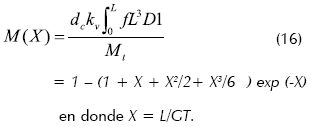
La función de retención M’(X) = 1 – M(X) representa la fracción másica de cristales retenidos a un cierto tamaño especificado L. Esta función, junto con los balances mencionados y la cinética del proceso, ayuda a establecer el método de diseño.
La distribución de la fracción de cristales en la suspensión para cada tamaño L es:
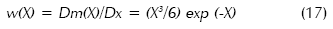
El máximo de la curva w(X) versus X corresponde al tamaño dominante o moda de la función:
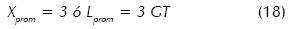
De los modelos ingenieriles, las velocidades de nucleación y crecimiento tienen las expresiones:

En donde kn se puede estimar con la relación:
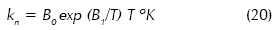
Dividiendo la ecuación (20) por G y teniendo presente que B/G representa la densidad de población de núcleos, fº, se reemplaza en la ecuación (15) y se obtiene:
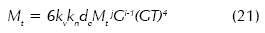
Despejando G:
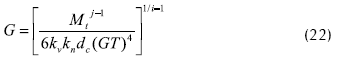
Esta última ecuación puede resolverse una vez conocida la temperatura de operación y el término GT, el cual se determina por iteración de la ecuación (16) para M’(X), dada las características del tamaño del producto.
Diseño.
Teniendo en cuenta lo anterior, se ha planteado una rutina de diseño de un cristalizador por evaporación y es la siguiente:
- Una de las variables más importantes para el diseño de cristalizadores es la temperatura de operación. Se utiliza como criterio de optimización minimizar el volumen del equipo, a una temperatura de operación comprendida en un intervalo que permita hacer mínima la formación de incrustaciones en las paredes del equipo. El criterio de selección para equipos de evaporación es minimizar la evaporación del solvente.
- Elegida la temperatura de operación se calcula:
* Densidades de las soluciones de alimentación y descarga mediante la ecuación (10), expresada en Kg/m3.
* Concentración de saturación en la descarga, C2, expresada en kg de soluto/kg de solvente, con la ecuación (9).
- Variables independientes de la temperatura:
* Densidad de los cristales puros, dc en gr/cm3.
* Factor de forma kv.
* Exponentes cinéticos i y j.
* Razón de solvente evaporado a solvente alimentado, a.
- Con la información anterior se calcula la densidad de la suspensión Mt, con la ecuación (8), el flujo volumétrico de suspensión, Q2 con ecuación (7); y la fracción de volumen de solución, e con ecuación (6).
- A partir de datos sobre las características exigidas al producto, como es el caso de la función de retención M’(X) hasta un cierto tamaño L, se resuelve la ecuación (16) por iteración para X y como L es un dato, se calcula GT como:

- De la ecuación (23) se determina G y con este valor se obtiene el tiempo medio de residencia y el volumen de suspensión:
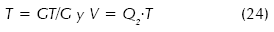
- Como primera aproximación, se puede suponer que el diámetro del equipo sea similar a la altura del nivel, así:
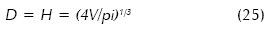
Los valores obtenidos del volumen y condiciones de operación deben considerarse solo como una guía cualitativa preliminar. El diseño industrial se basa en experimentos de laboratorio y planta piloto, utilizando datos cinéticos medidos en el intervalo deseado de sobresaturación, considerando las impurezas del sistema y la conFiguración real del proceso. Solo así se logrará un escalamiento de cierta confiabilidad.
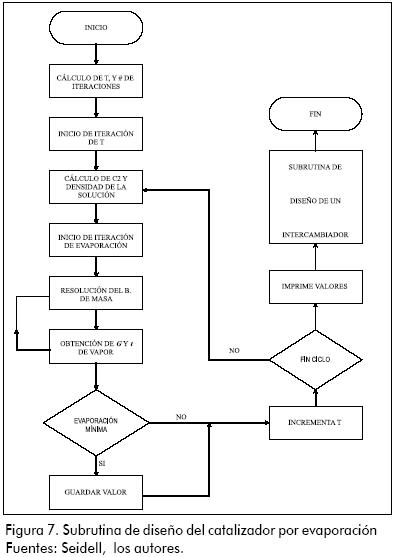
En la Figura 7 se observa la rutina planteada para el diseño preliminar de un cristalizador de evaporación.
Conclusiones
Experimentalmente se alcanzaron porcentajes cercanos al 90% de recuperación de NaCl, con una pureza del 97%, siendo esta afectada por la impregnación de los cristales con licor madre en el momento de su separación.
Un proceso viable de cristalización se debe realizar entre un 90% y 98% de agua evaporada, obteniéndose concentraciones de NaCl en el efluente final del orden de 0 – 1.060 Kg de NaCl/kg de solución.
Los altos requerimientos energéticos para evaporar el porcentaje de agua conducen al diseño preliminar de una unidad de calentamiento continuo, basada en los principios de transferencia de calor por radiación.
Bibliografía
Asarsson, Gunnar, Equlibria in aqueous systems containing K+, Na+, Ca+2, Mg+2 y Cl-, Part I, The ternary system CaCl2, KCl, NaCl, H2O., en Journal American Chemistry Society, 72, pp. 1.433-1.438, abril, 1950. [ Links ]
Asarsson, G., Equlibria in aqueous systems containing K+, Na+, Ca+2, Mg+2 y Cl-, Part II, The cuaternary system CaCl2, KCl, NaCl, H2O, Journal American Chemistry Society, 72, pp. 1.439-1.441, april, 1950. [ Links ]
Sholkovitz, E. R., The flocculation of iron, aluminum and humates from river water by electrolytes., en Geochimica et cosmochimica acta, 40, pp. 847-848,1981. [ Links ]
Seidell., Solubilities inorganic and metal-organic compounds, Amsterdam, Editorial Van Nostrand,1965. [ Links ]
Avellaneda, A., Petróleo e impacto ambiental en Colombia., en revista Universidad Nacional, 6, 24, 1960. [ Links ]
Carvajal, Cinthia., Cristalización desde soluciones., Contribuciones científicas y tecnológicas, No. 12, 1986. [ Links ]
Fitch, Bryant., How to design fractional crystallization processes., Industrial and engineering chemistryl, 62, 12, 1970 [ Links ]
Mc Cabe., Operaciones básicas de ingeniería química., Vol. I y II, Barcelona, Editorial Reverté S.A., 1981. [ Links ]
Merck, Métodos complexométricos de valoración con titriplex., Darmstad, reactivos Merck, tercera edición, 1990. [ Links ]
Meyer, Ted, Equilibria in satured salt solutions V. The quinar system CaCl2, MgCl2, KCl, NaCl, H2O a 35ºC., en Journal American Chemistry Society, 71, pp. 1.236-1.237, 1949. [ Links ]
Perry, R., Manual del ingeniero químico., Vols. I y II, Mc Graw-Hill, sexta edición, 1992. [ Links ]
Slater, V., Aqueous solution and the phase diagram., Londres, Editorial Edward Arnold, pp. 63-130, 1989. [ Links ]














