Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ingeniería e Investigación
versão impressa ISSN 0120-5609
Ing. Investig. v.26 n.2 Bogotá maj./ago. 2006
Álvaro Orjuela Londoño,1 Fernando Leiva Lenis,2 Luis Alejandro Boyacá Mendivelso,3 Gerardo Rodríguez Niño,4 Luis María Carballo Suárez5
1 Ingeniero químico, M.Sc. Profesor de la Universidad Nacional de Colombia, Bogotá, Departamento de Ingeniería Química. aorjuelal@unal.edu.co
2 Ingeniero químico, M.Sc. Ingeniero de Procesos, Andercol S.A. Medellín, Colombia. feleiva@hotmail.com
3 Ingeniero químico, M.Sc. Profesor de la Universidad Nacional de Colombia, Bogotá, Departamento de Ingeniería Química. laboyacam@unal.edu.co
4 Ingeniero químico, M.Sc., Ph. D. Profesor de la Universidad Nacional de Colombia, Bogotá, Departamento de Ingeniería Química. grodriguezn@unal.edu.co
5 Ingeniero químico, M.Sc., Ph. D. Profesor de la Universidad Nacional de Colombia, Bogotá, Departamento de Ingeniería Química. lmcarballos@unal.edu.co
RESUMEN
En este trabajo se adelantó un estudio de la reacción de esterificación de ácido acético y n-butanol en fase líquida (Patm = 0,76 Bar), utilizando unas resinas de intercambio catiónico (Lewatit K-2431) como catalizador. Se estableció la ausencia de efectos de transferencia de masa dentro y fuera de las partículas de catalizador en las condiciones estudiadas. Se efectuaron ensayos para determinar la influencia de la carga del catalizador (0.5 %, 1%, 2% p/p), la temperatura (73°C, 80°C, 87°C) y la relación molar de alimentación (ácido/alcohol 1:2, 1:1, 2:1) sobre la velocidad de la reacción, y se obtuvieron dos expresiones cinéticas del tipo LHHW y seudohomogéneo que representa adecuadamente los datos experimentales.
Palabras clave: resinas de intercambio, esterificación, acetato de butilo, cinética
ABSTRACT
This work was aimed at studying liquid-phase acetic acid and butyl alcohol esterification reaction (Patm=0.76 Bar), using an ion exchange resin (Lewatit K-2431) as catalyst. The effect of the absence of internal and external mass transport on catalyst particles was established in the research conditions used here. A set of assays to determine the effect of catalyst load (0.5%, 1%, 2% w/w) temperature (73°C, 80°C, 87°C) and molar ratio (1:2, 1:1, 2:1 acid/alcohol) on reaction rate was carried out and both LHHW and pseudo-homogeneous kinetic expressions were obtained, these being in good agreement with the experimental data.
Keywords: ion exchange resins, esterification, butyl acetate, kinetics
Recibido: febrero 3 de 2005
Aceptado: septiembre 26 de 2005
Introducción
La producción de ésteres orgánicos es bien conocida desde hace tiempo y ha sido objeto de diversas investigaciones debido a su gran importancia en el ámbito industrial por su uso como materia prima para diversos procesos (Groggins, 1953; Peterson, 1956; Sánchez, 1996), y también como método para el tratamiento de aguas residuales provenientes de plantas de procesamiento con alto contenido de ácido (producción de acetatos de celulosa, acetilación, destilación de madera, fermentación, etc.) (Bianchi et al., 2003; Cardona et al., 2004; Saha et al., 2000). En general, la producción de acetato de butilo se realiza por esterificación directa de ácido acético y butanol en fase líquida, a temperatura de ebullición de la mezcla y en presencia de catalizadores ácidos homogéneos (Oleum, H2SO4, ácido p-Toluen-sulfónico) o heterogéneos (resinas de intercambio, zeolitas, óxidos metálicos, etc.). La reacción de esterificación es reversible y termodinámicamente factible, y no presenta efectos térmicos muy marcados (Orjuela, A.., et al., 2003, 2004, 2005).
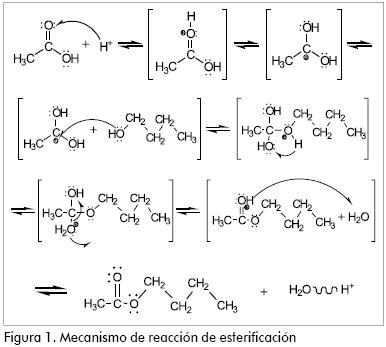
El mecanismo de reacción (Figura 1) indica que la activación se da por protólisis del ácido carboxílico acelerada por el catalizador. Por este hecho, la velocidad de la reacción depende principalmente del impedimento estérico entre el alcohol y el ácido (a medida que este aumenta, disminuye la velocidad y el rendimiento en la formación del éster), y la fuerza ácida del ácido carboxílico desempeña un papel secundario (Groggins, 1953; Sánchez, 1996).
En los procesos industriales convencionales ha ganado terreno el uso de catalizadores heterogéneos, debido a su menor efecto corrosivo sobre los equipos, facilidad de recuperación del medio de reacción, disminución en los costos de purificación de los productos, facilidad de almacenamiento, su reutilización en varios ciclos de operación y, en algunos casos, aumentos de selectividad y conversión al producto de interés.
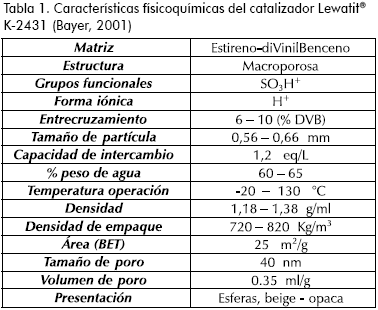
Debido a la importancia de la esterificación, el estudio del proceso y el uso de catalizadores ha sido ampliamente reportado en la literatura para diversos sistemas (Altiokka, 2003; Lee et al., 2000, 2002; Lilja et al., 2002; Mazzotti et al., 1997; Song et al., 1998; Xu, 1996; Yadav, 2000; Yu et al., 2004), y específicamente en la producción de acetato de butilo (Bianchi et al., 2003; Orjuela et al., 2004; Lee et al., 2000; Al-Saadi, 1981; Chu et al., 2004; Dhanuka et al., 1977; Gangadwala et al. 2003; Liu, 2002; Steinigeweg, 2002). Entre los catalizadores heterogéneos más utilizados se encuentran las resinas de intercambio, sólidos poliméricos sulfonados conformados por matrices entrecruzadas de estireno y diVinilBenceno. En un trabajo anterior se evaluaron diversos catalizadores (Orjuela, 2003, 2004, 2005) y se estableció que la resina Bayer® Lewatit® K-2431 es apropiada para promover la reacción. Las características de este sólido se reportan en la Tabla 1.
Una de las principales limitantes que caracteriza a los sistemas de esterificación está asociada con la reversibilidad de la reacción y sus restricciones en cuanto a conversión debidas al equilibrio químico. Como respuesta a estas dificultades se han generado alternativas de proceso, entre las que se destaca principalmente la destilación reactiva o catalítica (DR), tecnología que reúne simultáneamente y en una sola unidad, la reacción química y la separación. Esta brinda la posibilidad de obtener conversiones muy superiores a las del equilibrio, a través de la remoción selectiva de los productos de la reacción, al mismo tiempo que mayores selectividades al producto de interés.
A pesar de que el reconocimiento de la destilación reactiva como una operación prometedora se había establecido para los años veinte, no fue sino hasta los años ochenta que se demostraron sus bondades, con la implementación de una planta de proceso para producción de acetato de metilo por la compañía Eastman (Agreda et al., 1990). Los avances en algunos procesos vía DR son dramáticos, y reacciones tales como la eterificación, esterificación, hidrólisis, acetalización, hidratación, alquilación, etc., son susceptibles de adelantarse en este tipo de unidades. Este mismo hecho ha dirigido el interés hacia la investigación en áreas como la cinética de las reacciones, el equilibrio de fases, los fenómenos de transporte, la catálisis heterogénea, etc., con el fin de construir las bases y herramientas necesarias para el desarrollo de modelos computacionales útiles en el diseño de este tipo de unidades (Gangadwala et al., 2004; Giessler et al., 1999; Hanika et al.,1999; Smejkal, 2002; Venimadhavan et al., 1999; Wang et al., 2003; Zhicai et al., 1998).
Uno de los primeros intentos referenciados para determinar la cinética de esterificación de ácido acético y butanol la presentan Leyes y Othmer, 1945. En su expresión de ley de potencias se describe un modelo para reacciones catalizadas por H2SO4 con grandes excesos de alcohol:


W es la concentración de catalizador (% peso), y las concentraciones C del ácido y el butanol están dadas en base molar.
Venimadhavan (1999), reinterpretó los datos de Leyes y desarrolló un modelo cuasihomogéneo:
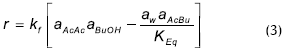
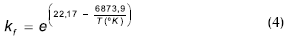
En donde r es la velocidad de reacción por mol de mezcla y kf tiene unidades de 1/h; la constante de equilibrio KEq es igual a 12,57, y la energía de activación de Ea = 57,15 kJ/mol. Este modelo utiliza la ecuación de Uniquac para la determinación de los coeficientes de actividad a.
Dhanuka presentó un modelo homogéneo más generalizado que el de Leyes en la reacción catalizada por H2SO4
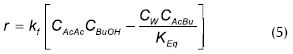

La velocidad de reacción en este modelo se presenta en unidades de mol/h. La constante de reacción tiene unidades de L/mol h, y la constante de equilibrio tiene un valor de 2,7. Los parámetros de la constante cinética de reacción son α = 3,18e-3 y β = 32,55. Tanto la concentración del catalizador, como la de los reactivos y productos, es molar.
Al-saadi, (1981), presentó un modelo similar, pero la expresión para la constante de reacción depende de la concentración del agua y del ácido sulfúrico.
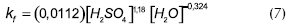
En esta expresión kf se encuentra en unidades de L/mol min, la velocidad se expresa en mol/min y la constante de equilibrio varía respecto de la concentración del catalizador, con valores entre 16–28.
Liu (2001, 2002), realizó un estudio de la esterificación acoplada a la perevaporación, utilizando como catalizador Zr(SO4)⋅4H2O. La cinética de reacción se describe por un modelo homogéneo:
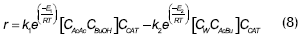
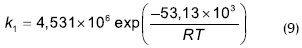
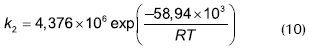
Las concentraciones son molares, las constantes de reacción en (mol x L x h)-1. La energía de activación se presenta en j/mol.
Steinigeweg (2002), utilizó un modelo seudohomogéneo para representar la esterificación utilizando amberlyst 15 como catalizador.
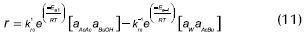
La expresión de reacción se presenta en mol/s. kf01 = 6,1084e4, kf0-1 = 9,8420e4, Ea1 = 56,67 kj/mol, Ea-1 = 67,66 kJ/mol, donde kf0-1 hace referencia a constante cinética de la reacción inversa (hidrólisis). Para el cálculo de las actividades se utiliza la ecuación de Uniquac.
Wasylkiewicz (2000), analizó el sistema no reactivo y obtiene una expresión para el cálculo de la constante de equilibrio utilizando la ecuación de Uniquac.

Löning (200), presentó un modelo de Eley-Rideal con catalizador amberlyst 15.


Donde Kfo es 32 mmol/eq-s (cinética de reacción basada en el número de sitios activos), kW = 1,4 y kAcAc = 9. La velocidad de reacción se expresa como mol/eq-s.
Gangadwala (2003), estudió la reacción usando diferentes resinas de intercambio como catalizadores y seleccionó amberlyst 15, ajustó los datos experimentales con cuatro modelos cinéticos teóricos y empíricos (seudohomogéneo, Eley-Rideal, LHHW, LHHW modificado), logrando buenos ajustes con cada uno de ellos, y presentando la siguiente expresión como la más adecuada:
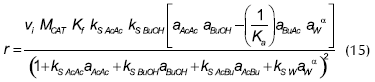
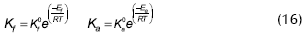
La expresión de reacción se presenta en Kmol/s, Kf0 = 14,0093x106, Ka0 = 3,8207x106, Ef = 72896 kJ/mol, Ea = -3581,7 kJ/mol, kS AcAc = 4,4521, kS BuOH = 6,9211, kS AcBu = 3,5995, kS W = 9,0304 y α = 3. Para el cálculo de las actividades se utilizó la ecuación Uniquac.
Con el propósito de obtener información útil en el modelamiento de operaciones de DR, el presente trabajo se centró en el estudio, a escala de laboratorio, de la influencia de las condiciones de reacción (relación molar de alimentación de reactantes, temperatura y concentración de catalizador) en la síntesis de acetato de n-butilo a presión de 0,76 Bar en fase líquida, utilizando la resina Bayer® Lewatit® K-2431 como catalizador. Dicho estudio permitió obtener una expresión cinética que representa de forma adecuada los datos experimentales.
Metodología
Los reactivos utilizados fueron obtenidos de Merck® y su pureza fue confirmada por cromatografía de gases (ácido acético 99,9%, n-butanol 99,5%, acetato de n-butilo 99,6% y agua desionizada). Previo a la utilización el catalizador se sometió a lavados con etanol anhidro para retirar el agua presente, se secó a 80°C durante 24 h, y luego a vacío a 100°C por 12 h, para posteriormente almacenarlo en un recipiente hermético, dentro de un desecador. Para confirmar su actividad, se determinó la capacidad de intercambio con el procedimiento descrito en la literatura (Orjuela, 2003).
Para la evaluación en reacción se utilizó un reactor de vidrio de 500 mL con chaqueta, al que se adaptó un sistema de agitación con velocidad controlada, un condensador para operación a reflujo total, un termómetro y una toma de muestras para seguimiento de la esterificación. El control de temperatura se mantuvo por medio de un baño de recirculación con aceite térmico (Julabo 4®, Julabo Labortechnik GMBH), el cual mantenía el valor de temperatura constante en un intervalo de ±0.1°C.
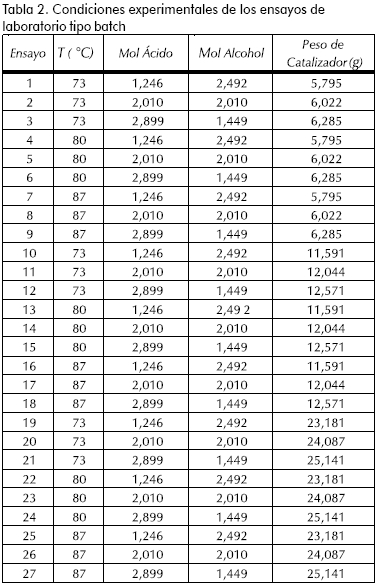
Las condiciones de operación para evaluar el efecto de las variables de reacción correspondieron a: relación molar inicial de reactivos ácido/alcohol 1:2, 1:1 y 2:1; temperatura de reacción 73°C, 80°C, 87°C; carga de catalizador correspondiente, en equivalentes ácidos, a 0,5%, 1%, y 2% p/p de H2SO4. Para determinar la incidencia de los efectos difusivos tanto internos como externos en el catalizador, se realizaron ensayos con diferentes tamaños de partícula y velocidades de agitación.
En cada ensayo, el reactor se cargó con el catalizador previamente seco y pesado, y la cantidad requerida de ácido; en otro recipiente se colocó el alcohol necesario, y se adecuaron a la temperatura de reacción estabilizando por 1 hora. Posteriormente se mezclaron los reactivos y se empezó a tomar el tiempo. El volumen total de reacción fue de 300 mL. Periódicamente se tomaron muestras de 0,5 mL del reactor a intervalos que se incrementaban con el paso del tiempo (minuto 1, luego cada 20 minutos y cada hora hacia el final). El ensayo era detenido cuando la variación en la conversión entre tres muestras consecutivas no superara el 2%, lo que ocurría entre 5 y 8 horas. Para el seguimiento y caracterización de las muestras de reacción se utilizó un cromatógrafo de gases HP 5890A equipado con detector de conductividad térmica, y utilizando una columna empacada de Poropak Q en las condiciones descritas en estudios anteriores (Orjuela, 2003, 2005).
Resultados y discusión
La capacidad de intercambio medida al catalizador seco fue de 4,57 Eq/kg, lo que es característico para resinas fuertemente ácidas. Este valor se tomó como referencia para calcular los equivalentes ácidos, correspondientes a los porcentajes en peso de H2SO4 utilizados en los ensayos posteriores.
Para determinar la incidencia de los efectos difusivos en el catalizador, sobre la velocidad intrínseca de reacción, se desarrollaron ensayos preliminares variando la velocidad de agitación (afectaría la velocidad de transferencia de masa externa), y el tamaño de partícula del catalizador (afectaría la velocidad de transferencia de masa intrapartícula). Estos efectos se estudiaron en condiciones similares a las reportadas en la literatura (Yadav, 2000; Gangadwala et al., 2003; Teo, 2004). La Figura 2 muestra cómo por encima de 200 rpm la velocidad de reacción es independiente del nivel de agitación.
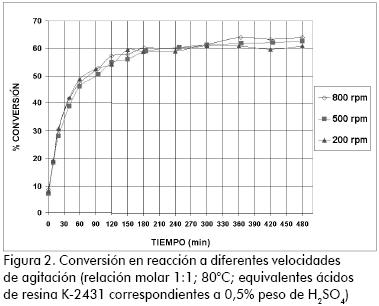
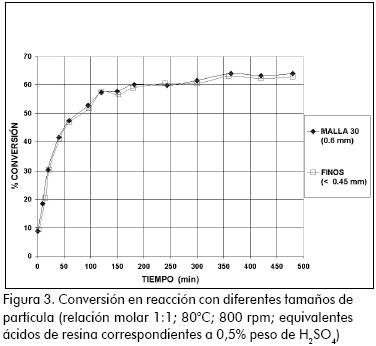
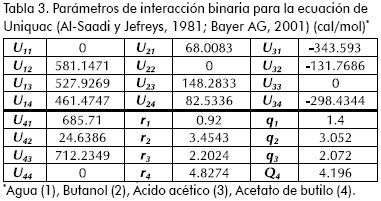
Para garantizar la ausencia de fenómenos externos, los ensayos posteriores se realizaron con una velocidad de 800 rpm. Para analizar los fenómenos difusivos intrapartícula se realizó un tamizado a la resina (mallas 20, 30 y 40) y se evaluaron en reacción las fracciones correspondientes a lo retenido en malla 30 (≥ 600 µ m) y lo que sobrepasaba la malla 40 (< 450 µ m). En la Figura 3 se observa que no existe efecto notorio del tamaño de partícula utilizado sobre la velocidad, ni el avance de la reacción. Este hecho puede ser atribuido al hinchamiento de la estructura del polímero, lo que facilita el acceso y la movilidad de los reactivos a los sitios activos. (Lilja et al., 2002; Yu et al., 2004; Gangadwala et al., 2003; Bayer AG., 2001; Teo, 2004)
Los procedimientos utilizados para la determinación de parámetros cinéticos a partir de información experimental de reacción (las condiciones de operación de los ensayos se reportan en la Tabla 2), corresponden generalmente a métodos de regresión y ajuste de datos, a modelos de reacción catalítica reportados en la literatura.
En el presente trabajo se utilizó una estrategia de regresión nolineal, a través del método de los mínimos cuadrados (implementada sobre Excel®), utilizando como función objetivo la diferencia entre las concentraciones de la fase líquida de reacción xEXP (en el laboratorio se caracterizaron alícuotas de la fase líquida sobrenadante) y las obtenidas por integración en el tiempo para el modelo evaluado xMODEL.
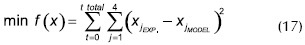
Para obtener los datos a través del modelo cinético a evaluar se integró la expresión de la velocidad de reacción r (mol/min), por medio de un método numérico de diferencias finitas hacia delante.
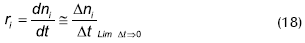


Las expresiones cinéticas evaluadas corresponden a modelos no ideales
- Seudohomogéneo con solución noideal (Q-HNIDS)
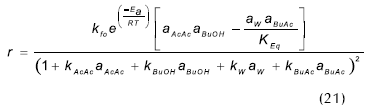
- Langmuir – Hinshelwood – Hougen – Watson (LHHW)
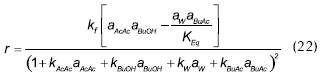
En estos modelos se considera que la etapa controlante es la reacción química entre especies adsorbidas. Este hecho ha sido ampliamente reportado para diversos sistemas reactivos (Altiokka, 2003; Lee et al., 2000, 2002; Lilja et al., 2002; Mazzotti, et al., 1997, Yadav, 2000; Löning et al., 2000; Teo, 2004), y además en un trabajo previo (Orjuela, 2005) se corroboró que en el sistema en estudio (síntesis de acetato de butilo) el equilibrio de adsorción se alcanzaba en tiempos no mayores a 20 minutos, mientras el equilibrio químico se obtenía con 5 u 8 horas de operación.
Debido a la presencia del catalizador heterogéneo, en las expresiones cinéticas se consideró la concentración de sitios ácidos por mol total de mezcla reactiva (eq H+ / mol mezcla) en la constante de reacción.
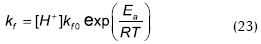
En la integración de los modelos se utilizó un diferencial de tiempo de 1 minuto (cada ensayo oscilaba entre 480 - 520 min.), y el valor de las actividades de cada componente en la mezcla (sistema altamente no-ideal Bevia et al., 1984; Esquivel, 1990) se calcularon a través del modelo Unicuaq (Venimadhavan et al., 1999; ver Tabla 3). Para disminuir el error generado en el ajuste de los parámetros se redujo su número utilizando la expresión para evaluar la constante de equilibrio químico obtenida en una etapa anterior de esta investigación (Orjuela, 2005).
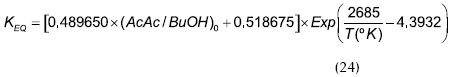
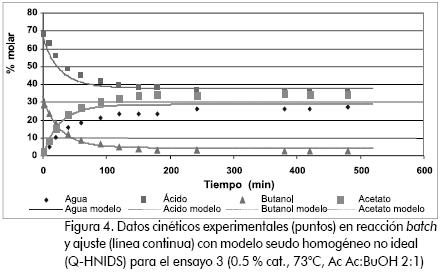
En un ensayo preliminar se desarrolló el ajuste de los datos a un modelo seudohomogéneo, sin la consideración de los fenómenos de adsorción sobre el catalizador. En la Figura 4 se muestra un resultado típico de este ajuste del modelo y se observa que aunque los perfiles de ácido acético y butanol corresponden con los experimentales, las curvas que representan la concentración molar del acetato y el agua se superponen y no coinciden con los datos evaluados en el laboratorio. Tomando en cuenta la estequiometría de la reacción (no hay variación de las moles totales del sistema y hay equimolaridad en los productos), la concentración del agua y el éster deberían ser iguales en todo el intervalo de tiempo. En todos los ensayos experimentales se observó que la concentración molar del acetato en la fase líquida era mayor que la del agua, indicando que dentro del reactor se presentó una adsorción selectiva de agua por parte de la resina, empobreciendo la fase líquida respecto del éster, confirmando lo reportado anteriormente (Orjuela, 2005).
Debido a la dificultad de generar los parámetros asociados a la adsorción de los componentes sobre el catalizador heterogéneo (sistema altamente no ideal), a través de procedimientos experimentales o modelos teóricos simples (Orjuela, 2005) este fenómeno se incorporó dentro del modelo cinético (tanto cuasi homogéneo como LHHW), como una constante de adsorción, interpretada como coeficiente de reparto o de distribución molar entre las fases líquida y polimérica, para cada uno de los componentes.

Donde niS corresponde a las moles del componente i en la fase polimérica (adsorbido en la superficie y absorbido en la matriz del sólido), niL son las moles del componente i en la fase líquida y ki representa el coeficiente de distribución del componente i entre las dos fases. Este último es una medida de la adsorción de los componentes en el catalizador. Para poder realizar la integración del modelo cinético con estas consideraciones, se supuso que la reacción ocurría a las condiciones del líquido adsorbido dentro del catalizador y en contacto con los sitios activos, por lo que fue necesario calcular en cada etapa de la integración las composiciones tanto en el líquido sobrenadante como dentro de la resina.
Este procedimiento se efectuó realizando balances molares sobre el sistema en su totalidad y en cada fase por separado:

Donde ni corresponde a las moles totales del componente i en el sistema reactivo (ecuación 20). Dividiendo la ecuación 26 por niL y reemplazando ki de la ecuación 25:


Los valores de las concentraciones molares en el sólido para determinar las actividades se calcularon con la siguiente expresión:

De igual forma se calcularon las composiciones en la fase líquida para realizar la comparación y el ajuste del modelo con los datos experimentales.

Además de las cuatro constantes de distribución, los modelos propuestos requieren el cálculo del factor pre-exponencial kf0, y el cambio de energía de la reacción Ea.
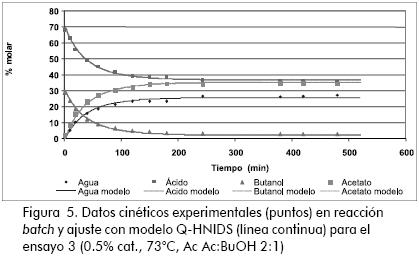
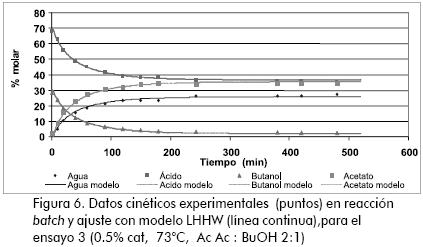
En las figuras 5 y 6 se muestra el ajuste de los modelos cinéticos, para algunos ensayos típicos, donde se puede observar la buena correspondencia entre los modelos evaluados y los datos obtenidos experimentalmente. En la Tabla 4 se resumen los parámetros que ajustan las expresiones cinéticas seudo homogéneas (ecuación 21) y LHHW (ecuación 22) a los datos experimentales.
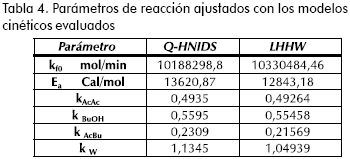
Al comparar los valores correspondientes al cambio de energía de la reacción se encuentra datos muy similares respecto de los publicados por otros autores (Gangadwala et al., 2003; Steinigeweg, 2002; Venimadhavan et al., 1999), como se presentó anteriormente. Por otra parte, el orden de magnitud de las constantes de distribución corresponde con el reconocimiento que se ha realizado anteriormente sobre la adsorción preferencial (ensayos de hinchamientro) de agua por parte de la resina, y la escasa afinidad por el éster (Orjuela, 2005).
Conclusiones y resultados
En el presente trabajo se desarrolló una revisión sobre los modelos utilizados para representar la cinética de reacción de síntesis de acetato de butilo.
Se desarrolló un estudio experimental de la reacción utilizando la resina Bayer Lewatit K-2431 como catalizador, y se pudo establecer la ausencia de efectos difusivos y de transporte tanto al exterior como al interior de las partículas sólidas. Por medio del ajuste de los datos experimentales de reacción, con modelos cinéticos no ideales (representación de los componentes a través de sus actividades calculadas con la ecuación de Uniquac) se corroboró la necesidad de incorporar los parámetros de adsorción dentro de los modelos de ajuste.
Finalmente, se obtuvieron dos expresiones cinéticas semiempíricas que se ajustan adecuadamente con los datos obtenidos a nivel de laboratorio, útil para su introducción en modelos computacionales dirigidos a la simulación de operaciones de destilación reactiva. Los parámetros calculados concuerdan con lo esperado según la naturaleza del sistema y con lo reportado por otros autores.
Agradecimientos
Este trabajo fue posible gracias a la colaboración de Colciencias y la Universidad Nacional de Colombia, quienes financiaron la investigación bajo el proyecto Ref: 1101-05-035-99
Bibliografía
Agreda, V., Partin L., y Hebe, W., High-Purity Methyl Acetate via Reactive Distillation., Chem. Eng. Prog., Vol 86, 1990, pp. 40-46. [ Links ]
Al-Saadi, A., y Jefreys, G., Esterification of butanol in a two-phase liquid/liquid system., AIChE Journal, 27, 1981, pp. 754 - 773. [ Links ]
Altiokka, M., y Çýtak, A., Kinetics study of esterification of acetic acid with isobutanol in the presence of amberlite catalyst., Applied Catalysis A: General, 239, 2003, pp. 141-148. [ Links ]
Bayer AG., Bayer Catalyst K 2431, Product Information, Leverkusen – Germany, 2001. [ Links ]
Bayer AG., Catalysis and chemical processing with Lewatit®., Technical Information, Leverkusen – Germany, 2001. [ Links ]
Bevia, F., Prast, D., Gomis, V., y Varo, P., Quaternary liquid-liquid equilibrium: water – acetic acid – butanol – n-butyacetate at 25 °C., Fluid Phase Equilibria, 18, 1984, pp. 171-183. [ Links ]
Bianchi, C., Ragaini, V., Pirola, C., y Carvoli, G., A new method to clean industrial water from acetic acid via esterification., Applied Catalysis B: Environmental, Vol 40, 2003, pp. 93 – 99. [ Links ]
Cardona, C., Marulanda, V., y Young, D., Analysis of the environmental impact of butylacetate process through the WAR algorithm,. Chem. Eng. Sci., Vol. 59, 2004, pp. 5839-5845. [ Links ]
Dhanuka, V., Malche, V., y Chandalia, B., Kinetics of liquid phase esterification of carboxylic acid with alcohols in the presence of acid catalysts., Chem. Eng. Sci., Vol 32, 1957, pp. 551-556. [ Links ]
Chu, W., Hu, J., Xie, Z., y Chen Q., Design and Elaboration of New Solid Acids for the Synthesis of Butylacetate., Catalysis Today, 90, 2004, pp. 349 – 353. [ Links ]
Esquivel, M., y Bernardo-Gil, M., Liquid-liquid equilibria for the systems water – alcohols - acetic acid., Fluid Phase Equilibria, 57, 1990, pp. 307-316. [ Links ]
Gangadwala, J., Mankar, S., y Mahajani, S., Esterification of Acetic Acid with Butanol in the presence of Ion-exchange resins as Catalysts., Ind. Eng. Chem. Res., Vol 42, 2003, pp. 2146-2155. [ Links ]
Gangadwala, J., Kienle, A., Stein, E., y Mahajani, S., Production of Butyl Acetate By Catalytic Distillation: Process Design Studies., Ind. Eng. Chem. Res., Vol 43, 2004, pp. 136-143. [ Links ]
Giessler, S., Danilov, R., Pisarenko, R., Serafimov, L., Hasebe, S., y Hashimoto, I., Feasible Separation Modes for Various Reactive Distillation Systems., Ind. Eng. Chem. Res., 38, 1999, pp. 4060-4067. [ Links ]
Groggins, P.H., Procesos de Industriales de Síntesis Orgánica., Ed Gustavo Gili, Barcelona, 1953. [ Links ]
Hanika, J., Kolena, J., y Smejkal, Q., Butylacetate via reactive distillation - modelling and experiment., Chem. Eng. Sci., Vol 54, 1999, pp. 5205-5209. [ Links ]
Lee, M., Wu, H., y Lin, H., Kinetics of Catalytic Esterification of Acetic Acid and Amyl Alcohol over Dowex., Ind. Eng. Chem. Res., Vol. 39, 2000, pp. 4094-4099. [ Links ]
Lee, M., Chiu, J., y Lin, H., Kinetics of Catalytic Esterification of Propionic Acid and n-Butanol over Amberlyst 35., Ind. Eng. Chem. Res., Vol 41, 2002, pp. 2882-2887. [ Links ]
Leyes, C., y Othmer, D., Continuous Esterification of Butanol and Acetic Acid, Kinetic and Distillation Considerations., Trans., Amer. Inst. Chem. Engrs., Vol 41, 1945, pp. 157-196. [ Links ]
Lilja, J., Aumo, J., Salmi. T., y Murzin, D., Kinetics of esterification of propanoic acid with methanol over a fibrous polymer-supported sulphonic acid catalyst., Applied Catalysis A: General, 228, 2002, pp. 253-267. [ Links ]
Liu, O., Zhang, Z., y Cheng, H., Study on the coupling of esterification with pervaporation., Journal of Membrane Science, 182, 2001, pp. 173 – 181. [ Links ]
Liu, O., y Chen, H., Modeling of esterification of acetic acid with n-butanol in the presence of Zr(SO4)2⋅4H2O coupled pervaporation., Journal of Membrane Science, 196, 2002, pp. 171 – 178.
Löning S., Horts, C., y Hoffmann, U., Theoretical Investigation on the quaternary system n-butanol, butyl acetate, acetic acid and water., Chem. Eng. Tech., Vol 23, No. 9, 2000, pp. 789-793. [ Links ]
Mazzotti, M., Neri, B., Gelosa, D., Kruglov, A., y Morbidelli, M., Kinetics of Liquid-Phase Esterification Catalyzed by Acidic Resins., Ind. Eng. Chem. Res., Vol 36, 1997, pp. 3-10. [ Links ]
Orjuela, A., Leiva, F., Rodríguez, G., Boyacá, A., y Carballo, L., Estudio de la Síntesis de Acetato de Butilo – 2. Análisis de las condiciones del equilibrio químico., Ingeniería e Investigación, Universidad Nacional de Colombia, Bogotá, Vol 25, No. 3, 2005, pp. 13-21. [ Links ]
Orjuela, A., Leiva, F., Rodríguez, G., Boyacá, A., y Carballo, L., Estudio de la Síntesis de Acetato de Butilo – 3. Análisis de adsorción sobre el catalizador., Ingeniería e Investigación, Universidad Nacional de Colombia, Bogotá, Vol. 26, No. 1, 2006, pp. 15-24. [ Links ]
Orjuela, A., Evaluación de un Sistema de Destilación Reactiva a Nivel de Planta Piloto en Reacciones de Esterificación., Proyecto de Grado, Maestría en Ingeniería Química, Universidad Nacional de Colombia, Bogotá, 2003. [ Links ]
Orjuela, A., Leiva, F., Rodríguez, G., Boyacá, A., y Carballo, L., Estudio de la Síntesis de Acetato de Butilo – 1. Selección del Catalizador., Ingeniería e Investigación, Universidad Nacional de Colombia, Bogotá, Vol. 24, 2004, pp. 50-60. [ Links ]
Peterson, M., y Way, J., Esterification., Ind. and Eng. Chem., Vol 48, 1956, pp. 1576-1584. [ Links ]
Saha, B., Chopade, S., y Mahajani, S., Recovery of dilute acetic acid through esterification in a reactive distillation column., Catalysis today, Vol 60, 1-2, 2000, pp. 147-157. [ Links ]
Sánchez, F., y Rodríguez, G., Esterificación., Ingeniería e Investigación, Universidad Nacional de Colombia, Bogotá, Vol. 9, 1996, pp. 87-94. [ Links ]
Smejkal, Q., y Soos, M., Comparison of computer simulation of reactive distillation using ASPEN PLUS and HYSYS software., Chem. Eng. and Proc., Vol 41, 2002, pp. 413-418. [ Links ]
Song, W., Venimadhavan, G., Manning, J., Malone, M., y Doherty, M., Measurement of Residue Curve Maps and Heterogeneous Kinetics in Methyl Acetate Synthesis., Ind. Eng. Chem. Res., Vol 37, 1998, pp. 1917-1928. [ Links ]
Steinigeweg, S., y Gmehling, J., n-Butyl Acetate Synthesis via Reactive Distillation: Thermodynamic Aspects, Reaction Kinetics, Pilot-Plant Experiments, and Simulation Studies., Ind. Eng. Chem. Res., 41, 2002, pp. 5483-5490. [ Links ]
Teo, H., y Saha, B., Heterogeneous catalyed esterification of acetic acid wiyh isoamyl alcohol: kinetic studies., Journal of Catalysis, 228, 2004, pp. 174 – 182. [ Links ]
Venimadhavan, G., Malone, M., y Doherty, M., A novel distillate policy for batch reactive distillation with application to the production of butyl acetate., Ind. Eng. Chem. Res., Vol 38, 1999, pp. 714-722. [ Links ]
Wang, S., Wong, D., y Lee, E., Control of a Reactive Distillation Column in the Kinetic Regime for the Synthesis of n-butyl Acetate., Ind. Eng. Chem. Res., Vol 42, 2003, pp. 5182-5194. [ Links ]
Wasylkiewicz, S., y Ung, S., Global phase stability analysis for heterogeneous reactive mixtures and calculation of reactive liquid-liquid and vapor-liquid-liquid equilibria., Fluid Phase Equilibria, 175, No. 1-2, 2000, pp. 253-272. [ Links ]
Xu, Z., y Chuang, K., Kinetics of Acetic Acid Esterification over Ion Exchange Catalysts., The Canadian Jour. of Chem. Eng., Vol 74, 1996, pp. 493-500. [ Links ]
Yadav, G. D., y Kulkarni, H. B., Ion-Exchange Resin Catalysis in the Sinthesis of Isopropyl Lactate., Reactive and Funct. Polymers, Vol 44, No.2, 2000, pp. 153 – 165. [ Links ]
Yu, W., Hidajat, K., y Ray, A., Determination of adsorption and kinetic parameters for methyl acetate esterification and hydrolysis reaction catalyzed by Amberlyst 15., Applied Catalysis A: General, 260, 2004, pp. 191-205. [ Links ]
Zhicai, Y., Xianbao, C., y Jing, G., Esterification-Distillation of Butanol and Acetic Acid., Chem. Eng. Sci., Vol 53, 1998, pp. 2081-2088. [ Links ]














