Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ingeniería e Investigación
versão impressa ISSN 0120-5609
Ing. Investig. v.27 n.2 Bogotá maio/ago. 2007
María Carolina Sáenz,1 Carlos Andrés Báez Quintero,2 José de Jesús Díaz Velásquez3 y Gerardo Rodríguez Niño4
1 Ingeniera química, Universidad Nacional de Colombia, Bogotá. carolina.saenz@gmail.com
2 Ingeniero químico, Universidad Nacional de Colombia, Bogotá. cabaezq@unal.edu.co
3 Ingeniero químico, M. Sc., Ph.D., en ingeniería. Profesor, Laboratorio de Investigación en Combustibles y Energía, Departamento de Química, Universidad Nacional de Colombia, Bogotá. jddiazv@unal.edu.co
4 Ingeniero químico. M.Sc., Ph.D. Profesor, Departamento de Ingeniería Química y Ambiental, Universidad Nacional de Colombia, Bogotá. grodriguezn@unal.edu.co
RESUMEN
En este artículo se presentan las condiciones de síntesis (temperatura de reacción, concentración de ácido sulfúrico y silicato de sodio) más adecuadas para la obtención de sílica gel adsorbente SGA, haciendo uso de materias primas elaboradas en Colombia. La obtención de este producto se lleva a cabo principalmente por una neutralización de ácido sulfúrico con silicato de sodio, variando la concentración de los reactivos y la temperatura de reacción; se determinó el efecto que tiene la interacción de estas variables sobre la capacidad de adsorción de humedad, encontrando que esta se favorece al combinar concentraciones de silicato bajas y temperaturas altas, o concentraciones de ácido altas y temperaturas altas, dentro de los intervalos estudiados. Por otro lado, se realizó una comparación detallada del producto obtenido frente a una sílica de referencia comercial (Gel de sílice granulare con indicatore – Grupo Montedison. Lote 1684G100. Código 453301) a través de curvas de adsorción, área B.E.T., difracción de rayos X, espectrometría de masa e infrarroja, así como resistencia mecánica; encontrándose que la SGA sintetizada en este trabajo posee mayor área superficial específica y menor resistencia mecánica que la comercial, además se vislumbró que las muestras evaluadas exponen bajo grado de ordenamiento molecular y la estructura química característica de la sílica gel.
Palabras clave: sílica gel, capacidad de adsorción, resistencia mecánica.
ABSTRACT
This article presents an appropriate set of reaction parameters (reaction temperature, sulphuric acid and sodium silicate reagent concentration) for obtaining adsorbent silica gel (ASG) using Colombian-produced raw materials. The core of ASG synthesis lies in sulphuric acid’s neutralisation reaction with sodium silicate. Their effect on final ASG moisture adsorption capacity was measured after changing such synthesis’ above–mentioned reaction parameters. Within the range of conditions studied, it was found that the highest adsorption capacity occurred by combining both low sodium silicate concentration with high temperatures or high sulphuric acid concentration and temperature. Synthesised ASG was also compared to a commercial product (Gel de sílice granulare con indicatore. Montedison group. Batch number 1684G100. Code number 453301) using adsorption capacity plots, BET areas, X–ray diffraction, mass and infrared spectrometry and mechanical strength measurements. Synthesised ASG presented larger specific surface areas but weaker mechanical strength than the commercial one. Likewise, all evaluated samples exhibited a low degree of molecular arrangement and conventional ASG chemical structure.
Keywords: silica gel, adsorption capacity, mechanical strength.
Recibido: diciembre 22 de 2006
Aceptado: junio 21de 2007
Introducción
La sílica gel adsorbente es una forma porosa del óxido de silicio, amorfa, traslúcida, granular, químicamente estable y no tóxica. Posee una excelente capacidad para la deshumidificación debido a su amplia área superficial y estructura hidrofílica. La SGA puede reutilizarse ya que se regenera, liberando la humedad adsorbida al calentarla a condiciones específicas (Ullmann, S., 1993).
El hombre ha planteado su interés por la sílica desde hace más de un siglo, estudiando condiciones, metodologías, materias primas, fenómenos, entre otros factores influyentes; sin embargo, países como Colombia han sido ajenos a este tipo de desarrollos y satisface su demanda interna con importaciones que en el año 2002 ascendieron a 667 toneladas, correspondientes a US$ 1,36 millones (Proexport, DANE).
El país produce ácido sulfúrico y silicato de sodio, materias primas aptas para la producción de sílica gel, por tanto surge la inquietud de avanzar hacia un desarrollo tecnológico que permita la producción de SGA cuyo fin sea suplir la demanda interna con producto nacional y generar excedentes de exportación.
Esta investigación se enfocó a estudiar la influencia que tienen la concentración de los reactivos (ácido sulfúrico y silicato de sodio) y la temperatura de reacción, sobre la capacidad de adsorción del producto final. El producto obtenido se caracterizó a través de curvas de adsorción, área B.E.T., difracción de rayos X, espectrometría de masas e infrarroja, así como resistencia mecánica, comparándolo con una sílica de referencia comercial.
Desarrollo experimental
Producción de sílica gel adsorbente
La síntesis de sílica gel adsorbente se realizó mediante la neutralización de ácido sulfúrico con silicato de sodio en un reactor agitado a 600 rpm, en el cual se deposita inicialmente la solución ácida para proveer un pH inferior a 7 durante la reacción (Iler, 1979), la adición de silicato se hizo de forma controlada a través de un infusor peristáltico, en esta etapa se cuenta con control de temperatura. En el estudio se evaluaron valores para la concentración de SiO2 en el silicato de 1,60-1,98 y 2,42-2,98M, concentración del ácido de 1,31 y 2,62M y temperaturas de reacción de 20ºC y 30ºC. El fin de la etapa de neutralización está determinado por la formación de un gel a pH entre 5 y 6, el cual se deja en reposo (etapa de maduración) de 120 a 150 minutos, posteriormente se retiran las sales formadas y el ácido remanente a través de un lavado con agua y por último se efectúan operaciones de secado (120ºC, 14 horas) y calcinación (300ºC, 5 horas).
Los valores de temperatura de secado, el tiempo y la temperatura de maduración se establecieron por estudios preliminares a esta investigación (Sáenz y Báez, 2005).
Análisis del gel intermedio
Sobre el gel obtenido luego de la etapa de lavado se efectúo un análisis termogravimétrico (TGA) y térmico diferencial (DTA) para analizar los efectos de las etapas de secado y calcinación. El TGA se practicó en un intervalo de 25 a 800ºC (en un equipo Universal V2.5H TA instrument), y el DTA en el mismo intervalo de temperatura (Universal V2.5H TA instrument) con rampa de 10°C/min (Daniels, 1974).
Curvas de adsorción (capacidad máxima de adsorción de la sílica gel adsorbente)
Con el propósito de determinar caracterización de los productos obtenidos y de la muestra de referencia comercial en cuanto a la propiedad de mayor interés, la capacidad de adsorción, en un ensayo gravimétrico se tomaron muestras de cada sílica, de tamaño uniforme en estado anhidro exponiéndose a la humedad del ambiente (65% HR y 20°C en promedio, condiciones de Bogotá D.C.), haciendo un seguimiento de la ganancia del peso (adsorción de humedad) en función del tiempo, hasta el equilibrio; es decir, la máxima capacidad de adsorción. De igual forma, se realizó un ensayo en una cámara de estabilidad: humedad y temperatura controlada, con condiciones de 80% HR y 37ºC.
Análisis estadístico
Mediante un análisis estadístico se correlacionó la máxima capacidad de adsorción con las variables estudiadas (concentración de los reactivos y temperatura de reacción). Estos datos se alimentaron al software SAS 8.0 y SPSS 10, y se analizaron las interacciones más influyentes.
Área superficial específica y resistencia mecánica
El área superficial se determinó por curvas de adsorción de nitrógeno a 72K, obteniendo el área B.E.T., (en un sortómetro Micrometrics Gemini III 2375). La resistencia mecánica se evaluó en una máquina universal de ensayos (modelo UH – 50A, Shimadzu Corporation), registrando la máxima carga que resiste una partícula antes del colapso.
Análisis estructural
Sobre el producto final y uno de referencia comercial se efectuaron análisis de difracción de rayos X (en un equipo Siemens D5000), con el propósito de vislumbrar el ordenamiento molecular de la sílica gel adsorbente, y espectroscopia infrarroja para determinar la estructura química del producto; este último en un espectrofotómetro de IR con transformada de Fourier (Paragon 500 serie 500, Perkin Elmer) con software Spectrum for Windows.
Composición química
La composición química de una de las sílicas elaboradas y una de referencia comercial se determinó en un espectrómetro de fluorescencia de rayos X (ARL 9800), y en otro espectrómetro de emisión óptica (Perkin Elmer ICP-OES Optima 3000).
Resultados y discusión
Seguimiento de la etapa de reacción
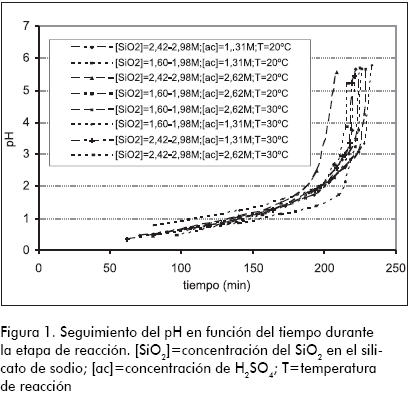
En la Figura 1 se encuentra el seguimiento del pH en función del tiempo durante la etapa de reacción. La finalización de la etapa de reacción (punto de gelación), se halla en un intervalo de pH entre 5,19 y 5,75, que según Iler (1979), provee una mayor área superficial y mayor volumen de poro.
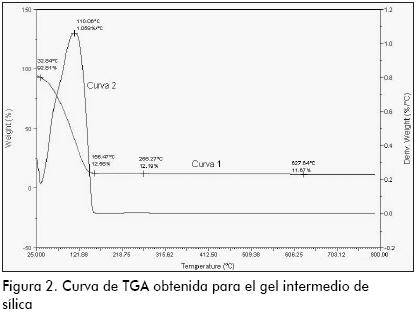
Pruebas de TGA y DTA sobre el gel intermedio
En la Figura 2 se presenta el análisis termogravimétrico (TGA). La línea 1 describe la pérdida de masa en función de la temperatura, mientras que la número 2 representa el diagrama termogravimétrico derivativo (DTG). Se aprecia una rápida disminución del peso en el primer tramo de la curva (hasta 156,47 ºC), correspondiente a la liberación de agua no ligada a la estructura de la sílica. El DTG alcanza una máxima velocidad de pérdida de peso a 110,06 ºC, que indica la temperatura más apropiada para realizar el proceso de secado pues permite el retiro de agua no ligada a alta velocidad, evitando el colapso de la estructura (Ilier, 1979). En la etapa de secado, que va desde temperatura ambiente hasta 156,47 ºC, se presenta una disminución total en el peso de la muestra correspondiente a 87,44%. Posteriormente la reducción de peso es de tan solo el 0,97% con respecto al gel seco (obtenido hasta 156,47 ºC), la cual corresponde a la formación de grupos siloxano (liberación de agua ligada).
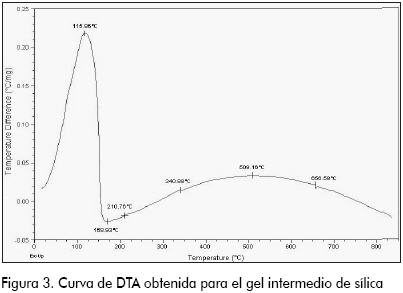
El análisis térmico diferencial, DTA (Figura 3), contiene la sección que corresponde al secado del gel (115,96 ºC), seguido por cambios energéticos poco drásticos, correspondientes a la formación de grupos siloxanos y reordenamiento interno de la estructura (ubicados a temperaturas de 210,76, 340,88, 509,16 y 656,58 ºC).
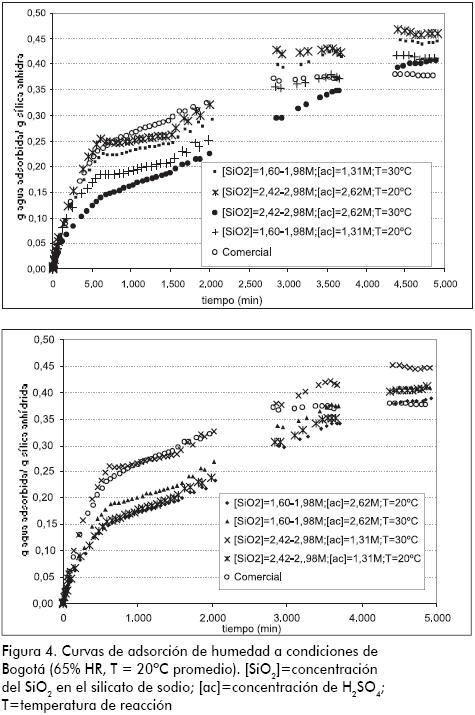
Efecto de la concentración de los reactivos y la temperatura de reacción sobre la capacidad de adsorción. Curvas de adsorción
Se efectuó un análisis gravimétrico para cuantificar el agua que adsorbe la estructura con el fin de evaluar la influencia de las variables estudiadas. En la prueba se registra el incremento de la masa en función del tiempo de una muestra de SGA anhidra, la cual es expuesta a condiciones de humedad y temperatura determinadas, sobre una balanza analítica. En la Figura 4 se muestran las gráficas que relacionan el porcentaje de adsorción en función del tiempo para cada una de las muestras analizadas a condiciones de Bogotá (65% HR, T = 20 ºC promedio); en las curvas se aprecia un crecimiento, que puede explicarse por la adsorción del agua en multicapas. La mayor rapidez de adsorción se observa entre 0 y 500 min seguido de una disminución de la pendiente de la curva, hasta alcanzar el punto de saturación o equilibrio con la humedad del ambiente. En dichas gráficas se hace evidente que la sílica comercial tiene una mayor rapidez de adsorción inicial, en comparación con las SGA obtenidas en el estudio; esto se puede explicar ya que, como se analizará más adelante, existe una elevada presencia de sulfato de sodio en el producto sintetizado (4,81% con respecto al sólido seco), con lo cual se disminuyen los sitios activos de la superficie externa; este fenómeno no se presenta en la comercial, donde la mayoría de grupos silanol se encuentran disponibles. No obstante, en la etapa final (que inicia entre 2.500 y 3.500 minutos), las muestras elaboradas en el estudio presentan una mayor capacidad de adsorción de humedad que el producto comercial, gracias a que poseen mayor área superficial y un alto porcentaje de porosidad (se detallará más adelante), permitiendo que la adsorción de agua continúe en el interior. Esta afirmación se confirma debido a que la sílica comercial estabiliza a los 2700 minutos, mientras que las SGA sintetizadas lo hacen alrededor de 4500 minutos.
Con respecto a las curvas de adsorción realizadas a condiciones de 80% HR y 37 ºC para los productos obtenidos bajo las condiciones mencionadas, se alcanzó una máxima capacidad de adsorción similar a la obtenida con las condiciones anteriores; sin embargo, el equilibrio se logró en un menor tiempo (2.500–3.000 minutos). Esto se puede explicar si se asume que la cinética de adsorción es directamente proporcional a la humedad disponible en el ambiente.
Análisis estadístico
En la Tabla 1 se encuentran consignadas las máximas capacidades de adsorción para cada una de las muestras sintetizadas, así como para el producto comercial. El análisis de estos datos no evidencia una tendencia del efecto de cada variable sobre la capacidad de adsorción, esto se debe a que la interacción entre las variables solapa los efectos individuales; por esta razón se requiere un análisis estadístico de las máximas capacidades de adsorción en función de la correlación de las variables, para vislumbrar los efectos reales. Como resultado se halló que ninguna de las variables tiene influencia por sí sola, pero las interacciones concentración de silicato – temperatura y concentración de ácido – temperatura afectan directamente la respuesta, donde la variable predominante es la temperatura. De igual forma, se obtienen sílicas gel con buenas capacidades de adsorción al utilizar las siguientes combinaciones:
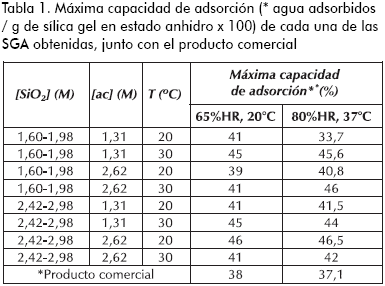
a) [SiO2] =1,60 – 1,98 M y T =30 ºC, sin importar el nivel de la [ac].
b) [ac] =1,31 M y T =30 ºC, sin importar el nivel de la [SiO2].
Ensayos de área superficial específica y resistencia mecánica
El área superficial específica se determinó usando el método desarrollado por Brunauer et al. (1938), el cual se basa en la medición del volumen de nitrógeno adsorbido en la superficie de la partícula a intervalos de presión inferiores a 1 atm. El análisis fue enfocado sobre cuatro de las ocho muestras obtenidas experimentalmente elegidas al azar, así como sobre la muestra comercial. Los resultados se encuentran consignados en la Tabla 2.
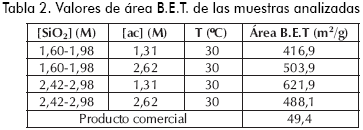
Se resalta que el área superficial de las SGA obtenidas en el estudio es superior al del producto comercial; este fenómeno explica la mayor capacidad de adsorción del producto sintetizado, pero puede implicar debilidad en la resistencia mecánica por la presencia de mayor porosidad (Carballo, 2002).
En las tablas 3.1-3.4 se reporta la carga máxima que tolera una partícula de sílica con forma irregular y área transversal aproximada de 25mm2 antes del colapso (fraccionamiento total), para diferentes sílicas sintetizadas y la comercial.
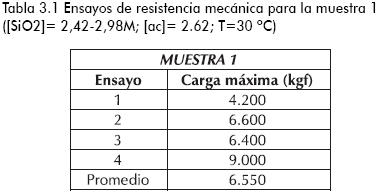
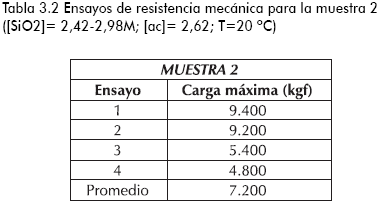
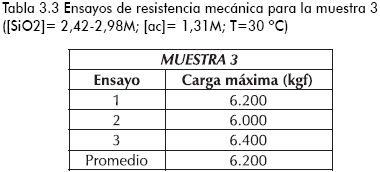
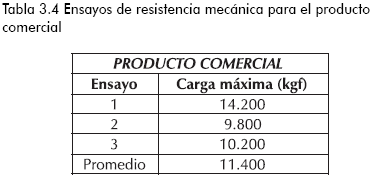
Se aprecia una mayor resistencia a esfuerzos de compresión por parte del producto comercial con respecto a los logrados en el estudio, tal vez justificado por el menor porcentaje de porosidad que presenta la muestra comercial, ya que, como se reporta en la literatura, existe una disminución de la resistencia a esfuerzos compresivos con el incremento del porcentaje de porosidad del sólido (Anderson y Pratt, 1985; Kalapathy et al., 2000; Yasumori y Kawaguchi, 1988). De igual forma, se puede atribuir la menor tolerancia a esfuerzos mecánicos, debido la presencia de sulfato de sodio (subproducto de la etapa de reacción) en la superficie o en la estructura misma del sólido, generando zonas de estrés que colapsan fácilmente al aplicar un esfuerzo compresivo (Anderson y Pratt, 1985).
Resultados del análisis estructural
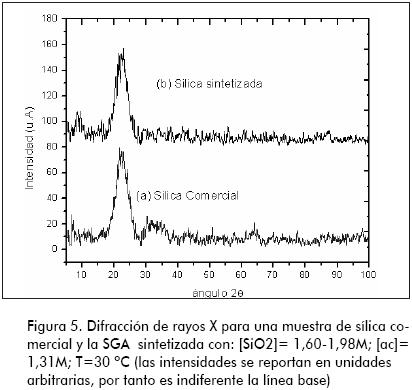
La Figura 5 señala los difractogramas típicos obtenidos por difracción de rayos X para el producto comercial y uno de los sintetizados en este estudio, se evidencia el carácter amorfo de la estructura en las dos muestras.
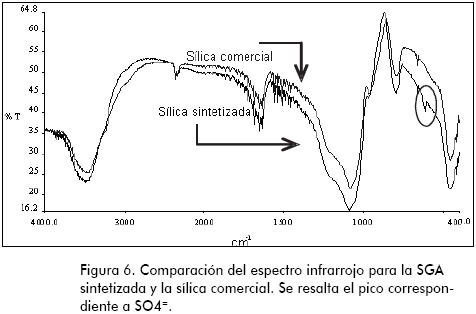
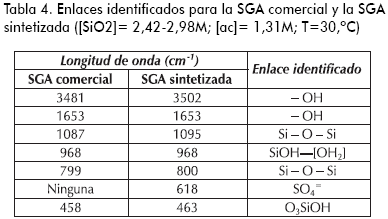
En la Figura 6 se encuentra la comparación de los espectros infrarrojos para una SGA obtenida en el estudio y el producto comercial. Se aprecia una gran similitud, lo que permite inferir la analogía estructural de las dos muestras. Así mismo, se resalta la presencia del ion sulfato en la sílica elaborada en el proyecto (a 618 cm-1 de longitud de onda, círculo), que representa impurezas de sales de sulfato.
En la Tabla 4 se exponen los enlaces identificados en los espectros (Imelik y Vedrine, 1994; Legrand, 1998; Meloan, 1963), para las estructuras de cada una de las muestras.
Composición química
La Tabla 5 enmarca los resultados obtenidos en el espectrómetro de fluorescencia de rayos X, y en la Tabla 6 los correspondientes al espectrómetro de emisión óptica.

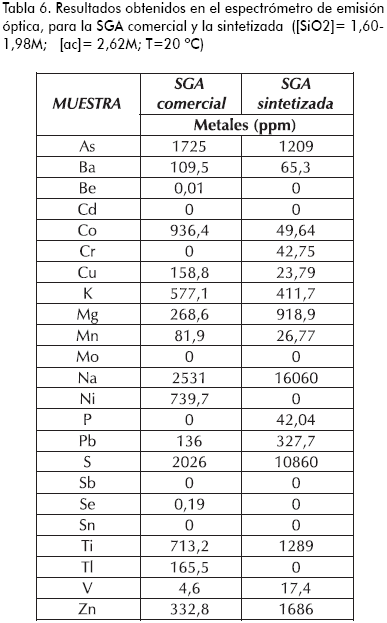
Se observa que la SGA sintetizada en el laboratorio presenta una cantidad de sodio y azufre superior a la sílica comercial, indicando que el sulfato de sodio no se retiró completamente en el proceso de lavado. Esta aseveración se confirma en el espectro infrarrojo con la presencia de la banda característica del ion sulfato. Se cuantificó el Na2SO4 en 4,81% con respecto al sólido seco para una de las sílicas sintetizadas en el laboratorio, mientras que en el producto comercial es de 0,08%. De igual manera, se destaca la presencia elevada de cobalto en la sílica comercial, ya que el CoCl2 es el indicador (por cambio de color) de cantidad de humedad adsorbida usado en estos productos. Se halla presente aproximadamente en 0,21% con respecto al sólido seco.
Conclusiones
Las sílicas gel adsorbentes obtenidas poseen una mayor capacidad de adsorción que la SGA comercial, pero una menor resistencia mecánica a esfuerzos de compresión, siendo esta la única deficiencia presente en las SGA sintetizadas. Lo anterior se debe a la mayor porosidad y a la presencia de sulfato de sodio, evidenciando la necesidad de estudiar la etapa de lavado para encontrar las condiciones que permitan remover completamente esta sal y optimizar la cantidad de agua con respecto a la silica gel producida, ya que esta relación es un aspecto importante al momento de escalar el proceso. Por otra parte, se evidenció la fuerte similitud entre las sílicas sintetizadas y la comercial en diversos aspectos. Por último, se concluye a través del análisis estadístico de los datos obtenidos que se favorece la capacidad de adsorción de la sílica al sintetizarla con [SiO2] de 1,60 – 1,98 M, temperatura de reacción de 30 ºC, sin importar el nivel de la [ac]; o con [ac] de 1,31 M y T de 30 ºC, sin importar el nivel de la [SiO2] en los intervalos estudiados.
Agradecimientos
Los autores expresan su agradecimiento a la Universidad Nacional de Colombia; a Levapan S.A. Colombia por los ensayos en la cámara de humedad controlada; a Holcim Colombia por los de espectrometría de masa, y a la Universidad Louis Pasteur de Estrasburgo, Francia, por su colaboración con los ensayos de difracción de rayos X y área B.E.T.
Nomenclatura
[SiO2] Concentración de SiO2 en el silicato de sodio (M)
[ac] Concentración de ácido sulfúrico (M)
T Temperatura de reacción (°C)
Bibliografía
Anderson, J.R. and Pratt, K. C., Introduction to characterization and testing catalysts., Academic Press. Sydney, 1985. [ Links ]
Brunaer, S., Emmett, P.H. and Teller, E., Adsorption of gases in multimolecular layers., The Journal of the American Chemical Society, 1938. [ Links ]
Carballo, L., Introducción a la Catálisis Heterogénea., Editorial Universidad Nacional de Colombia, Bogotá, Primera edición, Colombia, 2002, pp. 172 – 180 y 194. [ Links ]
DANE: Departamento Administrativo Nacional de Estatística., Colombia, Disponible en: http://www.dane.gov.co [ Links ]
Daniels, T., Thermal Analysis., John Wiley and Sons., New York, 1974. [ Links ]
Iler, R.K., The Chemestry of Silica, Solubility, Polimerization, Colloid and Surface Properties, and Biochemistry., John Wiley and Sons., New York, 1979. [ Links ]
Imelik, B. and Vedrine, J.C., Catalyst Characterization physical Techniques for Solid Materials., Plenum Press., New York and London, 1994. [ Links ]
Kalapathy, U., Proctor, A. and Shultz, J., Silica xerogels from rice hull ash: structure, density and mechanical strength as affected by gelation pH and silica concentration., Journal of Chemical Technology and Biotechnology, J Chem Technol Biotechnol , Vol. 75, No. 4, 2000, pp. 464-468. [ Links ]
Legrand, A.P., The Surface Properties of Silicas., John Wiley and Sons., New York, 1998. [ Links ]
Meloan, C., Elementary Infrared Spectroscopy., The Macmillan Company, New York, 1963. [ Links ]
PROEXPORT., Colombia, Disponible en: http://www.proexport.gov.co [ Links ]
Saenz, G.M.C. y Baez,. Q.C., Estudio de las condiciones de reacción para la obtención de sílica gel adsorbente., Universidad Nacional de Colombia, Departamento de Ingeniería Química. y Ambiental, 2005. [ Links ]
Ullmann’S., Encyclopaedia of Industrial Chemistry., Advisory Board, FIFTH Complety Revised, Edición 1993, Vol. A23, 1993, pp. 614 – 643. [ Links ]
Yasumori, M.Y. and Kawaguchi. T., Ultrastructure Processing of Advanced Ceramics., eds. J.D. Mackenzie and D.R. Ulrich, Wiley, New York, 1988, pp. 355 – 366. [ Links ]














