Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería e Investigación
Print version ISSN 0120-5609
Ing. Investig. vol.28 no.2 Bogotá May/Aug. 2008
Juliana Reyes Calle1, Jairo Antonio Cubillos Lobo2, Consuelo Montes de Correa3 y Aida Luz Villa Holguín4
1 Ingeniera química, Universidad Nacional de Colombia. Candidata a Magíster, Ingeniería con énfasis en química, Universidad de Antioquia, Colombia. ejurc553@udea.edu.co
2 Ingeniero químico y Magíster en Ingeniería Ambiental, Universidad de Antioquia, Colombia. Doctor, en Ciencias Naturales, RWTH-Aachen, Alemania. Profesor, Departamento de Ingeniería Química, Universidad de Antioquia, Colombia. jclobo@udea.edu.co
3 Ingeniera química, Universidad de Antioquia, Colombia. Ph.D., en Ingeniería Química, Virginia Polytechnic Institute And State University, U.P.I.S.U, Estados Unidos. Postdoctorado, Universite Catholique De Louvain, U.C.L, Bélgica. Profesora, Departamento de Ingeniería Química, Universidad de Antioquia, Colombia. cmontes@udea.edu.co
4 Ingeniera química, Universidad Nacional de Colombia. Magíster, en Ciencias Químicas, Universidad de Antioquia, Colombia. Ph.D., en Ciencias Biológicas Aplicadas, Universite Catholique De Louvain, U.C.L, Bélgica. Profesora, Departamento de Ingeniería Química, Universidad de Antioquia, Colombia. alvilla@udea.edu.co
RESUMEN
Se presenta el efecto del agente oxidante en la diastereoselectividad del epóxido de R-(+)-limoneno utilizando catalizadores tipo Jacobsen, tanto en su forma quiral como aquiral. Se encontró que el tipo de agente oxidante afecta marcadamente la diastereoselectividad. Así, en presencia de agentes oxidantes preparados in situ se obtuvieron excesos diastereoméricos moderados y similares en ausencia de catalizador (23% con DMD y 29% con O2/ pivalaldehído). También se observó este comportamiento en presencia de ambos catalizadores. Con DMD se obtuvo 56% con el catalizador quiral y 50% con el aquiral, y con O2/pivalaldehído se obtuvo 38% con ambos catalizadores. Por otro lado, con los agentes oxidantes comerciales no se presentó exceso diastereomérico en ausencia de catalizador. En este caso, el catalizador quiral alcanzó un exceso diastereomérico mayor que el aquiral. Con NaOCl se logró 65% con el catalizador quiral y 38% con el aquiral, y con m-CPBA 79% con el catalizador quiral y 39% con el aquiral. Lo anterior sugiere que debe existir al menos otra especie oxidante intermediaria diferente a la aceptada convencionalmente (MnV(oxo)). De esta manera, se propone una modificación al ciclo catalítico tradicional teniendo en cuenta el agente oxidante. En presencia de los agentes oxidantes comerciales se presume que el centro quiral del catalizador gobierna la inducción asimétrica, mientras que para los agentes oxidantes preparados in situ la inducción asimétrica estaría gobernada por el centro quiral del R-(+)-limoneno. Adicionalmente se encontró que la estabilidad química del catalizador de Jacobsen mejoró cuando el agente oxidante fue DMD generado in situ.
Palabras clave: diastereoselectividad, epoxidación, R-(+)-Limoneno, agente oxidante, inducción asimétrica, catalizador quiral, catalizador aquiral.
ABSTRACT
The oxidising agent effect on R-(+)-Limonene epoxide diastereoselectivity using chiral and achiral Jacobsens type catalysts is presented. The type of oxidising agent strongly influences diastereoselectivity. Moderate diastereomeric excesses were achieved in the presence of oxidising agents prepared in situ but in the absence of catalyst (23% for DMD and 29% for O2/pivalaldehyde). Similar diastereomeric excesses were obtained with both chiral and achiral catalyst when the oxidising agents were prepared in situ; 56% and 50% excesses were obtained when using DMD for the chiral and achiral catalyst (respectively) and 38% using O2/pivalaldehyde for both catalysts. Diastereomeric excesses were not observed in the absence of catalyst when using commercial oxidising agents; the chiral catalyst presented larger diastereomeric excesses than its achiral counterpart: 65% and 38% excess using NaOCl for the chiral and achiral catalyst, respectively, and 79% and 39% using m-CPBA for the chiral and achiral catalyst, respectively. This suggests that at least one oxidant species, different from the conventionally accepted (MnV(oxo)), might be involved in this catalytic process. A modification of the traditional catalytic cycle is proposed considering the type of oxidising agent. The catalysts chiral centre appears to govern asymmetric induction when commercial oxidising agents are used, whereas the R-(+)-Limonene chiral centre appears to govern asymmetric induction in the presence of in situ-prepared oxidising agents. On the other hand, the chemical stability of Jacobsens catalyst improved when in situ produced DMD was used as oxidising agent.
Keywords: diastereoselectivity, epoxidation, R-(+)-Limonene, oxidising agent type, asymmetric induction, chiral, achiral.
Recibido: enero 17 de 2008
Aceptado: julio 3 de 2008
Introducción
La transferencia directa de oxígeno a una olefina es un método bien establecido y popular para la obtención de epóxidos que son compuestos de gran importancia en síntesis orgánica (Johnson y Sharpless, 1993; Jacobsen, 1993). En los últimos años se han dedicado muchos esfuerzos a la transformación catalítica selectiva de olefinas (Katsuki, 1995; Katsuki, 1996; Ito, 1999). Hasta la fecha, uno de los mejores métodos para la epoxidación enantioselectiva de olefinas no funcionalizadas es la epoxidación de Jacobsen-Katsuki, en la cual se emplean catalizadores basados en complejos de salen de manganeso (III) ópticamente activos e hipoclorito de sodio o yodosilbenceno como agentes oxidantes (Zhang y Jacobsen, 1991). Aunque tradicionalmente se ha aceptado que las especies MnV(oxo) son responsables del excelente comportamiento catalítico, el mecanismo de la reacción de epoxidación de olefinas todavía se encuentra bajo intenso debate (Dalton et al., 1998; Finney et al., 1997; Palucki et al., 1998; Linker, 1997). La isomerización del sustrato es uno de los temas que más se ha discutido, ya que las cis-olefinas (cis-?-metilestireno y cis-estilbeno) pueden producir una mezcla de cis- y trans-epóxidos (Katsuki, 1995; Katsuki, 1996; Ito y Katsuki, 1999; Dalton et al., 1998; Finney et al., 1997; Palucki et al., 1998; Linker, 1997; Adam et al., 2002). Se han realizado estudios con el fin de comprobar la existencia de la especie MnV(oxo) en reacciones de epoxidación de olefinas, ya que estas se propusieron como análogas a las especies CrV(oxo), las cuales se han determinado por análisis cristalográfico de rayos X, mientras que las especies activas propuestas para el manganeso son una simple especulación (Linker, 1997).
La gran mayoría de los estudios se han hecho por síntesis e-nantioselectiva, proceso en el cual el componente quiral se puede utilizar en cantidades catalíticas y se dispone de una amplia gama de sustratos, mientras que en la síntesis diastereoselectiva el sustrato es el componente quiral, lo cual limita su uso a sustancias naturales. Por tanto, la gran ventaja que presenta la síntesis diastereoselectiva frente a la síntesis enantioselectiva es que en la primera se pueden usar catalizadores aquirales en lugar de catalizadores quirales. Un catalizador quiral (enantioméricamente puro), generalmente es más costoso que uno aquiral (Sheldon, 1993; Lin et al., 2001). Por tanto, se decidió estudiar en este artículo la quiralidad del catalizador, además del efecto del agente oxidante. Por otro lado, hasta la fecha no se han reportado este tipo de estudios con un monoterpeno natural como el R-(+)-limoneno. En la Figura 1 se muestra la estructura química del catalizador de Jacobsen, quiral y aquiral.
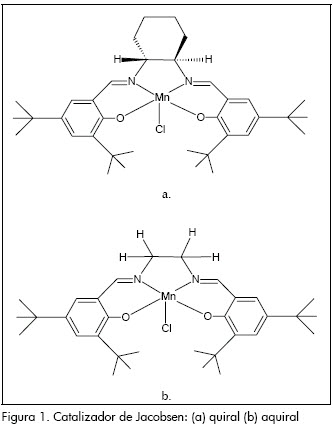
Los epóxidos ópticamente activos derivados del limoneno son una materia prima clave en la síntesis de fragancias, productos farmacéuticos y saborizantes artificiales. La oxidación del limoneno conduce en general a una variedad de productos, donde los epóxidos son los principales cuando la oxidación ocurre en las posiciones olefínicas. El limoneno tiene dos enlaces olefínicos (1,2 y 8,9) y la oxidación puede tomar lugar en cualquiera de estos enlaces. Además, se pueden obtener dos tipos de diastereoisómeros por cada uno de los epóxidos producidos (Saikia et al., 2006). En la Figura 2 se presenta un esquema de la reacción de epoxidación diastereoselectiva del R-(+)-limoneno.
El objetivo del presente artículo es presentar el efecto del tipo de agente oxidante y la quiralidad del catalizador en la epoxidación diastereoselectiva de R-(+)-limoneno. De igual forma, se desea estudiar el efecto del tipo de agente oxidante en la estabilidad del catalizador de Jacobsen y proponer un mecanismo de reacción modificado para la epoxidación asimétrica de R-(+)-limoneno con complejos de salen de Mn (III) como catalizadores. Se pretende demostrar que las especies MnV(oxo) no son las únicas involucradas en la epoxidación de olefinas con catalizadores tipo Jacobsen y que debe existir al menos otra especie oxidante activa que involucre el tipo de agente oxidante. Para ello, se sintetizaron dos complejos de salen de manganeso(III): el catalizador de Jacobsen y su contraparte aquiral. Estos se caracterizaron por diferentes técnicas, tales como: FTIR, UV-Vis y TGA, y se probaron en la epoxidación diastereoselectiva de R-(+)-limoneno utilizando cuatro agentes oxidantes, dos de los cuales están disponibles comercialmente (NaOCl y m-CPBA) y los otros dos son preparados durante la reacción (DMD y O2/pivaladehido). La actividad catalítica se expresó en términos de la conversión de R-(+)-limoneno, la selectividad a los epóxidos endocíclicos (cis+trans) y el exceso diastereomérico de cis-1,2-óxido de limoneno con respecto a trans-1,2-óxido de limoneno. El catalizador recuperado con cada agente oxidante se caracterizó por FTIR para evaluar su estabilidad hacia la degradación oxidativa.
A continuación se presenta una descripción de la metodología experimental que se siguió durante el desarrollo del trabajo, posteriormente se presentan los resultados tanto de caracterización de los catalizadores como los resultados de actividad catalítica (conversión, selectividad y exceso diastereomérico), así como el análisis de los mismos. Finalmente, se despliega un ciclo catalítico alternativo al ciclo tradicional en la epoxidación de Jacobsen-Katsuki, así como la estabilidad de los catalizadores en la reacción de estudio con cada uno de los agentes oxidantes.
Desarrollo experimental
Síntesis del catalizador de Jacobsen
El catalizador de Jacobsen (catalizador quiral) se sintetizó Siguiendo el procedimiento reportado por Jacobsen y colaboradores (Larrow y Jacobsen, 1994). Para la síntesis del catalizador aquiral se siguió el mismo procedimiento empleado para el catalizador quiral, pero utilizando 1,2 diamino-etano en lugar de la amina activa 1,2 diamino-ciclohexano.
Caracterización de catalizadores
Los análisis de espectroscopía infrarroja con transformada de Fourier (FTIR) se efectuaron utilizando un equipo marca Nicolet Avatar 330 con celda dispersiva. Cada una de las muestras se diluyeron con bromuro de potasio para obtener una mezcla de aproximadamente 3%p/p. Los espectros se midieron en el rango de 400 a 4.000 cm-1. Los análisis UV-VIS se practicaron en un espectrofotómetro Lamda 4B (Perkin Elmer). Las muestras se diluyeron con BaSO4, el cual se utilizó como estándar. Los análisis termogravimétrico se llevaron a cabo en un equipo TGA 2950 usando una velocidad de calentamiento de 2 K/min en aire ambiente.
Ensayos catalíticos
Para la reacción de prueba se emplearon cuatro agentes oxidantes: dimetildioxirano (DMD) generado in situ, hipoclorito de sodio (NaOCl), ácido meta-cloroperbenzoico (m-CPBA) y O2/pivalaldehído, tanto en presencia del catalizador de Jacobsen quiral como su contraparte aquiral.
DMD generado in situ como agente oxidante
A 30 mL de acetona se adicionaron 0.702 g de R-(+)-limoneno, 1 g NaHCO3 y 0.03 g de catalizador. El pH de la mezcla obtenida se llevó a un valor de aproximadamente 8.5 utilizando una solución acuosa de bicarbonato de sodio (NaHCO3, 5%p/p). Por otro lado, 2 mmol de Oxone® (2KHSO5KHSO4K2SO4) se disolvieron en 25 mL de agua desionizada. Mientras que la solución de R-(+)-Limoneno se agitaba continuamente, la solución de Oxone® se adicionó lentamente, manteniendo el valor del pH entre 8.0 y 8.5 utilizando una solución acuosa de bicarbonato de sodio (NaHCO3, 5%p/p, pH= 8.0). Después de la adición total de la solución de Oxone®, la agitación se interrumpió y el bicarbonato de sodio sólido obtenido se eliminó por centrifugación y posteriormente por decantación. La mezcla líquida se extrajo con 30 mL de diclorometano. La fase acuosa se descartó y la orgánica se destiló al vacío (160 °C y 0.08 MPa) para separar el catalizador de los productos de reacción. Luego, la muestra se concentró por evaporación al vacío (Cubillos, 2005) y una alícuota de la solución obtenida se analizó por cromatografía de gases (GC) en un equipo Varian Star 3400 provisto de un detector de ionización de llama FID, un automuestreador Varian CP 8200 y una columna capilar DB-1 de 0.32 mm de diámetro interno, 50 m de longitud y 1.20 µm de espesor para la cuantificación de conversión y selectividad, mientras que para la cuantificación del exceso diastereomérico se utilizó un cromatógrafo de gases Agilent Technologies, 7890 A GC System, provisto de un detector de ionización de llama FID y una columna capilar β-Dex de 0.25 mm de diámetro interno, 60 m de longitud y 0.25 µm de espesor.
m-CPBA como agente oxidante
A 30 mL de diclorometano se le adicionaron 0.702 g de R-(+)-limoneno, 1.1715 g de N-metilmorfolina (NMO) y 0.03 g de catalizador. Mientras la mezcla anterior se agitaba continuamente, se adicionaron 0.69 g de m-CPBA en 4 porciones durante 2 minutos. Luego de 30 minutos de reacción, la agitación se interrumpió y se adicionaron 20 mL de NaOH 1M. La mezcla líquida obtenida se extrajo con 30 mL de dicloro-metano. La fase acuosa se descartó, la fase orgánica se destiló al vacío (160 °C y 0.08 MPa) para separar el catalizador de los productos, y finalmente se concentró por evaporación al vacío (Wang et al., 2006). Una alícuota de la fase orgánica se analizó por cromatografía gaseosa utilizando el mismo procedimiento descrito anteriormente.
NaOCl como agente oxidante
A 10 mL de diclorometano se adicionaron 0.27 g de R-(+)-limoneno, 0.1 g de 4-fenilpiridina N-óxido (4-PPNO) y 0.025 g de catalizador. Mientras que la mezcla de reacción se mantenía bajo agitación magnética continua, se adicionaron 10.9 mL de una solución 0.55 M de NaOCl en Na2HPO4 (pH= 11.3). Luego de 24 horas, la agitación se interrumpió y la fase acuosa se separó de la fase orgánica en un embudo de separación. Luego, la fase orgánica se destiló al vacío (160 °C y 0.08 MPa) para separar el catalizador de los productos de reacción (Cubillos, 2005). Finalmente, se tomó una alícuota de la fase orgánica para analizar por cromatografía gaseosa según el procedimiento anteriormente descrito.
O2/pivalaldehído como agente oxidante
En un reactor de teflón se cargaron 0.504 g de R-(+)-limoneno, 0.7929 g de pivalaldehído, 0.03 g de catalizador y 18.5 mL de tolueno. Esta mezcla se llevó a un reactor Parr en acero inoxidable provisto con un recipiente de teflón y agitación mecánica. La mezcla de reacción se presurizó con oxígeno hasta 450 psi a temperatura ambiente. Luego de 24 horas la agitación mecánica se interrumpió y el reactor se despresurizó hasta alcanzar la presión atmosférica (Bhattacharjee y Anderson, 2004; Schuster y Hölderich, 2000). Finalmente, los productos de reacción se separaron del catalizador por destilación al vacío (160 °C y 0.08 MPa) y una alícuota de la solución obtenida se analizó por cromatografía gaseosa según el procedimiento anteriormente descrito.
Resultados
FTIR
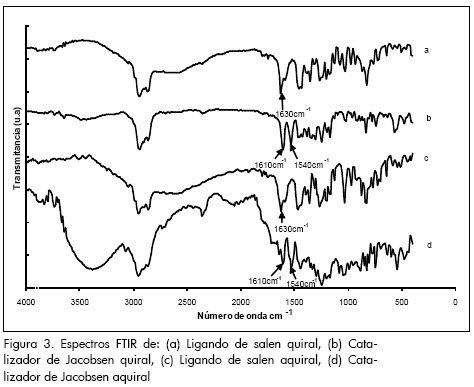
En la Figura 3 se comparan los espectros FTIR del ligando de salen quiral, el catalizador de Jacobsen quiral, el ligando de salen aquiral y el catalizador de Jacobsen aquiral. Tanto en el ligando de salen quiral como aquiral aparece una banda representativa a 1.630 cm-1, correspondiente a las vibraciones del grupo imina o doble enlace carbono-nitrógeno. Los espectros IR del catalizador de Jacobsen quiral y aquiral revelan la banda asociada al grupo imina, la cual se desplaza hasta 1.610 cm-1 como primera evidencia de la formación del complejo organometálico, pero adicionalmente presentan una nueva banda a 1.540 cm-1 aproximadamente, la cual corresponde a la complejación del manganeso por parte del ligando de salen (Frunza et al., 1997).
Análisis termogravimétrico
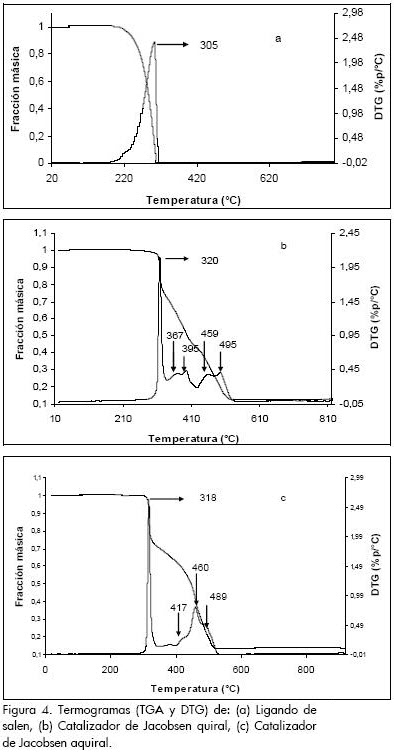
En la Figura 4 se presentan los termogramas del ligando de salen quiral, el catalizador de Jacobsen quiral y el catalizador de Jacobsen aquiral. El ligando de salen presenta descomposición máxima a una temperatura de aproximadamente 305 °C, mientras que esta temperatura se retardó a 320 °C para el catalizador quiral y a 318 °C para el catalizador aquiral. Además, se observan otras temperaturas de descomposición alrededor de 367, 395, 459 y 495 °C para el catalizador de Jacobsen quiral, y alrededor de 417, 460 y 489 °C para el catalizador de Jacobsen aquiral; estos picos, en ambos casos, están asociados con los grupos orgánicos más estables (grupos tert-butilo). Adicionalmente, a temperaturas superiores de 520 °C el residuo no quemado corresponde a la formación de óxidos de manganeso (Frunza et al., 1997).
Ultravioleta visible (UV-Vis)
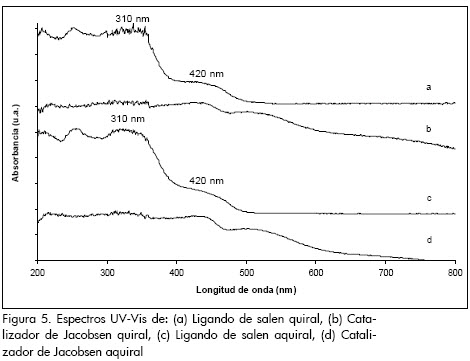
En la Figura 5 se muestran los espectros UV-Vis, para el ligando de salen (quiral y aquiral), el catalizador quiral y el catalizador aquiral. Los espectros de los ligandos de salen presentan bandas de absorción típicas a aproximadamente 310 nm y 420 nm, las cuales son atribuibles a la transferencia de carga Π-Π* y n-Π*, respectivamente. Después de la complejación del ligando de salen con manganeso se obtiene una banda muy débil cerca a 510 nm para ambos catalizadores, la cual está asociada con la transición d-d de los iones de manganeso (Karandikar et al., 2004).
Ensayos catalíticos
En la Tabla 1 se presentan los resultados de epoxidación diastereoselectiva de R-(+)-limoneno en ausencia y en presencia del catalizador de Jacobsen y su contraparte aquiral utilizando cuatro agentes oxidantes: DMD preparado in situ, O2/pivalaldehído, NaOCl y m-CPBA. El DMD como agente oxidante se preparó in situ a partir de acetona (solvente de reacción) y monopersulfato de potasio KHSO5 (Oxone®), mientras que O2 y pivalaldehído generan in situ un peroxi-ácido. Por otro lado, NaOCl y m-CPBA se aplicaron como agentes oxidantes comerciales.
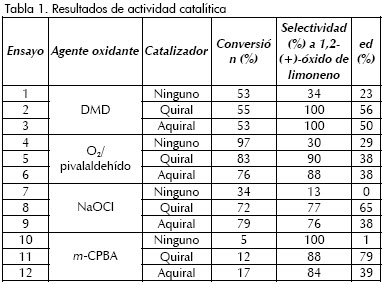
Cuando se usaron agentes oxidantes preparados in situ como DMD y O2/pivalaldehído en ausencia de catalizador (ensayos 1 y 4) se obtuvo un exceso diastereomérico moderado en ambos casos (23% y 29%, respectivamente). Adicionalmente, para estos dos agentes oxidantes, el exceso diastereomérico alcanzado con el catalizador quiral es muy similar al obtenido con el catalizador aquiral (ensayos 2,3 y 5,6). Estos resultados sugieren que el centro quiral del R-(+)-limoneno gobierna la inducción asimétrica y la formación del diastereoisómero principal. Es decir, con el catalizador aquiral, que es menos costoso que el quiral, se obtuvieron resultados de diastereoselectividad comparables. En contraste, cuando se utilizaron los agentes oxidantes comerciales en ausencia de catalizador el exceso diastereomérico obtenido fue casi nulo (ensayos 7 y 10), mientras que en ambos casos, el valor de este parámetro obtenido con el catalizador de Jacobsen quiral fue muy superior al obtenido con el catalizador aquiral (ensayos 8,9 y 11,12). Este resultado sugiere que para este tipo de agentes oxidantes el centro quiral del catalizador de Jacobsen gobierna la inducción asimétrica y la formación del diastereoisómero principal. Lo anterior muestra un marcado efecto del tipo de agente oxidante en la epoxidación diastereoselectiva del R-(+)-limoneno.
Aunque tradicionalmente se ha aceptado que el primer paso en la epoxidación de Jacobsen-Katsuki es la formación de las especies MnV(oxo) como la especie oxidante activa, esta afirmación se encuentra bajo intenso debate, ya que si estas fueran las únicas especies oxidantes activas en la epoxidación del R-(+)-limoneno, el exceso diastereomérico alcanzado debería ser el mismo independientemente del agente oxidante utilizado en la reacción de epoxidación. Sin embargo, esto no ocurre en la epoxidación diastereoselectiva de R-(+)-limoneno cuando se utilizan agentes oxidantes comerciales como NaOCl y m-CPBA. Esto, conduce a plantear que para la reacción bajo estudio debe existir otra especie catalítica activa diferente a la aceptada convencionalmente. Por tanto, el ciclo catalítico de Jacobsen-Katsuki (Figura 6) (Dalton et al., 1998) se debe modificar teniendo en cuenta el tipo de agente oxidante con el fin de explicar esta divergencia mecanística. Recientemente se han efectuado estudios con el fin de comprobar la existencia de las especies MnV(oxo) durante la reacción de epoxidación de olefinas (Bryliakov et al., 2000; Linde et al., 1999; Abashkin et al., 2000; Bryliakov et al., 2000) y hasta el momento no ha sido posible demostrar la existencia de estas especies.
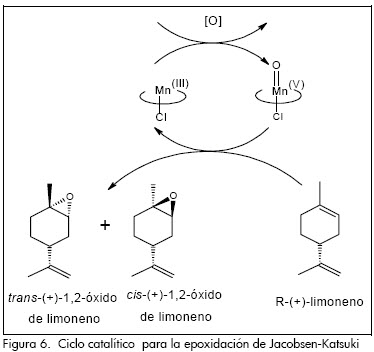
En la Figura 6 se presenta el ciclo mecanístico aceptado tradicionalmente para la reacción de epoxidación de Jacobsen-Katsuki. En este caso, el catalizador de Jacobsen reacciona con el agente oxidante para formar las especies MnV(oxo), las cuales posteriormente oxidarán la olefina para obtener una mezcla de epóxidos cis-trans. En este caso, la especie oxidante activa siempre será la misma, independientemente del agente oxidante que se utilice, y por tanto el exceso diastereomérico obtenido con cualquier agente oxidante debería ser muy similar.
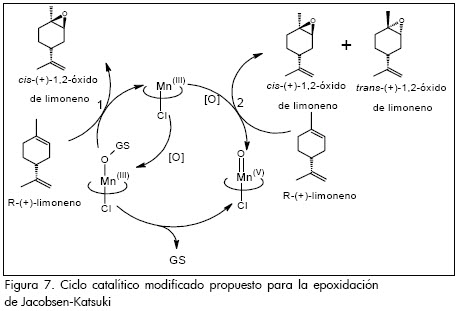
En la Figura 7 se exhibe el ciclo propuesto para la epoxidación de R-(+)-limoneno en presencia de catalizadores tipo Jacobsen, en el cual se tiene en cuenta la influencia del agente oxidante en la formación del diastereoisómero mayoritario. Este ciclo catalítico se basa en el mecanismo planteado por Adam y colaboradores (Adam et al., 2002), según los resultados experimentales obtenidos en la epoxidación de cis-estilbeno con complejos de salen de manganeso (III) y concuerda con los resultados obtenidos en el presente trabajo para la epoxidación asimétrica del R-(+)-limoneno, donde un marcado efecto del tipo de agente oxidante en la formación del diastereoisómero mayoritario. Sin embargo, para validar el ciclo mecanístico propuesto son necesarios estudios cinéticos. En este ciclo modificado se incluye una bifurcación al ciclo tradicional, donde después de la oxidación del complejo de salen de Mn(III) se obtiene una especie intermediaria MnIII(OGS) que tiene en cuenta la influencia del tipo de agente oxidante en la formación del dias-tereoisómero mayoritario, la cual finalmente oxida el R-(+)-limoneno (ruta 1). Este es el caso de los agentes oxidantes comerciales (NaOCl y m-CPBA) con los que se obtiene preferencialmente el cis-(+)-1,2-óxido de limoneno y donde se presume que el centro quiral del catalizador gobierna la inducción asimétrica. Por otro lado, se plantea la oxidación del R-(+)-limoneno por parte de las especies MnV(oxo) (ruta 2). En este caso se obtiene una mezcla de diastereoisómeros con una diastereoselectividad más baja hacia el isómero cis que la obtenida por la ruta 1. Esta corresponde a los agentes oxidantes preparados in situ (DMD y O2/pivalaldehído) con los cuales se presume que el centro quiral del R-(+)-limoneno gobierna la formación del diastereoisómero mayoritario. Adicionalmente, se plantea la formación de las especies MnV (oxo) a partir de las nuevas especies intermediarias propuestas luego de la eliminación del grupo saliente (GS) del agente oxidante utilizado.
Estabilidad de los catalizadores usados
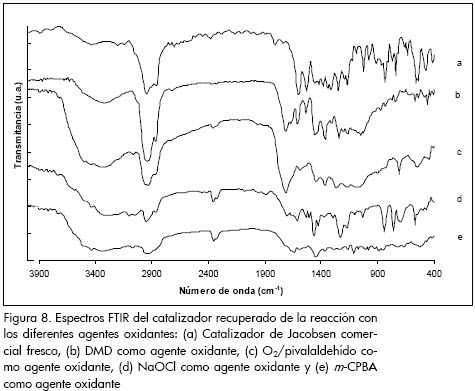
En la Figura 8 se despliegan los espectros FTIR de los catalizadores utilizados con cada uno de los agentes oxidantes, los cuales se recuperaron después de reacción por destilación al vacío. Para el catalizador de Jacobsen comercial se observan las bandas características de este tipo de compuestos: a 1.610 cm-1, asociada al grupo imina, y a 1.540 cm.1, correspondiente a la complejación del manganeso por el ligando de salen. El espectro del catalizador recuperado de la reacción en la cual se utilizó DMD preparado in situ como agente oxidante presenta las dos bandas características del catalizador de Jacobsen mencionadas anteriormente a 1.610 cm-1 y 1.540 cm.-1, aunque con una leve disminución en su intensidad. Esto sugiere que el DMD preparado in situ no afecta considerablemente la integridad química del catalizador. Con O2/pivalaldehído, NaOCl y m-CPBA se presentó una gran disminución en la intensidad de las bandas típicas del catalizador, indicando que con estos agentes oxidantes el catalizador se degrada.
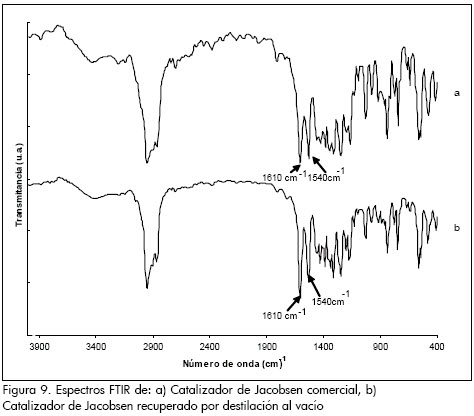
Con el fin de determinar si la separación por destilación al vacío afecta la identidad química del catalizador, se efectuó una prueba de separación por este método con una muestra de catalizador fresco. En la Figura 9 se presenta el espectro FTIR del catalizador de Jacobsen comercial, en el cual se muestran las señales típicas de los complejos de salen de manganeso. Para el catalizador recuperado por destilación al vacío, continúan apareciendo las señales características del catalizador de Jacobsen con la misma intensidad que para el catalizador fresco. Estos resultados sugieren que la separación por destilación al vacío no afecta la estructura química del catalizador.
Conclusiones
El tipo de agente oxidante utilizado en la epoxidación diastereoselectiva de R-(+)-limoneno utilizando complejos de salen de Mn(III) tiene una gran influencia en la diastereoselectividad de los productos.
Con DMD y O2/pivalaldehído como agentes oxidantes, el exceso diastereomérico alcanzado con el catalizador aquiral es muy similar al obtenido con el catalizador quiral. Este hecho, unido a un exceso diastereomérico moderado en ausencia de catalizador, sugieren que el centro quiral del R-(+)-limoneno gobierna la formación del diastereoisómero mayoritario.
En presencia de agentes oxidantes comerciales se encontró un marcado efecto del tipo de catalizador (quiral o aquiral) en la diastereoselectividad. Por tanto, se presume que para este tipo de agentes oxidantes el centro quiral del catalizador gobierna la inducción asimétrica para la epoxidaión de R-(+)-limoneno.
Dado que el tipo de agente oxidante influye notablemente en la diastereoselectividad de la reacción de epoxidación de R-(+)-limoneno debe existir al menos otra especie oxidante activa diferente a la especie intermediaria convencional MnV(oxo).
La estabilidad del catalizador de Jacobsen mejoró cuando se utilizó DMD generado in situ como oxidante.
Agradecimientos
Los autores agradecen el apoyo financiero de Colciencias y de la Universidad de Antioquia a través de Cenivam RC No. 432.
Bibliografía
Abashkin, Y. G., Collins, J. R., Burt, S. K., (Salen)Mn(III)-Catalyzed Epoxidation Reaction as a Multi-channel Process with Different Spin States., Electronic Tuning of Asymmetric Catalysis: A Theoretical Study., Inorganic Chemistry, Vol. 40, 2001, pp. 4040-4048. [ Links ]
Adam, W., Roschmann, K. J., Saha-Möller, C. R. , Seebach, D., Cis-Stilbene and (1α,2β,3α)-(2-Ethenyl-3-methoxycy-clopropyl)benzene as mechanistic probes in the MnIII(salen)-catalyzed epoxidation: Influence of the oxygen source and the counterion on the diastereoselectivity of the competitive concerted and radical-type oxygen transfer., Journal of American Chemical Society, Vol. 124, No. 18, 2002, pp. 5068-5073. [ Links ]
Bhattacharjee, S., Anderson, J. A., Epoxidation by layered double hydroxide-hosted catalysts. Catalyst synthesis and use in the epoxidation of R-(+)-Limonene and (-)-α-Pi-nene using molecular oxygen., Catalysis Letters, Vol. 95, No. 3-4, Jun., 2004, pp. 119-125. [ Links ]
Bryliakov, K. P., Babushkin, D. E., Talsi, E. P., H NMR and EPR spectroscopic monitoring of the reactive intermediates of (salen)MnIII catalyzed olefin epoxidation., Journal of Molecular Catalysis. A: Chemical, Vol. 158, No. 1, Sept., 2000, pp. 19-35. [ Links ]
Bryliakov, K. P., Khavrutskii, I. V., Talsi, E. P., Kholdeeva, O. A., EPR detection and characterization of high-valent manganese complexes in MnIII(salen) catalyzed aerobic olefin epoxidation., Reaction Kinetics and Catalysis Letters, Vol. 71, No. 1, Sept., 2000, pp. 183-191. [ Links ]
Cubillos, J. A., Heterogeneous asymmetric epoxidation of cis-ethyl cinnamate over Jacobsens catalyst immobilized in inorganic porous materials., tesis presentada a la Universidad RWTH-Aachen, Aachen-Alemania, para optar al grado de Doctor en Ciencias Naturales., 2005. [ Links ]
Dalton, C. T., Ryan, K. M., Wall, V. M., Bousquet, C., Gilheany, D. G., Recent progress towards the understandding of metal-salen catalysed asymmetric alkene epoxidation., Topics in Catalysis,Vol. 5, No. 1-4, Abril, 1998, pp. 75-91. [ Links ]
Finney, N. S., Pospisil, P. J., Chang, S., Palucki, M., Konsler, R. G., Hansen, K. B., Jacobsen, E. N., On the viability of oxametallacyclic intermediates in the (salen) Mn-catalyzed asymmetric epoxidation., Angewandte Chemie International Edition in English, Vol. 36, No. 16, Sept., 1997, pp. 1720-1723. [ Links ]
Frunza, L., Kosslick, H., Landmesser, H., Höft, E., Fricke, R., Host/guest interactions in nanoporous materials I. The embedding of chiral salen manganese(III) complex into mesoporous silicates., Journal of Molecular Catalysis. A: Chemical, Vol. 123, No. 2-3, Agosto, 1997, pp. 179-187. [ Links ]
Ito, Y. N., Katsuki, T., Asymmetric catalysis of new generation chiral metallosalen complexes., Bulletin of the Chemical Society of Japan, Vol. 72, N° 4, 1999, pp. 603-619. [ Links ]
Jacobsen, E. N., Catalytic Asymmetric Synthesis; I. Ojima, (ed.); New York, VCH, 1993, capítulo 4.2. [ Links ]
Johnson, R. A., Sharpless, K. B., Catalytic Asymmetric Synthesis; I. Ojima, (ed.), New York, VCH, 1993, capítulo 4.1. [ Links ]
Karandikar, P., Dhanya, K., Deshpande, S., Chandwadkar, A., Sivasanker, S., Agashe, M., Cu/Co-salen immobilized MCM-41: characterization and catalytic reactions., Catalysis Communications. Vol. 5, No.2, Feb., 2004, pp. 69-74. [ Links ]
Katsuki, T., Catalytic asymmetric oxidations., Coordination Chemistry Reviews, Vol. 140, Marzo, 1995, pp. 189-214. [ Links ]
Katsuki, T., Mn-salen catalyst, competitor of enzimes, for asymmetric epoxidation., Journal of Molecular Catalysis. A: Chemical, Vol. 113, No. 1-2, Nov., 1996, pp. 87-107. [ Links ]
Larrow, J. F., Jacobsen, E. N., A practical method for the large-scale preparation of [N,N-Bis(3,5-di-tert-butylsalicy-lidene)-1,2-cyclohexanediaminato(2-)]manganese(III) chloride, a highly enantioselective epoxidation catalyst., Journal of Organic Chemistry, Vol. 59, No 7, 1994, pp. 1939-1942. [ Links ]
Lin, G. Q., Li, Y. M., Chan. A. S. C., Principles and Applications of Asymmetric Synthesis., New York, Wiley/ Interscience, 2001. [ Links ]
Linde, C., Akermark, B., Norrby, P., Svensson, M., Timing is critical: Effect of spin changes on the diastereoselectivity in Mn(salen)-catalyzed epoxidation., Journal of American Chemical Society, Vol. 121, No. 21, 1999, pp. 5083-5084. [ Links ]
Linker, T., The Jacobsen-Katsuki epoxidation and its controversial mechanism., Angewandte Chemie International Edition in English. Vol. 36, No. 19, Oct., 1997, pp. 2060-2062. [ Links ]
Palucki, M., Finney, N. S., Pospisil, P. J., Güler, M. L., Ishida, T., Jacobsen, E. N., The mechanistic basis for electronic effects on enantioselectivity in the (salen)Mn(III)-catalyzed epoxidation reaction., Journal of American Chemical Society, Vol. 120, No. 5, 1998, pp. 948-954. [ Links ]
Saikia, L., Srinivas, D.,y Ratnasamy, P., Chemo-, regio- and stereo-selective aerial oxidation of limonene to the endo-1,2-epoxide over Mn(Salen)-sulfonated SBA-15., Applied Catalysis. A: General, Vol. 309, No. 1, Jul., 2006, pp. 144-154. [ Links ]
Schuster, C., Hölderich, W., Modification of faujasites to generate novel host for ship-in-a-bottle complexes., Catalysis Today. Vol. 60, No. 3-4, Jul., 2000, pp. 193-207. [ Links ]
Sheldon, R. A., Chirotechnology, Marcel Dekker, Inc. (ed.), New York, 1993. [ Links ]
Wang, D., Wang, M., Zhang, R., Wang, X., Gao, A., Ma, J., Sun, L., Asymmetric epoxidation of styrene and chromenes catalysed by dimeric chiral (pyrrolidine salen)Mn(III) complexes., Applied Catalysis. A: General. Vol. 315, Nov., 2006, pp. 120-127. [ Links ]
Zhang, W., Jacobsen, E.N., Asymmetric olefin epoxidation with sodium hypochlorite catalyzed by easily prepared chiral Mn(III) salen complexes., Journal of Organic Chemistry. Vol. 56, N° 7, 1991, pp. 2296-2298. [ Links ]














