Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería e Investigación
Print version ISSN 0120-5609
Ing. Investig. vol.29 no.1 Bogotá Jan./Apr. 2009
Alejandra Montenegro Hernández1 y Jorge Enrique Rodríguez Páez2
1 Ingeniera física, Universidad del Cauca, Colombia. Estudiante, Ph.D., en física, Centro atómico Bariloche, San Carlos de Bariloche, Argentina. Investigadora, Grupo de Ciencia y Tecnología de Materiales Cerámicos (CYTEMAC), Universidad del Cauca, Colombia. amontenegro@unicauca.edu.co
2 Físico, Universidad Nacional de Colombia, Bogotá. M.Sc., Ciencia y Tecnología de Materiales, Universidad Nacional Mar de Plata, Argentina. Ph.D., en Ciencias, Universidad Autónoma de Madrid, España. Investigador, Grupo de Ciencia y Tecnología de Materiales Cerámicos (CYTEMAC), Universidad del Cauca, Colombia. jnpaez@unicauca.edu.co
RESUMEN
El óxido de estaño es un compuesto ampliamente utilizado en aplicaciones tecnológicas, destacándose como catalizador, sensor de gases, y en la fabricación de varistores, conductores transparentes, electrodos electrocatalíticos y celdas fotovoltaicas, entre otras. En el presente trabajo se utilizó una sal de etilhexanoato de estaño, un ácido carboxílico y su poliesterificación, para sintetizar óxido de estaño altamente reactivo. El control del proceso de síntesis se llevó a cabo haciendo uso de espectroscopia infrarroja con transformada de Fourier (FTIR) y del registro de la variación de la viscosidad. Las características del óxido de estaño obtenido se determinaron utilizando espectroscopia infrarroja FTIR, difracción de rayos X (DRX) y microscopia electrónica de barrido (MEB). El polvo de SnO2 sintetizado y tratado térmicamente a 550 ºC permitió obtener agregados altamente densificados con un tamaño de partícula mayor a 50µm. Este resultado pone en evidencia la alta reactividad del polvo cerámico sintetizado.
Palabras clave: síntesis, óxido de estaño, poliesterificación, nanopartículas, caracterización.
ABSTRACT
Tin oxide is a widely used compound in technological applications, particularity as a catalyst, gas sensor and in making varistors, transparent conductors, electrocatalytic electrodes and photovoltaic cells. An ethylhexanoate tin salt, a carboxylic acid and polyesterification were used for synthesising highly reactive tin oxide in the present study. Synthesis was controlled by Fourier transform infrared (FTIR) spectroscopy and recording changes in viscosity. The tin oxide characteristics so obtained were determined using FTIR spectroscopy, X-ray diffraction (XRD) and scanning electron microscopy (SEM). The SnO2 dust synthesised and heat-treated at 550°C yielded high density aggregates, having greater than 50 µm particle size. This result demonstrates the high reactivity of the ceramic powders synthesised here.
Keywords: synthesis, tin oxide, polyesterification, nanoparticle, characterisation.
Recibido: abril 29 de 2008
Aceptado: marzo 3 de 2009
Introducción
La síntesis de partículas de óxidos cerámicos es un campo de gran interés científico y tecnológico debido a las propiedades físicas y químicas que ellas presentan (Klanbunde, 2001; Edelstein y Cammarata, 2002). La estructura cristalina, el tamaño y forma de las partículas, así como sus características superficiales, dependen de la ruta de síntesis utilizada para su obtención. Esto exige conocer más en detalle los métodos de síntesis de los polvos cerámicos para garantizar la calidad del producto y sus propiedades, y por lo tanto las características del dispositivo final que se fabrique con esta materia prima.
El óxido de estaño es un material semiconductor transparente con gran estabilidad química y mecánica. Tiene una fase estable conocida como casiterita, SnO2, y otra denominada romarchita, SnO (Jarzebski y Marton, 1976). Los principales yacimientos del mineral de estaño se encuentran en Brasil, Perú y Bolivia (Huamán, 1998). Al igual que el óxido de cinc, el SnO2 es un semiconductor con banda prohibida ancha y presenta una adecuada combinación de propiedades químicas, electrónicas y ópticas que lo hacen útil como material para sensores de gas (Montenegro et ál., 2007), varistores (Mosquera et ál., 2007), dispositivos optoelectrónicos, electrodos electrocatalíticos y celdas fotovoltaicas (Chopra et ál., 1983; Chatterjee et ál., 2003; Fagan y Amarakon, 1993).Las propiedades eléctricas de los cerámicos policristalinos de SnO2 dependen fuertemente de la química de los defectos que ellos contengan, los cuales son determinadas por el método de síntesis del polvo cerámico, así como la temperatura y la atmósfera utilizada para realizar el tratamiento térmico del compuesto. Diferentes métodos de síntesis han sido utilizados para obtener SnO2 puro o dopado, siendo los ms importantes: el método de precipitación homogénea (Song et ál., 2000), precipitación controlada (Ararat et ál., 2007; Montenegro et ál., 2007; Lee y Yang, 2005), precursor polimérico (Ararat et ál., 2005), y reacciones en estado sólido a través de la descomposición de carbonatos (Leite et ál., 2002) entre otros.
Otro método de síntesis ampliamente utilizado para la obtención de polvos cerámicos es el denominado sol-gel, proceso en fase líquida, muy versátil para obtener materiales cerámicos y vítreos (Brinker y Scherer, 1990). En general, el proceso sol-gel implica la transición de un sistema en un estado líquido, denominado sol, suspensión coloidal de partículas sólidas muy pequeñas, a una fase sólida, denominada "gel", sólido constituido por al menos dos fases, entre ellas la fase líquida atrapada e inmovilizada por la fase sólida (Brinker y Scherer, 1990; Farago y Cantor, 2002). Los precursores principalmente usados para la preparación del "sol" son sales inorgánicas de metal o compuestos metal-orgánicos tales como los alcóxidos. En un proceso típico sol-gel, el precursor experimenta una serie de reacciones de hidrólisis y policondensación en la solución y que llevan a la formación de una suspensión coloidal (Jolivet, 2000). La transformación posterior de sol a gel permite obtener materiales cerámicos en diversas formas, dependiendo de su aplicación (Pierre, 2002).
Giuntini y colaboradores (Giuntini et. ál., 1990) sintetizaron SnO2, del que estudiaron sus propiedades de transporte, utilizando el método sol-gel. El alcóxido de estaño que utilizaron, Sn(C4H9O)2, lo sintetizaron basados en las siguientes reacciones:
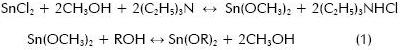
Con R= C2H5, C4H9, etc., seleccionaron el butilato Sn(C4H9O)2 porque era el único de la serie soluble en un solvente orgánico usual. En la hidrólisis del Sn(C4H9O)2 emplearon el método de polimerización de especies químicas a través de la hidrólisis parcial, utilizando para ello la razón:
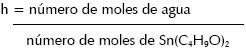
Según Giuntini, el alcóxido reaccionó fuertemente con el agua, tal que para h=2 el alcóxido reacciona inmediatamente formándose un precipitado blanco cuya fórmula química propuesta fue CH22Sn6O22. Si se toma h=1, la solución se torna clara, conformándose una suspensión nubosa blanca que llevó a la sedimentación de un precipitado y a la formación de un gel. Para obtener un gel perfecto se requirió que h<1. Luego este gel la secó a 60 °C y el polvo obtenido presentó una estructura amorfa tal que para tratamiento térmico a 350 °C su cristalización como casiteriata SnO2 se hizo evidente.
Por otro lado, Hiratsuka y colaboradores (Hiratsuka et ál., 1990) obtuvieron geles transparentes de SnO2 a partir de soluciones acuosas de SnCl4. La precipitación de las partículas de tamaño coloidal la realizaron utilizando hidróxido de amonio (6.5N) y encontraron que el pH (además de la temperatura, envejecimiento, concentración y naturaleza de los iones en solución) era un pará-metro importante para determinar las características físicas y químicas del polvo cerámico resultante. Concretamente, el valor del pH del sistema y la concentración de iones fueron muy importantes para el proceso de solvatación. El precipitado que lograron lo lavaron muchas veces, utilizando agua bidestilada para eliminar los Cl- que comprometían la estabilidad del sistema coloidal, favoreciendo la conformación de grandes agregados en el seno del mismo, y retardaba su proceso de gelación. La peptización del precipitado de oxihidróxido de estaño que se formó en la solución acuosa se vio favorecida por la presencia de NH4+ o OH- y la transición de sol a gel del sistema indujo un cambio de flujo plástico a pseudolástico en el mismo debido a la formación de una red tridimensional.
Un trabajo para caracterizar morfológicamente un gel de oxihidróxido de estaño, conformado a partir de una solución acuosa de SnCl4 utilizando la metodología sol-gel, fue realizado por Pulcinelli (Pulcinelli et ál., 1994). Los resultados del análisis del gel con dispersión de luz, microscopia electrónica y difracción de rayos X indicaron que estaba constituido por partículas cristalinas de tamaño 2-3 nm, agregadas como cadenas ramificadas rígidas.
Más recientemente Zhang y Gao (Zhang y Gao, 2004) sintetizaron nanopartículas de SnO2, utilizando el método sol-gel, empleando para ello estaño granulado. El estaño en esta presentación se disolvió en una solución de HNO3 a la que se le adicionó ácido cítrico para estabilizar la solución precursora, propiciando procesos de hidrólisis y condensación lentos. Las partículas que obtuvieron tenían un tamaño entre 2.8 y 5.1 nm con una superficie específica de 289 – 143 m2g-1, respectivamente, cuando el gel se trató térmicamente a diversas temperaturas.
En este trabajo se estudió la obtención de óxido de estaño a partir de soluciones estables utilizando como precursor etylhexanoato de estaño. Además de estructurar una adecuada metodología de síntesis, reproducible y a condiciones ambientales normales, se analizaron los principales fenómenos físico-químicos que pueden ocurrir en el interior del sistema y que llevan a la formación de las partículas de SnO2. Al final del proceso, los polvos cerámicos obtenidos se caracterizaron utilizando espectroscopia infrarroja (FTIR), difracción de rayos X (DRX) y microscopia electrónica de barrido (MEB).
Procedimiento experimental
Conformación de los soles estables de estaño
Para conformar el sol de estaño se empleó alcohol etílico (Mallinckrodt, 99,9%), como solvente, y Tin(II) 2- ethylhexanoate [CH3(CH2)3CH(C2H5)CO2] SIGMA, 95%) como precursor de estaño, con una relación 3 a 1 precursor - alcohol, es decir 20 mL de precursor con 60 mL de alcohol para obtener 80mL de solución. Se garantizó la estabilidad de la solución y se evitó la formación de precipitado. A la solución obtenida al mezclar el precursor de estaño y el etanol en las condiciones indicadas se le realizó el seguimiento de su envejecimiento utilizando espectroscopia IR, empleando para ello el espectrofotómetro FTIR Nicolet Model IR200 spectrometer, y la medida de su viscosidad, usando el viscosímetro Brook field dial viscometer modelo No. DV 111. Con estos estudios se determinó la evolución de los grupos funcionales presentes en el sistema y el avance de las reacciones de intercambio de ligandos y polinucleación, respectivamente.
Obtención y caracterización del material en polvo
Con la solución estable, luego de estudiar su comportamiento, se procedió a tratarla térmicamente a 450 y 550 °C, para eliminar tanto el solvente como el material orgánico y así obtener el óxido deseado. Este material en polvo se caracterizó utilizando espectroscopia infrarroja con transformada de Fourier (FTIR), difracción de rayos X, utilizando la radiación Kα del Cu (λ=1,54Å) a 40Kv y 60mA del difractograma marca Philips, la morfología y el tamaño de partícula fueron determinados utilizando microscopia electrónica de barrido (MEB), empleando para ello el microscopio JEOL JSM-59910LV.
Resultados y discusión
Curvas de viscosidad
Un parámetro útil para determinar el avance de las reacciones de polinucleación en la solución, es la viscosidad. Para ello se registraron los valores de viscosidad de la solución en función del tiempo durante varios días de envejecimiento del sistema; la curva de variación de la viscosidad del sistema con el tiempo se muestra en la Figura 1.
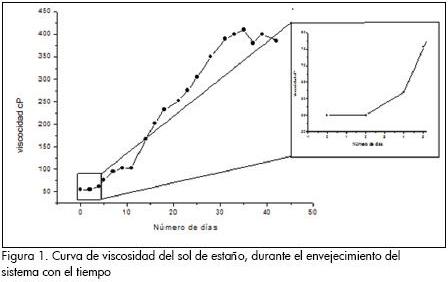
En el recuadro de la Figura 1 se observa que la viscosidad de la suspensión coloidal de estaño se mantuvo prácticamente constante durante los primeros cuatro días de envejecimiento del sistema. La principal reacción que ocurre en este periodo inicial se puede expresar como se indica a continuación, considerando que el etilhexanoato de estaño se puede representar como M(R1COOR2).
Donde R1 = CH3(CH2)3CH y R2 = CH2CH3, y analizando su reacción con el etanol se tendría (Salomon, 1992):
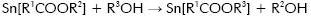
Siendo R3 = R2 = CH2CH3, lo que reitera que un alcohol es el solvente adecuado para que la sal carboxílica sea menos reactiva (Patai, 1992); esta condición es favorable si se piensa en obtener recubrimientos. Por otro lado, considerando que la reacción se realiza al medio ambiente es muy probable que el compuesto de estaño reaccione con las moléculas de agua allí presentes, tal que:
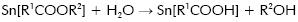
Ocasionando una reacción de hidrolisis del precursor de estaño.
Por encima de los diez días de envejecimiento, Figura 1, la viscosidad se incrementó rápidamente, haciéndose evidente un proceso de polinucleación en el sistema que ocasionó la formación interna de una red de enlaces, incrementando la rigidez del sistema y reduciendo su fluidez.
En esta región de la curva, a partir del décimo día de envejecimiento comienzan a ser importantes las reacciones de poliesterificación que llevarían a la conformación de especies polinucleares del tipo SnOOC(CH2)nCOOSn (Patai, 1992) o en forma más general, a especies polinucleares de estaño, partiendo de reacciones que permiten la formación de dímeros como la siguiente:
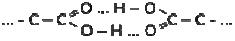
Y a través de reacciones de poliesterificación de estos dímeros se conformarían las grandes cadenas responsables de la estructura tridimensional que reduce la fluidez de la solución con el tiempo (Figura 1).
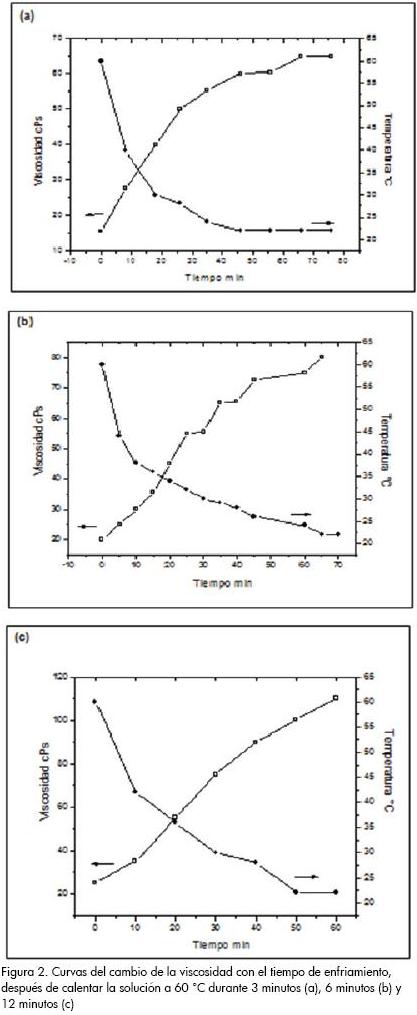
Considerando que esta solución se puede utilizar para la conformación de películas delgadas, y que la viscosidad que presenta este sistema es alta para tal fin (≥ 50 cP), se procedió a realizar un estudio de la variación de su viscosidad con la temperatura, para controlar, con ella, el valor de este parámetro y no tener que recurrir, como normalmente se hace, a la adición de solventes que disminuyan la viscosidad. Para adquirir los datos de este estudio se calentó la solución precursor de estaño-etanol a 60 °C, durante tiempos diversos, después de lo cual se siguió la variación de la viscosidad durante el enfriamiento del sistema.
En la Figura 2 se muestran los resultados del estudio y se observa que la temperatura tuvo un efecto importante sobre la viscosidad que presentó el sistema. Estas curvas indican que la solución a los 60 °C presenta una viscosidad baja, de 20 cP, en comparación con el valor de 55 cP que se tenía a temperatura ambiente. La viscosidad aumentó con el tiempo a medida que se avanzó en el proceso de enfriamiento de la solución; al alcanzarse la temperatura ambiente el valor de la viscosidad del sistema adquirió un valor prácticamente constante. De acuerdo a los resultados obtenidos, Figura 2, el procedimiento de control de la viscosidad del sistema con la temperatura, tanto calentando pero especialmente enfriando, es de gran utilidad para obtener el valor de viscosidad adecuado para conformar recubrimientos uniformes, homogéneos y con buena adherencia.
Espectroscopia Infrarroja con transformada de Fourier (FTIR)
Los espectros IR de muestras de la solución precursor de estaño-etanol tomadas durante el envejecimiento de la misma, por varios días, se muestran en la Figura 3.
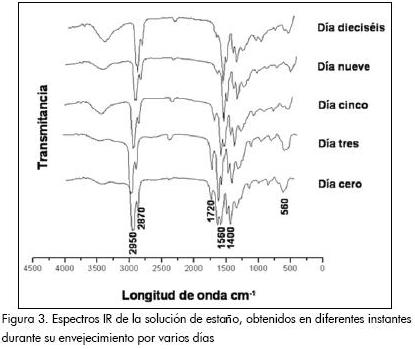
En los espectros IR de la Figura 3 es evidente una pequeña banda por encima de los 300 cm-1 y que se puede asociar al grupo funcional O-H. La banda a 1.700 cm-1, puede corresponder al modo de tensión asimétrico del COO de un complejo unidentado (Nakamoto, 1997); las bandas intensas ubicadas a 2.950 y 2.870 cm-1 corresponden al grupo funcional C-H, al igual que las que se encuentran entre 1.250-1.500 cm-1. El doblete alrededor de 1.500 cm-1 son bandas que corresponden al grupo carboxilo COO-, comúnmente en configuración bidentada. Una característica de estos espectros, que pone en evidencia el avance de las reacciones de polinucleación, es la disminución de la intensidad relativa de la banda por debajo de 1.500 cm-1 con relación a la que está por encima de este referente.
Por otro lado, la banda ubicada a 880 cm-1 corresponde al modo de tensión del C-O y contiene, además, información de las flexiones fuera del plano del grupo C-H.
La banda a 650 cm-1 corresponde al enlace Sn-O, y las ubicadas entre 560 y 490 cm-1 se pueden asociar a las frecuencias esqueletales del Sn-C correspondientes a estructuras tetraédricas, Sn(CH3)4, lineales, [Sn(CH3)2]2+, planares [Sn(CH3)3]+ o tetraédricas del tipo Sn(C2H5)4 (Nakamoto, 1997).
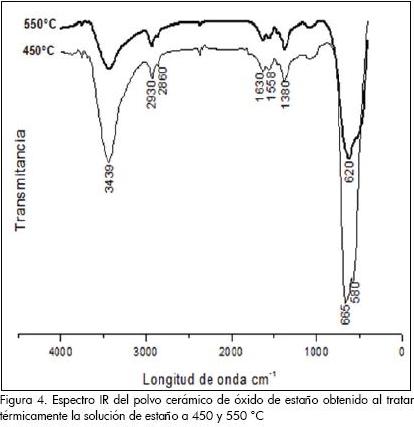
En los espectros IR de la Figura 4 son evidentes las bandas del grupo funcional O-H, ubicadas por encima de 3.000 y en 1.630 cm-1, y las correspondientes al grupo funcional C-H, a 2.930, y 2.860 cm-1. La banda a 1.558 cm-1 pone en evidencia la existencia de enlaces C-O en las muestras. Las bandas por debajo de los 900 cm-1 son atribuidas a grupos funcionales que contienen estaño, tal que las ubicadas a 665 y 620 cm-1 pueden corresponder al enlace Sn-O-Sn, y la ubicada a 580 cm-1, en la muestra tratada térmicamente a 450 °C, se puede asociar al enlace Sn-O-H.
Difracción de rayos X (DRX)
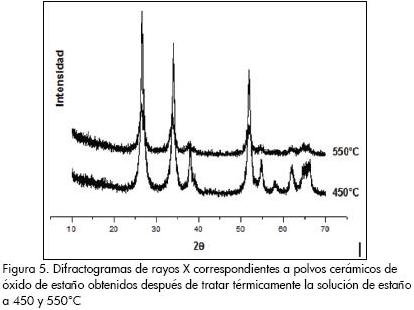
En la Figura 5 se ilustran los difractogramas correspondientes a muestras sintetizadas y tratadas a diferentes temperaturas. Para la muestra tratada térmicamente a 450 °C, su difractograma indica que la fase cristalina más importante en ella es la casiterita, SnO2 (PDF41-1445) bien cristalizada. Tratando el sólido a 550 °C se evidenció la presencia del SnO2, pero no bien cristalizado. Esto se puede justificar si se considera que al tratar la muestra a 550°C, los enlaces C-O y Sn-O-H comienzan a romperse y son ellos, en parte, los responsables de la estabilidad de la estructura del SnO2 en la muestra tratada a 450°C. Los resultados de espectroscopia IR verifican y corroboran el análisis anterior. Observando los picos de los difractogramas de la Figura 5 se puede concluir que el tamaño de cristalito es pequeño, picos más anchos en la muestra tratada a 550 °C; este resultado indica que los polvos cerámicos son muy reactivos.
Microscopia electrónica de Barrido. (MEB)
La Figura 6 muestra fotografías obtenidas con MEB del polvo cerámico sintetizado utilizando el método descrito en el presente trabajo y luego tratado térmicamente a 450 y 550 °C.

Las fotografías indican la existencia de aglomerados para la muestra tratada a 450 °C (Figuras 6(a) y 6(b), y agregados, en la muestra tratada a 550 °C (Figuras 6(c) y 6(d) ), de tamaños entre 2,5 y 5 µm, para los aglomerados y =50 µm para los agregados. La existencia de estos grandes agregados en la muestra tratada a 550 °C pone en evidencia la gran reactividad de los polvos de SnO2 sintetizados. Normalmente, el SnO2 presenta dificultad para sinterizarlo y se requiere adicionar CoO, por ejemplo, para alcanzar altos valores de densificación en el sistema; las Figuras 6(c) y 6(d) muestran agregados altamente densificados sólo tratando térmicamente el polvo de SnO2 sintetizado utilizando el método descrito en este trabajo. Dichos resultados son importantes ya que motivan el interés por determinar las condiciones adecuadas para sinterizar piezas de SnO2, a relativas bajas temperaturas, y que presenten alta densificación sin adicionar CoO o MgO para lograrlo.
Conclusiones
De este trabajo se puede concluir lo siguiente:
El método de síntesis desarrollado en este trabajo permitió obtener polvos cerámicos de óxido de estaño, altamente reactivos, tal que tratándolos a 550 °C se conformaron agregados muy densos, con un tamaño mayor a 50 µm.
El proceso desarrollado permite un control adecuado de sus principales etapas y por lo tanto la garantía de reproducibilidad del mismo. Su estudio permitió determinar que son las reacciones de poliesterificación, a partir de dímeros del tipo SnOOC(CH2)nCOOSn principalmente, las que llevan a la formación de una red tridimensional en el sistema etilhexanoato de estaño-etanol, condición que se ve reflejada en el incremento de la viscosidad de la solución durante su envejecimiento. La formación de redes Sn-O-Sn-O-Sn, tal como lo indican los resultados de espectroscopia IR, también favorecen este comportamiento.
Los resultados obtenidos en este trabajo permiten vislumbrar posibilidades de usar esta solución, con una adecuada viscosidad, para la conformación de nanoestructuras bidimensionales de SnO2 con diversas posibilidades de aplicación, en el campo de la electrocerámica. Actualmente se trabaja en esta temática.
Agradecimientos
Este trabajo fue financiado a través del proyecto Colciencias código 1103-14-17900, agradecimientos a la VRI-Unicauca por la ayuda para gestionar los recursos.
Bibliografía
Ararat, C., Varela, J. A., Rodríguez. J. E., Uso de métodos químicos para la obtención de polvos cerámicos del sistema (Sn,Ti)O2., Boletín de la Sociedad Española de cerámica y vidrio; Vol. 44, 2005, pp. 215-222. [ Links ]
Ararat, C., Mosquera, A. A., Parra, R., Castro, M. S., Rodriguez, J. E., Synthesis of SnO2 nanoparticles through the controlled precipitation route, materials chemistry and physics, Vol. 101, 2007, pp. 433 – 440. [ Links ]
Brinker, C. J., Scherer, G. W., Sol gel Science: the physics and chemistry of sol-gel processing., academic Press Inc, Boston, San diego, New York, 1990. [ Links ]
Chopra, K. L., Major, S., Pandya, P. K., Transparent conductors–A status review., Thin Solids Films; Vol. 102, 1983, pp. 63-66. [ Links ]
Chatterjee, K., Chatterjee, S., Banerjee, A., Raut, M., Pal, N., Maiti, H. S., The effect of palladium incorporation on methane sensitivity of antimony doped Tin., Materials Chemistry and Physics, Vol. 81, 2003, pp. 33-38. [ Links ]
Edelstein, A. S., Cammarata, R. C., Nanomaterials: Synthesis, Propierties and applications., Institute of Physics publishing Ltd, Series in Micro and Nanoscience and technology, Bristol, 2002. [ Links ]
Fagan, J. G., Amarakon, V. R., Realiability and reproducibility of ceramic sensors–III., Ceram. Soc. Bull., Vol. 72, 1993, pp. 119-129. [ Links ]
Farago, O., Cantor, Y., Entropic elasticity at the sol-gel transition., Europhys. Lett., Vol. 57, No. 3, 2002, pp. 458-463. [ Links ]
Gruntini, J.C., Granier, W., Zancheta, J. V., Taha, A., Sol-gel preparation and transport properties of a tin Oxide., J. Mat. Sci. Lett., Vol 9, 1990, pp. 1383-1388. [ Links ]
Huamán, F., Reyes, L., Estrada, W., Gutarra A., Detección de vapor de etanol por modificación de la conductividad eléctrica del dióxido de estaño., Tecnia., Vol. 8, 1998, pp. 77-83. [ Links ]
Hiratsuka, R. S., Pulcinelli, S. H., Santilli, C. V., Formation of SnO2 gels from dispersed sols in aqueous colloidal solutions., J. Non-crystal Solids, Vol, 121, 1990, pp. 76-83. [ Links ]
Jarzebski, J. M., Marton J. P., Physical properties of SnO2 materials-II., Marton., Electrochem. Soc., Vol. 129, 1976, pp. 299-310. [ Links ]
Jolivet, J., Metal oxide chemistry and synthesis: from solution to solid state., John Wiley & Sons, Inc., New York, 2000. [ Links ]
Klanbunde, K. J., Nanoscale Materials in chemistry., John Wiley & Sons (ed), Inc., New York, 2001. [ Links ]
Lee, J. H., Yang, Y. S., Effect of hydrolysis conditions on morphology and phase content in the crystalline TiO2 nanoparticles synthesized from aqueous TiCl4 solution by precipitation., Mater. Chem. & Phys., Vol. 93, 2005, pp. 237-242. [ Links ]
Leite, E. R., Gomes, J. W., Oliveira, M. M., Synthesis of SnO2 nanoribbons by a carbothermal reduction process., J. Nanosci. Nanotechn., Vol. 2, No. 2, 2002, pp. 125-128. [ Links ]
Marques, V., Influência do óxido de cromo nas propriedades varistoras do óxido de estanho., Tesis presentada en el instituto UNESP de Araraquara, para optar al grado de Magíster en química., 2003. [ Links ]
Montenegro, A., Ponce, M., Castro, M., Rodríguez, J., SnO2–Bi2O3 and SnO2–Sb2O3 gas sensors obtained by soft chemical method., Journal of the european ceramic society, Vol, 27, 2007, pp. 4143-4146. [ Links ]
Montenegro, A., Castro, M., Rodríguez, J., Efecto del lavado con etilendiamina sobre las propiedades de las nanopartículas de óxido de estaño., Boletín de la sociedad española de cerámica y vidrio, Vol. 46, No. 4, 2007, pp. 177-183. [ Links ]
Mosquera , A. A., Varela, J. A., Bueno, P. R., Rodriguez, J. E., Synthesis of SnO2 by chemical routes and its use in varistor production., Journal of the european ceramic society, Vol 27, No. 13-15, 2007, pp. 3893-3896. [ Links ]
Nakamoto, K., Infrared and Raman spectra of inorganic and coordination compounds Part B., John Wiley & Sons, fifth edition, Inc., New York, 1997. [ Links ]
Solomons, T. W. G., Organic Chemistry., John Wiley & Sons, Inc. Fifth edition, New York, 1992. [ Links ]
Song, K. Ch., Kang, Y., Preparation of high surface area tin oxide powders by a homogeneus precipitation method., Materials Letters., Vol. 42, 2000, pp. 283-289. [ Links ]
Patai, S., Chemistry of Carboxylic Acids an Esters., Wiley Intersciencie (ed), New York, 1992. [ Links ]
Pierre, A. C., Introduction to sol-gel processing., Kluwer academic Publishers Boston, 2002. [ Links ]
Pulcinelli, S. H., Santilli, C. V., Jolivet, J. P., Tronc, E., Morphological characterization of aqueus tin oxyhydroxide gel., J. Non-crystal solids, Vol. 170, 1994, pp. 21-26. [ Links ]
Zhang, J. Gao, L. J. Synthesis and characterization of nanocrystalline tin oxide by sol-gel method., Solid Stat. Chem. Vol. 177, 2004, pp. 1425-1430. [ Links ]














