Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería e Investigación
Print version ISSN 0120-5609
Ing. Investig. vol.29 no.1 Bogotá Jan./Apr. 2009
Carlos Alberto Guerrero Fajardo1 y Francisco José Sánchez Castellanos2
1 Químico e Ingeniero mecánico. M.Sc., Ingeniería Ambiental. Ph.D., Ingeniería Química. Profesor, Departamento de Química, Universidad Nacional de Colombia. caguerrerofa@unal.edu.co
2 Químico e Ingeniero químico, M.Sc. y Ph.D. en Química. Profesor pensionado, Universidad Nacional de Colombia. fjsanchezc@unal.edu.co
RESUMEN
Materiales de hierro-molibdeno soportados sobre sílice fueron obtenidos por el método sol-gel para evaluar su actividad catalítica en la reacción de oxidación selectiva de metano hasta formaldehído. Este método permite obtener un área superficial extensa y una alta dispersión de los metales sobre la superficie amorfa de la sílice. Se prepararon siete (7) catalizadores, uno del soporte de sílice, otro con carga de Fe 0,5% sin molibdeno, y los otros cinco (5) con la misma carga de Fe 0,5% pero con cargas variables de molibdeno entre 0,1-1,0% en peso. Las mayores áreas BET fueron del orden de 830 y 879 m2.g-1 para los catalizadores 2 (Fe0,5%-Mo0%) y 4 (Fe0,5%-Mo0,3%), con porcentajes promedio de 28% de microporosidad y 47% de mesoporosidad. La difracción de rayos X confirma la estructura amorfa de los catalizadores. El espectro TPR mostró bajo consumo de hidrógeno, atribuido a la ausencia de especies aisladas de Fe y Mo. El análisis ESCA registró la misma relación atómica Fe/Mo en la superficie del catalizador como en el bulk. La actividad catalítica es determinada a presión atmosférica, con mezcla de reacción CH4/O2/N2 =7.5/1/4, intervalo de temperatura 400-800 °C. Los catalizadores 4 (Fe0,5%-Mo0,3%), 5 (Fe0,5%-Mo0,5%) y 7 (Fe0,5%-Mo1,0%) presentan la mayor conversión de metano, mientras los catalizadores 5 (Fe0,5%-Mo0,5%), 4 (Fe0,5%-Mo0,3%), 2 (Fe0,5%-Mo0%) y 7 (Fe0,5%-Mo1,0%) dan los mejores resultados de producción de formaldehído. Para el catalizador 4 (Fe0,5%-Mo0,3%), la mayor conversión (4,07 mol%) se presenta a 700 °C. A esta temperatura la producción de formaldehído es de 202,0 gHCHO.kg-1cata.h-1.
Palabras clave: catalizadores Fe-Mo/SiO2, formaldehido, oxidación selectiva: sol-gel.
ABSTRACT
The selective oxidation of methane to formaldehyde was analysed using iron-molybdenum catalysts supported on silica prepared by the sol-gel method which leads to obtaining a greater surface area and high iron and molybdenum metal dispersion on the silicas amorphous surface. Seven catalysts were prepared, one of them as silica support, another as 0.5% wt iron load without molybdenum and the remaining five having 0.1%-1.0% weight molybdenum and 0.5% wt iron loads. The highest BET areas were 830 and 879 m2.g-1 for catalysts 2 (0.5% Fe - 0% Mo) and 4 (0.5% Fe - 0.3% Mo) respectively, having 28% average microporosity and 47% average mesoporosity. X-ray diffraction confirmed the catalysts amorphous structure. The TPR spectrum showed low hydrogen consumption attributed to the absence of isolated Fe and Mo species. ESCA analysis revealed the same Fe/Mo atomic ratio on the catalyst surface as in the bulk preparation. Catalytic activity was carried out at atmospheric pressure, CH4/ O2/N2 = 7.5/1/4 reaction mixture, 400-800°C temperature interval. Catalysts 4 (0.5% Fe - 0.3% Mo), 5 (0.5% Fe - 0.5% Mo) and 7 (0.5% Fe - 1.0% Mo) displayed greater methane conversion, whereas catalysts 5 (0.5% Fe - 0.5% Mo), 4 (0.5% Fe - 0.3% Mo), 2 (0.5% Fe - 0% Mo) and 7 (0.5% Fe - 1.0% Mo) gave better formaldehyde product results. The highest conversion per-centage (4.07% mol) was presented at 700°C for catalyst 4 (0.5% Fe-0.3% Mo). Formaldehyde yield was 202,0 gHCHO.kg-1cata.h-1 at this temperature.
Keywords: Fe-Mo/SiO2 catalysts, formaldehyde, selective oxidation, sol-gel.
Recibido: junio 18 de 2008
Aceptado: marzo 9 de 2009
Introducción
La oxidación selectiva de metano (MSO) para obtener formaldehído como producto de mayor valor agregado, ha sido de gran interés en las últimas décadas por razones económicas y por los efectos ambientales del metano en el calentamiento global (Guerrero, 2007).
El gas metano es una materia prima de gran potencial en muchos países, tanto como combustible fósil proveniente de pozos de gas y asociado a la producción petrolera, o como biogás resultante de los sistemas de tratamiento anaeróbico de aguas residuales y de residuos sólidos de origen doméstico e industrial (Guerrero, 2006).
El formaldehído se produce por oxidación catalítica de metanol en fase de vapor, siendo uno de los productos químicos más importantes a nivel mundial por su bajo costo, alta pureza y la amplia gama de aplicaciones, en especial para la producción de resinas termoestables, principalmente resinas fenólicas, de urea, y melamina que son utilizadas como adhesivos y aglutinantes en la industria (Guerrero, 2008).
El principal objetivo de la reacción MSO está en producir formaldehído en una sola etapa y no en las tres que considera la costosa etapa de reformado de metano (Herman, 1997):
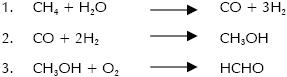
La mayoría de investigaciones relacionadas con la oxidación directa y selectiva del metano hasta formaldehído provee información sobre el desarrollo de catalizadores de óxidos metálicos (Herman, 1997).
Para la reacción de oxidación directa de metano se requiere activar tanto la molécula de metano como la de oxígeno a través de la participación de sitios activos en la superficie del catalizador, esto se puede hacer simultáneamente si se colocan sobre la superficie las dos especies activantes. Para la activación del oxígeno pueden ser usados los semiconductores tipo p, ellos actúan como oxidantes, e.j.: AgO, Cu2O, CuO, CoO, MoO3, V2O5. Para la activación del metano, los semiconductores tipo n pueden ser utilizados, ellos actúan como deshidrogenantes y deshidratantes, e.j.: SnO2, Al2O3, Fe2O3, ZnO, CaO, TiO2 y Sb2O4 (Sánchez, 1989).
Teniendo en cuenta el trabajo realizado por varios investigadores sobre el desempeño de la superficie de la sílice en la reacción de oxidación parcial de metano que está afectada por el método de preparación (Parmaliana, 2002; Arena, 2000), que el método de preparación con precursores de Fe (II) mejora la dispersión de la fase activa de hierro aumentando la producción de formaldehído (Arena, 2004), y que esto se puede relacionar con las especies Fe3+ (Kobayashi, 1996), se estableció en este trabajo utilizar el método sol-gel a partir de precursores de Fe (II) y Mo(II) con el fin de mejorar la selectividad y el rendimiento en la oxidación de metano hasta formaldehído.
Desarrollo experimental
Preparación de los catalizadores
El procedimiento sol-gel para la síntesis de catalizadores de óxidos metálicos soportados sobre sílice facilita obtener altas áreas superficiales a través de precursores metalorgánicos que se hidrolizan cuidadosamente con acondicionamiento del pH del medio y la temperatura de la reacción de condensación (Lambert, 1997). Durante el proceso de transformación de sol a xerogel, el pH del sol junto con el tiempo de maduración, son variables que determinan la estructura del poro del producto final (Chu, 1997).
En la preparación de nanocompuestos de hierro-sílice por síntesis sol-gel, la red de sílice se forma más rápidamente que la red de óxido de hierro (Tongpool, 2004). La estructura de poro de la sílice, usando alquilsilicatos como precursores, está definida por el tamaño y geometría del empaquetamiento de las partículas de sílice; en este sentido, a un valor de pH, los alquilsilicatos que tienen más pequeños grupos alquilo reaccionan más rápido con agua, produciendo partículas más pequeñas (Chu, 1997).
Muestras de sílice dopadas con hierro y preparadas por la técnica sol-gel para analizar sus propiedades ópticas, dan como alternativa de preparación la utilización de HF para conseguir una solución homogénea y facilitar la incorporación del hierro, con precursor de FeO al 5% mol (Mendoza, 2002).
Catalizadores de óxidos de vanadio soportados sobre sílice mesoporosa han resultado ser muy activos y selectivos hacia la formación de formaldehído en la reacción de oxidación parcial de metano (Nguyen, 2006).
La alta dispersión de MoO3 en los catalizadores soportados sobre sílice muestra una actividad relativamente alta para la oxidación parcial de metano hasta compuestos oxigenados en exceso de vapor de agua, debido a la generación del ácido silicomolíbdico sobre la superficie del catalizador (Sugino, 2000).
La preparación del gel de hierro y molibdeno se realiza utilizando solución etanólica de las sales precursoras de los componentes del catalizador soportado, principalmente el alcóxido de silicio y las sales de hierro (II) y molibdeno (II) que deben ser solubles en el solvente del etanol absoluto. Las sales precursoras utilizadas fueron: tetraetil ortosilicato (TEOS) del 98% (Acros organics product), acetato de hierro (II) anhidro del 95% (Aldrich) y Molybdenum (II) acetate dimer, 99% (Strem Chemicals).
Se utiliza la proporción molar: Si(OC2H5)4/ oxálico/agua: 4/2/15 y ácido nítrico en solución diluida para evitar la precipitación de las especies metálicas de hierro y molibdeno. El gel formado es secado en estufa durante 12 horas a una temperatura de 90 °C y pasa luego a calcinación en un horno a temperatura controlada de 400 °C (rampa de calentamiento de 2 °C/minuto) hasta completar 8 horas de calcinación (Guerrero, 2006, 2007, 2008).
Se prepararon siete (7) catalizadores, uno del soporte de sílice (catalizador 1), otro con carga de hierro 0,5% sin molibdeno (catalizador 2) y los otros cinco con la misma carga de 0,5% de Fe pero con cargas variables de molibdeno: 0,1% (catalizador 3); 0,3% (catalizador 4); 0,5% (catalizador 5); 0,7% (catalizador 6) y 1,0% (catalizador 7) de carga en peso del metal.
Caracterización de los catalizadores
Superficie activa y porosidad
El equipo utilizado para hacer las mediciones es un porosímetro Coulter SA 3100, con el cual se tomaron automáticamente las isotermas de adsorción a 77 K (Bedel, 2002).
Microscopía Electrónica de Transmisión (MET)
El equipo empleado es un microscopio de alta resolución de tipo EM-002B de Topcon, con una tensión de aceleración de 200 KV, el cual tiene acoplado un sistema de análisis de espectroscopia de energía dispersiva de rayos X (XEDS KEVEX Deltapro Quantum).
Reducción a temperatura programada (TPR)
Esta técnica permite identificar las especies potencialmente reducibles (óxidos metálicos) del catalizador, por medio de la medida del hidrógeno consumido en función de la temperatura. En nuestro estudio, permite establecer la inserción de los metales dentro de la estructura de la sílice y la posibilidad de formación de especies aisladas de cada uno de los dos metales.
Microscopia electrónica de barrido (MEB)
El equipo usado es un microscopio JEOL 6700 SEM que opera entre 0.5–3.0 kV con resolución última de 1.0 nm y un rango de ampliación de 10X hasta 700.000X.
Espectroscopia fotoelectrónica de rayos X ( XPS)
El equipo utilizado es un espectrómetro VG (Vacuum Generators) ESCA 3, operando a alto vacío de 5x10-7 Pa. Los rayos X provienen de magnesio (línea Ka, h?= 1253,6 e.V) (Provendier, 2002).
Difracción de rayos X (XRD)
El análisis XRD se ejecuta en un equipo para material en polvo, marca Siemens de tipo D5000, equipado de un anticátodo de cobre (línea Kα, λ = 1,5406 Å) o de cobalto (línea Kα, λ = 1,7890 Å). El programa de análisis incluye un ángulo de barrido: 10° ≤ 2θ ≤ 90°, paso en 2Φ: 0.015 grados y tiempo de conteo: 1 s; difractogramas XRD de muestras de sílice y de hierro soportados sobre sílice, preparadas por el método sol-gel, no presentan picos de estructuras cristalinas en el espectro XDR aun después de la calcinación a 800 °C (Tongpool, 2004).
Actividad catalítica
La reacción de la oxidación selectiva de metano se llevó a cabo a presión atmosférica en un reactor de cuarzo en U, con diámetro interior de 6.6 mm (Figura 1). La mezcla de reacción está dada por la relación (CH4/O2/N2 = 7.5/1/4) (Nguyen, 2004). Los gases de entrada se introducen independientemente y sus flujos se controlan con flujómetros másicos tipo Brooks 5850, mediante sistemas electrónicos.
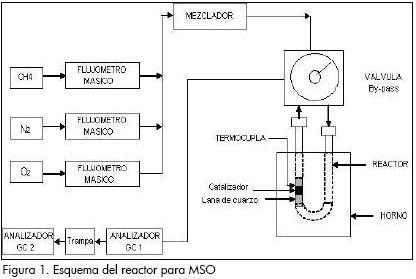
Los productos de reacción se analizan mediante cromatografía de gases en dos vías, la primera con el cromatógrafo tipo Delsi con columnas Hayesep (polímero poroso) R y T, con detector de conductividad térmica para permitir la identificación de varios productos, entre ellos metano, CO2, etano, eteno, formaldehído, agua y metanol, y el segundo cromatógrafo tipo Varian, provisto de malla molecular de 5 Å con detector TCD que facilita la resolución relacionada con la identificación de O2 y N2 y además el análisis de CH4 y CO.
Resultados y discusión
Caracterización de catalizadores
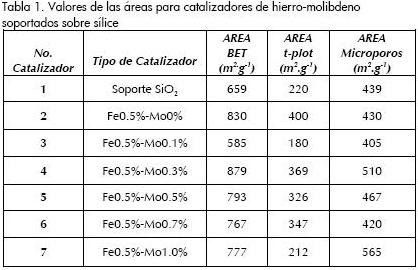
Las áreas obtenidas por el método BET para los diferentes catalizadores, se relacionan en la Tabla 1. Las áreas superficiales de los sólidos presentan en promedio un valor de 756 m2.g-1, del cual se encuentran alejados los catalizadores 3 y 4, área BET 585 y 879 m2.g-1, respectivamente. Las áreas superficiales de estos catalizadores son mayores a la que presenta el soporte de sílice, 659 m2.g-1 (Guerrero, 2006, 2007, 2008), a excepción del catalizador 3. Estas grandes superficies son fundamentales para obtener una buena dispersión de óxidos metálicos.
La distribución del tamaño de los poros se establece a través del método BJH diseñado como método estándar de la ASTM para realizar cálculos sobre mesoporos. La distribución del tamaño de poros por el método de adsorción BJH muestra los siguientes resultados, presentados en la Tabla 2.
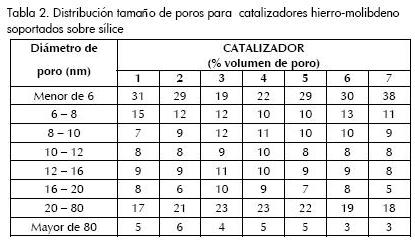
Los catalizadores exhiben un porcentaje promedio alrededor del 28% de microporosidad, e igualmente poseen un promedio del 47% para el intervalo de mesoporos, entre 6 y 20 nm.
La mayor área superficial de los catalizadores de hierro-molibdeno soportados sobre sílice la presenta el catalizador 4 (Fe0,5%-Mo 0,3%) con un valor de 879 m2.g-1, lo cual corresponde a un 33% mayor que el área del soporte de sílice (659 m2.g-1) y a un 14% mayor que el área promedio de los catalizadores preparados de hierro-molibdeno (772 m2.g-1); este análisis conduce a establecer que la inserción metálica favorece el incremento de la superficie del catalizador. Por otra parte, se presenta efecto sobre la porosidad de los sólidos, ya que el catalizador 4 tiene menor microporosidad que el soporte (22% comparado con 31%) y mayor mesoporosidad, entre 6 y 20 nm, que el soporte (50% comparado con 47%). La inserción metálica al mismo tiempo que favorece la superficie del soporte, permite mejorar la dispersión metálica sobre la superficie del catalizador.
Las microfotografías MEB tomadas a los diferentes catalizadores de hierro-molibdeno, catalizador 1 (Foto 1) con un aumento X10000; catalizador 2 (Foto 2) con un aumento X3000; catalizador 3 (Foto 3) con un aumento X100000; catalizador 4 (Foto 4) con un aumento X2000, muestran en todos los casos una estructura amorfa continua con aglomerados, forma general de presentación de la sílice preparada por el método sol-gel y calcinada a 400 °C.




No se identifica ninguna diferencia entre los catalizadores con la carga del metal, ni con el hierro que está en un porcentaje del 0,5% en los catalizadores de las Fotos 2, 3 y 4, ni con la presencia de molibdeno en porcentajes del 0%, 0,1% y 0,3% para los catalizadores 2, 3 y 4 respectivamente.
El material amorfo se presenta en forma continua como en las Fotos 1 y 2, o discreta en gránulos de diferentes tamaños, como en las Fotos 3 y 4.
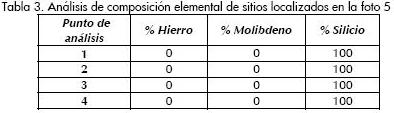
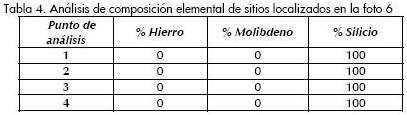
Se realizaron análisis MET de los catalizadores 5 y 7 que presentan cargas del 0,5% en peso de hierro y del 0,5% y 1,0% de molibdeno, respectivamente. Las fotografías fueron tomadas con aumento de 20 KX, catalizador 5 (Foto 5) y catalizador 7 (Foto 6). La información del análisis elemental hecho en diversos puntos de la muestra (para ambos casos se toman cuatro puntos), para el catalizador 5 (Tabla 3) y para el catalizador 7 (Tabla 4), no se reporta la presencia de los metales Fe y Mo, indicando una alta dispersión metálica.
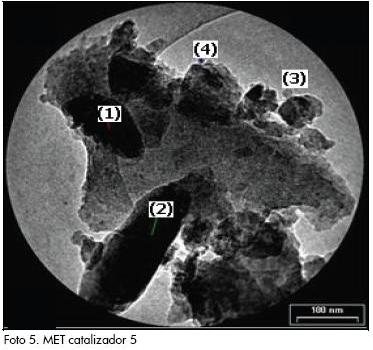
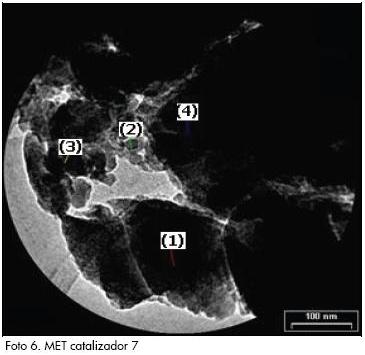
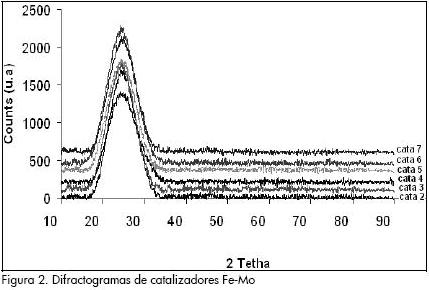
El análisis de XDR de los catalizadores preparados indica la presencia de una banda ancha centrada en un valor aproximado de d = 3.8 y a un máximo de 2θ = 23. En estos intervalos se pueden encontrar las estructuras de silicio como la cristobalita y el cuarzo, pero no corresponden a la estructura amorfa que exhiben los catalizadores preparados por el método sol-gel. Se puede decir que la estructura base que muestran los diferentes difractogramas de los catalizadores de hierro-molibdeno en la Figura 2, es el óxido de silicio dentro de la matriz amorfa. Se presentan los difractogramas de los catalizadores 2 a 7 para observar la forma constante de la banda ancha que caracteriza la estructura amorfa de la sílice.
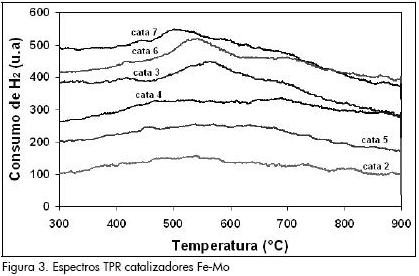
Los experimentos de reducción a temperatura programada (TPR) se llevaron a cabo con flujo de 5% hidrógeno/argón en el rango de temperatura entre 200 y 900 °C, con una variación de 20 °C/min y una masa de 50 mg de catalizador. Los resultados mostraron consumos relativamente bajos de hidrógeno sin mostrar picos de consumo relacionados con las especies posibles de reducción como Fe2O3, FeO, MoO3 y MoO2, indicando que los dos metales se hallan dispersos en alta proporción dentro de la matriz de la sílice y no hay formación de especies aisladas de óxidos de los dos metales (Figura 3). Los catalizadores 6 y 7 son los únicos que presentan un ligero consumo de hidrógeno, como se observa en la banda ancha localizada entre 500 y 600 °C, atribuida a la especie Fe+3 diluida dentro de la matriz de sílice, ya que las especies de molibdeno despliegan picos de reducción en los valores estimados de 590 y 950 °C (Yang, 2000).
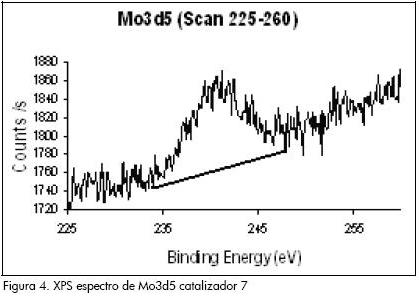
La espectroscopia XPS se hizo para el catalizador 7 (Fe 0,5%-Mo 1%), donde se destaca el intervalo entre 225 y 260 eV que corresponde a la banda del molibdeno (Mo3d5) (Figura 4).
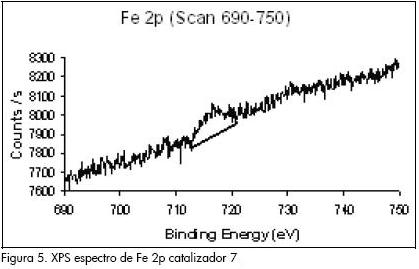
La relación atómica en porcentaje determinada por las áreas de las bandas para el hierro (intervalo 690-750 eV), (Figura 5), y la del molibdeno, son: 46,81% (Fe2p) y 53,19% (Mo3d5); este resultado corresponde exactamente a los porcentajes atómicos de los metales en la preparación del bulk para el catalizador 6, que son: 53,79 % atómico Mo y 46,20% atómico para Fe. En conclusión, se puede establecer que los porcentajes de los metales tanto en el bulk como en la superficie son los mismos.
Actividad catalítica
Los ensayos de actividad catalítica se realizaron en el intervalo entre 400 y 750 °C, utilizado en anterior estudio (Guerrero, 2006, 2007), pero ampliándose en algunos casos hasta 800 °C con el fin de establecer el máximo en la producción del formaldehído.
Las conversiones de metano obtenidas para los seis catalizadores Fe-Mo se observan en la Figura 6, donde la conversión de metano aumenta con la temperatura de reacción, con mejores resultados para los catalizadores 4 (Fe0,5%-Mo0,3%), 2 (Fe0,5%-Mo0%), 7 (Fe0,5%-Mo1,0%) y 5 (Fe0,5%-Mo0,.5%).
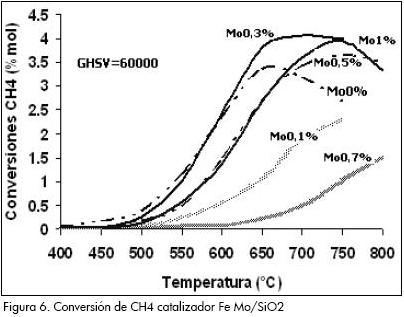
La Tabla 5, contiene los resultados de actividad de los catalizadores con mayor reactividad en términos de conversión de metano, selectividades de productos y rendimiento de formaldehído para la reacción de MSO.
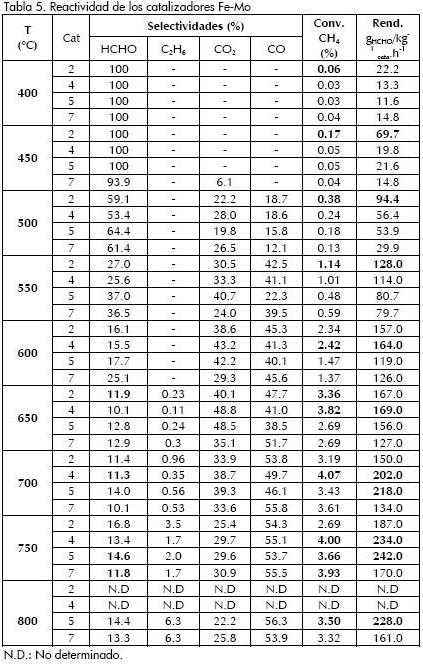
A la temperatura de 650 °C, las conversiones de metano en % mol son: 3,82, 3,36, 2,69 y 2,69 para los catalizadores 4, 2, 5 y 7, respectivamente. También de la Tabla 5 se puede concluir que la máxima conversión de metano se consigue con el catalizador 4 (4,07%mol) a 700 °C y que la producción máxima de formaldehído se obtiene con el catalizador 5 (242,0 gHCHO/kg-1cata.h-1) a la temperatura de 750 °C.
El soporte de sílice (catalizador 1) señala una baja de conversión de metano, obteniéndose la máxima conversión de 0,50%mol, y su máximo rendimiento de 68,3 gHCHO.kg-1cata.h-1, a 800 °C, valores pequeños para estimar el soporte de la sílice como un buen catalizador para la reacción de MSO.
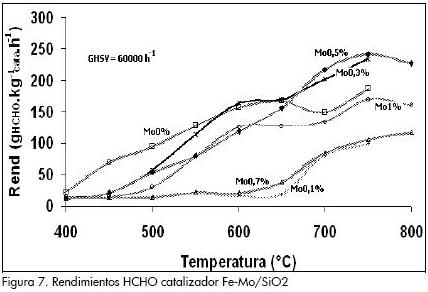
En la Figura 7, se registran los rendimientos comparativos de los seis catalizadores de Fe-Mo evaluados. Se observa que los catalizadores 4 (Fe0,5%-Mo0,3%) y 5 (Fe0,5%-Mo0,5%) presentan los mejores rendimientos a temperaturas entre 700 y 750 °C. Para el catalizador 4; 202,0 y 234,0 gHCHO.kg-1cata.h-1 catalizador respectivamente, y para el catalizador 5; 218,0 y 242,0 gHCHO.kg-1cata.h-1 respectivamente. Pero a la temperatura de 650 °C, la producción de formaldehído es muy similar para los catalizadores 2, 4 y 5, indicando que la presencia del molibdeno dentro de la estructura del catalizador mejora el rendimiento o la producción del formaldehído, pero a temperaturas superiores de 650 °C.
La selectividad del formaldehído decrece con el incremento de temperatura; los valores promedios para los mejores catalizadores analizados (2, 4, 5 y 7) son del orden del 12%, 11,5% y 14% para las temperaturas de 650, 700 y 750 °C, respectivamente.
Los resultados obtenidos para el catalizador 4 (Fe 0,5%-Mo 0,3%) preparado por el método sol-gel; el porcentaje de conversión de metano de 4,07% mol, selectividad de HCHO 11,3%mol y la producción de 202,0 gHCHO.kg-1cata.h-1 a la temperatura de 700 °C, son comparables con algunos trabajos realizados por R.G. Herman et ál (Herman, 1997), donde obtienen conversiones de metano de 4,3 hasta 6,2%mol y selectividades de HCHO entre 10,8 hasta 16,3%mol para catalizadores de V2O5 con cargas entre 0,5-2,0% soportados sobre sílice y a una temperatura de 600 °C.
Los resultados de R.G. Herman et ál con catalizadores de 2% MoO3 sobre Cab-O-Sil (EH-5) sólo produjeron conversiones de metano de 0,08%mol y selectividad de HCHO de 100%mol, aspecto corroborado por los investigadores de la reacción de oxidación de metano, donde las altas selectividades de formaldehído están relacionadas con bajas conversiones de metano y el aumento de la conversión de metano incide directamente en la reducción de la selectividad del formaldehído.
Conclusiones
Los resultados obtenidos permiten establecer que los catalizadores de hierro-molibdeno soportados sobre sílice y preparados por el método sol-gel en las condiciones propuestas en el presente estudio son una buena alternativa para mejorar la productividad del formaldehído en la oxidación selectiva del metano, y que la introducción del segundo metal de molibdeno dentro de la estructura incrementa tanto la conversión del metano como el rendimiento del producto formaldehído, a temperaturas superiores de 650 °C. El método de preparación sol-gel es muy importante en el proceso de formación del sólido para obtener la dispersión de especies de óxidos metálicos dentro de la matriz de la sílice, aspecto básico para mejorar la selectividad y el rendimiento de la reacción de oxidación del metano hasta formaldehído, y que puede servir de referencia para la preparación de otros óxidos metálicos en estudios posteriores.
Agradecimientos
Esta investigación se adelantó en los laboratorios de Materiales, Superficies y Procesos Catalíticos de la Universidad Louis Pasteur, en la ciudad de Estrasburgo, Francia, con la colaboración especial del profesor Alain Kiennemann y del personal profesional y técnico.
Bibliografía
Arena, F., Frusteri, F., Parmaliana, A., Modelling the partial oxidation of methane to formaldehyde on silica catalyst., Applied Catalysis A: General 197, 2000, pp. 239-246. [ Links ]
Arena, F., Gatti, G., Coluccia, S., Martra, G. A., Parmaliana., Catalysis Today 91-92, 2004, pp.305-309. [ Links ]
Bedel, L., Structure et réductibilité de pérovskites La-Co-Fe. Application à la synthèse Fischer-Tropsch., Thèse de doctorat de lUniversité Louis Pasteur de Strasbourg-France, 2002. [ Links ]
Chu, L., Tejedor-Tejedor, M.I., Anderson, M.A. Particulate sol-gel route for micropourous silica gels. Microporous Materials 8, 1997, pp. 207-213. [ Links ]
Guerrero, C. A., Oxidación selectiva de metano hasta formaldehído., Tesis doctorado en Ingeniería Química, Universidad Nacional de Colombia, Bogotá, 2007. [ Links ]
Guerrero, C. A., NGuyen, Y., Courson, C., Roger, A. C., Catalizadores Fe/SiO2 para la oxidación selectiva de metano hasta formaldehído., Ingeniería e Investigación, Vol 26, No. 2, 2006, pp.37-44. [ Links ]
Guerrero, C. A., Niznansky, D., NGuyen, Y., Courson, C., Roger, A. C., Methane selective oxidation to formaldehyde with Fe-catalysts supported on silica or incorporated into the support., Catalysis Communications, 9, 2008, pp. 864-869. [ Links ]
Herman, R. G., Sun, Q., Shi, C., Klier, K., Wang, C., Hu, H., Wachs I. E., Bashin, M., Development of active oxide catalysts for the direct oxidation of methane to formaldehyde., Catalysis Today, 37,1997, pp. 1-14. [ Links ]
Kobayashi, T., Guilhaume, N., Miki, J., Kitamura, N., Haruta, M., In situ Raman spectroscopy. A powerful tool for studies in selective catalytic oxidation., Catalysis Today 32, 1996, pp. 171-175. [ Links ]
Lambert, C. K., González, R. D., Rh/SiO2 catalysts prepared by the sol-gel method., Microporous Materials, 8, 1997, pp. 179-188. [ Links ]
Mendoza, D., Barboza-Flores, M., Bernal, R., Jiménez-Sandoval, S., Castaño, V. M., Inorganic Materials, Vol. 38, No.1, 2002, pp. 45-47. [ Links ]
Nguyen, L. D., Loridant, S., Launay, H., Pigamo, A., Dubois, J. L., Millet, J. M. M., Study of new catalysts base don vanadium oxide supported on mesoporous silica for the partial oxidation of methane to formaldehyde: catalytic properties and reaction mechanism., Journal of Catalysis, 237, 2006, pp. 38-48. [ Links ]
Nguyen, Y., Roger, A., Rapport de stage., Université Louis Pasteur, ULP, 2004. [ Links ]
Parmaliana, A., Arena, A., Frusteri, F., Martinez-Arias, F., LópezGranados, A., Fierro, M., Effect of Fe-adittion on the catalytic activity of silicas in the partial oxidation of methane to formaldehyde., Applied Catalysis A: General 226, 2002, pp. 163-174. [ Links ]
Provendier, H., Etude de la solution solide LaNixFe(1-x)O3 comme précurseur de catalyseur pour la transformation du méthane en gaz de synthèse., Thèse de doctorat de lUniversité Louis Pasteur de Strasbourg-France, 2002. [ Links ]
Sánchez, F. J., Estudio de catalizadores y cinética para la oxidación selectiva de etanol a acetaldehído., Tesis de Maestría en Ingeniería Química, Universidad Nacional de Colombia, Bogotá, 1989. [ Links ]
Sugino, T., Kido, A., Azuma, N., Ueno, A., Udagawa, Y., Partial oxidation of methane on silica-supported silicomolybdic acid catalysts in an amount of water vapor., Journal of Catalysis 190, 2000, pp. 118-127. [ Links ]
Tongpool, R., Jindasuwan, S., Sol-gel synthesis and characterization of iron oxide-silica nanocomposites., Surface and Interface Analysis, 36, 2004, pp. 1130-1132. [ Links ]
Yang, X., Jung, K., Cho, S., Joo, O., Uhm, S., Han, S., Catalysis letters, 64, 2000, pp.185. [ Links ]














