Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Ingeniería e Investigación
Print version ISSN 0120-5609
Ing. Investig. vol.30 no.1 Bogotá Apr. 2010
John Jairo Gallo Castro1, Bibiana Margarita Vallejo Díaz2 y Clara Eugenia Plazas Bonilla3
1 Químico farmacéutico. M.Sc., en Ciencias Farmacéuticas, Universidad Nacional de Colombia. jjgalloc@unal.edu.co 2 Química farmacéutica. M.Sc,. en Ingeniería de Materiales. Esp., en Gerencia de Tecnología. Candidata a Ph.D., en Ingeniería Química, Universidad Nacional de Colombia. Profesor asistente, Facultad de Ciencias, Departamento de Farmacia, Universidad Nacional de Colombia. bmvallejod@unal.edu.co 3 Química farmacéutica. DE.A. Ciencia y Tecnología de Alimentos, Universidad Católica de Lovaina, Bélgica. Profesor asistente, Facultad de Ciencias, Departamento de Farmacia, Universidad Nacional de Colombia. ceplazasb@unal.edu.co
RESUMEN
El Sector Farmacéutico está constituido por los subsectores: medicamentos, cosméticos, fitoterapéuticos, artículos de aseo y limpieza e insumos para la salud, el subsector de medicamentos lo integran organizaciones que elaboran, importan y comercializan estos productos. La mayoría de estudios sobre la industria de medicamentos se direccionan a los aspectos económicos sin evaluar los aspectos tecnológicos de los procesos productivos, razón por la cual se propone una metodología para evaluar y describir el sector productor de medicamentos de acuerdo con su grado de desarrollo tecnológico, empleando el concepto capacidad de manufactura.El estudio fue llevado a cabo con la información obtenida de las bases de datos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima), de plantas de producción de medicamentos en la ciudad de Bogotá que realizan procesos de transformación de materiales. El estudio permitió la identificación de tres características que definen la capacidad de manufactura de los laboratorios farmacéuticos: las relacionadas con el grupo farmacológico al que pertenecen los principios activos, las que corresponden a especificaciones del medicamento por su condición de esterilidad, y las asociadas a la tecnología requerida para la fabricación de cada forma farmacéutica. Como resultado, se presenta un análisis de estas características y se identifican algunas tecnologías que no han sido transferidas o asimiladas por las organizaciones bajo estudio, encontrando en la capacidad de manufactura un criterio para ser considerado como indicador del grado de desarrollo tecnológico del subsector en Colombia.Palabras clave: capacidad de manufactura, transferencia de tecnología, Sector Farmacéutico Industrial Productor, proceso de transformación de materiales, medicamento.
ABSTRACT
The pharmaceutical industrial has five subsectors: medicines, cosmetics, phytotherapeutics, cleaning products and medical devices. The medicine subsector consists of organisations producing, importing and selling these products. Most studies about this industry have been guided by economic interests without assessing technological aspects of production. This article was aimed at proposing a methodology for assessing and describing the medicine sector according to its technological development by using the manufacturing capability concept. The main information was taken from the Colombian Medicaments and Food Surveillance Institutes (Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA) databases related to pharmaceutical plant production in Bogotá, including material transformation facilities. This study led to three characteristics being identified for defining the pharmaceutical industrys manufacturing capability: that related to the pharmacological group to which active pharmaceutical ingredients belong, that linked to specifications regarding medicines sterility and that related to the technology required for manufacturing each pharmaceutical product. An analysis of these features has thus been presented and some technologies have been identified which have not been transferred or assimilated by the organisations being studied. It was found that manufacturing capability should be considered as being an indicator of the degree of technological development in these subsectors in Colombia.
Keywords: manufacturing capability, technology transfer, materials transformation, pharmaceutical supply chain, pharmaceuticals.
Recibido: febrero 26 de 2009 Aceptado: febrero 22 de 2010
Introducción
Algunos de los estudios desarrollados dentro del Grupo de Investigación en Procesos de Transformación de Materiales, de la Universidad Nacional de Colombia, han tenido por objeto caracterizar el Sector Farmacéutico Industrial Productor (SFIP. se entiende como el sector de organizaciones/empresas que realizan procesos de fabricación de medicamentos localmente. Entre las actividades de fabricación se pueden estratificar aquellas relacionadas con operaciones de elaboración, semielaboración, envase y acondicionamiento de medicamentos, cada una de las cuales involucra en mayor o menor proporción un determinado porcentaje de aporte en el valor agregado al medicamento o producto terminado) de medicamentos. En los resultados se han evidenciado diversos problemas asociados a la cadena de abastecimiento, encontrando una especial concentración de ellos en la actividades que suceden en la relación proveedor / productor (Carvajal y Bolívar, 2005).
Otros estudios relacionados con este subsector de la industria farmacéutica, tales como los efectuados por Proexport (Unctad/ OMC, 2006) y la Asociación Nacional de Industriales (Andi Econometría, 2004; Andi Econometría, 2007), demuestran que el eslabón de proveedores y la dinámica internacional del negocio farmacéutico afectan el comportamiento del productor nacional. Entre las principales causas detectadas se pueden citar:
-La dependencia de la importación de materias primas (principios activos y excipientes) para la producción de medicamentos.
-La cantidad de productos terminados que se importan es mayor a la cantidad de productos que se exportan.
-La importación se concentra cada vez más en productos semielaborados, disminuyendo el valor agregado aportado en los procesos de producción a nivel nacional.
La ausencia de trabajos de investigación en el Sector Farmacéutico en donde se evalúe la industria desde la perspectiva tecnológica de sus procesos productivos (Carvajal y Bolívar, 2005; Vallejo y Torres, 2007), conlleva a la necesidad de buscar indicadores que permitan estudiar el sector desde esta óptica. El presente estudio establece una metodología estructurada para evaluar y describir las plantas de producción del SFIP de medicamentos de acuerdo con su grado de desarrollo tecnológico, empleando el concepto de capacidad de manufactura utilizado por la Organización Mundial del Comercio (World Trade Organization —WTO—, 2001) y las especificaciones relacionadas con procesos productivos establecidas en las guías de Buenas Prácticas de Manufactura, de la Organización Mundial de la Salud (World Health Organization —WHO—, 2007).
La capacidad de manufactura y el Sector Farmacéutico Industrial Productivo
En un proceso de transformación de materiales se lleva a cabo una secuencia lógica de operaciones durante las cuales los insumos adquieren un mayor valor agregado frente a su condición inicial. Esta serie de transformaciones implica la existencia de elementos tecnológicos, representados en materias primas, material de envase, equipos, instalaciones, procedimientos, recursos humanos, y un mecanismo constante de retroalimentación de la información dentro de los procesos (Figura 1).
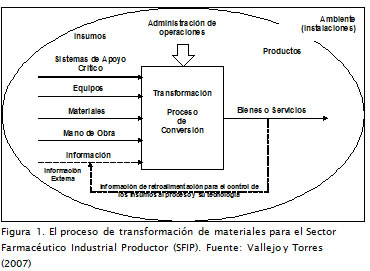
El concepto capacidad de manufactura es utilizado por la Organización Mundial del Comercio (OMC) para establecer el potencial de fabricación de medicamentos, identificando la capacidad de un país para utilizar una licencia obligatoria, permiso que otorga la OMC a un Gobierno para fabricar un producto patentado o utilizar un procedimiento patentado sin el consentimiento del titular de la patente (WTO, Doha Declaration, 2001). Debido a la importancia de la protección de la salud pública y el acceso de la población a los medicamentos, los Acuerdos de Propiedad Intelectual relacionados con el Comercio (ADPIC) deben ser interpretados e implementados para estos fines (Correa, 2002). En el caso de situaciones de emergencia sanitaria, donde la demanda de un medicamento protegido por una patente supera la oferta, se da lugar a la liberación y autorización para su fabricación a la industria farmacéutica local. Sin embargo el problema sanitario no podría aún ser atendido en el caso de países donde la capacidad tecnológica de producción del sector es sustancialmente nula o muy reducida.
Desde esta perspectiva, la capacidad de manufactura necesaria para elaborar medicamentos se relaciona con un conjunto de recursos mínimos requeridos y apropiados dentro de una organización (Kaplan y Laing, 2003). Los estudios desarrollados por el grupo de investigación en procesos de transformación de materiales (Vallejo y Torres, 2007), han evidenciado que este concepto puede emplearse como un indicador de desarrollo tecnológico para el SFIP.
Metodología
Durante una primera fase se trabajaron las bases de datos de todos los laboratorios farmacéuticos certificados en Buenas Prácticas de Manufactura para la elaboración de medicamentos en el país (Invima, 2007) y se identificaron los parámetros y las principales características que usa el INVIMA para establecer el alcance de la certificación.
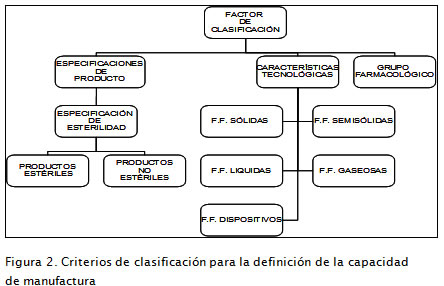
A continuación se identificaron todas aquellas organizaciones ubicadas en la ciudad de Bogotá, en donde se concentra la mayor población de laboratorios que realizan procesos de producción, excluyendo las empresas que llevan a cabo solamente actividades de envase, acondicionamiento o almacenamiento. Posteriormente se evaluó el alcance de la certificación en BPM con base en los siguientes criterios:
-Aspectos relacionados con las especificaciones de producto en cuanto a esterilidad.
-Características farmacológicas de los principios activos procesados.
-Aspectos técnicos relacionados con el tipo de formas farmacéuticas (FF) que fabrican, agrupadas por el estado físico en el cual se encuentran: líquidos, gases, sólidos, semisólidos 4.
En la Figura 2 se resumen las características que definen el alcance de la certificación otorgada por la autoridad regulatoria Invima a un laboratorio farmacéutico y sobre la cual se establecen las capacidades de manufactura.
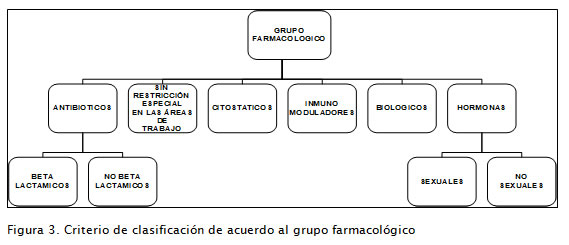
El alcance de la capacidad de manufactura otorgada por el Invima a cada establecimiento fabricante es evaluado de manera particular para ciertos principios activos que se reúnen en grupos farmacológicos específicos (WHO Collaborating Centre for Drug Statistics Methodology, Norwegian Institute of Public Health, 2007), establecidos con base en la actividad, potencia y toxicidad para el personal involucrado en la producción o el medio ambiente. La Figura 3 presenta este criterio de clasificación en forma desagregada.
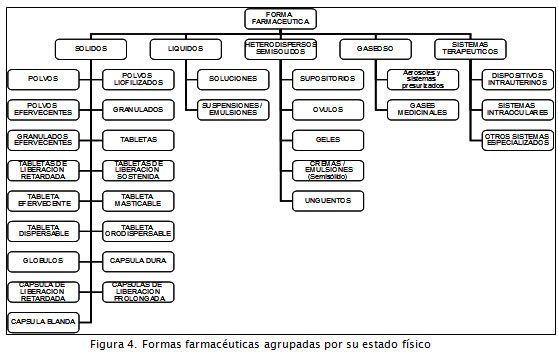
En relación con las formas farmacéuticas, el Invima las agrupa de acuerdo al estado físico en que se encuentran (Invima, 2008), listado que incluye sólidos, líquidos, semisólidos, gases ( Figura 4). Se encuentra un grupo adicional para aquellas formas farmacéuticas que por sus características no pueden ser clasificadas por el estado físico, tales como los sistemas terapéuticos.
Con la información consolidada se construyeron matrices para correlacionar cada uno de los criterios de clasificación, identificar la capacidad de manufactura de cada establecimiento y definir el perfil productor del SFIP de medicamentos en la ciudad de Bogotá.
Resultados y análisis
Se encontraron 83 establecimientos que realizan procesos de producción, de un total de 193 laboratorios farmacéuticos certificados en Buenas Prácticas de Manufactura a nivel nacional (Invima, 2007), representando un 43% de la fuerza productiva del subsector, concentrada en la capital. A continuación se analizan los resultados encontrados para cada uno de los criterios de evaluación de la capacidad de manufactura en la ciudad de Bogotá.
Aspectos relacionados con las especificaciones de producto en cuanto a esterilidad
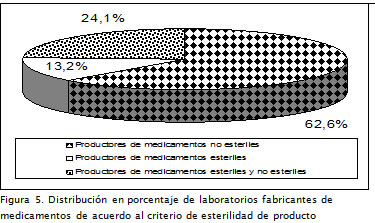
Como característica de clasificación la selección del criterio de esterilidad representa un conjunto de requisitos técnicos superiores a los exigidos en la fabricación de productos no estériles, demandando de la organización mayor inversión en tecnología de producto y proceso. Los resultados mostraron una tendencia a la producción de medicamentos no estériles: 52 establecimientos (62,7%), frente a 31 establecimientos (37,3%) que cuentan con la capacidad de manufactura para fabricar productos estériles.
De acuerdo al comportamiento mostrado en la Figura 5, se observa la existencia de un porcentaje de la población correspondiente a 20 establecimientos (24,1%) que cuenta con la capacidad para elaborar medicamentos estériles y no estériles, indicando de manera general un mayor grado de diversificación en las capacidades instaladas respecto de aquellas plantas de producción que concentran sus esfuerzos en un solo tipo de producción.
Características farmacológicas de los principios activos procesados
Los resultados obtenidos revelaron que no existen certificaciones de capacidad de manufactura en la ciudad de Bogotá para la fabricación de productos citostáticos, por cuanto éstos requieren un manejo especial dada su potencial toxicidad. Tampoco se encontró ninguna certificación de capacidad de manufactura para pro-ductos inmunomoduladores, debido a que esta clase de principios activos presentan elevada potencia, alta toxicidad y variados efectos adversos.
La manufactura de estos medicamentos requiere la existencia de áreas de dedicación exclusiva con estrictos requisitos técnicos que aseguren la calidad del producto, la seguridad del personal y la preservación del medio ambiente, lo cual demanda altas inversiones en tecnología para los laboratorios farmacéuticos.
La Figura 6 permite identificar que 39 plantas de producción (46%) dedican su instalación a la fa-bricación de medicamentos sin restricciones especiales en las áreas de manufactura. En este grupo farmacológico se encuentran los medicamentos que poseen principios activos no incluidos en los otros 7 grupos; la toxicidad, los efectos adversos y la potencia de estos principios activos, aun cuando son importantes, no conllevan el mismo nivel de riesgo identificado para los otros. El resultado permite concluir que estos establecimientos fabricantes tienen el potencial para diversificar en el tipo de productos que elaboran.
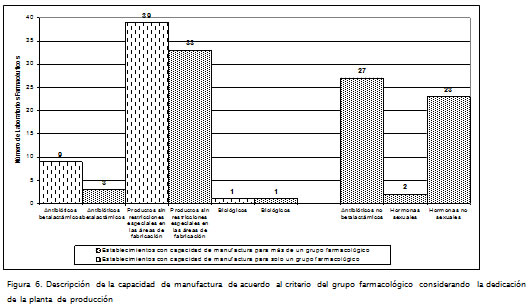
La Figura 6 muestra la existencia de doce plantas con capacidad para manufacturar antibióticos betalactámicos, distribuidas así: nueve son exclusivas para la elaboración de productos de este grupo y tres pueden elaborar otro grupo farmacológico, lo cual significa la existencia de instalaciones independientes en la infraestructura de producción.
Este comportamiento puede ser interpretado como un intento de especialización en el manejo de procesos que involucran la manufactura de medicamentos con principios activos betalactámicos.
Se encontraron dos laboratorios con capacidad para manufacturar productos biológicos; así como otros dos con capacidad para elaborar medicamentos del grupo farmacológico hormonas de tipo sexual; demostrando un intento por fortalecer el desarrollo de procesos con elevados componentes tecnológicos, así como la incursión en el manejo de medicamentos de nueva generación (Figura 6).
De la información primaria se resalta la existencia de dos laboratorios farmacéuticos con capacidad de producción para cinco grupos farmacológicos, equivalente al 2,4% del total de la población en estudio. Este comportamiento particular muestra la existencia de plantas de producción en donde la capacidad de gestión tecnológica ha permitido desarrollar diversos procesos de producción, observando un alto nivel de diversificación, con mayor integración de tecnología que involucran un componente de inversión importante.
Aspectos técnicos relacionados con el tipo de formas farmacéuticas
El comportamiento del sector para este criterio presenta el número de laboratorios de acuerdo al tipo de forma farmacéutica que elaboran (sólidas, líquidas, semisólidas, gaseosas). Los resultados permiten iden-tificar una tendencia hacia la especializa-ción en productos en FF gaseosa (15,6%). Tal comportamiento se debe a la gran di-ferencia en la infraestructura y la tecnolo-gía requerida para la producción de este tipo de medicamentos (Figura 7).
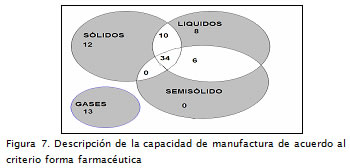
Se resalta la existencia de un 14,4% de la población especializada en la línea de producción de sólidos, en la cual los procesos de transformación, en algunos casos, conllevan mayor número de componentes tecnológicos asociados a la cantidad de operaciones unitarias involucradas.
Se observa también un importante nivel de diversificación en los establecimientos que cuentan con certificación de capacidad para elaborar FF sólidas, líquidas y semisólidas: 34 establecimientos fabricantes (40,9%).
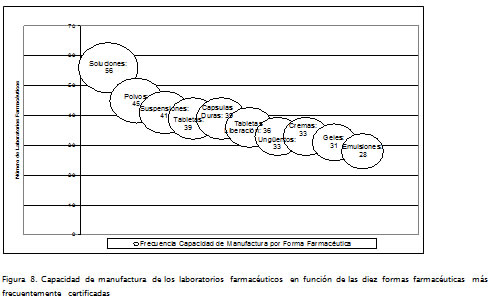
Tomando como parámetro las 10 FF a las que más frecuentemente se autoriza su fabricación (Invima, 2007), se puede visualizar en la Figura 8 que el 67,4% de las plantas de producción tienen capacidad certificada para elaborar formas líquidas tipo solución, comportamiento que permite identificar una trayectoria relacionada con el conocimiento que posee el SFIP de medicamentos para manejar esta clase de productos y sus tecnologías asociadas, las cuales han evolucionado ya que sus principales desarrollos se presentaron a mediados del siglo anterior (Buerki y Higby, 2007).
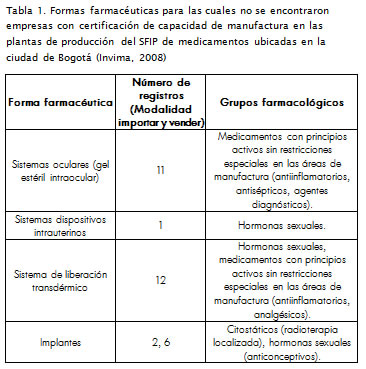
La investigación también evidencia la falta de capacidad para manufacturar ciertas formas farmacéuticas que tienen como característica ser sistemas de entrega de fármacos. La Tabla 1 presenta al gunos de estos ejemplos, productos que aunque están disponibles para el cuerpo médico como recurso terapéutico su registro se encuentra en la modalidad importar y vender, no existiendo en Colombia registros sanitarios en la modalidad de fabricar y vender o fabricar y exportar. Esto revela la falta de procesos de investigación, desarrollo e innovación en el SFIP de medicamentos para la obténción de productos novedosos y de mayor grado de complejidad tecnológica, e incentiva al sector productivo a incorporar nuevas tecnologías a sus procesos y obtener productos con mayor valor agregado.
Este estudio abre la puerta para profundizar en aspectos relacionados con la competitividad de los laboratorios de producción. Una vez conocida la capacidad de manufactura de una organización, se debe evaluar la fortaleza de sus procesos productivos a partir de la identificación de variables que permitan establecer de manera objetiva, concreta y cuantitativa el grado en el cual cada organización y el subsector observado como un colectivo, desarrollan sus procesos productivos de manera competitiva en un entorno global.
De esta manera se podría contribuir en el manejo de la problemática del desequilibrio en la balanza comercial propia del Sector Farmacéutico colombiano.
Finalmente, se encuentra que este trabajo es pionero para Colombia, en la industria farmacéutica, y constituye un ejemplo de trabajo conjunto entre la universidad, la industria y el Estado, como una contribución al mejoramiento de la competitividad del sector. Esta propuesta metodológica podría también ser aplicada en contextos de producción industrial de medicamentos en el ámbito internacional con el fin evaluar su desarrollo tecnológico.
Conclusiones
Los resultados encontrados permiten definir un perfil característico desde el concepto de capacidad de manufactura para el SFIP de medicamentos u-bicado en la ciudad de Bogotá, en donde se identifican las debilidades y fortalezas y las principales características tecnológicas relacionadas con estas plantas de producción, desde el conocimiento de sus procesos productivos.
Se demostró que el concepto capacidad de manufactura, de la Organización Mundial del Comercio (2001), puede ser utilizado para estudiar el grado de desarrollo tecnológico de un sector apoyado en criterios de certificación para Buenas Prácticas de Manufactura. Cuando se correlacionó la capacidad instalada detectada en la ciudad de Bogotá con los desarrollos tecnológicos del Sector Farmacéutico, fue posible identificar las tecnologías que no habían sido transferidas o asimiladas por las organizaciones bajo estudio y establecer algunas causas por las cuales las organizaciones presentaron rezago tecnológico.
Los planteamientos realizados durante el desarrollo del presente estudio permitieron identificar algunas de las debilidades y amenazas del subsector; el resultado es un aporte desde la academia al ofrecer una visión de los aspectos técnicos del Sector Farmacéutico, que pueden relacionarse con las descripciones realizadas en otros estudios con enfoques de tipo económico, político y social.
Se considera que la metodología propuesta podría ser usada para evaluar el desarrollo tecnológico en todo el sector farmacéutico y en ámbitos internacionales que presenten similitudes con el contexto colombiano.
Agradecimientos
El Grupo de Investigación en Procesos de Transformación de Materiales agradece a la División de Investigación de la Universidad Nacional de Colombia por el apoyo al proyecto "Evaluación del impacto de la logística de materiales del SFIP de la ciudad capital, asociada al desarrollo tecnológico de sus actuales procesos de transformación". Adicionalmente agradecemos la colaboración de la Dirección del Departamento de Farmacia de la Universidad Nacional de Colombia, a la Dirección General del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima), y a la Dirección Ejecutiva de la Cámara de la Industria Farmacéutica de la Asociación Nacional de Industriales (ANDI).
Bibliografía
Andi Econometría S.A., Estudio de la política de precios de medicamentos en Colombia., Anexo 1 Caracterización de la Industria Farmacéutica Nacional, Cámara de la industria farmacéutica, 2004, pp. 16. [ Links ]
Andi Econometría S.A., Estudio de la política de precios de medicamentos en Colombia., Anexo 1 Caracterización de la Industria Farmacéutica Nacional, Cámara de la industria farmacéutica, 2007, pp. 1. [ Links ]
Buerki, R., Higby, G., En: Encyclopedia of Pharmaceutical Technology: Dosage Forms and basic preparations: History., Edición, Editor James Swarbrick, Informa Health Care, New York, 2007, pp. 948. [ Links ]
Carvajal, F., Bolívar, D. C., Caracterización de las necesidades de apoyo tecnológico en los procesos de transformación de materiales en la industria de medicamentos, de la ciudad de Bogotá., Tesis de Grado, Universidad Nacional de Colombia, 2005. [ Links ]
Centro de Comercio Internacional., Estudio de oferta y demanda del Sector Farmacéutico y Productos Naturales., PROEXPORT, UNCTAD/ OMC, Latinpharma, Julio, 2006. [ Links ]
Correa, C., Implications of the Doha Declarations on the TRIPS Agreement and Public Health., World Health Organization, Health Drugs and Medicines Policy, Universidad de Buenos Aires, EDM Series, No. 12, 2002. [ Links ]
Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA., Base de Datos Laboratorios Farmacéuticos Nacionales Certificados en Buenas Prácticas de Manufactura para Producción de Medicamentos., Febrero, 2007. [ Links ]
Instituto Nacional de Vigilancia de Medicamentos y Alimentos INVIMA, Circular DG100-00420-06. Disponible en: http://www.invima.gov.co:8080/Invima/cum/archivos/circularcodigo2versionfinal.htm, Consultada Enero 2008. [ Links ]
Instituto Nacional de Vigilancia de Medicamentos y Alimentos, INVIMA., Consultas Públicas: Bases de datos Medicamentos Registrados en la República de Colombia., Julio, 2007. [ Links ]
Kaplan W., Laing R., Local production: Industrial policy and access to medicines - An overview of key concepts, issues, and opportunities for future research., Health, Nutrition and Population (HNP) Discussion paper, Washington, 2003. [ Links ]
Ministerio de Salud, República de Colombia., Resolución 1267, Por la cual se definen las áreas técnicas de producción de los establecimientos farmacéuticos, Bogotá, 2001. [ Links ]
Ministerio de la Protección Social, República de Colombia., Resolución 3028 de 2008., por la cual se definen las áreas técnicas de producción de los establecimientos farmacéuticos y se establecen otras disposiciones., Bogotá, 2008. [ Links ]
Vallejo B., Torres, S., Desarrollo Tecnológico del Sector Farmacéutico Industrial asociado a procesos de Transformación de Materiales., VITAE, Revista de la Facultad de Química Farmacéutica, Vol. 14, No. 2, 2007, pp. 59 - 70. [ Links ]
World Health Organization, WHO., Network for Monitoring the impact of globalization and TRIPS on Access to Medicines: Market Share., Essential Drugs and Medicines Policy, Report of a Meeting Bangkok, Thailand, Febrero 2001, pp. 34 - 35. [ Links ]
World Health Organization, WHO., WHO Expert committee on specifications for pharmaceutical preparations Report 36 Annex 5: Basic elements of good manufacturing practices in pharmaceutical production., WHO Technical Report Series, No 902, 2002. [ Links ]
World Health Organization, WHO., WHO Expert Committee on Specifications for Pharmaceutical Preparations: forty-first report., Technical reports Series, Geneva, No. 937, 2007. [ Links ]
World Health Organization Collaborating Centre for Drug Statistics Methodology., Norwegian Institute of Public Health., http://www.whocc.no/atcddd/, Consultada Septiembre, 2007. [ Links ]
World Trade Organization WTO., Doha WTO Ministerial 2001: Trips Wt/Min (01)/Dec/2 20 November 2001, Declaration on the Trips Agreement and Public Health Adopted on 14 November 2001, http://www.wto.Org/English/Thewto_E/Minist_E/Min01_E /Mindecl_Trips_E.Htm, Consultada Septiembre, 2008. [ Links ]
World Trade Organization WTO., WT/L/641 8 December 2005 Amendment of the TRIPS Agreement Decision of December 2005., Appendix to The Annex to the Trips Agreement. Assessment of Manufacturing Capacities in the Pharmaceutical Sector, http://www.wto.org/english/tratop_e/trips_e/wtl641_e.htm, Consultada Septiembre 2008. [ Links ]
4 Semisólidos: este grupo asocia los productos que por sus características reológicas requieren unos recursos y una tecnología diferencial respecto de los produc-tos reunidos en el grupo de líquidos.














