Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.12 no.2 Bogota Aug. 2005
Trasplante autólogo de células progenitoras derivadas de la médula ósea, por vía intramiocárdica, para revascularización en cardiopatía isquémica crónica
Autologous intramyocardial transplant of bone marrow derived stem cells for revascularization in ischemic chronic cardiopathy
Óscar Velásquez, MD.(2); Juan M. Senior, MD.(1, 2); Francisco Cuéllar, MD.(1, 2); Margarita Velásquez, MD.(1); Luis F. García, MD., MSc.(1); Claudia Navas, MD.(2)
(1) Universidad de Antioquia, Medellín, Colombia.
(2) Hospital Universitario San Vicente de Paul, Medellín, Colombia.
Correspondencia: Óscar Velásquez Uribe, MD. Grupo de Terapia Celular Regenerativa. Hospital Universitario San Vicente de Paul, Universidad de Antioquia. Calle 64, carrera 51D. Teléfono: 516-23-53 ext. 230. Medellín, Colombia. Correo electrónico: ooavelasquez@epm.net.co
Introducción: estudios experimentales y clínicos demuestran que la implantación intramiocárdica de células progenitoras derivadas de la médula ósea, produce angiogénesis y mejora la función cardiaca en pacientes con cardiopatía isquémica crónica.
Metodología: este es el reporte del seguimiento a dos meses de un paciente con cardiopatía isquémica crónica no susceptible de revascularización quirúrgica o percutánea, a quien se le realizó ,por vía epicárdica, un implánte de células progenitoras derivadas de médula ósea movilizadas con factor de crecimiento granulocito-macrófago.
Resultados: se demostró mejoría significativa en la sintomatología, en la capacidad funcional (1.8 MET a 10 MET), en el estado funcional (IV a I), en el tamaño del defecto de perfusión miocárdica por medicina nuclear, en la fracción de eyección y en la disminución del volumen sistólico final del ventrículo izquierdo, sin observar complicaciones relacionadas con el procedimiento.
Conclusión: el trasplante de células progenitoras derivadas de la médula ósea es una terapia efectiva y segura para promover neovascularización y para mejorar la contractilidad y la perfusión miocárdica en los pacientes con cardiopatía isquémica crónica pobres candidatos a cirugía.
Palabras clave: cardiopatía isquémica, células madre, intramiocárdico, angiogénesis, médula ósea.
Introduction: experimental and clinical studies have demonstrated that intramyocardial bone marrow derived stem cells implantation produce angiogenesis and improvement of cardiac function in patients with chronic ischemic cardiopathy.
Methodology: this is a two months follow-up report of a patient with chronic ischemic cardiopathy not susceptible of surgical or percutaneous revascularization, to whom bone marrow stem cells mobilized with granulocyte - macrophage growth factor was implanted.
Results: significant improvement was demonstrated in symptomatology, functional capacity (1.8 Mets to 10 Mets), functional state (IV to I), size of the myocardial perfusion defect by nuclear medicine, in the ejection fraction and diminution of the final left ventricular systolic volume, without complications related to the procedure.
Conclusion: bone marrow derived stem cells transplant is an effective and safe therapy in order to promote neo-vascularization and improve contractility and myocardic perfusion in patients with chronic ischemic cardiopathy considered poor surgical candidates.
Key words: ischemic cardiopathy, stem cells, intramyocardic, angiogenesis, bone marrow.
Introducción
El tratamiento de la enfermedad coronaria ha variado sustancialmente en la última década debido a la modificación de los factores de riesgo, la utilización de nuevos y más potentes medicamentos tales como: antiagregantes, betabloqueadores e inhibidores de la enzima convertidora de angiotensina y bloqueadores de los receptores de angiotensina II, y al avance significativo en las técnicas de revascularización tanto percutánea como quirúrgica, las cuales han reducido en forma significativa la morbimortalidad por cardiopatía isquémica y falla cardiaca secundaria.
Es posible ofrecer un trasplante cardiaco ortotópico (1), y actualmente para una mayor población, el trasplante de células progenitoras (2, 3), a un porcentaje de pacientes que no se beneficia de los procesos de revascularización descritos inicialmente (quirúrgico y/o percutáneo), por la presencia de lechos arteriales coronarios distales deficientes, oclusiones arteriales crónicas y comorbilidades (31); adicionalmente, las oclusiones tardías de los puentes coronarios o con restenosis intrastent, también hacen parte de este grupo, el cual se caracteriza por deterioro en la calidad de vida debido al desarrollo de angina refractaria y falla cardiaca a pesar de efectuar un tratamiento médico óptimo.
Clásicamente, se ha considerado que durante la etapa embrionaria y fetal hay replicación activa de cardiomiocitos por la presencia de reguladores positivos del ciclo celular permitiendo la carioquinesis (4). Antes del nacimiento, la actividad disminuye y se produce duplicación genómica con cardiomiocitos binucleados con posterior aumento de reguladores negativos que detienen el ciclo celular en un estado postmitótico, sin replicación celular activa significativa en la edad adulta (4-6). Lo anterior explica por qué después de la lesión producida por un evento isquémico miocárdico, se pierde un número significativo de cardiomiocitos y hay deterioro de la función ventricular por el proceso de remodelación a largo plazo (7). Las células progenitoras, pueden tener origen en el embrión o en estructuras adultas, como las células satélites o mioblastos esqueléticos y células derivadas de la médula ósea. Resultados de estudios experimentales y clínicos demuestran que las células progenitoras derivadas de la médula ósea pueden utilizarse no sólo para regenerar cardiomiocitos sino para producir angiogénesis, debido a su plasticidad a través de mecanismos como transdiferenciación y fusión (8-10).
El objetivo de este reporte es demostrar la seguridad y efectividad del trasplante autólogo de células progenitoras derivadas de la médula ósea (TCPDMO) movilizadas con factor de crecimiento granulocito-macrófago en un paciente con cardiopatía isquémica crónica.
Paciente y métodos
Este es un reporte del seguimiento a dos meses, de un paciente con cardiopatía isquémica crónica, pobre candidato para revascularización quirúrgica o percutánea, atendido en la Unidad Cardiovascular y de Trasplantes del Hospital Universitario San Vicente de Paul, a quien se le realizó TCPDMO por vía epicárdica.
El caso se discutió en consenso médico-quirúrgico de la institución y se suministró el consentimiento informado evaluado por el Comité de Ética Médica al paciente y a la familia acerca de la patología y el procedimiento. Se obtuvo historia clínica completa y paraclínicos de base como: hemoleucograma y sedimentación, PCR, BUN, creatinina, ionograma, CK MB, troponina I, LDH, ácido úrico, perfil lipídico y glicemia, electrocardiograma de doce derivaciones, angiografía coronaria, ecocardiograma M, 2D, Doppler color, viabilidad e isquemia miocárdica con talio reposo-redistribución-reinyección y monitoreo Holter. El paciente se monitorizó en la unidad de cuidado intensivo cardiovascular por 48 horas, y se realizó manejo convencional posquirúrgico. Luego del alta se reevaluó a los dos meses post-procedimiento con una evaluación clínica completa, hemoleucograma y sedimentación, PCR, BUN, creatinina, troponina I, CPK MB, química sanguínea, ecocardiograma, electrocardiograma, viabilidad miocárdica e isquemia por medicina nuclear y monitoreo Holter.
Las células progenitoras derivadas de la médula ósea se obtuvieron por la estimulación del paciente (autólogas) con factor estimulante de colonias granulocito-macrófago por vía subcutánea 10 mcg/kg/día, en los 5 días previos a su implantación. El día del procedimiento se lleva al paciente a la sala de cirugía y bajo anestesia local se extraen 50 mL de médula ósea por aspiración en la cresta ilíaca. Las células mononucleares se aíslan por gradiente de densidad en Ficoll-Paque Plus en el laboratorio de Inmunología de la Facultad de Medicina de la Universidad de Antioquia, por citometría de flujo el conteo de las CD34, CD4, CD8, CD20, CD 19, CD14 y CD 56 y cultivos para hongos y bacterias (11).
La suspensión celular contiene 726 x 106 de células mononucleares, 24,7 x 106 CD34+, la viabilidad celular fue del 100% por azul de tripano, CD34+CD45LOW 1%, CD34+ICAM1+ 3,4% y los cultivos microbiológicos fueron negativos.
La implantación se realizó en la sala de cirugía. Luego de la esternotomía convencional se visualizó la zona de necrosis y el área isquémica, y se procedió a la implantación de la suspensión celular inyectando en forma directa 0,2 mL en 10 oportunidades, con aguja fina a lo largo de toda la circunferencia del borde de la lesión.
Resultados
Caso clínico
Paciente de 59 años, hipertenso y dislipidémico, con enfermedad coronaria severa de tres vasos, revascularizado en 1996 en forma quirúrgica, con adecuada evolución. Asintomático hasta agosto de 2003, cuando consultó por angina estable de dos meses de evolución progresiva estado funcional II Clasificación Canadiense (CCS); se optimizó el manejo médico adicionando nitratos orales y sublinguales a su tratamiento con ácido acetilsalicílico, metoprolol, lovastatina y captopril. Se realizó angiografía coronaria y de puentes, con lo que se demostró oclusión del puente de la arteria mamaria a la descendente anterior y del puente venoso a la coronaria derecha, permeabilidad del puente venoso a la primera obtusa marginal, oclusión crónica del lecho nativo (CD-DA) y pésimos lechos distales; la medicina nuclear demostró un gran territorio isquémico en la cara anterior e inferior y una pequeña zona de necrosis apical. Se consideró pobre candidato para nueva revascularización quirúrgica o percutánea, por lo cual se optimizó el manejo médico con el aumento de la dosis de nitratos orales y la adición de un calcioantagonista. El paciente persistió en estado funcional II, hasta septiembre de 2003 en el que progresó a estado funcional IV, con gran compromiso de su calidad de vida a pesar de la utilización de 120 mg/día de nitrato oral, más 30 mg de nitrato por vía sublingual cada día, betabloqueadores, calcioantagonistas, inhibidores de la enzima convertidora de angiotensina y estatinas. Se discutió en consenso médico-quirúrgico en el cual se recomendó revascularización percutánea de la arteria descendente anterior, con intento fallido de angioplastia el 30 de septiembre de 2003. Posterior a esto, se decidió realizar TCPDMO por vía epicárdica.
El día del trasplante el paciente fue trasladado a la sala de cirugía donde se realizó el aspirado de médula ósea. Se inició el procedimiento quirúrgico en forma convencional a través de una esternotomía media, extensa liberación de múltiples adherencias secundarias a la revascularización quirúrgica previa, y posteriormente se realizó la implantación de las células en la forma descrita. Durante el procedimiento presentó hipotensión al luxar el corazón para la implantación de las células en la cara inferior, la cual se recuperó rápidamente con la administración de cristaloides y la suspensión de la maniobra. No se encontró ninguna arteria susceptible de revascularización por puentes aortocoronarios. Se terminó el procedimiento en forma convencional y el paciente fue extubado y trasladado a la unidad de cuidados intensivos. No se presentaron complicaciones en el postrasplante inmediato tales como arritmias, sangrado en el sitio de la implantación, elevación de marcadores séricos de injuria miocárdica, derrame pericárdico o aumento de la efusión pleural atribuibles al procedimiento, y fue dado de alta en el cuarto día.
En el seguimiento a dos meses en el programa de rehabilitación cardiaca, se demostró mejoría significativa en los parámetros evaluados (Tabla 1), pasando a estado funcional I, sin episodios anginosos con actividades de la vida diaria, disminución en el consumo de nitratos (30 mg/día oral y 0 mg/día sublingual), sin cambios en la dosis de las otras medicaciones y con disminución significativa en el defecto de perfusión durante el ejercicio en la medicina nuclear (Figuras 1 y 2). Después de dos meses no se detectaron alteraciones del ritmo cardiaco en el Holter de control.
Tabla 1. Parámetros de respuesta A DOS meses de seguimiento
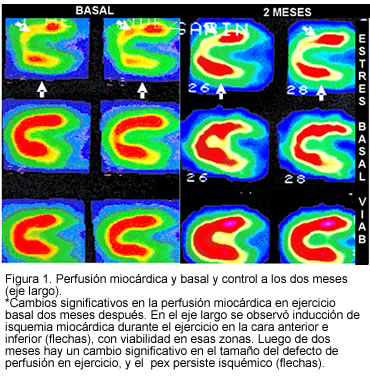
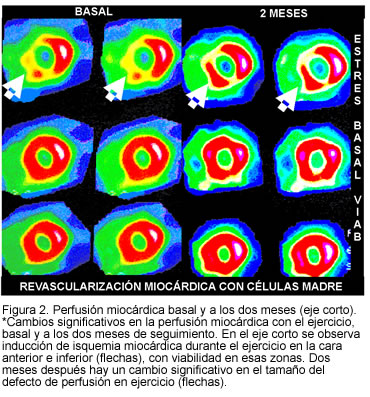
Discusión
Nuestros resultados demuestran que la implantación epicárdica de células progenitoras derivadas de la médula ósea movilizadas con factor de crecimiento granulocito-macrófago en pacientes con cardiopatía isquémica crónica es segura y eficaz. Orlic y colaboradores (8) y otros grupos de investigación han demostrado en forma fehaciente la posibilidad de diferenciación de las células progenitoras derivadas de la médula ósea Lin– cKit+ en cardiomiocitos, células endoteliales y de músculo liso vascular, lo que permite no sólo regenerar tejido miocárdico sino revascularizar el tejido isquémico (12 -15). La utilización de factor estimulante de crecimiento de colonias de granulocito-macrófago aumenta el número de células progenitoras endoteliales en la médula ósea y circulantes, asegurando una mayor concentración de éstas y menor volumen de la suspensión celular para la implantación (16,17) lo cual es crucial cuando se realizan inyecciones intramiocárdicas como en este caso; además, estimula la maduración y activación de las células progenitoras (18), posiblemente del subgrupo que se requiere para regeneración y revascularización, y promueve el crecimiento de colaterales arteriales cardiacas (19). Sin embargo, no se pueden pasar por alto los efectos secundarios protrombóticos reportados en dos casos relacionados con la administración del factor y leucocitosis (20, 21) no confirmados en otros estudios (16, 22-26).
La mejoría dramática experimentada por este paciente luego de dos meses, evidenciada por la mejoría en la perfusión miocárdica y además por el cambio en el estado funcional de IV a I CCS, el aumento significativo en el número de metros caminados en el test de los seis minutos, el cambio de su capacidad de ejercicio de 1,8 MET a 10 MET, la disminución de los episodios anginosos y la dosis de vasodilatadores consumidos tanto por vía oral como sublingual, concuerda con lo reportado en la literatura (9-10,27-29) y constituye una base firme para recomendar el TCPDMO en pacientes con cardiopatía isquémica crónica, pobres candidatos a revascularización quirúrgica o percutánea, sin esperanza de mejoría (30). El cambio en la función ventricular con aumento en la fracción de eyección, disminución del volumen de fin de sístole del ventrículo izquierdo y la disminución del defecto de perfusión demuestran la bondad de esta terapia (29) y la ausencia de efectos secundarios. Persisten interrogantes acerca de la carga celular «ideal», así como de la vía de implantación en los diferentes tipos de cardiopatías, que pueden beneficiar en mayor grado a los pacientes.
Bibliografía
1. Kirklin JK, Young JB, McGiffin D. Recipient evaluation and selection. In: Kirklin JB, Young JB, McGiffin DC eds. Heart Transplantation. New York: Churchill Livingstone; 2002. p. 198-231. [ Links ]
2. Laham RJ, Oettgen. Bone marrow transplantation for the heart: fact or fiction? Lancet 2003; 361: 11. [ Links ]
3. Laham RJ, Simons M, Sellke F. Gene transfer for angiogenesis in coronary artery disease. Annu Rev Med 2001; 52: 485-502. [ Links ]
4. Pasumarthi KB, Field L. Cardiomyocyte cell cycle regulation. Circ Res 2002; 90: 1044-1054. [ Links ]
5. Srivastava D, Olson EN. A genetic blueprint for cardiac development. Nature 2000; 407: 221-226. [ Links ]
6. Soonpaa MH, Kim KK, Pajak L, Franklin M, Field LJ. Cardiomyocyte DNA synthesis and binucleation during murine development. Am J Physiol 1996; 271: H2183-H2189. [ Links ]
7. Sharpe N. Cardiac remodeling in congestive heart failure. In: Hosenpud JD, Greenberg BH eds. Congestive Heart Failure 2nd edition. Philadelphia: Lippincott Williams Wilkins 2000. p. 101-116. [ Links ]
8. Orlick D, Kajstura J, Chimenti S, et al. Bone marrow cells regenerate infarcted myocardium. Nature 2001; 410: 701-705. [ Links ]
9. Perin E, Dohmann H, Borojevic R, et al. Transendocardial, autologous bone marrow cell transplantation for severe, chronic ischemic heart failure. Circulation 2003; 107: 2294-2302. [ Links ]
10. Tse HF, Kwong YL, Chan J et al. Angiogenesis in ischaemic myocardium by intramyocardial autologous bone marrow mononuclear cell implantation. Lancet 2003; 361: 47-49. [ Links ]
11. Cuéllar-Ambrosi F, Karduss UA, Gómez WR, Mondragón AMC, Velásquez LM, Calle FS. Hematological reconstitution following high dose and supralethal chemo-radiotherapy using store non-cryopreserved autologous hematopoietic stem cells. Transplantation Proceedings. 2003; In press. [ Links ]
12. Kocher AA, Schuster MD, Szaboles MJ, et al. Neovascularization of ischaemic myocardium by human bone marrow angioblast cardiomyocytes apoptosis, reduces remodeling and improve cardiac function. Nat Med 2001; 7: 430-436. [ Links ]
13. Tomita S, Mickle DA, Weisel RD, et al. Improved heart function with myogenesis and angiogenesis after autologous porcine bone marrow stromal cell transplantation. J Thorac Cardiovasc Surg 2002; 123: 1132-1135. [ Links ]
14. Kamihata H, Matsubara H, Nishiue T, et al. Implantation of bone marrow mononuclear cells into ischemic myocardium enhances collateral perfusion and regional function via side supply of angioblasts, angiogenic ligands and cytokines. Circulation 2001; 104: 1046-1052. [ Links ]
15. Kawamoto A, Gwon HC, Iwaguro H, et al. Therapeutic potential of ex vivo expanded endothelial progenitor cells for myocardial ischemia. Circulation 2001; 103: 634-637. [ Links ]
16. Tateishi-Yuyama E, Matsubara H, Murohara T, et al. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone marrow cells: a pilot study and a randomised controlled trial. Lancet 2002; 360: 427-35. [ Links ]
17. Takahashi T, Kalka C, Masuda H, et al. Ischemia and cytokine-induced mobilization of bone marrow-derived endothelial cells for neovascularization. Nat Med 1999; 5: 434-438. [ Links ]
18. Tajima F, Sato T, Laver J, Ogawa M. CD34 expression by murine hematopoietic stem cells mobilized by granulocyte colony-stimulating factor. Blood 2000; 96: 1989-1993. [ Links ]
19. Seiler C, Pohl T, Wustman K, et al. Promotion of collateral growth by granulocyte-macrophage colony-stimulating factor in patients with coronary artery disease: a randomized, double-blind, placebo-controlled study. Circulation 2001; 104: 2012-2017. [ Links ]
20. Fukumoto Y, Miyamoto T, Okamura T, et al. Angina pectoris occurring during granulocyte colony-stimulating factor combined preparatory regimen for autologous peripheral blood stem cells transplantation in a patient with acute myelogenous leukaemia. Br J Haematol 1997; 97: 666-668. [ Links ]
21. Kawachi Y, Watanabe A, Uchida T, et al. Acute arterial thrombosis due to platelet aggregation in a patient receiving granulocyte colony-stimulating factor. Br J Haematol 1996; 94: 413-416. [ Links ]
22. Ramon GG, Brachet O, Llamas FJ, et al. Terapia de angiogénesis en pacientes con isquemia crítica en extremidades inferiores con autotrasplante de células mononucleares de sangre periférica. Resultados preliminares. Rev Mex Angiol 2004; 32: 5-10. [ Links ]
23. Kang HJ, Kim HS, Zhang SY, et al. Effects of intracoronary infusion of peripheral blood stem-cells with granulocyte-colony stimulating factor on left ventricular systolic function and reestenosis after coronary stenting in myocardial infarction: the MAGIC cell randomized clinical trial. Lancet 2004; 363: 9411: 751-56. [ Links ]
24. Anderlini P, Przepiorka D, Champlin R, Korbling M. Biologic and clinical effects of granulocyte colony-stimulating factor in normal individuals. Blood 1996; 88: 2819-2825. [ Links ]
25. Cavallaro AM, Lilleby K, Majolino I et al. Three to six year follow-up of normal donors who received recombinant human granulocyte colony-stimulating factor. Bone Marrow Transplant 2000; 25: 85-89. [ Links ]
26. Bensinger W, Singer J, Appelbaum F, et al. Autologous transplantation with peripheral blood mononuclear cells collected after administration of recombinant granulocyte stimulating factor. Blood 1993; 81: 3158-3163. [ Links ]
27. Stamm C, Westphal B, Keene HD, et al. Autologous bone marrow stem-cell transplantation for myocardial regeneration. Lancet 2003; 361: 45-46. [ Links ]
28. Mohanty S, Kumar L, Venugopal P, et al. Autologous bone marrow (BM) stem cell transplantation into infarcted myocardium- A pilot study. J Clin Oncol ASCO Meeting abstracts 2004; 22: 599. [ Links ]
29. Patel A, Viña R, Geffner L, et al. Surgical treatment for congestive heart failure using autologous adult stem cell transplantation: a prospective randomized study. Presentado en American Association for Thoracic Surgery AATS 84th annual meeting. Toronto, Ontario, Canadá Metro Convention Centre; 2004. [ Links ]
30. Ozbaran M, Omay S, Nalbantgil S, et al. Autologous peripheral stem cell transplantation in patients with congestive heart failure due to ischemic heart disease. Sur J Cardiothoracic Surg 2004; 25: 342-350. [ Links ]
31. Kouchoukos N, Blackstone E, Doty D, et al. Ischemic heart disease: Kirklin / Barratt-Boyes. Cardiac Surgery. Philadelphia, Pennsylvania: Churchill Livingstone; 2003. p. 351-435. [ Links ]














