Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.13 no.1 Bogota Aug. 2006
Premio Trabajos de Concurso "Mejor trabajo de investigación en la caterogía Guillermo Lara Hernández" en el XXI Congreso Colombiano de Cardiología
(1) Cardiología Intervencionista y Vascular Periférica. Universidad de Antioquia – Hospital Universitario San Vicente de Paúl, Medellín.
(2) Servicio de Hemodinamia, Fundación Cardio Infantil – Instituto de Cardiología, Bogotá.
Correspondencia: Boris Eduardo Vesga, MD. Calle 56 # 30-38. Bucaramanga. Correo electrónico: borisvesga@yahoo.com.
Recibido: 14/03/06. Aprobado: 04/08/06
Introducción: la anti-agregación plaquetaria es «piedra angular» en el tratamiento de la enfermedad cardiovascular. El ácido acetil salicílico es la terapia de elección en dosis entre 81-325 mg para la prevención y tratamiento de la enfermedad coronaria.
Objetivo: caracterizar la agregación plaquetaria en sujetos con enfermedad coronaria estable, consumidores de ácido acetil salicílico, para determinar la prevalencia de resistencia.
Metodología: previa aprobación por los Comités de Ética y de Investigaciones de la Institución, se efectuó un estudio descriptivo transversal en sujetos de 40 años y mayores, con diagnóstico de angina estable que ingresaron para realización de angiografía coronaria. Se obtuvo una muestra de sangre venosa periférica para determinar la agregación plaquetaria mediante ácido araquidónico, epinefrina, colágeno y ADP en un agregómetro HELENA PACKS-4. La resistencia al ácido acetil salicílico se definió al tener agregaciones con ácido araquidónico mayores al 20%. El análisis estadístico se desarrolló con la prueba exacta de Fisher, prueba t de Student y Mann-Whitney de acuerdo con la distribución de las variables.
Resultados: se incluyeron 71 sujetos; 51 (71,8%) varones, edad 63,5 ± 9,4 años. Con factores de riesgo: 52 (73,2%) con dislipidemia, 48 (67,6%) con hipertensión arterial, 15 (21,1%) con diabetes mellitus y 9 (12,7%) con tabaquismo. Angiografía coronaria con enfermedad de 1 vaso en 31 (15,9%), y enfermedad multivaso en 58 (81,7%). Los valores de agregometría plaquetaria obtenidos fueron: ADP 64 ± 19,1%, colágeno 72 ± 18,9%, epinefrina 43,8 ± 23,9% y ácido araquidónico 26,1 ± 33,7%, siendo este el mejor marcador del efecto del ácido acetil salicílico. La prevalencia de resistencia fue de 28,2% (IC 95%: 18,1-40,1).
Conclusión: la resistencia al ácido acetil salicílico en nuestra población es altamente prevalente, por lo que se debe considerar la medición de rutina de la agregación plaquetaria en pacientes de alto riesgo y el asociar otro fármaco anti-agregante (terapia dual) que garantice una mejor protección anti-trombótica en pacientes con enfermedad coronaria.
Palabras clave: ácido acetil salicílico, agregación plaquetaria, enfermedad coronaria.
Introduction: platelet anti-aggregation is the «corner stone» in the treatment of cardiovascular disease. Acetylsalicylic acid is the therapy of choice in the prevention and treatment of coronary disease, in doses of 81 – 325 mg.
Objective: to assess platelet aggregation in subjects with stable coronary disease receiving acetylsalicylic acid, in order to determine its prevalence resistance.
Methods: cross-sectional descriptive study in 71 subjects of 40 or more years of age with diagnosis of stable angina, who were admitted for coronary angiography performance. A peripheral venous blood sample was obtained in order to determine the platelet aggregation through arachidonic acid, epinephrine, collagen and ADP in a HELENA PACKS-4 aggregometer. Resistance to the acetylsalicylic acid was defined when having aggregations greater than 20% with arachidonic acid. The statistical analysis was developed with the exact Fisher t test of Student and Mann-Whitney according to variable distribution.
Results: 71 subjects were included; 51 were male (71.8%); mean age 63.5 ± 9.4 years. Risk factors: 52 (73.2%) had dyslipidemia, 48 (67.6%) arterial hypertension, 15 (21.1%) diabetes mellitus and 9 (12.7%) were cigarette smokers; in 31 (15.9%) arteriography showed one-vessel coronary disease, and multi-vessel disease in 58 (81.7%). The platelet aggregometric values obtained were: ADP: 64 ± 19.1%, collagen 72 ± 18.9%, epinephrine 43.8± 23.9% and arachidonic acid 26.1 ± 33.7%, being this one the best marker in the acetylsalicylic acid's effect. The prevalence of aspirin resistance was 28.2% (IC 95%: 18.1 -40.1).
Conclusion: in our population, acetylsalicylic acid resistance is highly prevalent; for this reason, routine measurement of platelet aggregation in high risk patients must be considered, as well as the addition of another anti-aggregation drug (dual therapy) that may guarantee a better anti-thrombotic protection in patients with coronary disease.
Key words: acetylsalicylic acid, platelet aggregation, coronary heart disease.
Introducción
Las enfermedades cardiovasculares son la primera causa de mortalidad a nivel mundial (1, 2) y dentro de éstas la enfermedad coronaria aterosclerótica es responsable de 15 millones de muertes anuales (3). En la población colombiana en las últimas tres décadas, se ha observado un incremento en la enfermedad cardiovascular (4), el cual se refleja en un incremento en la tasa de mortalidad por enfermedad isquémica en sujetos entre los 20 a 84 años, que progresó de 75,9/100.000 en los años 1980-1984 a 97,3/100.000 en el período 1990-1996 (5).
Dentro del proceso aterosclerótico, la ruptura de una placa genera aterotrombosis, proceso que se caracteriza por la adhesión plaquetaria al endotelio disfuncionante y por la agregación y liberación de mediadores protrombóticos, prostaglandinas y tromboxano A2 (TxA2), que tiene doble papel en la formación del trombo y en el aumento del tono vascular. Debido a este proceso aterotrombótico, la utilización de fármacos que bloqueen la actividad plaquetaria ofrece beneficio clínico en la enfermedad arterial coronaria. Uno de estos antiplaquetarios es el ácido acetil salicílico (AAS), el cual es ampliamente utilizado para reducir la función plaquetaria mediante la inhibición irreversible de la producción de TxA2 (6). Con relativa frecuencia se observa que pacientes con enfermedad coronaria estable que reciben AAS consultan por síndrome coronario agudo o por muerte súbita; esto puede sugerir una falta de efecto terapéutico en este grupo de sujetos, por lo cual han sido llamados «no-respondedores» o «resistentes» (7).
En este estudio se pretende determinar la prevalencia de resistencia al AAS en sujetos con enfermedad coronaria estable consumidores de AAS, así como evaluar su relación con factores de riesgo como diabetes mellitus, tabaquismo, hipertensión arterial, dislipidemia y la medicación concomitante.
Materiales y métodos
Tipo de estudio
Se realizó un estudio descriptivo, de corte transversal para evaluar la acción antiagregante del AAS en sujetos con enfermedad coronaria estable y determinar la presencia de resistencia a dicho medicamento.
Lugar de realización
Los sujetos se reclutaron dentro de la población de consultantes por sospecha de enfermedad coronaria estable en la Fundación Cardio Infantil - Instituto de Cardiología de Bogotá.
Tamaño de la muestra
Este estudio hace parte de un proyecto de evaluación de resistencia al AAS en diferentes fases de la enfermedad coronaria. La muestra se calculó para tener el suficiente poder para detectar diferencias significativas en la inhibición de la agregación plaquetaria (si estas diferencias en realidad existen) entre los pacientes que reciben ácido acetil salicílico con síndrome coronario agudo, de aquellos con enfermedad coronaria estable que también lo reciben. Asumiendo un nivel de error alfa (falsos positivos) de 0,05, con poder de 0,8, con una mínima diferencia clínicamente importante del 7% y con una desviación estándar del 14% (obtenidos de un estudio previo de Echeverri y colaboradores, información no publicada) en los valores del porcentaje de agregación, teniendo una relación de pacientes entre el evento agudo y estable de 1:1, se necesitarían 60 sujetos por grupo.
Población
Criterios de inclusión
Fueron elegibles para ingresar los sujetos de 50 años y mayores o los sujetos entre 40 y 49 años con enfermedad coronaria previa, quienes consumieran AAS en dosis de 100 mg/día y a quienes se diagnosticara angina estable. Adicionalmente, como sujetos control se incluyeron seis personas con árbol coronario sano que no consumían AAS.
Criterios de exclusión
Tiempo de ingestión de la última dosis de AAS mayor de 48 horas, niveles de plaquetas menores a 150.000 mm3, presencia de una condición psiquiátrica que dificulte la toma de la información o una valoración clínica adecuada (retardo mental, demencia, psicosis), deseo expreso de no participar o la no firma del consentimiento informado por parte del sujeto; existencia de ectasia coronaria, presencia de síndromes de hipercoagulabilidad, insuficiencia renal en diálisis y presencia de coronarias sanas y de contraindicación para la realización de cateterismo cardiaco.
Procedimiento
Una vez se constató el cumplimiento de los criterios de inclusión y exclusión, a los sujetos se les explicó en qué consistía el estudio y se les leyó el consentimiento informado, el mismo que firmarían en caso de aceptar. Se tomó una muestra de sangre para realizar en esta las pruebas de agregación plaquetaria; se continuó con el estudio angiográfico de las arterias coronarias. Se tomaron los datos de la historia clínica y del cateterismo cardíaco una vez fueron revisados por uno de los investigadores con el fin de llenar el formato de recolección clínica.
Pruebas de agregación plaquetaria
Se utilizó el agregómetro PACKS-4 de Helena Laboratories, el cual es un analizador que mide la agregación de plaquetas humanas por el método de absorbancia usando cuatro canales, utilizando simultáneamente como agregantes ácido araquidónico, ADP, colágeno y epinefrina (8).
Definición de términos
Angina estable: cuando no existe deterioro sustancial de la clínica en los últimos meses (al menos dos meses), no se han notado cambios infrecuencia, duración o intensidad de los episodios de angina, como en los factores precipitantes o la facilidad con la cual se mejora (9).
Enfermedad coronaria significativa: definida angiográficamente al existir una estenosis igual o mayor al 70% del diámetro de un segmento de una arteria epicárdica mayor o igual o mayor del 50% del diámetro del tronco de la arteria coronaria izquierda (10).
Diabetes mellitus: describe varios síndromes de alteración en el metabolismo de carbohidratos que se caracterizan por hiperglicemia; está asociada a una incapacidad parcial o total de la secreción de insulina y/o la presencia de resistencia a la acción de la insulina. Los parámetros considerados son (11): normal – glicemia en ayunas <100 mg/dL, intolerancia a los carbohidratos: glicemia en ayunas: 100 a 125 mg/dL, diabetes mellitus: glicemia en ayunas >126 mg/dL o glicemia aleatoria > 200 mg/dL.
Dislipidemia: de acuerdo con el Tercer reporte del Panel de Expertos en la Detección, Evaluación y Tratamiento de Colesterol Sanguíneo en Adultos (ATP III), las alteraciones de los lípidos se clasifican como (12): colesterol LDL (mg/dL): <100 óptima, 100-129 cerca o arriba de lo óptimo, 130-159 limítrofe alto, 160-189 alto, ³190 muy alto. Colesterol total: <200 deseable, 200-239 limítrofe alto, >240 alto. Colesterol HDL: <40 bajo, >60 alto.
Tabaquismo: factor de riesgo reversible para enfermedad coronaria. La incidencia de infarto de miocardio se incrementa seis veces en mujeres y tres veces en varones que fumen al menos 20 cigarrillos al día comparado con los no fumadores (13,14).
Resistencia al AAS: para este estudio se definió como la presencia de agregación plaquetaria con ácido araquidónico a los 10 minutos mayor del 20%.
Análisis de los datos
Los datos fueron almacenados por duplicado en una base de datos en el programa Epi Info 6,04d. Por medio de un análisis descriptivo se obtuvieron los promedios y proporciones de las variables clínicamente relevantes con sus correspondientes desviaciones estándar e intervalos de confianza del 95%. Se utilizó la prueba t de Student para comparar los grupos de acuerdo con la presencia de vaso único o multivaso y la presencia de resistencia al AAS. Mediante la prueba del Chi cuadrado se cruzaron las variables demográficas, los antecedentes patológicos y la medicación que recibían. Se consideró un nivel de significancia estadística con valor p menor a 0,05. Cuando es necesario se presentan los intervalos de confianza al 95% (IC95%). Para establecer los valores de sensibilidad y especificidad se usó la metodología de evaluación de tecnologías diagnósticas para un muestreo de corte transversal (15).
Aspectos éticos
El estudio fue realizado en sujetos adultos quienes por su enfermedad cardiovascular iban a ser sometidos a procedimiento de cateterismo cardíaco. A todos los sujetos se les explicaron los alcances del proyecto y de aceptar su participación se hizo que firmaran el consentimiento informado. La estrategia para la recolección de datos fue mediante la entrevista verbal, la toma de muestras de sangre con material desechable y la revisión de las películas de los cateterismos. Los datos recolectados durante el estudio han sido confidenciales y de uso exclusivo de la investigación. Este proyecto de forma global ha sido aprobado por el Comité de Ética en Investigación de la Fundación Cardio Infantil para su realización. Esta investigación se clasificó como estudio «con riesgo mínimo», según el numeral b del Artículo 11, de la resolución 008430 de 1993 del Ministerio de Salud de la República de Colombia.
Resultados
Aspectos demográficos
Se incluyeron 71 sujetos con enfermedad coronaria estable que venían consumiendo AAS, cuya mayoría (51, 71,8%) eran varones. De 6 sujetos sanos, 4 (66,7%) fueron mujeres. Las edades en el grupo enfermo oscilaron entre 42 y 81 años, con promedio de 63,5±9,4 años, y en el grupo control entre 54 a 67 años, con promedio de 61,3±4,6 (p: 0,42).
Antecedentes clínicos y farmacológicos
Los factores de riesgo en la población con enfermedad coronaria se encontraron en orden de frecuencia: 52 (73,2%) dislipidémicos, 48 (67,6%) hipertensos, 15 (21,1%) diabéticos y 9 (12,7%) fumadores. En asociación de factores: 4 (4,9%) no tuvieron factores de riesgo, 27 (26,6%) tuvieron un factor y 51 (62,2%) 2 o más factores de riesgo. La población control tuvo dos casos con un factor de riesgo y cuatro casos con dos o más factores.
En cuanto a los medicamentos de consumo en 45 (63,4%) casos se documentó AAS: genérico en 17 (37,8%), Asawin® en 11 (24,4%), Aspirina® en 10 (22,2%), Cardioaspirina® en 4 (8,9%) y de origen norteamericano en 3 (6,7%); agrupándolas en genéricas suman 22 (44,9%) y de marca 27 (55,1%). Otros medicamentos que venían siendo administrados simultáneamente fueron betabloqueadores 48 (67,6%), estatinas 45 (63,4%), inhibidores de la enzima convertidora de angiotensina 37 (52,1%), calcio-antagonistas 18 (25,4%), clopidogrel 15 (21,1%), diuréticos 14 (19,7%), nitratos 11 (15,5%), biguanidas 10 (14,1%), sulfonilúreas 7 (9,9%), tiroxina 5 (7%), insulina 4 (5,6%), fibratos 4 (5,6%), ARA-II 2 (2,8%), amiodarona 2 (2,8%), alfa-antagonistas 1 (1,4%), digital 1 (1,4%) e ibuprofeno 1 (1,4%).
Datos de angiografía coronaria
En relación con el número de vasos detectados con lesiones severas, en 13 (15,9%) se documentó un vaso, en 31 (37,8%) dos vasos y en 27 (32,9%) tres vasos; agrupando los dos y tres vasos como enfermedad multivaso corresponden a 58 (81,7%) casos. Al describir por arteria coronaria: 57 (69,5%) tuvo compromiso de la derecha, 55 (67%) de la descendente anterior y 22 (48,9%) de la circunfleja. Al comparar el compromiso vascular y los grupos etáreos se aprecia predominio de enfermedad multivaso (Figura 1).

Pruebas de agregometría plaquetaria
La agregación plaquetaria obtenida para ADP, colágeno, epinefrina y ácido araquidónico se presenta en la tabla 1.
Comparación entre grupos de acuerdo con enfermedad vascular
La relación entre variables demográficas, antecedentes, tipos de AAS, medicación concomitante y agregometrías se comparó de acuerdo con el grado de compromiso vascular (Tabla 2).

La comparación de los valores de ADP entre los sujetos consumidores de clopidogrel fue de 49,9±13,9 versus no consumidores 67,8±18,6, lo cual la hace estadísticamente significativa (p<0,01).
La evaluación de los valores de agregación plaquetaria de acuerdo con cada factor de riesgo en la población con enfermedad coronaria, se presenta en la tabla 3; se destaca la presencia estadísticamente significativa de mayor agregación mediada por ácido araquidónico en el grupo de fumadores y una menor respuesta al ADP en el grupo de diabéticos.
Resistencia al AAS
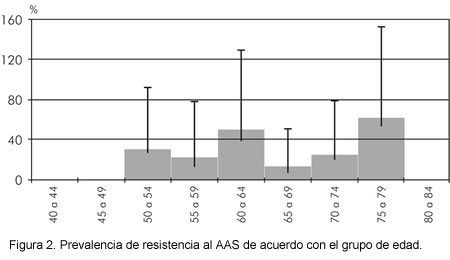
Del grupo de 71 sujetos con enfermedad coronaria estable, 20 cumplían la definición de resistencia al AAS propuesta de tener un valor de agregación plaquetaria al ácido araquidónico mayor al 20%, por lo cual se pudo calcular una prevalencia del 28,2% (IC 95%: 18,1-40,1). La prevalencia de la resistencia al AAS por grupo etáreo muestra la presencia de dos picos: en el grupo de 60 a 64 años y en el de 75 a 79 años (Figura 2).
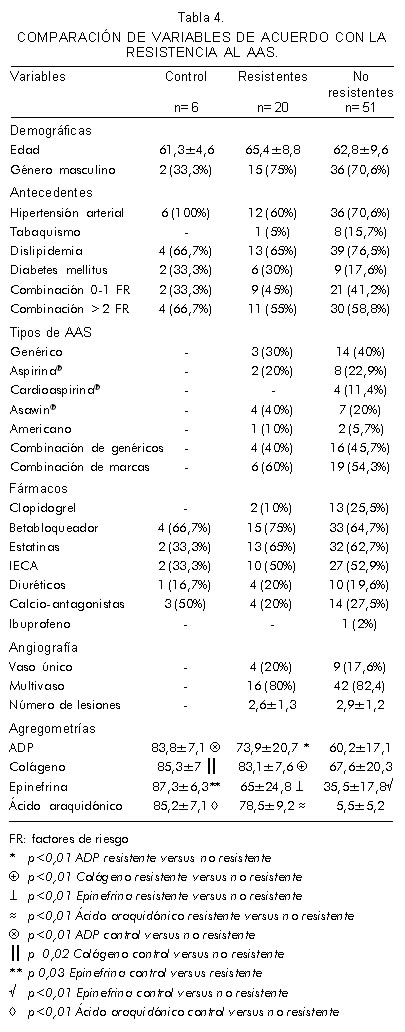
No existen diferencias estadísticamente significativas al comparar el ser resistente con las variables demográficas, antecedentes médicos, tipos de AAS, combinación de marcas de AAS y medicación coadyuvante (Tabla 4). Los valores de agregometría plaquetaria fueron significativamente más altos en la población resistente. La prevalencia de resistencia en el grupo de diabéticos es del 40% (IC 95%: 17,5-67,1), en hipertensos del 25% (IC 95%: 14,1-39,9), en dislipidémicos del 25% (IC95%: 14,5-39,2) y en fumadores del 11% (IC 95%: 0,6-49,3).
Al comparar los resultados de este estudio con los obtenidos aplicando los criterios de Gum (16), el número de casos de resistentes se reduce a 15 (21,1%) (IC 95%: 12,3-32,4), pero según estos criterios se presenta una población clasificada como semi-respondedores que para nuestro estudio sería de 23 (32,4%) sujetos adicionales. Al establecer comparaciones entre los criterios utilizados mediante la metodología de evaluación de tecnologías diagnósticas para un muestreo de corte transversal, para los utilizados en este estudio la sensibilidad es de 100%, la especificidad de 91,1%, el valor predictivo positivo de 75% y el valor predictivo negativo de 100%. Si se excluyen los sujetos que de forma concomitante reciben clopidogrel (15 casos), aplicando los criterios de Gum la prevalencia aumenta al 25% (IC 95%: 14,8-36,6), sin variar de manera importante la sensibilidad (100%), la especificidad (90,5%), el valor predictivo positivo (77,8%) y el valor predictivo negativo (100%).
La agregación plaquetaria fue significativamente mayor (p<0,01) en el grupo de resistentes al AAS, sin hallarse diferencias entre enfermedad de vaso único o multivaso entre los subgrupos de no resistentes y resistentes. Se hallaron diferencias significativas (p<0,01) en la agregación de epinefrina y ácido araquidónico entre los no resistentes con enfermedad multivaso y los resistentes con vaso único y multivaso (Figura 3).

Discusión
Este estudio de resistencia al AAS en enfermedad coronaria estable es el primero de este tipo en la población colombiana (17). Como se presentó en la metodología, corresponde a uno de los brazos del estudio «Resistencia al AAS en pacientes con síndromes coronarios agudos - PLASA» (18), que se desarrolla en la Fundación Cardio Infantil de Colombia.
La población con enfermedad coronaria tipo angina estable es la de mayor riesgo de presentar eventos adversos tales como infarto y muerte, y es allí donde el AAS juega un papel preventivo, tal como fue demostrado en el estudio SAPAT (19), donde en sujetos con angina estable y edades entre 30 a 80 años el utilizar la antiagregación con AAS redujo el riesgo en 34%.
La «resistencia al AAS» según algunos autores, no tiene una definición única (20, 21); es una expresión que se utiliza para describir un número de diferentes fenómenos, incluyendo la incapacidad que tiene el AAS para proteger de complicaciones trombóticas, causar prolongación de los tiempos de sangrado, reducir la producción de TxA2 o alterar pruebas de función plaquetaria (22, 23).
Las posibles causas del fenómeno de resistencia son (24): disminución de la biodisponibilidad dada por la no adherencia al tratamiento, el uso concomitante de antiinflamatorios no esteroideos como el ibuprofeno, causas inherentes a la función plaquetaria como el recambio plaquetario acelerado o el aumento de la COX-2 plaquetaria, la existencia de fuentes externas de TxA2 como los monocitos/macrófagos, la existencia de polimorfismos del receptor plaquetario y finalmente, la asociación con factores de riesgo cardiovascular como la diabetes.
Estudios de farmacodinamia han demostrado alteraciones en la inhibición de la activación plaquetaria entre 8% y 26% de los pacientes que la consumen (25). Una de las primeras descripciones de resistencia se hizo en un estudio de prevención secundaria con altas dosis de AAS en pacientes con ictus; en el grupo de no respondedores se tuvo 10 veces más frecuencia de eventos isquémicos (26). Otros estudios clínicos han encontrado prevalencias entre 5% a 45% (16, 27, 28). Hasta 40% de los pacientes que van a cirugía de revascularización miocárdica no presentan alteración en las pruebas de coagulación al utilizar AAS (29).
En el estudio de Gum, hecho en sujetos con enfermedad coronaria estable, utilizaron pruebas de agregometría plaquetaria para determinar la resistencia y definieron los sujetos como resistentes si tenían valores de agregación ante ADP iguales o mayores a 70% asociado con valores ante ácido araquidónico iguales o mayores al 20%. Los investigadores obtubieron una prevalencia de 5,5%, aunque si tenían uno solo de los criterios fueron denominados como semirrespondedores teniendo su prevalencia en 23%. Los desenlaces clínicos del grupo resistente demostraron un riesgo de 3,12 veces mayor probabilidad de muerte, infarto de miocardio o enfermedad cerebrovascular (30). En un subanálisis del HOPE los sujetos con niveles más elevados de 11-dehidrotromboxano B2, metabolito urinario del AAS, representan un menor efecto antiplaquetario, además de 3,5 veces mayor mortalidad de origen cardiovascular (31).
El presente estudio mostró un predominio masculino del 71,8%, no representativo de la verdadera proporción poblacional de Colombia. Este valor es producto de la forma de inclusión continua de los sujetos que consultaron para la realización de su coronariografía. La edad promedio de 63,4 años concuerda con los preceptos clásicos de mayor presentación de la enfermedad coronaria a medida que la edad avanza (32).
La prevalencia de factores de riesgo debido al tipo de población tiende a ser más alta que para la población general colombiana (33); siendo para la dislipidemia de 73,2% en nuestro estudio versus 28,2% en Colombia, hipertensión arterial 67,6% versus 24,7%, diabéticos 21,1% versus 3,3%, pero menor en cuanto a fumadores 12,7% versus 18,3%.
Con relación al tipo de AAS utilizado, debido a que está incluido como medicamento esencial dentro del Plan Obligatorio de Salud, el tipo de presentación de mayor consumo es el genérico con 37,8%. Los otros fármacos de uso concomitante muestran que son del grupo indicado para el tratamiento de la enfermedad coronaria estable como betabloqueadores, estatinas, inhibidores de la enzima convertidora de angiotensina, entre otros (9).
En la revisión angiográfica, la enfermedad multivaso predominó en 81,7% de los casos, situación que se mantiene a medida que avanza el grupo etáreo y está de acuerdo con la cronicidad y progresión de la enfermedad coronaria aterosclerótica (34).
La agregometría mostró que al probar con los cuatro diferentes reactivos el que presenta mayor inhibición con el AAS es el ácido araquidónico, situación dada por el bloqueo de la ciclo-oxigenasa y por consiguiente la no producción de TxA2 (35); en cuanto a la epinefrina está documentado que su efecto es antagonista al AAS, por lo que se sospecha que en estados de activación simpática el efecto antiagregante del AAS es menor (36). La activación de la agregabilidad plaquetaria mediada por colágeno depende de la reactividad plaquetaria al colágeno, la producción plaquetaria de TxA2 y la respuesta plaquetaria al ADP secretado (37, 38) por lo cual no es la sustancia ideal para evaluar resistencia al AAS.
El ADP tiene un mecanismo de activación diferente al del ácido araquidónico y TxA2, sólo permite evaluar la acción de otro tipo de fármacos como el clopidogrel, el cual actúa de manera sinérgica al AAS como antiplaquetario (39), tal como se observa al comparar los valores de ADP en el grupo que consume clopidogrel, los cuales muestran un menor valor de forma estadísticamente significativa. El mayor consumo de clopidogrel en el grupo de vaso único, se explica por la inclusión en el estudio de enfermos coronarios estables que fueron revascularizados percutáneamente.
El comportamiento de los valores de agregometría plaquetaria con respecto a los factores de riesgo según lo expresado en la literatura, muestra que la hipertensión, la diabetes, la dislipidemia y el tabaquismo se asocian con un incremento en la agregación plaquetaria (40); en este estudio los hipertensos no tuvieron diferencias significativas, aunque se observa una tendencia a tener menores valores de agregación ante el ácido araquidónico. Los fumadores presentan un menor valor estadísticamente significativo de agregación plaquetaria ante el ácido araquidónico, aunque con la epinefrina se observa una tendencia similar pero no se encuentran diferencias estadísticas; estos hallazgos sugieren que el tabaquismo favorecería el efecto antiagregante del AAS, situación que deberá aclararse en otro estudio.
En la agregación de los dislipidémicos no se encuentran diferencias a pesar de tener una tendencia a tener valores de ácido araquidónico y epinefrina más bajos. En los diabéticos hubo diferencia significativa a favor de una mayor agregabilidad mediada por ADP, el resto no fueron significativos, aunque tuvieron valores menores de ácido araquidónico.
La resistencia al AAS en sujetos con enfermedad coronaria estable fue documentada en 28,2% de los casos, cifra más alta que la encontrada en estudios con sujetos similares como el de Gum, que presentó un valor de 5,5% (16) y en el cual se incluyeron como criterios diagnósticos la asociación de agregometría con ácido araquidónico y ADP. Esta última sustancia no es adecuada dado que la vía de activación del ADP no es inhibida por el AAS; según lo descrito en la literatura el ADP es un estímulo fuerte que produce agregación plaquetaria de forma independiente (41), por lo tanto el grupo catalogado de semirrespondedores no debe tenerse en cuenta. Sin embargo, para establecer una comparación se utilizaron los mismos criterios existiendo descenso de la prevalencia a valores entre 21,1% a 25%, cifra mayor que el 5,5% encontrado en la población coronaria estadounidense, el 11,1% hallado en sujetos con enfermedad coronaria estable en Chile (42) o el 20% hallado en Polonia (43).
El criterio para diagnosticar resistencia al AAS de tener valores de ácido araquidónico mayores al 20%, tiene buen rendimiento cuando se compara con los criterios de Gum y cuenta con una buena sensibilidad y especificidad, por lo cual para futuros estudios se recomienda sólo tener en cuenta al ácido araquidónico.
No hubo diferencias en cuanto a variables demográficas, factores de riesgo y medicación concomitante, quizás por la falta de poder en la muestra estudiada. Se aprecia mayor frecuencia en los grupos de edad de 60 a 64 y 75 a 79, hallazgo de relación con la edad hasta ahora no descrito en la literatura. La prevalencia de resistencia en el grupo de diabéticos es mayor que el 21,5% hallado en diabéticos alemanes (44) o el 18,5% de los diabéticos chilenos (42); igual comportamiento en los dislipidémicos e hipertensos que son mayores que los respectivos 10,9% y 10,7% chilenos. Por el contrario, en los fumadores fue menor que el 21,2% de los chilenos y en cuanto al tabaquismo se ha documentado que está asociado con resistencia (45), pero en el estudio de Gum y en el presente se halló un efecto inverso.
La obtención de valores significativamente altos de agregación plaquetaria en el grupo de resistentes, permite suponer que en esta población existe una alteración plaquetaria como manifestación de un mecanismo de reactividad agregante mayor, que pudiera estar asociada al polimorfismo en las subunidades de la glicoproteína IIbIIIa (46-48) o al aumento en el número de eritrocitos (49), hipótesis que deberán corroborarse en un próximo estudio.
Otro aspecto que debe tenerse en cuenta es la asociación descrita entre resistencia y enfermedad multivaso, lo cual no pudo corroborarse en este estudio, pero que ha sido descrito en un estudio japonés donde la enfermedad multivaso se asoció con valores más altos de ADP y colágeno (50) y en el estudio de Polonia donde hubo mayor resistencia al AAS en la enfermedad multivaso (43). En un estudio posterior deberá aclararse la asociación entre resistencia y la progresión de enfermedad aterosclerótica.
Nuestro estudio cuenta con la limitación de ser un brazo de un proyecto que tiene por objetivo evaluar la presencia de resistencia en sujetos con enfermedad coronaria estable e inestable, por lo cual el poder puede ser insuficiente para detectar diferencias, aunque éstas puedan existir. Otra limitación está dada por el tipo de diseño del estudio que no permite definir causalidad.
Conclusiones
La resistencia al AAS no es una entidad exótica en nuestro medio ni es exclusiva de países desarrollados; la prevalencia hallada del 28,2% (es decir dos de cada siete sujetos con enfermedad coronaria estable que consuman AAS) es mayor que la registrada en otras series y el criterio diagnóstico para resistencia utilizado tiene buena sensibilidad y especificidad, por lo cual debe usarse para próximos estudios.
En un futuro cercano al analizar globalmente la población con enfermedad coronaria estable e inestable, se deberá aclarar la relación entre tabaquismo, agregabilidad plaquetaria y resistencia. Además deberán realizarse estudios genéticos para determinar si hay presencia de polimorfismos en la glicoproteína IIbIIIa como causa de resistencia en la población colombiana con enfermedad coronaria estable.
En los sujetos resistentes deberá hacerse un seguimiento a largo plazo que permita valorar cuál es el riesgo de eventos adversos mayores. Por otro lado, dada la alta prevalencia de resistencia y la posible asociación con enfermedad multivaso para este grupo, deberán diseñarse estudios de intervención con otras terapias antiagregantes como el clopidogrel.
Conflictos de interés
Trabajo financiado parcialmente por el Departamento de Investigaciones de la Fundación Cardio Infantil como «Mejor Propuesta de Investigación Año 2003».
Agradecimientos
A las bacteriólogas María Urrego y Patricia Parada de la Fundación Cardio Infantil por el apoyo logístico. A los pacientes y al personal del Servicio de Hemodinamia de la Fundación Cardio Infantil por su colaboración.
Bibliografía
1. Fuster V. Epidemic of cardiovascular disease and stroke: the three main challenges. Circulation 1999; 99: 1132-7. [ Links ]
2. National Institute of Health, Lung and Blood Institute. Morbidity & Mortality: 1998 Chartbook on Cardiovascular, Lung and Blood Diseases. UD Department of Health and Human Service, Public Health Services, 1998. [ Links ]
3. Rodríguez NL. Epidemiología de la enfermedad ateroesclerótica coronaria. Clínicas Colombianas de Cardiología 1999; 2: 21-2. [ Links ]
4. Pabon Rodriguez A. La mortalidad en Colombia 1953-1991. Bogotá, Colombia: Instituto Nacional de Salud, 1993. [ Links ]
5. López P, Casas JP, Bautista L, Serrano NC, Morillo CA. An integrated proposal to explain the epidemic of cardiovascular disease in a developing country: from socio-economic factors to free radicals. Cardiology 2001; 96:1-6. [ Links ]
6. Preston FE, Whipps S, Jackson CA, et al. Inhibition of prostacyclin and platelet thromboxane A2 after low-dose aspirin. N Engl J Med 1981; 304:76-9. [ Links ]
7. Patrono C. Aspirin resistance: definition, mechanisms and clinical read-outs. J Thromb Haemost 2003; 1:1710-3. [ Links ]
8. Helena Laboratories. Agregation reagents. Cat. No. 5366, 5367, 5368, 5369. [ Links ]
9. Gibbons RJ, Abrams J, Chatterjee K, Daley J, Deedwania PC, Douglas JS, et al. ACC/AHA 2002 guideline update for the management of patients with chronic stable angina: a report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines (Committee to Update the 1999 Guidelines for the Management of Patients with Chronic Stable Angina). 2002. Disponible en: www.acc.org/clinical/guidelines/stable/stable.pdf. [ Links ]
10. The Joint European Society of Cardiology/American College of Cardiology Comitee. Myocardial infarction redefined – A consensus document of The Joint European Society of Cardiology/American College of Cardiology Committee for the Redefinition of Myocardial Infarction. Eur Heart J 2000; 21: 1502-13. [ Links ]
11. Report of the Expert Committee on the diagnosis and classification of diabetes mellitus. Diabetes Care 2004; 20: 1183-97. [ Links ]
12. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. JAMA 2001; 285: 2486-97. [ Links ]
13. Njolstad I, Arnesen E, Lund – Larsen PG. Smoking, serum lipids, blood pressure, and sex differences in myocardial infarction. A 12-year follow-up of the Finnmark Study. Circulation 1996; 93: 450-6. [ Links ]
14. Prescott E, Hippe M, Schnohr P, Hein HO, Vestbo J. Smoking and risk of myocardial infarction in women and men: longitudinal population study. BMJ 1998; 316: 1043-7. [ Links ]
15. Orozco LC, Camargo D. Evaluación de tecnologías diagnósticas y tipos de muestreos. Biomédica 1997; 17: 321-4. [ Links ]
16. Gum PA, Kottke-Marchant K, Poggio ED. Profile and prevalence of aspirin resistance in patients with cardiovascular disease. Am J Cardiol 2001; 88:230-5. [ Links ]
17. Vesga BE, Echeverri D. Resistencia al ASA en pacientes con enfermedad coronaria. Rev Col Cardiol 2006; 12: 266. [ Links ]
18. Vesga BE, Echeverri D, Urrego MT. Resistencia al ASA en pacientes con síndromes coronarios agudos. Acta Med Col 2004; 29: 215-6. [ Links ]
19. Juul-Moller S, Edvardsson N, Jahnmatz B, et al. Double-blind trial of aspirin in primary prevention of myocardial infarction in patients with stable chronic angina pectoris. The Swedish Angina Pectoris Aspirin Trial (SAPAT) Group. Lancet 1992; 340: 1421-5. [ Links ]
20. Cattaneo M. Aspirin and clopidogrel, efficacy, safety, and the issue of drug resistance. Aterioscler Thromb Vasc Biol 2004; 24: 1980-7. [ Links ]
21. Hankey GJ, Eikelboom JW. Aspirin resistance. Lancet 2006; 367: 606-17. [ Links ]
22. Patrono C. Aspirin resistance: definition, mechanisms. J Thromb Haemost 2003; 1: 1710-3. [ Links ]
23. Silva F, Rueda C, Ardila Y. Resistencia al ácido acetil salicílico. Acta Med Col 2005; 30: 274-80. [ Links ]
24. DeGaetano G. Aspirin resistance. J Thromb Haemost 2003;1: 2048-50. [ Links ]
25. Alexander JH, Steinhubl SR. Aspirin resistence. In: Topol EJ (ed): Acute coronary Syndromes, 2nd. Ed. New York: Marcel Dekker, 2001.p. 499-514. [ Links ]
26. Grotenmeyer KH, Sharafinski HW, Husstedt IW. Two years follow-up of aspirin responder and aspirin non responder. A pilot-study including 180 post-sroke patients. Throm Res 1993; 71: 397-403. [ Links ]
27. Helgason CM, Tortorice KL, Winkler SR. Aspirin response and failure in cerebral infarction. Stroke 1993; 24: 345-50. [ Links ]
28. Sanderson S, Emery J, Baglin T, Kinmonth A. Narrative Review: Aspirin resistance and its clinical implications. Ann Intern Med 2005; 142:370-80. [ Links ]
29. Buchanan MR, Brister SJ. Individual variation in the effects of ASA on platelet function: implications for the use of ASA clinically. Can J Cardiol 1995; 11: 221-7. [ Links ]
30. Gum PA, Kottke K, Welsh P, White J, Topol E. A prospective, blind determination of the natural history of aspirin resistance among stable patients with cardiovascular disease. J Am Coll Cardiol 2003; 41: 961-5. [ Links ]
31. Eikelboom J, Hirsh J, Weitz J, Johnston M, Yusuf S. Aspirin – resistant thromboxane biosynthesis and the risk of myocardial infarction, stroke or cardiovascular death in patients. Circulation 2002; 105: 1650-5. [ Links ]
32. O´Rourke RA, O´Gara P, Douglas JS. Diagnosis and managemet of patients with chronic ischemic heart disease. In: Fuster V, Alexander RW, O´Rourke RA, eds. Hurt´s The Heart. 7th. edition. New York: McGRaw Hill, 2004. p. 1465-94. [ Links ]
33. Ministerios de Salud. III Estudio Nacional de Salud Bucal y II Estudio de Factores de Riesgo de las enfermedades crónicas. Colombia, 1999. [ Links ]
34. Morrow DA, Gersh BJ, Braunwald E. Chronic coronary artery disease. In: Zipes DP, Libby P, Bonow Ro, Braunwald E, eds. Braunwald´s Heart disease. 7th. edition. Philadelphia: Elsevier Saunders, 2005.p. 1281-41. [ Links ]
35. Smith WL, Garavito RM, DeWitt DL. Prostaglandin endoperoxide H synthases (cyclooxygenases)-1 and -2. J Biol Chem 1996; 271: 33157-60. [ Links ]
36. Larrson PT, Wallen NH, Hjemdal P. Norepinephrine-indiced human platelet activation in vivo is only partly conteracted by aspirin. Circulation 1994; 89: 1951-7. [ Links ]
37. Kawasaki T, Ozeki Y, Igawa T, Kambayashi J. Increased platelet sensitivity to collagen in individuals resistant to low dose aspirin. Stroke 2000; 31: 591-5. [ Links ]
38. Mangin P, Ohtman P, Eckly A, Cazenave JP, Lanza F, Gachet C. The P2Y(1) receptor plays an essential role in the platelet shape change induced by collagen when TxA2 formation is prevented. J Thromb Haemost 2004; 2: 969-77. [ Links ]
39. Quinn MJ, Fitzgerald DJ. Ticlopidine and clopidogrel. Circulation 1999; 100: 1667-72. [ Links ]
40. Fuster V. Mechanism leading to myocardial infarction: insights from studies of vascular biology. Circulation 1994; 90: 2126-46. [ Links ]
41. Cattaneo M, Gachet C, Cazenave JP, Packman MA. Adenosine diphosphate (ADP) does not induce thromboxane A2 generation in human platelets. Blood 2002; 99: 3668-9. [ Links ]
42. Dussaillant G, Zapata M, Fardella P, Conte G, Cuneo M. Frecuencia y características de resistencia alaaspirina en pacientes cardiovasculares chilenos. Rev Med Chile 2005; 133: 409-17. [ Links ]
43. Kuliczkowski W, Halawa B, Korolko B, Mazurek B. Aspirin resistance in ischaemic heart disease. Polish Heart Journal 2005; 62: 14-25. [ Links ]
44. Fateh-Moghadam S, Plockinger U, Cabeza N. Prevalence of aspirin resistance in patients with type 2 diabetes. Acta Diabetol 2005; 42: 99-103. [ Links ]
45. Hung J, Lam JY, Lacoste L. Cigarette smoking acutely increases platelet thrombus formation in patients with coronary artery disease taking aspirin. Circulation 1995; 92: 2432-6. [ Links ]
46. Michelson AD, Furman MI, Goldsehmidt P. Platelet GP IIIa PI9A) polymorphisms display different sensitivities to agonists. Circulation 2000; 101:1013-8. [ Links ]
47. Cooke G, Bray P, Hamlington J, Pham D, Goldschmidt- Clermont P. P1A2 polymorphisms and efficacy of aspirin. Lancet 1998; 351: 1253-5. [ Links ]
48. Hanjis C, Frishman WH, Lerner RG. Aspirin resistance: mechanisms and clinical implications. Cardiology in Review 2006; 14: 18-25. [ Links ]
49. Valles J, Santos MT, Aznar J, Osa A, Lago A. Erithrocyte promotion of platelet reactivity decreases the effectiveness of aspirin as an antithrombotic therapeutic modalito. The effect of low dose aspirin is less than optimal in patients with vascular disease due to prothrombotic effects of erythrocytes on platelet reactivity. Circulation 1998; 97: 350-5. [ Links ]
50. Ersoz G, Tikiz H, Yakarylmaz A, Tezcan K. Differential effect of aspirin on platelet aggregation in patients with coronary artery disease. Jpn Heart J 2003; 44: 21-9. [ Links ]














