Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.13 no.3 Bogota Nov./Dec. 2006
(1) Instituto de Investigaciones, Fundación Cardiovascular de Colombia. Floridablanca, Santander, Colombia.
(2) Unidad de Síncope, Laboratorio de Función Autonómica, Servicio de Arritmias, División de Cardiología, Departamento de Medicina, Universidad de McMaster. Hamilton, Ontario, Canadá.
(3) Departamento de Epidemiología y Salud de Poblaciones, London School of Hygiene and Tropical Medicine, Universidad de Londres, Reino Unido.
(4) Hospital Universitario de Santander. Universidad Industrial de Santander, Bucaramanga, Santander, Colombia.
(5) Universidad Industrial de Santander, Bucaramanga, Santander, Colombia.
Recibido: 12/15/06. Aprobado: 04/09/06.
Introducción: la enfermedad de Chagas es una infección parasitaria ocasionada por el Trypanosoma cruzi. En Latinoamérica esta enfermedad es endémica, y la cardiomiopatía chagásica es su manifestación más frecuente en Colombia. Este artículo describe las principales características clínicas, electrocardiográficas y ecocardiográficas de la cardiomiopatía chagásica en el Departamento de Santander, Colombia.
Materiales y métodos: se realizó un estudio descriptivo, transversal, de sujetos provenientes de Santander, entre los 18 y 80 años, seropositivos para T. cruzi, con síntomas de falla cardiaca no terminal. A estos pacientes se les realizó examen físico, electrocardiograma y ecocardiograma bidimensional.
Resultados: se evaluaron 119 pacientes, 62 mujeres y 57 hombres, con edad promedio de 58,5 ± 10,7 años. Los antecedentes más frecuentes fueron: hipertensión arterial (49,6%), implantación de marcapaso (8,4%) y dislipidemia (7,6%). En 34,3% de los sujetos se encontró hipertrofia ventricular izquierda en asociación con trastornos de repolarización. De las anormalidades de conducción, el bloqueo de rama derecha fue el más frecuente (11,8%). La valvulopatía más común fue la insuficiencia mitral (61,5%). Ninguna de estas variables se asoció con un peor estado de clase funcional.
Discusión: las características electrocardiográficas de la cardiomiopatía chagásica en Colombia, parecen tener un comportamiento diferencial por regiones, y para la zona del Departamento de Santander lo más usual es el hallazgo de hipertrofia ventricular izquierda, trastornos de repolarización y bloqueo de rama derecha. Las intervenciones tempranas en este grupo de pacientes son necesarias dado el alto costo social y económico que conlleva la cardiomiopatía chagásica.
Palabras clave: enfermedad de Chagas, Trypanosoma Cruzi, cardiomiopatía chagásica, falla cardíaca, infección parasitaria.
Background: Chagas’ disease (CD) is a parasitic infection caused by the Trypanosoma cruzi. In Latin America the disease is endemic and Chagas’ cardiomyopathy(CCM) is the main clinical presentation of CD in Colombia. This article describes the main clinical, electrocardiographic and echocardiographic characteristics of the CCM in Santander, Colombia.
Materials and methods: A cross-sectional study of patients of ages between 18 and 80 years, from the Department of Santander, Colombia, with positive serology for T. cruzi, and symptoms of non-terminal heart failure was performed. Physical examination, 12-lead electrocardiogram and 2D echocardiogram were carried out.
Results: The study included 62 women and 57 men, mean age 58.5±10.7 years. Hypertension (49.6%), pacemaker implantation (8.4%) and dyslipidemia (7.6%) were the most frequent antecedents. Left ventricular hypertrophy was seen in 34.3% of the subjects and it was associated to abnormalities in re-polarization. Right bundle branch block was determined in 11.8% of the subjects. Mitral insufficiency was identified by echocardiogram in 61.5% of the participants. None of these variables were associated with a worse functional class state.
Discussion: The electrocardiographic characteristics in patients with CCM in Colombia seem to have a different behaviour according to the regions, and for Santander the most frequent findings were left ventricular hypertrophy, abnormalities in repolarization and right bundle branch block. Early interventions on this group of patients are necessary in order to reduce the social and economic impact associated to the CCM.
Key Words: Chagas’disease, trypanosoma cruzi,chagasic cardiomyopathy, heart failure, parasitic infection.
Introducción
La enfermedad de Chagas es una infección parasitaria ocasionada por el Trypanosoma cruzi (T. cruzi), la cual fue descrita en 1909 por el doctor Carlos Chagas. Esta enfermedad ocasiona un marcado impacto en la salud pública de Latinoamérica (1) ya que afecta principalmente a la población adulta joven. No obstante, la implantación de medidas para su control y la erradicación del vector, han reducido de 700.000 nuevos casos en 1983 (2) a 200.000 en el 2000 (3, 4). La enfermedad de Chagas ocasiona un alto costo tanto económico como en la calidad de vida de quienes la padecen. Datos de la Organización Mundial de la Salud calculan gastos cercanos a los 1.200 millones de dólares en atención a los pacientes infectados y para el año 2000 se estimaron 22.000 muertes a razón de este mal, un número cercano a la mitad de las defunciones por la misma causa en 1983 (2, 3).
Tras la infección, en las seis a ocho semanas siguientes, se desarrolla la fase aguda que se caracteriza por una elevada parasitemia, la aparición de síntomas inespecíficos (fiebre, cefalea, anorexia y mialgias) y algunos signos clínicos como el complejo oftalmo-ganglionar (signo de Romaña), el chagoma y la linfadenopatía generalizada. Solamente en el 1% de los casos se presenta una verdadera carditis producto de la afectación del tejido miocárdico (5).
Durante la fase crónica se disminuye el conteo parasitario en sangre y consta de un período indeterminado o subclínico, que puede prolongarse por quince o veinte años. Sin embargo, aunque no se presentan alteraciones clínicas evidentes durante esta etapa, sí se han determinado cambios a nivel tisular en los órganos por los que el T. cruzi presenta trofismo especial como lo son el tejido muscular y de conducción cardiaco, y los plexos nerviosos mioentéricos (5-7). En el 30% al 40% de los sujetos seropositivos, se detectan anormalidades cardiacas desde la etapa asintomática, pero sólo el 20% desarrollará trastornos cardiacos (8, 9).
En estadios avanzados de la fase crónica se presentan las manifestaciones clásicas de la enfermedad tales como miocardiopatía chagásica, megacolon, dilatación esofágica y disautonomías. Dentro de los mecanismos fisiopatológicos se han propuesto efectos directos del parásito mediados por autoinmunidad, denervación autonómica y anormalidades microvasculares y de la matriz extracelular (10, 11).
En países como Brasil, Venezuela, Argentina y Colombia en donde la enfermedad de Chagas es endémica, la prevalencia global es del 10%, pero en zonas rurales las cifras oscilan entre el 25% al 75% (12). En Colombia el T. cruzi es trasmitido por el Rhodnius prolixus, sin embargo el T. dimidiata también ha sido descrito como un vector efectivo de transmisión de T. cruzi (13).
En Colombia se estima que el 10% de la población total se encuentra en riesgo; en promedio el 5% de la población de la región oriental del país está infectada, lo cual corresponde a unos 700.000 individuos de los cuales el 25% podría desarrollar alteraciones a nivel del miocardio. Los departamentos con mayor frecuencia de infección son Arauca, con una tasa de prevalencia por 100 habitantes de 21,1, Casanare con 10, Santander con 6,3 y Norte de Santander con 5,2 (14).
En Centroamérica, México, Colombia y Venezuela (11, 13) las manifestaciones gastrointestinales son raras. En nuestra población la cardiomiopatía chagásica es la manifestación más frecuente de la enfermedad de Chagas (13, 14); usualmente se presenta en pacientes mayores de 40 años de edad y se caracteriza por infiltración linfocitaria compatible con miocarditis crónica que finalmente conlleva cardiomegalia, aparición de aneurisma ventricular, falla cardiaca y trastornos de la conducción con potencial arritmogénico (6, 15). Sin embargo, cuando la cardiomiopatía chagásica se presenta en pacientes menores de 30 años, sus manifestaciones pueden ser más severas y conllevan un pobre pronóstico (16). Este artículo busca describir las principales características clínicas, electrocardiográficas y ecocardiográficas de la cardiomiopatía chagásica en Santander, determinadas durante la participación en el estudio CHARITY.
Materiales y métodos
En el estudio participaron hombres y mujeres entre los 18 y 80 años, seropositivos para T. cruzi, quienes recibieron atención en la Clínica de Falla Cardiaca de la Fundación Cardiovascular de Colombia de Floridablanca y San Gil, ambas localidades ubicadas en el Departamento de Santander. Previa firma del consentimiento informado, se realizó examen físico completo, tomas de tensión arterial en posición sentado y de pie, serología para T. cruzi, electrocardiograma de 12 derivaciones y ecocardiograma bidimensional.
Dentro de los criterios de inclusión se tuvieron en cuenta: síntomas de falla cardiaca en clase funcional I-III de la NYHA, fracción de eyección menor del 50%, dosis estables de inhibidores de la enzima convertidora de angiotensina o antagonistas del receptor de angiotensina durante las cuatro semanas previas a la inclusión y dosis estable de diurético en las dos semanas previas al enrolamiento. Se excluyeron aquellos pacientes que presentaban falla cardiaca de otro origen, insuficiencia aórtica severa, frecuencia cardiaca menor a 50 latidos por minuto en reposo, creatinina mayor a 2,5 mg/dL, embarazo o lactancia, sospecha de hepatitis B o de SIDA, historia de abuso de alcohol o drogas psicoactivas, alteraciones psiquiátricas o enfermedad que afectara la expectativa de vida en seis meses.
El protocolo fue avalado por el Comité de Ética de la Fundación Cardiovascular de Colombia, siguiendo los lineamientos de la Declaración de Helsinki y el decreto 8430/93 del Ministerio de Protección Social de Colombia.
Análisis estadístico
Se realizó un análisis descriptivo de una línea basal de los pacientes que ingresaron al estudio. El análisis se hizo en STATA 8,0; se estableció la normalidad y homocedasticidad de las variables de interés mediante la prueba de Shapiro–Wilk y Levene. A partir de esto, se estimaron las proporciones y medias con sus correspondientes intervalos de confianza del 95% de acuerdo con la distribución de frecuencias. Mediante un análisis bivariado se evaluaron los posibles efectos relacionados con factores de riesgo de la enfermedad; para este estudio se partió de un nivel de significancia del 0,05.
Resultados
En total, se evaluaron 119 pacientes, 62 mujeres (52,1%) y 57 hombres (47,9%), con edad promedio de 58,5 ± 10,7 años. El 11,9% de los pacientes fueron reclutados en Floridablanca y el 88,1% en la sede de San Gil. Los antecedentes más frecuentes fueron: hipertensión arterial en el 49,6% de los pacientes, seguida de implantación de marcapaso en 8,4% y dislipidemia en 7,6%. Los antecedentes personales de hipotiroidismo, valvulopatías, diabetes mellitus, insuficiencia cardiaca congestiva, accidente cerebrovascular y enfermedad renal se describen en la tabla 1.
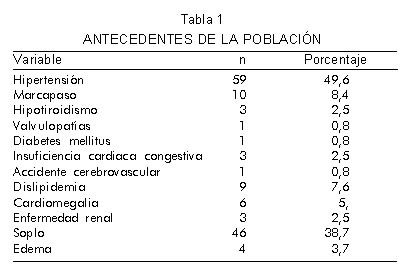
En el 38,7% de la población se determinó la presencia de soplos cardiacos al momento de la auscultación. La clase funcional II predominó en el 85,6% de los pacientes, seguidos de la clase funcional III con 13,6% y la clase funcional I con 0,8% según la clasificación propuesta por la NYHA.
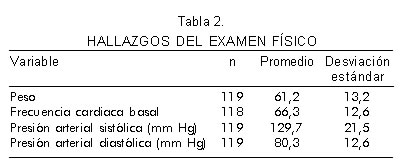
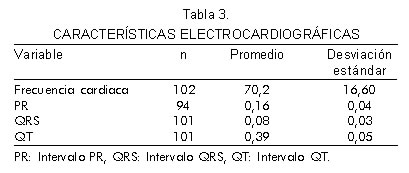
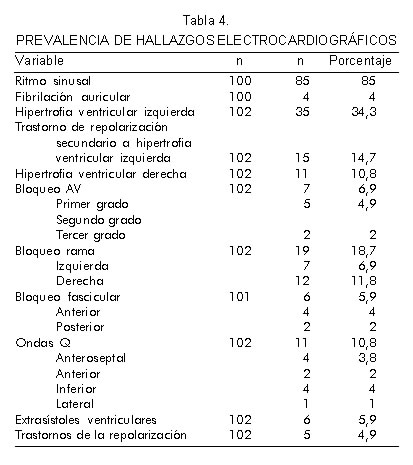
Las variables del examen físico se presentan en la tabla 2 y la descripción general del electrocardiograma se muestra en la tabla 3. El 85% de la población tuvo ritmo sinusal, el 7% ritmo de marcapaso, el 2% aleteo auricular, el 4% fibrilación auricular, el 1% bigeminismo ventricular y el 1% otra arritmia (Tabla 4). La anormalidad más frecuente fue la hipertrofia ventricular izquierda (34,3%) que se asoció a trastornos de repolarización (14,7%) con una razón de prevalencia (RP) de 4,35 (IC 95% 2,96 – 6,34). El 18,7% de los sujetos presentaba trastornos de conducción de los cuales el más frecuente fue el bloqueo de rama derecha (63,1%). Es interesante saber que la presencia de ondas Q patológicas se documentó en el 10,8%, con mayor frecuencia en la cara anteroseptal e inferior (Tabla 4).
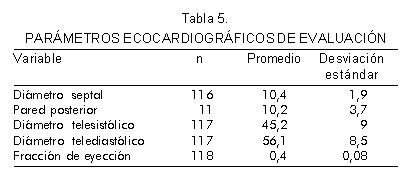
En la evaluación ecocardiográfica se obtuvo un diámetro telediastólico promedio de 56,1 mm ± 8,5 y un promedio de diámetro telesistólico de 45,2 mm ± 9; se encontró un leve aumento en los diámetros septal y posterior (Tabla 5). La regurgitación mitral se evaluó y clasificó según los métodos convencionales, encontrando algún grado de insuficiencia en el 61,5% de la población, con una asociación estadísticamente significativa entre la presencia de regurgitación mitral grado 4 con soplo sistólico (RP= 11,66; p= 0,013) como se muestra en la tabla 6.

Discusión
La cardiomiopatía chagásica se caracteriza por síntomas de falla cardiaca congestiva, arritmias que pueden predisponer a tromboembolismo sistémico o muerte súbita y bloqueo aurículo-ventricular (8, 17). La información disponible sobre anormalidades electrocardiográficas en pacientes con enfermedad de Chagas en Colombia, reporta que las más frecuentes en orden de frecuencia son: extrasistolia ventricular, bloqueo completo de rama derecha del haz de His, bloqueo aurículo-ventricular y fibrilación auricular (18). Sin embargo, las anormalidades varían dependiendo de la región evaluada. En Boyacá, los hallazgos electrocardiográficos más frecuentes en sujetos seropositivos para T. cruzi fueron los trastornos inespecíficos de la repolarización (22,4%), el bloqueo de rama derecha (14,1%) y la hipertrofia ventricular izquierda (7,3%) (19). En nuestro estudio se reporta una prevalencia de 4,9%, 11,8% y 34,3%, respectivamente. En la población evaluada se determinó una mayor prevalencia de ondas Q patológicas comparada con datos previamente publicados (18, 19).
Estudios prospectivos reportan que durante la fase indeterminada pueden existir cambios electrocardiográficos tempranos que no modifican el pronóstico de la enfermedad (20, 21). La diferencia entre los hallazgos electrocardiográficos descritos clásicamente en la enfermedad de Chagas reportados en otros estudios (8, 18, 19) y los encontrados en nuestra población, puede obedecer a que los pacientes incluidos en CHARITY presentaban un espectro más severo de la enfermedad. Los resultados de la evaluación por ecocardiograma bidimensional, corresponden a los hallazgos clásicos esperados para pacientes clasificados en los diferentes estadios de falla cardiaca según la NYHA.
Agradecimientos
Este manuscrito se realizó gracias al apoyo financiero del Instituto para el Desarrollo de la Ciencia y la Tecnología de Colombia, COLCIENCIAS (Código 6566-04-11795).
Bibliografía
1. Miles MA, Feliciangeli MD, Arias AR. American trypanosomiasis (Chagas’ disease) and the role of molecular epidemiology in guiding control strategies. Brit Med J 2003; 28: 1444-1448. [ Links ]
2. World Health Organization. Control de Chagas disease. Report of a WHO. Expert Committe World Health Organization, Geneva; 1991. p.1-95. [ Links ]
3. World Health Organization. Report of the Expert Committee on the control of Chagas´ disease, Technical Report Series 905, Geneva; 2002. p. 85. [ Links ]
4. Morel CM, Lazdins J. Chagas´ disease. Nature Rev Microbiol 2003; 1: 14-15. [ Links ]
5. Prata A. Clinical and epidemiological aspects of Chagas disease. Lancet Infect Dis 2001; 1 (2): 92-100. [ Links ]
6. Tanowitz HB, Kirchhoff LV, Simon D, Morris AS, Weiss LM, Wittner M. Chagas´ disease. Clin Microbiol Rev 1992; 5: 400-419. [ Links ]
7. Araujo RD, Bestetti RB, Godoy RA. Chronic Chagas’ heart disease in children and adolescents: a clinicopathologic study. In J Cardiol 1985; 9: 439-449. [ Links ]
8. Panamerican Organization. Status of Chagas’ disease in the region of the Americas. Panamerican Health Organization. Epidemiological bulletin. Washington, DC.; 1984. p. 5-9. [ Links ]
9. Elizari M, Chiale P. Cardiac arrhythmias in Chagas heart disease. J Cardiovasc Electrophysiol 1993; 4: 596-608. [ Links ]
10. Hagar J, Rahimtoola S. Chagas heart disease. Curr Probl Cardiol 1995: 12; 826-922. [ Links ]
11. Kirchhoff LV. American trypanosomiasis (Chagas´ disease). Gastroenterol Clin North Am 1996; 25: 517-533. [ Links ]
12. World Health Organization. Demographic year book 1983. New York; 1985. [ Links ]
13. Molina JA, Gualdron LE, Brochero HL, Olano VA, Barrios D, Guhl F. Distribución actual e importancia epidemiológica de las especies de triatomineos (Reduviidae: Triatominae) en Colombia. Biomédica 2000; 20: 344-360. [ Links ]
14. Moncayo A. Chagas´ disease: current epidemiological trends after the interruption of vectorial and transfusional transmission in the Southern Cone countries. Mem Inst Oswaldo Cruz 2003; 98 (5): 577-591. [ Links ]
15. Corredor A, Santacruz MM, Páez S, Guatame LA. Distribución de los triatomineos domiciliarios en Colombia. Ministerio de Salud, Instituto Nacional de Salud; Bogotá; 1990. p. 9-131. [ Links ]
16. Guhl F. Programas en la eliminación de la transmisión de la enfermedad de Chagas en los países suramericanos. Rev Col Cardiol 1997; 5: 345-348. [ Links ]
17. Rosas F, Rodríguez D, Jumbo L, Velasco V, Guhl F. The clinical spectrum of Chagas disease. Europace 2000; 1: D89. [ Links ]
18. Ucrós H, Rocha H, Duque M. Consideraciones clínicas, epidemiológicas, serológicas y parasitológicas sobre 141 casos de enfermedad de Chagas. Antioquía Médica 1971; 21: 629-673. [ Links ]
19. Rosas F, Guhl F, Velasco V, Jumbo J, Jaramillo C, Rodriguez D, et al. Morbilidad de la enfermedad de Chagas en fase crónica en Colombia. Detección de pacientes chagásicos con cardiopatía en un área endémica del departamento de Boyacá. Rev Col Cardiol 2002; 9: 349-359. [ Links ]
20. Maguire JH, Hoff R, Sherlock I, Guimaraes AC, Sleigh AC, Ramos NB, et al. Cardiac morbidity and mortality due to Chagas’ disease: prospective electrocardiographic study of a Brazilian community. Circulation 1987; 75: 1140-1145. [ Links ]
21. Carrasco HA, Parada H, Guerrero L, Duque M, Duran D, Molina C. Prognostic implications of clinical, electrocardiographic and hemodynamic findings in chronic Chagas’ disease. Int J Cardiol 1994; 43 (1): 27-38. [ Links ]














