Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.14 no.1 Bogota Jan./Feb. 2007
(1) Laboratorio de Fisiología Autonómica. Instituto de Investigaciones, Fundación
Cardiovascular de Colombia. Floridablanca, Santander, Colombia.
(2) Unidad de Síncope. Laboratorio de Función Autonómica, Servicio de Arritmias,
División de Cardiología, Departamento de Medicina, Universidad de McMaster.
Hamilton, Ontario, Canadá.
(3) Departamento de Ginecología y Obstetricia, Universidad Industrial de Santander,
Bucaramanga, Santander, Colombia.
Correspondencia: Patricio López-Jaramillo, MD., PhD. Calle. 155A No. 23–58, 3er piso. Floridablanca, Santander, Colombia. Teléfono: +57-7-6399292 Ext. 340, 343. Fax: +57-7-6392744. Correo electrónico: jplopezj@fcv.org
Recibido: 05/05/2006. Aprobado: 17/01/2007.
Antecedentes: el déficit de estrógenos propio de la etapa postmenopáusica, puede contribuir al desarrollo de un disbalance autonómico con la reducción del reflejo cardiovagal, lo que a su vez puede incrementar el riesgo cardiovascular. Aún no se han aclarado en su totalidad los mecanismos fisiopatológicos subyacentes de esta alteración. En este artículo se discute el efecto de la terapia hormonal de reemplazo sobre la función autonómica en mujeres sometidas a histerectomía.
Métodos: en este ensayo clínico cruzado, placebo-controlado, doble ciego, se incluyeron mujeres con histerectomía y amenorrea al menos un año antes de la cirugía. De forma aleatoria, recibieron estrógenos conjugados 0,625 mg/dL o placebo durante doce semanas, con un período intermedio sin medicación de dos semanas. Se evaluó la función autonómica cardiovagal y vascular mediante técnicas convencionales y a tráves de pletismografía por oclusión venosa para calcular el flujo sanguíneo en el antebrazo y la resistencia vascular periférica en condiciones basales, durante la prueba de mesa basculante y en la prueba de presión negativa en miembros inferiores.
Resultados: no se encontraron diferencias en la función autonómica cardiovagal entre los grupos de tratamiento en condiciones de reposo ni durante la prueba de mesa basculante y presión negativa en miembros inferiores. Se documentaron diferencias significativas tanto en el flujo sanguíneo en el antebrazo [1,9(0,5) vs. 1,5(0,5), p=0,02] así como en la resistencia vascular periférica [53,5(18,2) vs. 68,6(34), p=0,02], al comparar terapia de reemplazo hormonal con placebo.
Conclusiones: la terapia de reemplazo hormonal a corto plazo, no mejoró las respuestas reflejas autonómicas cardiovasculares en mujeres postmenopáusicas, pero sí incrementó la relajación vascular por reducción de la resistencia vascular periférica. La terapia de reemplazo hormonal puede utilizarse bajo supervisión adecuada para mejorar los síntomas de la menopausia durante un tiempo corto, principalmente en mujeres postmenopáusicas jóvenes no hipertensas.
Palabras clave: menopausia, sistema nervioso autónomo, terapia de reemplazo hormonal, pletismografía.
Background: estrogen deficit during menopause may be related to cardiac autonomic function imbalance, reducing the cardiovagal reflex response that could potentially increase cardiovascular risk. The physiological mechanisms that lead to this alteration in postmenopausal women remain unclear. In this article, the effect of hormonal replacement therapy on autonomic function in women submitted to hysterectomy is discussed.
Methods: Fifty women with a previous hysterectomy and amenorrhea for 1 year prior to surgery were enrolled in a prospective randomized crossover double-blind placebo controlled trial. Either oral estrogen replacement therapy (ERT) conjugated estrogens 0.625 mg once a day or placebo, were randomly administered in a crossover design during 12 weeks with a 2 week washout period. Cardiovagal autonomic function was assessed by conventional techniques and through venous occlusion plethysmography in order to evaluate vascular autonomic function calculating forearm blood flow (FBF) and peripheral vascular resistance (PVR) at baseline, and during head-up tilt (HUT) and a non-hypotensive stimuli (-10mmHg) lower-body negative pressure (LBNP).
Results: No differences were found in cardiovagal autonomic function comparing ERT vs. placebo at baseline resting conditions, nor during HUT and LBNP. A significant difference was identified in supine FBF [1.9(0.5) vs. 1.5(0.5), p=0.02] as well as in PVR [53.5(18.2) vs. 68.6(34), p=0.02] comparing ERT vs. placebo interventions.
Conclusions: Short term ERT did not improve cardiovascular autonomic reflex responses in postmenopausal women, but increased vascular relaxation primarily by reducing peripheral vascular resistance. Hormone replacement therapy can be used under adequate supervision in order to improve menopausal symptoms during a short period of time, mainly in young non-hypertensive post-menopausal women.
Key words: menopause, autonomic nervous system, estrogen replacement therapy, plethysmography.
Introducción
La reducción paulatina de los niveles de estrógenos durante la menopausia, conduce a múltiples cambios sistémicos que pueden lesionar potencialmente a la mujer postmenopáusica (1, 2). Los estrógenos, tradicionalmente reconocidos como cardioprotectores (3), han sido objeto de debate ante hallazgos de un aumento en la mortalidad de causa cardiovascular en mujeres con terapia de reemplazo hormonal (estrógenos y progestágenos) (4, 5). Sin embargo, la utilización de terapia de reemplazo estrogénica en mujeres con antecedente de histerectomía, no demostró aumento del riesgo cardiovascular (6).
En un estudio con 10.739 mujeres sometidas a histerectomía, se sugirió un menor riesgo de enfermedad coronaria en aquellas mujeres entre los 50 y 59 años de edad, con terapia de reemplazo estrogénica (7). Se han propuesto varios mecanismos en la potencial reducción de eventos cardiovasculares en mujeres postmenopáusicas, incluyendo la regulación del metabolismo lipídico (8), el aumento en la producción de óxido nítrico (9-11) y la inhibición de la proliferación en placas de ateromas (12). Los estrógenos restauran los reflejos cardiovasculares simpatovagales y aumentan la sensibilidad/densidad de receptores autonómicos o la disponibilidad de neurotransmisores en modelos animales (13-15). Sin embargo, los efectos de la terapia de reemplazo estrogénica sobre el sistema autonómico cardiovascular y la función refleja vascular, no se han evaluado de forma sistemática en mujeres postmenopáusicas con histerectomía.
Métodos
En el estudio se incluyeron 50 mujeres evaluadas en dos clínicas de menopausia afiliadas a la Fundación Cardiovascular de Colombia. Un ginecólogo del estudio evaluó a las participantes en una visita inicial que incluyó historia clínica y examen físico. Los criterios de inclusión y exclusión se presentan en la tabla 1. Las medidas antropométricas se obtuvieron usando recomendaciones internacionales (16). Se determinaron niveles de glucemia (Biosystems BTS-303 Photmetric, España), hormona folículo-estimulante (FHS; Immulite, Randolph, New Jersey, USA) y perfil lipídico (Biosystems BTS-303 Photometric, España). Antes de la intervención se obtuvo electrocardiograma de 12 derivaciones y mamografía de tamizaje. Todas la participantes firmaron el consentimiento informado tanto verbal como escrito. El comité de ética de la Fundación Cardiovascular revisó y aprobó el protocolo.

Intervención
Las participantes fueron aleatorizadas en estudio doble-ciego, cruzado, a recibir terapia de reemplazo estrogénica (estrógenos conjugados 0,625 mg/día, Climatrol®, Gynopharm SA, Barranquilla, Colombia) o placebo. La terapia de reemplazo estrogénica o el placebo, se administraron por 12 semanas, seguidos por dos semanas de lavado para cruzarse al otro brazo del estudio durante otras 12 semanas. Los eventos adversos se reportaron al comité de ética institucional.
El desenlace primario fue el cambio en la función autonómica refleja cardiovagal y vascular tras la intervención con terapia de reemplazo estrogénica o placebo.
Mediciones
Las participantes fueron evaluadas en el Laboratorio de Fisiología Autonómica de la Fundación Cardiovascular de Colombia en dos etapas. Las pruebas de función autonómica se realizaron en un cuarto a temperatura controlada (20ºC), en condiciones de ayuno de ocho horas, sin consumo de bebidas con xantinas el día previo a la evaluación.
Se canalizó una vena periférica para la infusión de solución salina normal a 20 mL/hora y la infusión de medicación del protocolo. Se obtuvo registro electrocardiográfico continuo en DII y se realizó monitorización continua no invasiva de la presión arterial latido a latido (Colin Pilot 9200, Colin Medicals, USA). Para el almacenamiento de estos datos se utilizó un microcomputador compatible con IBM-PC con un sistema de adquisición de señales DATAQ 720-WINDAQ PRO+ (DataQ Instruments, USA) y, para su análisis, un sistema winCPRS (Absolutely Aliens, Finland).
Variables hemodinámicas latido a latido
Se obtuvieron mediciones de la frecuencia cardiaca (latidos/minuto, lpm), presión arterial sistólica (mm Hg, PAS), diastólica (mm Hg, PAD) y media (mm Hg, PAM), volumen latido (mL/min, VL) y gasto cardiaco (GC) en reposo en posición supina (5 minutos), así como durante un estímulo no hipotensor de presión negativa de –10 mm Hg aplicada en miembros inferiores (presión negativa en miembros inferiores, 5 minutos) y realizando una inclinación de 60 grados (prueba de mesa basculante, 5 minutos). La variabilidad de la frecuencia cardiaca y de la presión arterial fue analizada en reposo en posición supina, durante un estímulo no hipotensor de presión negativa en miembros inferiores y en prueba de mesa basculante. Se calcularon los índices de variabilidad de la frecuencia cardiaca en dominio de tiempo (RMSSD) y en dominio de frecuencia: banda de baja frecuencia [LF (0,04-0,15 Hz)], banda de alta frecuencia [HF(0,15-0,4 Hz)] y balance simpato-vagal (LF/HF) (44). Igualmente, se analizó la variabilidad de la presión arterial sistólica utilizando técnicas de poder espectral. Se calcularon índices de dominio de frecuencia del espectro de poder total (SAP-TPS) y bajo normalizado (SAP-LF) utilizando algoritmos previamente publicados (17).
Se realizó la prueba de respiración profunda para valorar la respuesta cardiovascular refleja a la respiración controlada. Se registró la frecuencia cardiaca latido a latido durante un período de un minuto con una frecuencia estandarizada de seis respiraciones por minuto. Se calculó y se promedió la diferencia entre la frecuencia cardiaca máxima y mínima para cada uno de los seis ciclos para obtener la diferencia inspiratoria-espiratoria de respiración profunda (DRP) en latidos/minuto (valor normal >15 lpm) (18).
La sensibilidad barorrefleja arterial se obtuvo por medio de la técnica modificada de Oxford (19). Los cambios en el intervalo RR y PAS se correlacionaron en respuesta a un bolo endovenoso de fenilefrina (150 µg) seguido por un bolo endovenoso de nitroprusiato de sodio (100 µg) un minuto después de la primera intervención. Se utilizó el análisis de regresión lineal para calcular la pendiente para un cambio dado en el intervalo RR después del cambio previo en la PAS. Para el análisis sólo se aceptaron correlaciones mayores a 0,8.
Pletismografía del antebrazo
Se utilizó un dispositivo de medición de pletismografía con sensores de mercurio para establecer el flujo sanguíneo del antebrazo en reposo, en posición supina, con estímulo no hipotensor de presión negativa en miembros inferiores y en prueba de mesa basculante. En el antebrazo derecho se situó un instrumento de presión de silastic, 5 cm distal al pliegue antecubital y se conectó a un dispositivo de pletismografía (EC6, Hokanson Inc, USA). El brazo se sostuvo sobre el nivel de la aurícula derecha y se instaló un manguito para la región superior del brazo y para la muñeca. El manguito de la muñeca se insufló hasta 200 mm Hg para excluir la circulación de la mano de la medición un minuto antes y durante la medición del flujo sanguíneo en el antebrazo. El manguito de la región superior del brazo, se insufló a 40 mm Hg durante siete segundos en cada ciclo de 15 segundos para ocluir el flujo venoso proveniente del brazo utilizando un insuflador rápido (EC-20, Hokanson Inc, USA). El flujo sanguíneo en el antebrazo (mL/100 mL antebrazo/min) en reposo en posición supina y posterior a cada estímulo, se calculó por medio de la media de todas las curvas registradas durante un periodo de tiempo de cinco minutos (20). La resistencia vascular periférica también se calculó dividiendo la presión arterial media y el flujo sanguíneo en el antebrazo.
Actividad simpática vascular
Las respuestas vasculares simpáticas se registraron aplicando presión negativa no hipotensora en miembros inferiores (5 minutos) para estimular los receptores cardiovasculares (21), produciendo un aumento en la actividad simpática en los nervios de los miembros superiores, lo cual lleva a una reducción del 20% en el flujo sanguíneo en el antebrazo, asociado con aumento relativo en la resistencia vascular periférica sin ningún cambio concomitante en la presión arterial o en la frecuencia cardiaca (20).
Doble ciego y aleatorización
Tanto el personal del estudio como los participantes, fueron ciegos a la asignación del tratamiento durante el período de tiempo del estudio. Todos los participantes fueron aleatorizados utilizando una tabla de números aleatorios. El comité de ética de la Fundación Cardiovascular de Colombia almacenó los códigos en sobres cerrados hasta la finalización del estudio.
Análisis estadístico
Con el fin de comparar la función refleja vascular y cardiovagal después de la terapia cruzada con terapia de reemplazo estrogénica o placebo, se realizó un análisis por intención de tratamiento. Las variables continuas se informaron como promedios con desviación estándar (SD). Se realizó el test de Anderson-Darling para determinar la normalidad de la distribución de los datos. Se empleó el test de t de Student para comparar las muestras con distribución normal y el test Kruskal-Wallis para variables con distribución no normal. Se asumió el teorema del límite central por ser un estudio con una muestra mayor a 30 participantes.
La prueba de chi-cuadrado y el test exacto de Fisher se realizaron para analizar las variables categóricas así como las proporciones en los casos apropiados. Se definió un nivel de significancia alfa de dos colas de 0,05. El tamaño de la muestra para el estudio se calculó con base en los cambios en la variabilidad de la frecuencia cardiaca después de tres meses de terapia de reemplazo estrogénica. Con un tamaño de muestra calculado de 42 pacientes (21 por cada grupo), el estudio tiene un poder del 95% para detectar diferencias de grupo en la variabilidad de la frecuencia cardiaca de 1,7 (Intervalo RR HF) con una desviación estándar de 2,8. Para el análisis de datos se utilizó MINITAB versión 14.20 (Minitab Inc, US).
Resultados
Entre septiembre de 2003 a diciembre de 2004, se tamizaron 104 mujeres. Se excluyeron 49 y 5 no firmaron el consentimiento informado para participar en el estudio (Figura 1). Las participantes del estudio fueron seguidas al momento de la aleatorización, y por cuatro semanas se evaluó la adherencia al tratamiento y los potenciales efectos adversos durante ambas secuencias. Así mismo, asistieron al laboratorio de fisiología autonómica al final de ambas intervenciones a la evaluación del sistema nervioso autónomo cardiovascular.
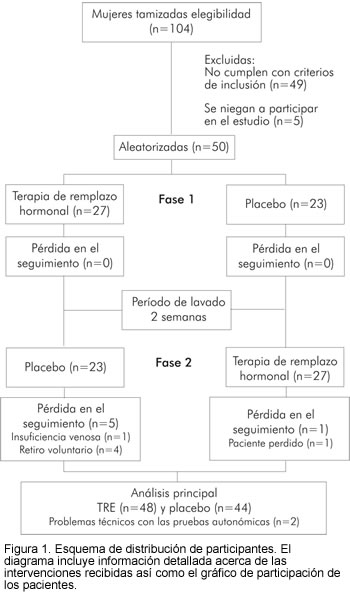
Se aleatorizaron y destinaron 50 mujeres para las secuencias de terapia de reemplazo estrogénica-placebo (n=27) o placebo-terapia de reemplazo estrogénica (n=23), y se cruzaron para alternar el tratamiento después de un periodo de lavado de dos semanas. Tras un seguimiento de 26 semanas, 44 participantes completaron el estudio y 6 pacientes se retiraron durante la segunda fase del tratamiento por diferentes razones (Figura 1). Una paciente fue retirada tras presentar un evento adverso de insuficiencia venosa leve documentada por eco Doppler, que se asoció con manifestaciones cutáneas. La paciente no presentó complicaciones tras seis meses de seguimiento. Se perdió una mujer en el seguimiento y no completó la evaluación autonómica de la segunda fase. Cuatro participantes retiraron el consentimiento por eventos adversos leves (estreñimiento y dolor mamario). En dos pacientes no se realizó el análisis computarizado de las señales biológicas debido a dificultades técnicas. El cuadro de seguimiento de las pacientes se resume en la figura 1.
La adherencia en los grupos terapia de reemplazo estrogénica y placebo fue alta (98,8% vs. 98,9% respectivamente p>0,05). En la tabla 2 se presentan las características demográficas. No se encontraron diferencias significativas en las variables demográficas ni en los marcadores bioquímicos al comparar las dos secuencias de tratamiento (terapia de reemplazo estrogénica–placebo vs. placebo–terapia de reemplazo estrogénica).
Variables hemodinámicas en reposo latido a latido y función autonómica cardiovascular tras las intervenciones
No se encontraron diferencias significativas en variables hemodinámicas latido a latido entre los grupos intervenidos. Sin embargo, los valores de presión arterial sistólica, diastólica y media tendieron a ser más bajos durante el período de tratamiento activo (Tabla 3).
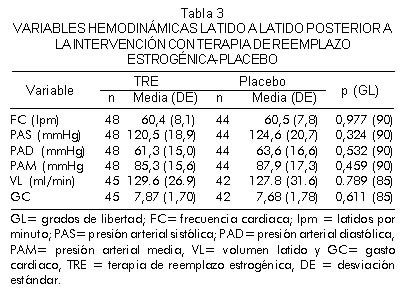
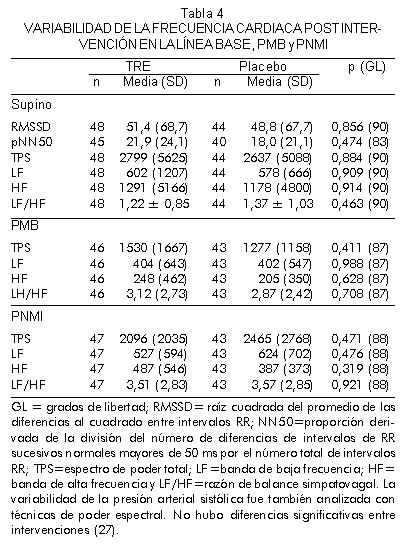
No se documentaron diferencias en los índices de variabilidad de la frecuencia cardiaca (Tabla 4) y en la variabilidad de la presión arterial sistólica (datos no mostrados) durante la evaluación supina, la prueba de mesa basculante ni con el estímulo no hipotensor de presión negativa en miembros inferiores entre los grupos activo y placebo. El delta de la prueba de mesa basculante (prueba de mesa basculante menos supino) así como también el delta de la presión negativa en miembros inferiores (presión negativa en miembros inferiores menos basal) fue similar en el grupo de terapia de reemplazo estrogénica y en el placebo. Además, los índices de reflejo cardiovagal postintervención (sensibilidad barorrefleja arterial y DRP) fueron similares al comparar los grupos (Tabla 5).
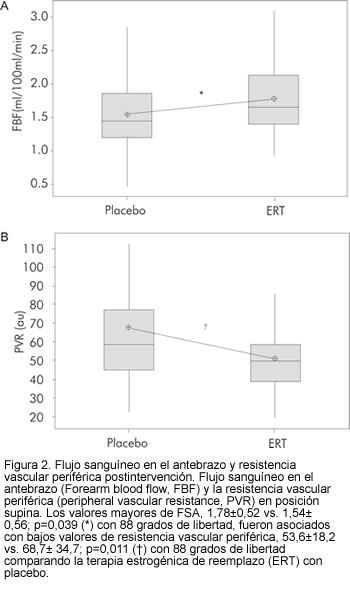
Función refleja autonómica vascular
Se encontraron diferencias significativas en los valores de flujo sanguíneo en el antebrazo y en la resistencia vascular periférica al comparar los grupos de terapia de reemplazo estrogénica (n=47) y placebo (n=43). Los mayores valores de flujo sanguíneo en el antebrazo (1,78 ± 0,52 vs. 1,54 ± 0,56, p=0,039 con 88 grados de libertad) se asociaron con menores valores de resistencia vascular periférica (53,6 ± 18,2 vs. 68,7 ± 34,7, p= 0,011 con 88 grados de libertad) (Figura 2).
Las cuantificaciones de pletismografía durante la prueba de mesa basculante y la presión negativa en miembros inferiores no fueron significativamente diferentes entre los grupos intervenidos.
Discusión
El déficit de estrógenos propio de la menopausia puede contribuir al desarrollo de un disbalance autonómico, con reducción de los reflejos cardiovagales lo cual puede incrementar el riesgo cardiovascular.
En este estudio se observó un aumento en la relajación vascular en las mujeres con histerectomía y terapia de reemplazo estrogénica, que se podría interpretar como una mejoría a corto plazo en la respuesta vascular. Sin embargo, no se encontraron diferencias en la función de los reflejos autonómicos cardiacos.
El impacto de la terapia de reemplazo estrogénica sobre las alteraciones autonómicas inducidas por la hipoestrogenemia de la etapa postmenopáusica, ha sido discutido por varios autores en múltiples publicaciones (17, 22-31). El efecto de la terapia se ha evaluado mediante diversos estudios, los cuales han reportado resultados no concluyentes. Estas diferencias son consecuencia de factores como el empleo de las técnicas para la valoración de la respuesta autonómica, la comparación de grupos no pareados y el uso de diferentes vías de administración del medicamento (17, 24-28, 31).
En un estudio poblacional reportado por Carnethon y colaboradores, en el cual se incluyeron 2.621 participantes, con ajustes por edad y factores de riesgo cardiovasculares, no se encontraron diferencias en la variabilidad de la frecuencia cardiaca asociadas a la implementación de la terapia de reemplazo hormonal (23).
Hasta el momento sólo se han registrado cinco experimentos clínicos aleatorizados, doble ciego, en los que se valoró el efecto de la terapia de reemplazo estrogénica o la terapia hormonal combinada, sobre la respuesta de los reflejos autonómicos cardiacos mediante la determinación de los índices de dominio de tiempo y de frecuencia de la variabilidad de la frecuencia cardiaca (17, 24, 26-28). En tres de éstos (24, 26, 27) se registró la respuesta autonómica cardiaca al principio del estudio y nuevamente después de periodos variables de tratamiento (desde tres semanas hasta tres meses). Dos de los estudios (24, 26) encontraron diferencias estadísticamente significativas a favor de la terapia al valorar la variabilidad de la frecuencia cardiaca. La principal diferencia entre esos dos estudios y el tercero, en el cual no se hallaron diferencias entre el grupo de terapia y el grupo control (27), es la forma en la que se evaluó la función autonómica. En los dos estudios que reportaron diferencias significativas, se determinó la variabilidad del intervalo RR en registros de 10 minutos, mientras que en el que no hubo diferencias significativas, se utilizó un registro de 24 horas realizado por medio de Holter. En nuestro estudio tampoco se encontraron diferencias significativas en los índices de dominio de tiempo y frecuencia de la variabilidad de la frecuencia cardiaca, a pesar de analizarse en un registro cardíaco por corto tiempo.
Otros estudios han analizado la liberación (spill-over) de noradrenalina y el tráfico simpático a nivel muscular como marcadores de la respuesta autonómica cardiaca (32-35). La administración transdérmica de terapia de reemplazo estrogénica a corto plazo, se asoció con reducción del tráfico simpático a nivel muscular, la cual a su vez no se asoció con cambios en la ganancia barorrefleja (34, 35). Sin embargo, esta forma de tratamiento no demostró disminución en la liberación de norepinefrina como parte del reflejo autonómico (33).
Los hallazgos son compatibles con los resultados de nuestro estudio, en el que la ganancia barorrefleja no mostró cambios. En nuestro estudio no se llevó a cabo la medición directa de marcadores de actividad simpática, pero en cambio, se valoró la resistencia vascular periférica, la cual es modulada principalmente por el tono simpático. La administración de la terapia de reemplazo estrogénica durante un estímulo no hipotensor con presión negativa en miembros inferiores, se asoció con disminución significativa de la resistencia vascular periférica y aumento en el flujo sanguíneo en el antebrazo.
En las mujeres postmenopáusicas se ha documentado una alteración en la reactividad vascular que conduce a la pérdida de la respuesta vasodilatadora. Esta alteración parece estar implicada en el desarrollo de enfermedad cardiovascular en estas mujeres (12). La administración de terapia de reemplazo estrogénica ha sido asociada con mejoría en la reactividad vascular con la consiguiente vasodilatación periférica y aumento en el flujo sanguíneo en el antebrazo, tanto en mujeres con factores de riesgo para enfermedad cardiovascular (36), como en aquellas sin estos factores (37). Este efecto puede ser consecuencia de un aumento en la producción de óxido nítrico (NO), que conlleva a una mejor función endotelial (11). En estudios recientes se observó un aumento en los metabolitos del NO (9) y mejoría en la actividad del sistema nervioso central (38). Por lo tanto, los estrógenos pueden incrementar la producción de óxido nítrico-sintasa endotelial y reducir la degradación de NO, disminuyendo de esta forma la formación de superóxido (39). El aumento en la liberación de NO por parte de la célula endotelial, puede deberse a un aumento en el calcio intracelular mediado por estrógenos (10, 40). En un estudio previo, reportamos un aumento en los niveles plasmáticos de NO y una mejoría en la vasodilatación dependiente del endotelio, asociados a la terapia de reemplazo estrogénica en postmenopáusicas jóvenes, lo cual sugiere que los efectos de la terapia de reemplazo estrogénica pueden explicarse en gran parte por su acción sobre la función endotelial (9).
Recientemente se publicaron seis experimentos clínicos aleatorizados, doble ciego, en los cuales se evaluó la función endotelial por medio de la vasodilatación mediada por flujo en mujeres postmenopáusicas a quienes se les asignó terapia de reemplazo estrogénica o terapia de reemplazo hormonal combinada. En todos se documentó mejoría en la función endotelial (5, 41-45). Estos resultados respaldan los hallazgos de nuestro estudio. En conclusión, la terapia de reemplazo estrogénica de corta duración no demostró mejoría en las respuestas reflejas cardiovasculares autonómicas en mujeres postmenopáusicas. La terapia de reemplazo estrogénica se asoció con reducción de la resistencia vascular periférica y aumento en la relajación vascular. La prescripción de terapia de reemplazo estrogénica de corta duración, se debe hacer en forma individualizada y con precaución, especialmente en las mujeres postmenopáusicas no hipertensas.
Agradecimientos
Este manuscrito se realizó con el apoyo financiero del Instituto para el Desarrollo de la Ciencia y la Tecnología de Colombia, COLCIENCIAS (Código 6566-04-11788).
Bibliografía
1. Greendale GA, Lee NP, Arriola ER. The menopause. Lancet 1999; 353: 571-580. [ Links ]
2. Sullivan JM, Fowlkes LP. The clinical aspects of estrogen and the cardiovascular system. Obstet Gynecol 1996; 87: 36S-43S. [ Links ]
3. Hishikawa K, Nakaki T, Marumo T, Susuki H, Kato R, Saruta T. Up-regulation of nitric oxide synthase by estradiol in human aortic endotelial cells. FEBS 1995; 360: 291-293. [ Links ]
4. Hulley S, Grady D, Bush T, Furberg C, Herrington D, Riggs B, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS) Research Group. JAMA 1998; 280: 605-613. [ Links ]
5. Saitta A, Altavilla D, Cucinotta D, Morabito N, Frisina N, Corrado F, et al. Randomized, double-blind, placebo-controlled study on effects of raloxifene and hormone replacement therapy on plasma no concentrations, endothelin-1 levels, and endothelium-dependent vasodilation in postmenopausal women. Arterioscler Thromb Vasc Biol 2001; 21: 1512-9. [ Links ]
6. Anderson GL, Limacher M, Assaf AR, Bassford T, Beresford SA, Black H, et al. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women’s Health Initiative randomized controlled trial. JAMA 2004; 291: 1701-1712. [ Links ]
7. Hsia J, Langer RD, Manson JE, Kuller L, Johnson KC, Hendrix SL, et al. Conjugated Equine Estrogens and Coronary Heart Disease: The Women’s Health Initiative. Arch Intern Med 2006; 166: 357-65. [ Links ]
8. Walsh BW, Schiff I, Rosner B, Greenberg L, Ravnikar V, Sacks FM. Effects of postmenopausal estrogen replacement on the concentrations and metabolism of plasma lipoproteins. N Engl J Med 1991; 325: 1196-1204. [ Links ]
9. López-Jaramillo P, Díaz LA, Pardo A, Parra G, Jaimes H, Chaudhuri G. Estrogen therapy increases plasma concentrations of nitric oxide metabolites in postmenopausal women but increases flow-mediated vasodilatation only in younger women. Fertil Steril 2004; 82: 1550-1555. [ Links ]
10. López-Jaramillo P, Gonzales MC, Palmer RsMJ, Moncada S. The crucial role of physiological calcium concentration in the production of endothelial nitric oxide and the control of vascular tone. Br J Pharmacol 1990; 101: 489-493. [ Links ]
11. López-Jaramillo P, Terán E. Improvement in functions of the central nervous system by estrogen replacement therapy might be related with an increased nitric oxide production. Endothelium 1999; 6: 263-266. [ Links ]
12. Oparil S. Hormones and vasoprotection. Hypertension 1999; 33: 170-176. [ Links ]
13. el-Mas MM, Abdel-Rahman AA. Estrogen enhances baroreflex control of heart rate in conscious ovariectomized rats. Can J Physiol Pharmacol 1998; 76: 381-386. [ Links ]
14. He XR, Wang W, Crofton JT, Share L. Effects of 17beta-estradiol on the baroreflex control of sympathetic activity in conscious ovariectomized rats. Am J Physiol 1999; 277: R493-R498. [ Links ]
15. O’Malley CA, Hautamaki RD, Kelley M, Meyer EM. Effects of ovariectomy and estradiol benzoate on high affinity choline uptake, ACh synthesis, and release from rat cerebral cortical synaptosomes. Brain Res 1987; 403: 389-392. [ Links ]
16. Standarizaton of anthropometric measurements. In: Lohman T, Roche A, Martorel R, eds. The Airle (VA) consensus Conference. Champaign, I11: Human Kinetics; 1988. p. 39-80. [ Links ]
17. Parati G, Bilo G, Vettorello M, Groppelli A, Maronati A, Tortorici E, et al. Assessment of overall blood pressure variability and its different components. Blood Press Monit 2003; 8: 155-9. [ Links ]
18. Faulkner MS, Hathaway D, Tolley B. Cardiovascular autonomic function in healthy adolescents. Heart Lung 2003; 32: 10-22. [ Links ]
19. Rudas L, Crossman AA, Morillo CA, Halliwill JR, Tahvanainen KU, Kuusela TA, et al. Human sympathetic and vagal baroreflex responses to sequential nitroprusside and phenylephrine. Am J Physiol 1999; 276: H1691-8. [ Links ]
20. Whitney RJ. The measurement of volume changes in human limbs. J Physiol 1953; 121: 1-27. [ Links ]
21. Wilkinson IB, Webb DJ. Venous occlusion plethysmography in cardiovascular research: methodology and clinical applications. Br J Clin Pharmacol 2001; 52: 631-646. [ Links ]
22. Brockbank CL, Chatterjee F, Bruce SA, Woledge RC. Heart rate and its variability change after the menopause. Exp Physiol 2000; 85: 327-330. [ Links ]
23. Carnethon MR, Anthony MS, Cascio WE, Folsom AR, Rautaharju PM, Liao D, et al. Prospective association between hormone replacement therapy, heart rate, and heart rate variability. The Atherosclerosis risk in communities study. J Clin Epidemiol 2003; 56: 565-571. [ Links ]
24. Chao HT, Kuo CD, Su YJ, Chuang SS, Fang YJ, Ho LT. Short-term effect of transdermal estrogen on autonomic nervous modulation in postmenopausal women. Fertil Steril 2005; 84: 1477-83. [ Links ]
25. Christ M, Seyffart K, Wehling M. Attenuation of heart-rate variability in postmenopausal women on progestin-containing hormone replacement therapy. Lancet 1999; 353: 1939-1940. [ Links ]
26. Farag NH, Nelesen RA, Parry BL, Loredo JS, Dimsdale JE, Mills PJ. Autonomic and cardiovascular function in postmenopausal women: the effects of estrogen versus combination therapy. Am J Obstet Gynecol 2002; 186: 954-61. [ Links ]
27. Fernandes EO, Moraes RS, Ferlin EL, Wender MC, Ribeiro JP. Hormone replacement therapy does not affect the 24-hour heart rate variability in postmenopausal women: results of a randomized, placebo-controlled trial with two regimens. Pacing Clin Electrophysiol 2005; 28: S172-7. [ Links ]
28. Kaya D, Cevrioglu S, Onrat E, Fenkci IV, Yilmazer M. Single dose nasal 17betaestradiol administration reduces sympathovagal balance to the heart in postmenopausal women. J Obstet Gynaecol Res 2003; 29: 406-11. [ Links ]
29. Mercuro G, Podda A, Pitzalis L, Zoncu S, Mascia M, Melis GB, et al. Evidence of a role of endogenous estrogen in the modulation of autonomic nervous system. Am J Cardiol 2000; 85: 787-789. [ Links ]
30. Ribeiro TF, Azevedo GD, Crescencio JC, Maraes VR, Papa V, Catai AM, et al. Heart rate variability under resting conditions in postmenopausal and young women. Braz J Med Biol Res 2001; 34: 871-877. [ Links ]
31. Weissman A, Lowenstein L, Porat M, Geva A, Rosenstein Y. The effect of hormone replacement therapy cessation on heart rate variability in postmenopausal women. Clin Auton Res 2005; 15: 411-3. [ Links ]
32. Hunt BE, Taylor JA, Hamner JW, Gagnon M, Lipsitz LA. Estrogen replacement therapy improves baroreflex regulation of vascular sympathetic outflow in postmenopausal women. Circulation 2001; 103: 2909-2914. [ Links ]
33. Sofowora GG, Singh I, He HB, Wood AJ, Stein CM. Effect of acute transdermal estrogen administration on basal, mental stress and cold pressor-induced sympathetic responses in postmenopausal women. Clin Auton Res 2005; 15: 193-199. [ Links ]
34. Vongpatanasin W, Tuncel M, Mansour Y, Arbique D, Victor RG. Transdermal estrogen replacement therapy decreases sympathetic activity in postmenopausalwomen. Circulation 2001; 103: 2903-8. [ Links ]
35. Weitz G, Elam M, Born J, Fehm HL, Dodt C. Postmenopausal estrogen administration suppresses muscle sympathetic nerve activity. J Clin Endocrinol Metab 2001; 86: 344-8 [ Links ]
36. Ching HL, Watts GF, Dhaliwal SS, Barrett PH, Stuckey BG. Vascular function of forearm microcirculation in postmenopausal women with type 2 diabetes: potential benefit of hormone replacement therapy? Climateric 2003; 6: 31-7. [ Links ]
37. Sanada M, Higashi Y, Nakagawa K, Tsuda M, Kodama I, Kimura M, et al. A comparison of low-dose and standard-dose oral estrogen on forearm endothelial function in early postmenopausal women. J Clin Endocrinol Metab 2003; 88: 1303-1309. [ Links ]
38. López-Jaramillo P, Terán E, Molina G, Rivera J, Lozano A. Oestrogens and depression. Lancet. 1996; 348: 135-6. [ Links ]
39. Hishikawa K, Nakaki T, Marumo T, Susuki H, Kato R, Saruta T. Up-regulation of nitric oxide synthase by estradiol in human aortic endotelial cells. FEBS 1995; 360: 291-293. [ Links ]
40. Stefano GB, Prevot V, Beavillain J-C, Cadet P, Fimiani C, Welters I, et al Cellsurface estrogen receptors mediate calcium-dependent nitric oxide release in human endothelial cells. Circulation 2002; 101: 1594-1597. [ Links ]
41. Cerquetani E, Vitale C, Mercuro G, Fini M, Zoncu S, Rosano GM. Comparative vascular effects of hormone replacement therapy and raloxifene in women at increased cardiovascular risk. Gynecol Endocrinol 2004; 18: 291-298. [ Links ]
42. de Kleijn MJ, Wilmink HW, Bots ML, Bak AA, van der Schouw YT, Planellas J, et al. Hormone replacement therapy and endothelial function. Results of a randomized controlled trial in healthy postmenopausal women. Atherosclerosis 2001; 159: 357-365. [ Links ]
43. Gerhard M, Walsh BW, Tawakol A, Haley EA, Creager SJ, Seely EW, et al. Estradiol therapy combined with progesterone and endothelium-dependent vasodilation in postmenopausal women. Circulation 1998; 98: 1158-1163. [ Links ]
44. Girdler SS, Hinderliter AL, Wells EC, Sherwood A, Grewen KM, Light KC. Transdermal versus oral estrogen therapy in postmenopausal smokers: hemodynamic and endothelial effects. Obstet Gynecol 2004; 103: 169-80. [ Links ]
45. Guzic-Salobir B, Keber I, Seljeflot I, Arnesen H, Vrabic L. Combined hormone replacement therapy improves endothelial function in healthy postmenopausal women. J Intern Med 2001; 250: 508-15. [ Links ]














