Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.14 no.3 Bogota May/July 2007
(1) Unidad de Arritmias - Instituto Cardiovascular. Hospital Clínico, Barcelona, España.
(2) Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, DC., Colombia.
Correspondencia: Guillermo Mora Pabón, MD. Facultad de Medicina, Universidad Nacional de Colombia, Ciudad Universitaria, Calle 45 Carrera 30, Teléfono: 3165000 Ext.: 15011. Bogotá, DC. Colombia. Correo electrónico: gmorap@unal.edu.co
Recibido: 10/08/06. Aprobado: 05/03/07.
Introducción y objetivos: la miocardiopatía hipertrófica es una enfermedad de origen genético con prevalencia de 1% al 2%. La mitad de los pacientes fallecen por muerte súbita cardiaca, la mayoría por arritmias ventriculares. Todavía no está claro a qué pacientes se les debe implantar un desfibrilador automático. El objetivo de este trabajo es describir una serie de pacientes con implante, los criterios empleados y los resultados obtenidos, así como analizar los predictores de terapia apropiada por el desfibrilador.
Métodos: se incluyeron 20 pacientes que recibieron un desfibrilador de tercera generación. En todos se realizó estudio electrofisiológico y seguimiento prospectivo con registro de eventos. En 18 (90%) se hizo estudio genético.
Resultados: el 55% eran hombres con edad promedio de 40 [11-78] años. Seis (30%) recibieron implantante por prevención secundaria y 14 (70%) por prevención primaria; los últimos por presentar varios factores de riesgo. Se indujo una arritmia sostenida en 15 (75%) y en 3 (15%) taquicardia ventricular monomórfica sostenida. A 22 meses de seguimiento 4 (20%) sufrieron terapia apropiada y 2 (10%) fallecieron. La taquicardia ventricular monomórfica clínica (p=0,03) y la inducida (p<0,01) fueron predictores significativos de terapia. En 10 (56%) se identificó una mutación; en 8 (44%) en el gen de la b-miosina.
Conclusiones: la taquicardia ventricular monomórfica sostenida clínica y la inducida, fueron predictores de terapia apropiada del desfibrilador, en esta serie. La estratificación con base en la suma de factores de riesgo, actualmente es una buena opción en prevención primaria. Las mutaciones en la cadena pesada de b-miosina también son las más frecuentes en nuestra población.
Palabras clave: miocardiopatía hipertrófica, desfibrilador, taquicardia ventricular.
Introduction and objectives: hypertrophic myocardiopathy is a genetic entity with 1% to 2% prevalence. Half patients die of sudden cardiac death, most due to ventricular arrhythmias. There is still no clarity with regard to the patients to whom an automatic defibrillator has to be implanted. The objective of this work is to describe a series of patients with implant, the criteria used and the results obtained, as well as to analyze the predictors of appropriate therapy with the defibrillator.
Methods: 20 patients that received a third generation defibrillator were included. Electrophysiological study and prospective follow-up with register of events was performed in all. Genetic study was done in 18 (90%).
Results: 55% were men with mean age 40 (11-78) years. Six (30%) received implant for secondary prevention and 14 (70%) for primary prevention; the last ones because of several risk factors. A sustained arrhythmia was induced in 15 (75%) and in 3 (15%) monomorphic sustained ventricular tachycardia. At 22 months of follow-up, 4 (20%) underwent appropriate therapy and 2 (10%) died. Clinical monomorphic ventricular tachycardia (p=0.03) and the induced one (p<0.01) were significant therapy predictors. In 10 (56%) a mutation was identified; in 8 (44%) in the b-myosin gene.
Conclusions: monomorphic sustained clinical ventricular tachycardia and the induced one were predictors of the appropriate defibrillator therapy in this series. The stratification based on the risk factors addition is actually a good option for primary prevention. Mutations in the heavy b-myosin chain are also the most frequent in our population.
Key words: hypertrophic myocardiopathy, defibrillator, ventricular tachycardia.
Introducción
La miocardiopatía hipertrófica es una enfermedad cardiaca de origen genético, que se caracteriza por la hipertrofia del ventrículo izquierdo sin una causa evidente que la explique. Su prevalencia se ha estimado entre 0,1% y 0,2% de la población general, pero seguramente se está subestimando dado el gran número de pacientes asintomáticos (1-4).
La mitad de los pacientes con miocardiopatía hipertrófica fallecen por muerte súbita cardiaca, cuya incidencia es de 2% a 4% en series de pacientes de centros de referencia y de 1% en centros no especializados en este tipo de pacientes (5-7). Las causas involucradas en la muerte súbita cardiaca son diversas. Se han implicado taquiarritmias supraventriculares, bradiarritmias, isquemia y obstrucción hemodinámica, pero la causa predominante son las arritmias ventriculares malignas (8-15). Es por ello que en pacientes considerados como de alto riesgo, se recomienda el implante de un desfibrilador automático (13-17).
Aún no es claro qué pacientes deben considerarse como de alto riesgo, sobre todo en prevención primaria. Hay muy poca información que provenga de estudios prospectivos y los marcadores encontrados tienen, en general, bajo valor predictivo positivo (17).
El objetivo de este trabajo es describir una población de pacientes con miocardiopatía hipertrófica a la que se le implantó un desfibrilador automático implantable, así como mostrar los criterios empleados y los resultados, y analizar variables clínicas, electrofisiológicas y genéticas con respecto a la ocurrencia o no de terapia apropiada por el desfibrilador automático implantable.
Materiales y métodos
Se incluyeron todos los pacientes con miocardiopatía hipertrófica a quienes se les implantó un desfibrilador automático implantable con capacidad de registro de electrogramas e intervalos RR que fueron seguidos en nuestro servicio. El diagnóstico de miocardiopatía hipertrófica se fundamentó en la demostración ecocardiográfica de hipertrofia del ventrículo izquierdo sin una causa evidente que la explicara. Se incluyeron 20 pacientes.
Estudio electrofisiológico
A todos se les realizó un estudio electrofisiológico previo al implante. Bajo sedación superficial con 10 mg de diazepam se usaron dos catéteres por vía venosa femoral derecha, uno para registro del haz de His y otro para estimulación auricular y ventricular. La estimulación ventricular se realizó desde el ápex del ventrículo derecho con 1, 2 y 3 extraestímulos en ritmo sinusal y sobre longitudes de ciclo de 600, 500 y 430 ms. El punto final de la estimulación fue la inducción de taquicardia ventricular sostenida, fibrilación ventricular, alcanzar la refractariedad ventricular o llegar a intervalos de acoplamiento de 200 ms. Se definió taquicardia ventricular sostenida aquella que duraba más de 30 segundos o que llevaba a un compromiso hemodinámico que requería su interrupción inmediata. La taquicardia ventricular sostenida cuyos complejos QRS cambiaban continuamente de morfología, se clasificó como polimórfica; las que no cambiaban como monomórfica. Se consideró fibrilación ventricular cuando no había QRS identificable en el electrocardiograma de 12 derivaciones de superficie.
Desfibriladores
Los desfibriladores automáticos implantables se colocaron por vía venosa subclavia izquierda con el generador ubicado en la región pectoral a nivel submuscular en los siete primeros pacientes y por vía subcutánea en el resto. Todos los dispositivos se programaron en dos zonas de terapia con los criterios adicionales activados de acuerdo con un algoritmo ya publicado (18). Se definió como terapia adecuada del desfibrilador automático implantable (estimulación anti-taquicardia o choque) a aquella que fue administrada por arritmias que cumplían los requisitos de programación y que fueron diagnosticadas como ventriculares, en la lectura de los electrogramas, por dos observadores experimentados independientes. Se consideró terapia inapropiada la que se administró frente a arritmias supraventriculares o artefactos.
Análisis genético
A 18 pacientes se les practicó estudio genético mediante amplificación por PCR de los exones 8, 9, 13, 14, 16, 19, 20 y 23 de la cadena pesada de la b-miosina; del exón 5 de la alfa-tropomiosina y de los exones 9 y 10 de la troponina T. Se evaluaron variaciones de secuencia por el método SSCP (single-strand conformation polymorphism). Si se encontraba un modelo anormal el producto de la PCR se purificaba por electroforesis y se hacía la secuencia clínica con el «TaqDyeDeoxyTerminator cycle sequencing Kit®».
Seguimiento
Los pacientes fueron seguidos de manera programada a los diez días y al mes del implante. Luego cada seis meses o cuando lo requerían, por terapia u otro evento clínico relevante. Se llevó un registro prospectivo de cada visita, así como de los episodios registrados y tratados por el dispositivo. Se evaluaron las siguientes variables clínicas: edad, género, síntomas, historia familiar de muerte súbita cardiaca, antecedente personal de muerte súbita cardiaca, taquicardia ventricular no sostenida, taquicardia ventricular monomórfica sostenida, fracción de eyección del ventrículo izquierdo, miocardiopatía hipertrófica obstructiva, tratamiento antiarrítmico post-implante y base genética. Se evaluaron las variables electrofisiológicas; inducibilidad de taquicardia ventricular sostenida, etapa del protocolo de estimulación con el que se indujo y tipo de taquicardia ventricular sostenida inducida. Se investigó si estos predictores clínicos o electrofisiológicos definían un grupo de pacientes con mayor probabilidad de terapia apropiada del desfibrilador automático implantable.
Análisis estadístico
El análisis estadístico se realizó utilizando el paquete SPSS (Versión 6,0 Chicago: SPSS,1993). Las variables categóricas fueron comparadas con el test exacto de Fisher. Las variables continuas se expresan en media ± 1 desviación estándar y rango, y se comparan con el test de Student. La ocurrencia o no de terapia apropiada, se estudió por medio del método de Kaplan-Meier y se comparó con test de log-rank. Se consideró significativo un valor p de dos colas menor a 0,05.
Resultados
Las características clínicas del grupo se presentan en la tabla 1. La mayoría eran hombres (55%) con edad promedio de 40 ± 18 [11-78] años. El ecocardiograma de todos los pacientes mostró hipertrofia, con un espesor septal de 20 ± 9 [13-37] mm. En 8 (40%) pacientes mostró también obstrucción moderada del tracto de salida del ventrículo izquierdo y la fracción de eyección del ventrículo izquierdo fue de 57±12% [25-77].
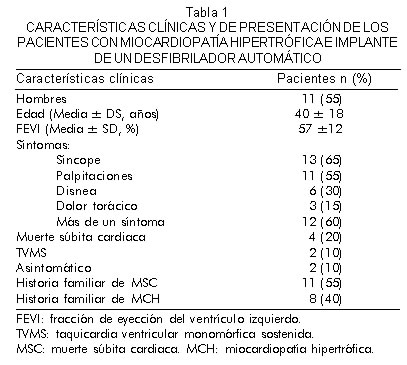
Se estudiaron seis pacientes (20%) y se les realizó implante por prevención secundaria; 2 (10%) con taquicardia ventricular monomórfica sostenida clínica documentada y 4 (20%) reanimados de muerte súbita cardiaca. En 14 (70%) la indicación fue prevención primaria. En 2 pacientes asintomáticos se indicó estudio electrofisiológico por tener antecedentes familiares de muerte súbita cardiaca relacionadas con miocardiopatía hipertrófica conocida. Nueve pacientes presentaron síncope de causa no aclarada, 6 tenían antecedentes familiares de miocardiopatía hipertrófica y/o muerte súbita cardiaca y los otros 3 referían además otros síntomas. Tres pacientes no tuvieron síncope pero referían historia de palpitaciones, otro síntoma y antecedente familiar de muerte súbita cardiaca. Los 12 pacientes estudiados por ser sintomáticos, tenían más de uno de los síntomas registrados y 9 de ellos antecedentes familiares de muerte súbita cardiaca. Cuatro de los 6 pacientes de prevención secundaria habían sufrido también por lo menos un episodio sincopal de causa no aclarada luego de agotar los estudios convencionales.
Durante el estudio electrofisiológico en 15 (75%) pacientes se indujo taquicardia ventricular sostenida. En 3 (15%) taquicardia ventricular monomórfica sostenida y en 13 (60%) taquicardia ventricular polimórfica/fibrilación ventricular. Las características del estudio electrofisiológico se resumen en la tabla 2. En la mayoría se logró inducir sólo al llegar a los tres extraestímulos y con la longitud de ciclo del tren de base más corto; es decir, en las etapas más agresivas del protocolo. A los 5 pacientes no inducibles se les implantó igualmente un desfibrilador automático implantable por considerarlos de alto riesgo al tener historia familiar de muerte súbita cardiaca relacionada con miocardiopatía hipertrófica y ser sintomáticos.

El tratamiento antiarrítmico previo al implante del desfibrilador automático fue: b-bloqueadores en 6 (30%), bloqueadores de los canales del calcio en 5 (25%), amiodarona en 4 (20%) y 7 (35%) no recibían medicación. Los pacientes que recibían tratamiento antiarrítmico lo continuaron sin cambios después del implante.
El seguimiento promedio fue de 22±17 [1-58] meses; ningún paciente vivo recibió seguimiento por menos de un año. Durante ese tiempo 4 (20%) pacientes presentaron al menos un episodio de terapia apropiada del desfibrilador automático implantable. En 3 de ellos el primer episodio ocurrió dentro del primer año del implante. En 5 (25%) pacientes se presentaron descargas inapropiadas, 3 por fibrilación/flutter auricular y 2 por artefactos del electrodo fracturado que fue cambiado.
Durante el seguimiento fallecieron 2 (10%) pacientes. Uno de 46 años con diagnóstico de miocardiopatía hipertrófica asimétrica ocho años antes, buena función ventricular, que había presentado tres episodios de taquicardia ventricular monomórfica sostenida clínica por lo que se envió a nuestro servicio. El ecocardiograma previo al estudio electrofisiológico mostró dilatación del ventrículo izquierdo con fracción de eyección del 25% e hipertrofia septal de 15 mm; la coronariografía descartó lesiones. El estudio electrofisiológico indujo taquicardia ventricular monomórfica sostenida y se implantó el desfibrilador automático implantable que dio la primera de tres terapias apropiadas a los nueve meses. Falleció a los 36 meses del implante en tormenta eléctrica que agotó la terapia.
El otro paciente tenía 64 años; también ingresó por taquicardia ventricular monomórfica sostenida clínica. El ecocardiograma no mostró dilatación, la fracción de eyección del ventrículo izquierdo fue 72% y tenía gradiente subvalvular aórtico de 80-100 mm Hg. El cateterismo descartó enfermedad coronaria. Se indujo taquicardia ventricular monomórfica sostenida tipo rama a rama pero no se practicó ablación ya que ésta no correspondía a la arritmia clínica del paciente. Falleció a un mes del implante, también en tormenta eléctrica.
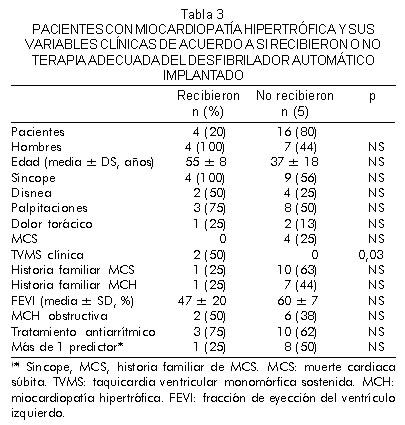
La tabla 3 muestra las variables clínicas estudiadas en el subgrupo que recibió terapia y en el grupo que no. El único predictor clínico estadísticamente significativo fue el antecedente de taquicardia ventricular monomórfica sostenida clínica (p=0,03). Ningún paciente con implante por muerte súbita cardiaca recuperada, recibió terapia.
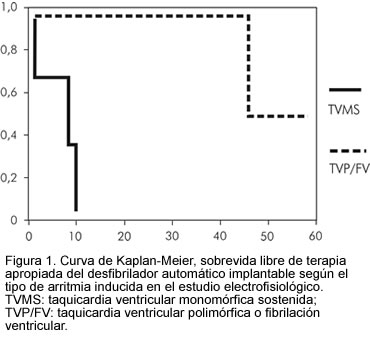
Al evaluar parámetros electrofisiológicos se encontró que la inducibilidad o no de una taquicardia ventricular sostenida en el estudio electrofisiológico, no predecía la terapia del desfibrilador automático implantable. Tampoco el número de extraestímulos o la longitud de ciclo sobre la cual se acoplaban. Todos los pacientes a los que se les indujo una taquicardia ventricular monomórfica sostenida tuvieron terapia apropiada, mientras que esto sólo en uno de los 12 en los que se indujo taquicardia ventricular polimórfica/fibrilación ventricular (p<0,01) (Figura 1). Además, los pacientes con taquicardia ventricular monomórfica sostenida, recibieron terapia en los primeros 10 meses post-implante, mientras que al grupo de pacientes a quien no se les inducía taquicardia ventricular monomórfica sostenida, presentaron terapia hasta los 46 meses.
Con respecto al fallecimiento el único predictor clínico fue el antecedente de taquicardia ventricular monomórfica sostenida (p<0,01) y entre las variables del estudio electrofisiológico nuevamente la inducción de taquicardia ventricular monomórfica sostenida (p=0,02). Los dos que murieron habían recibido terapia apropiada y efectiva del desfibrilador automático implantable. El tratamiento antiarrítmico con amiodarona, b-blo-queadores o la asociación de ellos posterior al implante, no disminuía el riesgo de descarga apropiada y tampoco inapropiada.
A 18 pacientes se les practicó estudio genético. En 10 de ellos (56%) se encontraron alteraciones genéticas, 2 en la troponina T y en 8 en la b-miosina. La presencia de estudio genético positivo, la alteración en la troponina T o la b-miosina no predecían terapia adecuada del desfibrilador automático implantable o muerte.
Discusión
En esta serie hubo predominancia masculina (55%) y la edad media giró en torno a los 40 años. Esto es lo que la mayoría de los autores encontró, seguramente debido a que son los pacientes que llegan a los centros de referencia cuando se hacen sintomáticos. Maron y colaboradores (7), en la serie multicéntrica más grande y menos seleccionada publicada, encontraron que 62% eran hombres y 45 años fue la edad de presentación.
La edad se relacionaría con la ocurrencia de muerte súbita cardiaca. Se ha encontrado mayor probabilidad de descarga de desfibrilador automático implantable en pacientes antes de los 31 y luego de los 55 años (14). En nuestra serie todos los que recibieron terapia apropiada eran mayores de 45 y la media fue 55 años, confirmando el segundo modo. Creemos que la razón para que no aparecieran pacientes más jóvenes se debe a lo pequeño del grupo.
Existe acuerdo sobre la indicación de implante de desfibrilador automático implantable en pacientes que han sufrido un episodio previo de muerte súbita cardiaca reanimada o taquicardia ventricular sostenida documentada (17). Esto se basa en la alta mortalidad y/o terapia apropiada de desfibrilador automático implantable posterior al evento, estimada hasta en 11% anual (14, 15, 19) y también en la falta de información respecto a un tratamiento farmacológico efectivo. El único medicamento propuesto ha sido la amiodarona y los resultados son conflictivos (20-21). De los 6 pacientes que recibieron implante por prevención secundaria 2 tuvieron terapia apropiada en la evolución, reafirmando lo oportuno de la indicación. Sin embargo, los 2 pacientes tratados fueron los que se habían presentado con taquicardia ventricular monomórfica sostenida clínica y ninguno de los que se presentó con muerte súbita cardiaca reanimada. La taquicardia ventricular monomórfica sostenida clínica, también se correlacionó con la mortalidad, que fue arrítmica. Si bien la diferencia que encontramos fue significativa, el número de pacientes es pequeño para establecer conclusiones definitivas. Los dos tipos de presentación, taquicardia ventricular monomórfica sostenida y muerte súbita cardiaca reanimada, se han analizado poco por separado en los trabajos que fundamentan nuestra práctica actual de implantación de desfibrilador automático implantable. Esto puede ser muy importante a la hora de definir costo–riesgo-beneficio.
La taquicardia ventricular monomórfica sostenida se ha descrito en pacientes con corazón sano y enfermo, en patologías con compromiso del ventrículo derecho e izquierdo. Se han hallado con mayor frecuencia en la cardiopatía isquémica pero también se ha descrito en miocardiopatía dilatada, en miocardiopatía hipertrófica y otras. El mecanismo de la mayoría de las taquicardias ventriculares monomórficas sostenidas sería la reentrada, y el hecho de que sea inducible en el estudio electrofisiológico está a favor de ello (22-24). La incidencia de taquicardia ventricular monomórfica sostenida en la miocardiopatía hipertrófica no es común y su mecanismo no está aclarado. En su fisiopatología se han involucrado los cambios en la arquitectura y la isquemia. Se ha relacionado con aneurismas apicales del ventrículo izquierdo (25) pero en ninguno de nuestros pacientes se encontró esta anomalía, lo que demuestra que su existencia no es indispensable.
La inducción de taquicardia ventricular monomórfica sostenida en el estudio electrofisiológico en pacientes con miocardiopatía hipertrófica, tampoco es común y oscila entre 0% y 30% según las series. Fananapazir y colaboradores en un grupo de pacientes considerados de alto riesgo, indujeron taquicardia ventricular sostenida en 43% pero taquicardia ventricular monomórfica sostenida sólo en 10% (16, 19, 26-29). En nuestra serie se indujo taquicardia ventricular monomórfica sostenida en 15%. En un paciente se indujo además una taquicardia ventricular tipo rama-rama que no es común en este tipo de patología.
Se ha propuesto el estudio electrofisiológico como un estudio útil en la estratificación de riesgo pero resulta controvertido y en la actualidad las pautas de muerte súbita cardiaca de la Sociedad Europea de Cardiología no lo recomiendan de rutina (1, 17, 24, 27-30). En nuestra serie todos los pacientes que recurrieron habían sido inducibles en el estudio electrofisiológico pero hay que notar que el 75% del total fue inducible. El protocolo empleado no es particularmente agresivo ni empleó medicación. Pese a ello la selección de los pacientes con base en los criterios clínicos, desempeña un papel muy importante.
Nuestro hallazgo principal fue que el tipo de arritmia inducida se relacionó con la ocurrencia y el tiempo de terapia apropiada. Todos los pacientes a quienes se les indujo una taquicardia ventricular monomórfica sostenida, sufrieron al menos un episodio de arritmia ventricular tratada efectivamente por el desfibrilador automático implantable dentro del primer año de seguimiento. Sólo un paciente en quien se había inducido taquicardia ventricular polimórfica/fibrilación ventricular, tuvo episodios y únicamente a los cuatro años de seguimiento (p<0,01). La ocurrencia de taquicardia ventricular monomórfica sostenida inducida, también se relacionó con la muerte arrítmica.
Dos de los 3 pacientes en quienes se indujo taquicardia ventricular monomórfica sostenida, habían presentado la misma arritmia de forma espontánea. Con esta serie no es posible distinguir cual podría ser el indicador de riesgo independiente. Resultaría apresurado sacar conclusiones definitivas sobre este tema, pero nuestros datos sugieren que la taquicardia ventricular monomórfica sostenida clínica o inducida, es un factor de riesgo de arritmia ventricular y que debería considerarse separada de arritmias menos específicas.
En el análisis retrospectivo de los 14 pacientes con miocardiopatía hipertrófica a quienes se les puso desfibrilador automático implantable por prevención primaria, 12 eran sintomáticos, 9 con síncope y 11 tenían antecedentes familiares de muerte súbita cardiaca, en su mayoría asociada a miocardiopatía hipertrófica. En 2 (14%) de ellos se documentó terapia apropiada del desfibrilador automático implantable, y ambos habían sufrido síncope. El síncope ha sido descrito como factor de riesgo, especialmente en niños, asociado con el ejercicio o con taquicardia ventricular inducible. También se considera como factor de riesgo el antecedente de muerte súbita cardiaca familiar (1, 9, 19, 29, 31-32).
La observación de taquicardia ventricular no sostenida en el Holter y la respuesta presora anormal en el ejercicio, también se han catalogado como factores de riesgo aunque con bajo valor predictivo positivo (33-35). Estos exámenes no fueron realizados de forma sistemática a todos los pacientes de nuestra serie. En los 9 que se hizo Holter se encontró arritmia ventricular en 2. En los 6 pacientes que se hizo prueba de esfuerzo se encontró una respuesta presora plana en 5. Ninguno de los dos factores se asoció con la ocurrencia de terapia apropiada por el desfibrilador automático implantable.
Todos los pacientes en prevención primaria referían más de un síntoma y/o tenían antecedentes familiares y/o estudios anormales sugestivos. Si bien no existe un algoritmo de estratificación de riesgo establecido, nuestra práctica fue establecer que los pacientes tuvieran varios de los factores descritos para definir el implante. Esto se fundamenta en que se está frente a una enfermedad globalmente considerada de buen pronóstico y que todavía no existe un marcador que por sí solo indique el implante de desfibrilador automático implantable con una relación costo-riesgo-beneficio aceptable. Elliot y colaboradores (36) estudiaron la presencia de cinco factores clínicos: taquicardia ventricular no sostenida, síncope, respuesta presora al ejercicio, historia familiar de muerte súbita cardiaca y espesor de la pared del ventrículo izquierdo. Encontraron que los pacientes con dos o más factores tenían un porcentaje del 5% anual de muerte súbita cardiaca, por lo que sería una buena forma de selección para decidir el implante. El inconveniente radica en que más de la mitad de los eventos de muerte súbita cardiaca ocurrió en los pacientes con uno o ninguno de los factores estudiados. Como señalan los mismos autores, es claro que aún se debe trabajar y buscar indicadores. Quizás la inducción de taquicardia ventricular monomórfica sostenida en un estudio electrofisiológico, indicado a pacientes seleccionados, pueda ser otro criterio que ayude a encontrar el grupo de mayor riesgo.
Un factor al que se le ha dado gran valor es al grosor del septum (37); en un seguimiento a 20 años, se observó que aquellos con espesor menor a 20 mm no tenían mortalidad en contraste con la mortalidad casi del 40% en aquellos con espesor mayor a 30 mm. Por otra parte, algunos autores no están de acuerdo y consideran que la hipertrofia severa sin otros factores de riesgo, no es suficiente para el uso de medidas profilácticas (38). En nuestro estudio sólo dos pacientes tenían grosor del septum mayor a 30 mm y en ellos no hubo mayor probabilidad de descarga relacionada posiblemente con el pequeño número de pacientes. Nuestro estudio demostró seguridad en el implante con 0% de mortalidad post-operatoria como se ha documentado previamente, y sin pacientes que no recibieran adecuada desfibrilación en el implante. Almquist (39) reportó 4% de pacientes que no respondieron de manera adecuada a la desfibrilación endocárdica y se relacionó con hipertrofia masiva (septum mayor 45 mm), que no existía en nuestra población, y al uso crónico de amiodarona, que nosotros no observamos.
Los resultados del análisis genético, confirman que también en nuestra población las mutaciones más frecuentes están en la cadena pesada de la b-miosina. Se han descrito más de 50 mutaciones en este gen y en nuestro estudio se encontraron en 8 (44%) de los 18 pacientes estudiados (2). Sin embargo, en las mutaciones buscadas, no se halló relación con la terapia apropiada del desfibrilador automático implantable o mortalidad.
Las mutaciones en genes que codifican la cadena pesada de la betamiosina, la proteína C unida a la miosina y la troponina T dan cuenta de la mayoría de casos de miocardiopatía hipertrófica (40). Las mutaciones de la cadena pesada de la betamiosina Arg403Glu y Arg453Cys se reportan como asociadas a alto riesgo de muerte cardiaca súbita, mientras que la mutación Va606Met se asocia con pronóstico benigno (41). Por otra parte, las mutaciones de la troponina T producen poca o ninguna hipertrofia pero sí alto riesgo de muerte súbita. No obstante, la presencia de la mutación no es suficiente para que se produzca muerte súbita, y son necesarios otros factores que pueden ser genes modificantes, modificación de productos genéticos, enfermedades coexistentes o factores del medioambiente (42). En nuestra población no se encontraron estas mutaciones de alto riesgo.
Limitaciones del estudio
El tamaño de nuestra serie es pequeño y ello no permite realizar análisis multivariado ni sacar conclusiones definitivas. De otro lado, es útil en la medida que proviene de un solo centro y tiene el valor de la homogeneidad de los criterios y pruebas aplicadas. No se ha llevado un registro sistemático de los pacientes con miocardiopatía hipertrófica a los que se resuelve no implantar, lo cual sería importante para comparar evoluciones. Los pacientes son referidos de otros centros y salvo que debamos seguirlos controlando por el desfibrilador automático implantable, regresan a su médico tratante y es difícil tener un seguimiento. Hay variables que han sido descritas como de riesgo y no se han evaluado en todos los pacientes. Finalmente, este no es un estudio de diseño prospectivo y como tal está expuesto a los desvíos que ya han sido señalados.
Conclusiones
En los pacientes con miocardiopatía hipertrófica que recibieron un desfibrilador automático implantable, la taquicardia ventricular monomórfica sostenida clínica y la inducida en el estudio electrofisiológico, fueron predictores de la ocurrencia de terapia apropiada. Este hallazgo debe confirmarse en una serie mayor, pero puede ser un criterio importante para agregar a la estratificación de riesgo de estos pacientes que aún no está completamente resuelta.
Al momento actual, la suma de factores de riesgo parece la forma más adecuada de decidir el tratamiento con desfibrilador automático implantable de pacientes en prevención primaria.
Las mutaciones en la cadena pesada de la b-miosina son la base genética más frecuente también en nuestra población.
Agradecimientos
A Mariona Matas y Eulalia Ventura por la colaboración en el estudio y por el apoyo brindado a todo nuestro trabajo.
Bibliografía
1. Spirito P, Seidman CE, McKenna WJ, Maron BJ. The management of hypertrophic cardiomyopathy. N Eng J Med 1997; 336 (11): 775-85. [ Links ]
2. Fananapazir L. Advances in molecular genetics and management of hypertrophic cardiomyopathy. JAMA 1999; 281 (18): 1746-52. [ Links ]
3. Maron BJ. Hypertrophic cardiomyopathy: a systematic review. JAMA 2002; 287 (10): 1308-20. [ Links ]
4. Maron BJ, Gardin JM, Flack JM, Gidding SS, Kurosaki TT, Bild DE. Prevalence of hypertrophic cardiomyopathy in a general population of young adults: echocardiographic analysis of 4111 subjects in the CARDIA Study. Circulation 1995; 92 (4): 785-9. [ Links ]
5. Spirito P, Chiarella F, Carratino L, Berisso MZ, Bellotti P, et al. Clinical course and prognosis of hypertrophic cardiomyopathy in an outpatients population. N Eng J Med 1989; 320 (12): 749-55. [ Links ]
6. McKenna WJ, Franklin RCG, Nihoyannopoulos P, Robinson KC, Deandield JE. Arrhythmia and prognosis in infants, children and adolescents with hypertrophic cardiomyopathy. J Am Coll Cardiol 1988; 11 (1): 147-53. [ Links ]
7. Maron BJ, Olivotto I, Spirito P, Casey SA, Bellone P, Gohman TE, et al. Epidemiology of hypertrophic cardiomyopathy–related death: revisited in a large non–referral-based patient population. Circulation 2000; 102 (8): 858-64. [ Links ]
8. Maron BJ, Roberts WC, Epstein SE. Sudden death in hypertrophic cardiomyopathy: a profile of 78 patients. Circulation 1982(7);65:1388-94. [ Links ]
9. McKenna WJ, Camm J. Sudden death in hypertrophic cardiomyopathy: assessment of patients at high risk. Circulation 1989; 80 (5): 1489-92. [ Links ]
10. Dilsizian V, Bonow RO, Epstein SE, Fananapazir L. Myocardial ischaemia detected by thallium scintigraphy is frequently related to cardiac arrest and syncope in young patients with hypertrophic cardiomyopathy. J Am Coll Cardiol 1993; 22 (3): 796-804. [ Links ]
11. Krikler DM, Davies MJ, Rowland E, Goodwin JF, Evans RC, Shaw DB. Sudden death in hypertrophic cardiomyopathy: associated accessory atrioventricular pathways B Heart J 1980; 43 (3): 245-51. [ Links ]
12. Yetman AJ, McCrindle BW, MacDonald C, Freedom RM, Gow R. Myocardial bridging in children with hypertrophic cardiomyopathy. A risk factor for sudden death. N Eng J Med 1998; 339 (17): 1201-9. [ Links ]
13. Primo J, Geelen P, Brugada J, Filho AL, Mont L, Wellens F, et al. Hypertrophic cardiomyopathy: roles of the implantable cardioverter-defibrillator. J Am Coll Cardiol 1998; 31 (5): 1081-15. [ Links ]
14. Maron BJ, Shen WK, Link MS, Epstein AE, Almquist AK, Dauber JP et al. Efficacy of implantable cardioverter-defibrillators for the prevention of sudden death in patients with hypertrophic cardiomyopathy. N Eng J Med 2000; 342 (6): 365-73. [ Links ]
15. Elliott PM, Sharma S, Varnava A, Poloniecki J, Rowland E, McKenna WJ. Survival after cardiac arrest or sustained ventricular tachycardia in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol 1999; 33 (6): 1596-601. [ Links ]
16. Zhu D, Sun H, Hill R, Roberts R. The value of electrophysiology study and prophylactic implantation of cardioverter defibrillator in patients with hypertrophic cardiomyopathy. Pacing Clin Electrphysiol 1998; 21 (1Pt2): 299-302. [ Links ]
17. Priori SG, Aliot E, Blomstrom-Lundqvist C, Bossaert L, Breithardt G, Brugada P, et al. Task Force on Sudden Cardiac Death of the European Society of Cardiology. Eur Heart J 2001; 22 (16): 1374-450 [ Links ]
18. Brugada J, Mont L, Figueiredo M, Valentino M, Matas M, Navarro-Lopez F. Enhanced detection criteria in implantable defibrillators. J Cardiovasc Electrophysiol 1998; 9 (3): 261-8. [ Links ]
19. Cecchi F, Maron BJ, Epstein SE. Long-term outcome of patients with hypertrophic cardiomyopathy successfully resuscitated after cardiac arrest. J Am Coll Cardiol 1989; 13 (6): 1283-8. [ Links ]
20. McKenna WJ, Oakley CM, Krikler DM, Goodwin JF. Improved survival with Amiodarone in patients with hypertrophic cardiomyopathy and ventricular tachycardia. Br Heart J 1985; 53 (4): 412-6. [ Links ]
21. Fananapazir L, Leon MB, Bonow RO, Tracy CM, Cannon RO, Epstein SE. Sudden death during empiric amiodarone therapy in symptomatic patients with hypertrophic cardiomyopathy. Am J Cardiol 1991; 67 (2): 169-74. [ Links ]
22. Simons G, Klein G, Natale A. Ventricular tachycardia: pathophysiology and radiofrequency catheter ablation. PACE 1997; 20 (2 Pt 2I): 534-51. [ Links ]
23. de Bakker JM, van Capelle FJ, Janse MJ Wilde AA, Coronel R, Becker AE, et al. Reentry as a cause of ventricular tachycardia in patients with chronic ischemic heart disease: electrophysiologic and anatomic correlation. Circulation 1988; 77 (3): 589-606. [ Links ]
24. Fananapazir L, Tracy CM, Leon MB, Winkler JB, Cannon RO, Bonow RO et al. Electrophysiologic abnormalities in patients with hypertrophic cardiomyopathy. A consecutive analysis in 155 patients. Circulation 1989; 80 (5): 1259-68. [ Links ]
25. Maron BJ, Hauser RG, Roberts WC. Hypertrophic cardiomyopathy with left ventricular apical diverticulum. Am J Cardiol 1996; 77 (14): 1263-65. [ Links ]
26. Watson RM, Schwartz JL, Maron BJ, Tucker E, Rosing DR, Josephson ME. Inducible polymorphic ventricular tachycardia and ventricular fibrillation in a subgroup of patients with hypertrophic cardiomyopathy at high risk for sudden death. J Am Coll Cardiol 1987; 10 (4): 761-74. [ Links ]
27. Geibel A, Brugada P, Zehender M, Stevenson W, Waldecker B, Wellens HJ. Value of programmed electrical stimulation using a standardized ventricular stimulation protocol in hypertrophic cardiomyopathy. Am J Cardiol 1987; 60 (8): 738-9. [ Links ]
28. Fananapazir L, Epstein SE. Hemodynamic and electrophysiologic evaluation of patients with hypertrophic cardiomyopathy surviving cardiac arrest. Am J Cardiol 1991; 67 (4): 280-7. [ Links ]
29. Fananapazir L, Chang AC, Epstein SE, McAreavey D. Prognostic determinants in hypertrophic cardiomyopathy. Prospective evaluation of a therapeutic strategy based on clinical, Holter, haemodynamic, and electrophysiological findings. Circulation 1992; 86 (3): 730-40. [ Links ]
30. Kuck KH, Kunze KP, Schluter M, Nienaber CA, Costard A. Programmed electrical stimulation in hypertrophic cardio-myopathy. Results in patients with and without cardiac arrest or syncope. Eur Heart J 1988; 9 (2): 177-85. [ Links ]
31. Maron BJ, Bonow RO, Cannon RO, Leon MB, Epstein SE. Hypertrophic cardiomyopathy: Interrelations of clinical manifestations, patophysiology and therapy. N Eng J Med 1987; 316 (14): 780-9. [ Links ]
32. McKenna W, Deanfield J, Faruqui A, England D, Oakley C, Goodwin J. Prognosis in hypertrophic cardiomyopathy: role of age and clinical, electrocardiographic and haemodynamic features. Am J Cardiol 1981; 47 (3): 532-8. [ Links ]
33. Maron BJ, Savage DD, Wolfson JK, Epstein SE. Prognostic significance of 24 hour ambulatory electrocardiographic monitoring in patients with hypertrophic cardiomyopathy: a prospective study. Am J Cardiol 1981; 48 (2): 252-7. [ Links ]
34. Spirito P, Rapezzi C, Autore C, Bruzzi P, Bellone P, Ortolani P, et al. Prognosis of asymptomatic patients with hypertrophic cardiomyopathy and nonsustained ventricular tachycardia. Circulation 1994; 90 (6): 2743-7. [ Links ]
35. Sadoul N, Prasad K, Elliot PM, Banneriee S, Frenneaux MP, McKenna WJ. Prospective prognostic assessment of blood pressure response during exercise in patients with hypertrophic cardiomyopathy. Circulation 1997; 96 (9): 2987-91. [ Links ]
36. Elliott PM, Poloniecki J, Dickie S, Sharma S, Monserrat L, Varnava A, et al. Sudden death in hypertrophic cardiomyopathy: identification of high risk patients. J Am Coll Cardiol 2000; 36 (7): 2212-2218. [ Links ]
37. Spirito P, Bellone P, Harris K et al. Magnitude of left ventricular hypertrophy and risk of sudden death in hypertrophic cardiomyopathy. N Eng J Med 2000; 342: 1778-85. [ Links ]
38. Elliot P, Gimeno J, Mahon N et al. Relation between severity of left-ventricular hypertrophy and prognosis in patients with hypertrophic cardiomyopathy. Lancet 2001; 357: 420-4. [ Links ]
39. Almquist A, Montgomery J, Haas T, Maron B. Cardioverter-defribillator implantation in high-risk patients with hypertrophic cardiomyopathy. Heart Rhythm 2005; 2: 814-9. [ Links ]
40. Marian AJ, Roberts R. The molecular genetic basis for hypertrophic cardiomyopathy. J Mol Cell Cardiol 2001; 33: 655-70. [ Links ]
41. Watkins H, Mckenna W, Thierfelder L et al. Mutations in the genes for cardiac troponin T and alpha-tropomyosin in hypertrophic cardiomyopathy. N Eng J Med 1995; 332: 1058-64. [ Links ]
42. Marian AJ. On predictors of sudden cardiac death in hypertrophic cardiomyopathy. J Am Coll Cardiol 2003; 41: 994-6. [ Links ]














