Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.14 no.4 Bogota July/Aug. 2007
Grupo de Dinámica Cardiovascular, Universidad Pontificia Bolivariana, Medellín, Colombia.
Correspondencia: John Bustamante, MD., Ph.D., Grupo de Investigación Dinámica Cardiovascular, Bl. 7. Escuela de Formación Avanzada, Universidad Pontificia Bolivariana, Medellín, Colombia. A.A. 56006, Tel.: (4) 4159015.
Recibido: 24/04/06. Aprobado: 05/05/07
Muchas de las enfermedades cardiovasculares congénitas pueden intervenirse mediante cirugía, con implantes biológicos o artificiales, lo cuales permitirán restablecer la funcionalidad del sistema cardiovascular. Por sus propiedades, los injertos biológicos procedentes de donantes cadavéricos (homoinjertos) son los más apropiados para cirugías reconstructivas del tracto de salida ventricular, pero infortunadamente son difíciles de adquirir ya que se obtienen de donantes con pocas semanas de nacidos, pretendiendo que se correlacionen con las dimensiones y geometría de la estructura nativa a reparar.
Con este proyecto se evaluó el comportamiento hidrodinámico de tramos valvulados de venas yugulares bovinas, obtenidas en la Central Ganadera de Medellín, montando el segmento venoso de estudio en un banco de pruebas que emulaba las condiciones del tracto de salida del ventrículo derecho y tronco de la pulmonar, con el fin de analizar su comportamiento en condiciones similares a las que debe afrontar el vaso como bioimplante en la corrección de alteraciones cardiovasculares congénitas en neonatos y niños.
Palabras clave: venas yugulares bovinas, bioimplantes valvulares, biomecánica vascular, flujo pulsante, probador biomecánico.
Many congenital heart diseases may be treated surgically with biological or artificial implants that will allow the restoration of cardiovascular system functionality. Due to its properties, the biologic implants obtained from dead donors (homografts) are the most appropriate for ventricular output reconstructive surgeries. Unfortunately, these are difficult to acquire, because they are obtained from newborn donors and may be correlated to the dimensions and geometry of the native structure to be repaired.
This project evaluated the hydrodynamic behavior of valvular segments of bovine jugular veins (obtained from the Livestock Central in Medellin), mounting the venous segment on a test bank that simulated the right ventricle output tract and the pulmonary trunk, in order to analyze its behavior in similar conditions to those that the vessel must face as bio-implant in the correction of congenital cardiovascular alterations in newborns and infants.
Key words: bovine jugular veins, valvular bio-implants, vascular biomechanics, pulsatile flow, biomechanical tester.
Introducción
La enfermedad cardiovascular congénita que afecta algunas estructuras del corazón y los grandes vasos limitando su progresión y madurez, que es causa de fallas estructurales y funcionales resultado de alteraciones durante el desarrollo embrionario o fetal, es un problema complejo cuyo tratamiento oportuno es indispensable para disminuir la mortalidad y las complicaciones cardiovasculares que tendrán repercusión sobre el recién nacido y el adulto.
Muchas de estas enfermedades congénitas cardiacas conllevan alteraciones circulatorias importantes, que determinan falla en el bombeo sanguíneo, insuficiencia cardiaca congestiva y muerte del paciente; otras sólo producen síntomas ocasionales relacionados con el incremento en la demanda de bombeo, como ocurre durante la actividad física. Varias de estas patologías pueden tratarse con cirugía por medio de homoinjertos; infortunadamente, la disponibilidad de donantes neonatos o de poco tiempo de nacidos para la obtención de homoinjertos que permitan un tratamiento oportuno de estas enfermedades es muy baja en nuestro medio, dado que se requiere que éstas se correlacionen con tallas y características específicas del receptor (1), lo cual genera grandes listas de espera para la cirugía correctiva y que transcurra un periodo de tiempo valioso antes de intervenir al paciente.
Esta dificultad crea la necesidad de explorar nuevos procedimientos que posibiliten una intervención oportuna de la enfermedad, y así surgen diferentes alternativas, entre ellas estudiar las venas yugulares bovinas como una opción para el tratamiento de las anomalías del tracto de salida del ventrículo derecho (2-4), a partir de realizar una descripción amplia de su histología y anatomía, así como de su comportamiento hidromecánico.
En los últimos años, el Grupo de Dinámica Cardiovascular ha estudiado la opción de usar las venas yugulares como bioimplantes cardiovasculares, obteniendo resultados previos de la anatomía e histología en estos vasos.
El objetivo de este estudio fue identificar el comportamiento hidromecánico de las venas yugulares bovinas valvuladas, con el fin de evaluar la posibilidad de utilizarlas como implantes para la corrección en cardiopatías y valvulopatías congénitas en el neonato. Para ello se sometió una muestra de vasos a condiciones hidrodinámicas controladas en un banco de pruebas, que permitió determinar la funcionalidad de las válvulas (apertura y oclusión) y el comportamiento del vaso ante variaciones de frecuencia, volumen latido y presión en un flujo pulsante.
Hasta el momento se han realizado algunos estudios sobre las propiedades mecánicas y la respuesta de arterias y venas de diferentes animales, que aportan nuevos conceptos en el área de la biomecánica cardiovascular. En dichos estudios, tanto in vitro como in vivo, se recurre a diferentes técnicas, entre las que se incluyen los bancos de prueba hidráulicos y las prácticas en modelos animales, con el fin de obtener valores y rangos de las propiedades de los tejidos.
Bia y colaboradores (5) realizaron uno de los estudios más recientes del comportamiento mecánico de la pared vascular; estudiaron específicamente la dinámica de la pared arterial usando un análisis de la relación presión-diámetro. De éste se reporta que las propiedades dinámicas de dicha pared dependen tanto de los componentes pasivos (fibras de colágeno y elastina) como de los activos (músculo liso vascular), ya que ellos determinan su comportamiento viscoelástico. Durante el desarrollo de este trabajo se realizaron medidas in vitro del diámetro y la presión en arterias femorales ovinas y venas yugulares bovinas, las cuales se compararon con prótesis vasculares artificiales de politetrafluoroetileno (ePTFEo Teflón®). El estudio demostró que las características mecánicas de la pared de arterias, venas y prótesis vasculares pueden evaluarse de manera exitosa in vitro, mediante índices dinámicos que permitan analizar la elasticidad y viscosidad del conducto, bajo condiciones de presión, flujo, frecuencia y temperatura controladas (6).
En otro estudio realizado en venas, se valida el modelo bifásico de la relación compliance-presión (5). La compliance ha sido uno de los parámetros utilizados en la caracterización de la pared, razón por la cual, en este trabajo se propone el empleo de dicha relación para describir las propiedades mecánicas de la pared venosa. En otro estudio, llevado a cabo por Hayashi y colaboradores (7), se evaluó la respuesta biomecánica de la vena femoral frente a la elevación crónica de la presión sanguínea en conejos. El propósito fue mostrar los cambios de dimensión y propiedades en respuesta a la elevación crónica de la presión sanguínea en venas, comparándolas con los resultados observados en arterias de especímenes hipertensos.
El trabajo que se presenta, es una contribución a la información sobre la funcionalidad valvular en venas yugulares, y aporta una nueva experiencia en cuanto a los aspectos biomecánicos (8-10). Esta información es relevante cuando se pretende usar como bioimplante valvulado, dada la importancia que tiene la respuesta ante flujos, frecuencias y presiones internas generadas por el flujo, para posteriormente validar su uso en humanos en relación con su comportamiento hidráulico (11).
Materiales y métodos
El estudio se realizó a partir de venas yugulares bovinas recolectadas en la Central Ganadera de Medellín S.A., de las razas Brahman y Brangus, provenientes de hatos de los departamentos de Antioquia y Córdoba. Las muestras obtenidas se mantuvieron en cadena de frío desde su extracción hasta la disección.
Las venas yugulares se seleccionaron con criterios que consideraron aspectos como: integridad de la pared venosa y valvular, simetría entre las valvas y presencia de tramos trivalvulados. Luego de la estandarización preliminar de los procedimientos con 20 vasos, se procedió a evaluar una muestra de 30 segmentos de venas o tramos valvulados. Después de disecar las venas, se determinaron dos grupos: uno de venas frescas y otro de venas fijadas en glutaraldehído al 0,5%. Ambos grupos de especímenes se montaron en un banco de pruebas hidromecánicas implementado para los ensayos, en el cual se varía la frecuencia y presión de expulsión de la cámara, y se mide la presión y el flujo resultante. La presión se registró por medio de transductores de presión electrónicos, conectados a una interfaz de adquisición de datos externo, para registrar los datos en la computadora a través de un programa desarrollado en la plataforma de LabView®.
Disección
Se resecaron los tejidos circundantes y adventicios de la pared venosa. Para ello se pasó a través de la luz de la vena un introductor fabricado en acrílico, que permite retirar ágilmente el tejido adiposo y partes de la adventicia que rodea el vaso. Esta técnica ayuda a evitar cortes accidentales en la pared y evidencia los vasos (vasa vasorum) presentes en este tipo de tejido. Posteriormente, se invierte el vaso para hacer una inspección morfológica y anatómica. En los estudios de estandarización se observó que la vena yugular bovina posee segmentos con dos, tres y hasta cuatro valvas, y en ocasiones sin ninguna valva, en las dos razas disponibles. De otro lado, tras una cuidadosa selección se descartaron las muestras que presentaban segmentos valvulados asimétricos, con diferentes tamaños de valvas, desniveles en la inserción de las cúspides, fenestraciones, retracciones, placas de ateromas, calcificaciones en la pared, granulomas, hematomas, coágulos adheridos o presencia de vasos con ostium en la zona valvular.
Después de esta exploración del interior de la vena, se seleccionaron los tramos trivalvulados óptimos (Figura 1); se aisló un segmento de 7,5 cm, manteniendo el plano valvular en la parte central, tratándose de evitar el contacto y la manipulación de las valvas para conservar su integridad física. Finalmente, se revirtió el vaso a su posición normal y se terminó de disecar la adventicia.
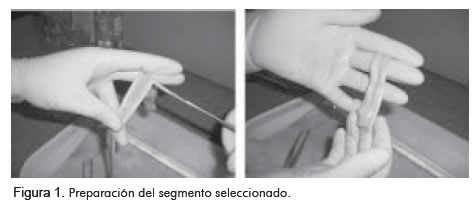
Luego de esta etapa, las venas seleccionadas se separaron entre los dos grupos: uno de venas frescas, conservadas en un recipiente con hielo hasta el momento de probarla, dentro de las 48 horas siguientes a la extracción, y otro de venas preservadas en glutaraldehído al 0,5%, libre de polímeros, durante 30 días a 4oC.
Fijación
El glutaraldehído es una sustancia química que tiene acción esterilizante y antimicrobiana, que además permite mantener los elementos de soporte de las paredes y las válvulas impidiendo la desnaturalización de la elastina y el colágeno, aún con el tejido desvitalizado. Los tramos a preservar se invirtieron y se les introdujo un soporte de acrílico con una depresión central, diseñada para conservar la estructura valvular sin tensión en la pared. A continuación, se abrieron las valvas con la ayuda de pequeñas torundas de hule-espuma bañadas en glutaraldehído al 0,5% (Figura 2), para que no se replieguen contra la pared durante la primera fase de la fijación, en la cual las venas se almacenan en tubos de 50 mL con glutaraldehído durante 24 horas.
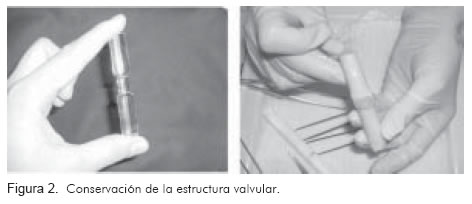
En la segunda fase, se retiró el soporte, se revirtió el vaso, conservando las torundas en su posición, y se volvió a almacenar en el tubo con glutaraldehído por 30 días, a temperatura de 40C.
Banco de pruebas
Para evaluar el comportamiento de las venas yugulares bovinas y analizar sus características hidrodinámicas, se implementó para los ensayos un banco de pruebas hidromecánicas, con el cual se emulan las condiciones hidráulicas del tracto de salida del ventrículo derecho y tronco de la pulmonar. Éste está compuesto por:
1. Una bomba de diafragma de accionamiento neumático, con flujo pulsante, dotada de una válvula St. Jude en la salida; controlada mediante un programa computacional, por medio de dos válvulas solenoides que regulan el paso de aire comprimido y vacío.
2. Una cámara de pruebas para montar el tramo venoso valvulado, con transductores de presión electrónicos en la entrada y la salida.
3. Un baño térmico con control proporcional, que sostiene la temperatura del fluido de trabajo a 370C ±1.
4. Un fluxómetro electromagnético para cuantificar la velocidad máxima de flujo en cada pulso, y una probeta calibrada de 1.000 mL para verificar el volumen latido.
5. Una interfaz de adquisición de datos externo autónomo, con una frecuencia de muestreo de 300 Hz, con 10 canales análogos de entrada, que se comunica con el computador a 9,6 kBaudios.
6. Un programa de software para el procesamiento de datos, mediante una plataforma desarrollada en LabView® (Figura 3).

El fluido de trabajo es una solución acuosa con 5 cPo a 370C, para simular la viscosidad sanguínea a temperatura corporal. La solución se prepara mediante carboximetilcelulosa (CMC), un polisacárido de alto peso molecular, que al entrar en contacto con el agua forma un gel viscoso, el cual se deja reposar 12 horas para obtener una viscosidad uniforme y estable. La viscosidad se midió con una copa Ford a temperatura ambiente, teniendo en cuenta la variación de la viscosidad con la temperatura (12).
La bomba hidromecánica opera de manera alterna, con aire a presión, para comprimir el elemento deformable, regulado con la válvula Vra y medido con el manómetro análogo Pa; y con vacío para expandirlo, ajustado con la válvula VRv y medido con el manómetro análogo Pv. Ambos se aplican mediante el controlador digital que abre y cierra las válvulas solenoides a las frecuencias de trabajo (60, 80 y 100 pulsos/min), variadas desde el programa de operación de la bomba.
Prueba hidráulica
Las condiciones de control de las pruebas hidrodinámicas, se definieron al operar la bomba hidromecánica a presiones sistémicas y pulmonares, y obtener las curvas de presión de entrada y salida en un tramo semi-rígido no valvulado instalado en el sitio en el cual se evaluaron las venas, en posición equivalente a la del tracto de salida ventricular. Las frecuencias de prueba son 60, 80 y 100 pulsos/min. Antes de fijar cada vaso en el banco de pruebas, se midió el diámetro y el espesor de la pared con un calibrador, con legibilidad de 0,1 mm. Luego, se hace una prueba de coaptación valvular irrigando solución a través del vaso, y con el referente de oclusión valvular se marca la orientación de las valvas, para su adecuado montaje en la línea de prueba (Figura 4).

El vaso se sujeta de forma mecánica a la línea y se somete a una prueba de estanquidad, para verificar que no queden fugas en los soportes y que la pared no sea permeable. Si la prueba resulta negativa para filtraciones, se llena la cámara con solución salina con densidad de 1,09 g mL-1, a 370C, para evitar la desecación del vaso.
Para realizar las pruebas con los vasos fue necesario especificar un estado de referencia (o nuevo estado natural), establecido por aplicaciones repetidas de la misma carga y descarga, hasta que el tejido mostrara un comportamiento estable. Con este proceso de precondicionamiento, la relación tensión-deformación es única para cada ciclo del proceso, la cual permite la repetibilidad de los resultados. Las venas se precondicionan a 60 pulsos/min, manteniendo constantes la cabeza hidrostática, las condiciones de suministro de aire comprimido y la presión de vacío. Se ajusta el flujo de aire comprimido mediante la válvula Vra, y de vacío, mediante la válvula VRv, para evitar la excesiva dilatación del vaso probado. Controlada la dilatación del vaso a esta frecuencia de pulsación, se deja en dichas condiciones por cinco minutos.
Una vez precondicionado el vaso, se inicia la captura de los datos empezando con la frecuencia de 60 pulsos/min, y se miden la presión en la entrada y salida de la vena, la velocidad de flujo durante un minuto y el volumen latido. Luego se aumenta desde el computador la frecuencia a 80 pulsos/min, se esperan tres minutos de precondicionamiento y se repite la captura de datos. Finalmente, se hace la misma operación a la frecuencia de 100 pulsos/min.
El flujo pulsante es resultado del equilibrio entre las fuerzas inerciales transitorias (Fi) y las fuerzas viscosas (Fv). Para caracterizar el flujo pulsante se requiere, además del número de Reynolds (Re), el número de Womesrley (Wo), que relaciona las dos fuerzas: si Wo es grande, dominarán las fuerzas inerciales transitorias; en cambio, si es pequeño, dominarán las fuerzas viscosas. De esta forma, el número de Wo tiene en un flujo pulsante un significado análogo al que tiene Re en un flujo continuo, pero en lugar de trabajar con la velocidad media de flujo, emplea la frecuencia del ciclo cardiaco (fc).
Resultados
Las condiciones de control para analizar el comportamiento y precondicionar los vasos yugulares fueron: una cabeza hidrostática en la instalación de 8 mm Hg, equivalente a la presión de fin de diástole en el tracto de salida ventricular, y una presión sistólica máxima de 35 mm Hg a 60 pulsos/min, que corresponden a la presión y la frecuencia a las cuales se ajusta la operación de la bomba hidromecánica al inicio de la prueba.
Los tramos venosos yugulares en ambos estados (frescos y preservados), se probaron simulando las condiciones equivalentes a las del tracto de salida ventricular, y se midieron las variables hidrodinámicas (presión y flujo) a frecuencias de 60, 80 y 100 pulsos/min; se mantuvieron constantes la viscosidad (5 cPo) y la temperatura (370C) del fluido de trabajo.
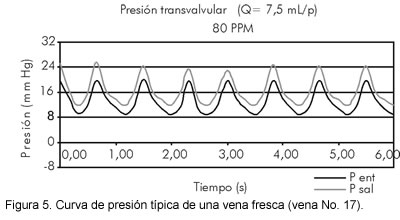
Las venas frescas presentaron un comportamiento muy flexible, es decir, una dilatación y contracción muy pronunciadas. El efecto de la dilatación excesiva es la reducción del flujo anterógrado, aunque se mantiene constante con los cambios de frecuencia; mientras que el efecto de la contracción excesiva provoca un colapso parcial que ayuda a completar el cierre valvular, el cual se manifiesta con una retracción del plano valvular al final de la sístole. Adicionalmente, la pared venosa fresca aporta poca atenuación, por lo que la amplitud de la presión de salida es amplificada, en especial a altas frecuencias (100 pulsos/min), lo que hace difícil determinar el gradiente de presión real con el que opera la válvula. Valga aclarar que la frecuencia cardiaca bovina es de 75 a 80 pulsos/min, lo cual se convierte en otro factor que propicia la resonancia, pues la vena está adaptada a esta frecuencia de operación. El gradiente de presión de la vena fresca es positivo (Figura 5).
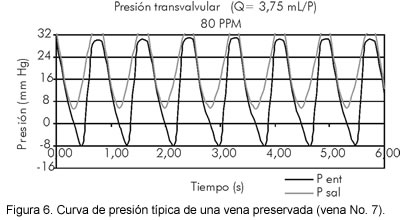
En contraste, las venas preservadas son más rígidas (pierden su carácter viscoelástico) y la presión y el flujo presentaron un comportamiento parecido al de la condición de control, donde la vena es reemplazada por un conducto semi-rígido no valvulado. La dilatación y contracción del vaso son moderadas, por lo que el flujo anterógrado se aproxima al de la condición de control en bajas frecuencias (60 pulsos/min), pero varía con los cambios de frecuencia, y se reduce al aumentar la frecuencia, incluso puede volverse nulo a altas frecuencias (100 pulsos/min). No se presenta la retracción al final de la sístole que caracteriza el cierre súbito de las válvulas frescas. La atenuación aportada por la pared de la vena es moderada, por lo que la amplificación de la presión es menor que en las frescas, pero hay un retraso de la presión de salida con respecto a la de entrada, que no existe en las frescas. El gradiente de presión presenta valores negativos, pero menores que en la condición de control, de manera que es asimétrico con respecto a la cabeza hidrostática (Figura 6).
En algunas de las venas frescas fue necesario volver a ajustar las condiciones de relajación (aumentar flujo de vacío) al aumentar la frecuencia de operación, porque la dilatación excesiva del vaso no permitía la coaptación de las valvas. En las venas preservadas no fue necesario hacer ningún ajuste; una vez precondicionada, enfrentaba los cambios de frecuencia de forma proporcional.
Discusión
Comportamiento de las venas frescas
Las venas frescas, con su excesiva flexibilidad y conducta viscoelástica, interactúan con el flujo pulsante de la siguiente forma:
1. En la sístole, la pared se dilata de manera excesiva y reduce el flujo anterógrado (axial) considerablemente, convirtiéndolo en flujo radial. La poca atenuación de la pared venosa no amortigua los pulsos de presión; se presenta resonancia en todas las frecuencias de prueba, lo cual dificulta la medida de la presión transvalvular, porque amplifica la señal del transductor de salida del vaso en estudio. Con los incrementos de frecuencia la dilatación del vaso aumenta, el gradiente de presión disminuye y el flujo anterógrado, aunque reducido, mantiene un valor casi constante.
2. Durante la diástole, el vaso se contrae rápidamente, absorbiendo la presión de relajación de la bomba hidráulica; se presenta un colapso apreciable a baja frecuencia, mientras que conserva su diámetro de reposo a alta frecuencia.
Con los incrementos de frecuencia, el flujo pulsante tiende a volverse continuo, debido a que la conducta viscoelástica de la vena absorbe las fluctuaciones de presión de la bomba hidráulica. Esta conducta obliga a modificar las condiciones de control tanto al iniciar la prueba (para precondicionar la vena) como al cambiar la frecuencia de trabajo, y modifica los parámetros característicos del cierre valvular.
El flujo radial producido y la presión de relajación de la bomba pulsante, intervienen de manera conjunta en el cierre de la válvula fresca: el flujo radial producido inicia el retroceso de las valvas, donde el exceso de dilatación venosa cumple la función de los senos de Valsalva en las válvulas sigmoideas. El cierre total de la válvula se advierte por un pulso que absorbe la pared venosa y que incluso genera el retroceso del plano valvular cuando es demasiado flexible el vaso. La intensidad del pulso de cierre valvular, disminuye con el incremento de la frecuencia ya que el aumento en la rapidez de las pulsaciones de la bomba, contrarresta el efecto gravitacional por la inercia del fluido.
El cierre de la válvula fresca se manifiesta de tres formas, según la viscoelasticidad de la pared:
1. Si la pared tiene alta rigidez y una composición uniforme, las valvas mantienen su posición al detener súbitamente el flujo retrógrado.
2. Si la pared tiene una rigidez moderada pero su morfología y composición son uniformes, se presenta una retracción del plano valvular por el cierre.
3. Si la vena tiene escasa rigidez, todo el vaso retrocede durante el cierre.
Cuando la pared es muy delgada y flexible y su morfología y composición son irregulares, el exceso de dilatación no permite la coaptación total por acción del flujo retrógrado; entonces es la presión de relajación de la bomba hidráulica la que termina de cerrar la válvula.
Comportamiento de las venas preservadas
Las venas preservadas pierden completamente su carácter viscoelástico; sólo se manifiesta la conducta elástica, mostrando una compliance considerablemente menor (menos flexible) que la de las frescas, de allí que su comportamiento sea parecido al de la condición de control, en la que se reemplazó la vena por un conducto semi-rígido:
1. Durante la sístole, la vena tiene menor distensión, hay menos flujo radial y el flujo anterógrado tiene el mismo comportamiento que el de la condición de control: es alto a baja frecuencia y varía con los cambios de ésta. Con una pared más rígida aumenta la atenuación, eliminando los efectos de la resonancia. El flujo conserva su carácter pulsante a cualquier frecuencia.
2. Durante la diástole, las valvas se cierran parcialmente debido a que la excesiva rigidez de la pared venosa reduce el flujo radial y restringe su movimiento. Esta condición es agravada por el lento movimiento de las valvas, provocado por el aumento del arrastre que generan al volverse más rígidas, debido a que la geometría más definida que adquieren es menos hidrodinámica en un fluido tan viscoso. Esto retarda el cierre valvular, y cuando la válvula venosa permanece abierta, se cierra por acción de la presión de relajación de la bomba hidráulica.
Que la válvula se cierre por efecto de la presión de relajación de la bomba hidráulica, genera un cierre total tardío, que se caracteriza por una presión de salida por debajo de la cabeza hidrostática de prueba.
Con los aumentos de frecuencia se nota la tendencia de la válvula a cerrarse por efecto del flujo retrógrado, pero con una reducción significativa del flujo, que puede volverse nulo si la vena es muy flexible, pues su respuesta viscoelástica equilibra las presiones de las dos fases del ciclo.
Conclusiones
Las venas yugulares bovinas frescas cuentan con una viscoelasticidad apropiada para actuar con las presiones pulmonares humanas (6-30 mm Hg): las valvas coaptan totalmente debido a que el exceso de dilatación permite la formación del flujo radial con suficiente energía para iniciar el retroceso de las valvas durante la diástole. Tras la severa contracción del vaso las valvas siempre coaptan, aunque tengan una morfología irregular, de manera que el flujo anterógrado es casi constante en todas las frecuencias de prueba, porque el cierre temprano de la válvula evita la superposición de las dos corrientes de flujo (anterógrado y retrógrado) y la coaptación evita la regurgitación.
Aunque el flujo axial de la válvula fresca es menor que el de la preservada, varía poco con los cambios de frecuencia y no es proporcional sólo al diámetro de la vena en reposo, sino a la compliance del vaso. Adicionalmente, el vaso venoso fresco puede amortiguar el flujo pulsante que recibe, convirtiéndolo en continuo cuando opera a altas frecuencias (mayores que 80 pulsos/min), con lo que reduce el esfuerzo de flujo en el árbol vascular pulmonar.
En cambio, en las válvulas preservadas se altera drásticamente la viscoelasticidad de la pared y la vena responde con la elasticidad de los materiales inertes. Este aumento de la rigidez de la pared reduce la distensión del vaso, disminuyendo el flujo radial a las presiones pulmonares; esto dificulta el posterior cierre de la válvula, porque el flujo radial no tiene la energía suficiente para enfrentar el arrastre que opone el fluido viscoso al movimiento de las valvas, y las valvas mismas más rígidas y geométricamente más definidas se oponen al flujo retrógrado, limitando la coaptación. Además, la pulsación en el vaso preservado se mantiene en cualquier frecuencia, transmitiéndose directamente al árbol vascular pulmonar el esfuerzo de flujo que recibe, sin previa amortiguación.
Las válvulas frescas funcionan de manera apropiada a las presiones pulmonares, cumpliendo las condiciones hidráulicas del flujo pulsante para reemplazar la válvula pulmonar. En cambio, las preservadas presentan un cierre parcial a las presiones pulmonares, propiciando la regurgitación, en especial a medida que aumenta la frecuencia, de modo que desde el punto de vista de la hidráulica no se ajustarían a las condiciones funcionales de la válvula pulmonar.
Agradecimientos
Agradecimientos expresos por su participación y apoyo al médico veterinario Francisco Valencia, de la Central Ganadera de Medellín S.A., así como a la enfermera Silvia Medina y a la auxiliar de enfermería Alba Nidia Jiménez, del Laboratorio de Válvulas y Banco de Tejidos de la Clínica Cardiovascular Santa María. Igualmente, al Laboratorio de Operaciones Unitarias de la Universidad Pontificia Bolivariana, donde se realizaron las pruebas de este trabajo. Muy especiales reconocimientos a los cirujanos Alberto Villegas y Jorge Zapata, por su apoyo incondicional en la realización del trabajo.
Bibliografía
1. Hopkins RA. Cardiac reconstructions with allograft valves. 1st. Edition. New York: Springer-Verlag; 1989.
2. Corno A, et al. Bovine jugular vein as right ventricle to pulmonary artery valved conduit. J Heart Valve Disease 2002; 11 (2): 242-248. [ Links ]
3. Corno AF, et al. Glutaraldehyde-fixed bovine jugular vein as a substitute for the pulmonary valve in the Ross operation. J Thorac Cardiovasc Surg 2001; 122 (3): 493-4. [ Links ]
4. Bové T, et al. Early results of valve bovine jugular vein conduit versus bicuspid homograft for right ventricular outflow tract reconstruction. Ann Thorac Surg 2002; 74 (2): 536-541. [ Links ]
5. Bia D et al. In vitro model to study arterial wall dynamics through pressure-diameter relation ship analysis. Latin American Applied Research 2005; 35: 217- 224. [ Links ]
6. Bia D, Bustamante J, Cabrera E, Zócalo Y, Pérez H, Saldias M, et al. Integrated metodology development for vascular and heart valve prosthesis evaluation in tissue banks. Cardiovasc Sciences Forum 2006; 1 (1): 11-29. [ Links ]
7. Hayashi K. Biomechanical response of femoral vein to chronic elevation of blood pressure in rabbits. Am J Physiol Heart and Circulatory Physiology 2003; 284 (2): 511-518. [ Links ]
8. Bustamante J, Valbuena J. Biomecánica cardiovascular. 1ª. Ed. Medellín: Editorial UPB; 1999. p.363. [ Links ]
9. Fung YC. Biomechanics: circulation. Second edition. USA: Springer; 1997. [ Links ]
10. LI, John k-J. Dynamics of the vascular system: Series on Bioengineering & Biomedical Engineering. 1 v. USA: World Scientific; 2004. [ Links ]
11. Bustamante J, Suárez G, Landaeta R. Nuevos recursos para la investigación en el área de la cardiología: técnicas numérico-matemáticas aplicadas al diseño y desarrollo de dispositivos de uso cardiovascular. Rev Fed Arg Cardiol 2005; 34 (3): 350-357. [ Links ]
12. Valbuena J. Instrumentación real y virtual para procesos de flujo. 1ª. Ed. Medellín: Editorial UPB; 2001. p.373. [ Links ]














