Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.14 no.5 Bogota Sep./Oct. 2007
Laboratorio de Investigación en Función Vascular. Fundación Cardioinfantil-Instituto de Cardiología, Bogotá D.C., Colombia.
Correspondencia: Dr. Darío Echeverri, Jefe Laboratorio de Investigación en Función Vascular, Fundación Cardioinfantil-Instituto de Cardiología, Calle 163 A No. 13B-60. Primer piso, Teléfono: (57-1) 6791192 - (57-1) 6672727 Ext. 1114 y 4322, Fax: (57-1) 6690382, correo electrónico: decheverri@cardioinfantil.org, funcionvascular@cardioinfantil.org
Recibido: 09/03/07. Aprobado: 08/08/07.
Resumen: estudios clínicos y experimentales previos, sugieren que los andrógenos podrían tener un efecto adverso, neutral o benéfico, sobre la aterosclerosis y sus manifestaciones clínicas.
Métodos: se realizó un estudio experimental aleatorizado y controlado en 40 conejos de raza Nueva Zelanda. 20 animales se sometieron a orquidectomía y 20 se alimentaron con dieta aterogénica durante 20 semanas. Se distribuyeron en cuatro grupos: 1: no castrados sometidos a dieta normal; 2: castrados sometidos a dieta normal; 3: no castrados sometidos a dieta aterogénica y 4: castrados sometidos a dieta aterogénica. Se hicieron mediciones de colesterol total y testosterona libre. Después de la eutanasia, se cuantificó en aorta la relajación arterial independiente de endotelio y dependiente de endotelio in-vitro, y se hicieron análisis histomorfométricos de la aorta torácica para cuantificar la formación de placa aterosclerótica.
Resultados: los animales sometidos a dieta normal (n=20) tuvieron colesterol total de 51,1 ± 8,5 mg/dL y los sometidos a dieta aterogénica de 429,2 ± 262,0 mg/dL (p < 0,001). Los niveles de testosterona en el grupo no castrados fueron 2,1 ± 0,3 ng/mL y en los castrados 0,8 ± 0,4 ng/ml (p = 0,024).
En conejos no castrados, el efecto de la hipercolesterolemia (366 ± 226,1 mg/dL) fue muy leve en inducir placa aterosclerótica y alteración vascular funcional. En cambio, en conejos castrados la dieta aterogénica indujo un incremento en el colesterol total de 387,6 ± 292,7 mg/dL (p < 0,001), y severos cambios morfológicos como área de placa 2,6 ± 2,3 mm2 (p < 0,001), índice de área de placa/área del vaso de 0,25 ± 0,1 (p < 0,001) e índice de área de la placa/área de la media de 0,4 ± 0,3 (p < 0,001). El porcentaje de relajación independiente de endotelio fue de 85,5 ± 14,3% (p = NS) y el de relajación dependiente de endotelio de 38,5 ± 20,1% (p = 0,03).
Conclusión: en este estudio realizado en conejos, se demuestra que la testosterona endógena podría tener un efecto preventivo sobre la aterosclerosis y favorecer la relajación vascular dependiente de endotelio en presencia de hipercolesterolemia severa.
Palabras clave: andrógenos, aterosclerosis, colesterol, testosterona, endotelio.
Summary: previous clinical and experimental studies suggest that androgens could have an adverse, neutral or beneficial effect on atherosclerosis and its clinical manifestations.
Methods: an experimental, randomized controlled study in 40 New Zealand white male rabbits was realized. 20 rabbits underwent orchiectomy and 20 were fed with an atherogenic diet for 20 weeks.
These were distributed in four groups: 1. non-castrated under normal diet, 2. castrated under normal diet, 3. non-castrated under atherogenic diet, and 4. castrated under atherogenic diet. Total cholesterol and free testosterone were measured. After euthanasia, arterial relaxation independent of endothelium was quantified in aorta, as well as the one depending on endothelium, in vitro, and histomorphometric analysis of thoracic aorta were made in order to quantify the atherosclerotic plaque formation.
Results: animals that had a normal diet (n=20) had total cholesterol of 51.1 ± 8.5 mg/dl and those with atherogenic diet, of 429.2 ± 262.0 mg/dl (p< 0.001). Testosterone levels in the non- castrated group were 2.1 ± 0.3 ng/mL and in the castrated were 0.8 ± 0.4 ng/mL (p= 0.024).
In non-castrated rabbits the effect of hypercholesteremia (366 ± 226.1 mg/dL) inducing atherosclerotic plaque and functional vascular alteration was mild. On the other hand, atherogenic diet in castrated rabbits induced an increment in total cholesterol from 387.6 ± 292.7 mg/dL (p <0.001) and severe morphological changes such as plaque area 2.6 ± 2.3mm² (p <0.001), vessel plaque/area 0.25 ± 0.1 (p <0.001) and area index of plaque/area of the media 0.4 ± 0.3 (p <0.001). Endothelium independent relaxation percentage was 85.5 ± 14.3% (p = NS) and endothelium dependent relaxation was 38.5 ± 20.1% (p = 0.03).
Conclusion: this study realized in rabbits demonstrates that endogenous testosterone might have a preventive effect on atherosclerosis and favor endothelium dependent vascular relaxation in the presence of severe hypercholesterolemia.
Key words: androgens, atherosclerosis, cholesterol, testosterone, endothelium.
Introducción
La enfermedad cardiovascular es la principal causa de muerte e incapacidad en el mundo occidental (1). La mujer sufre enfermedad cerebrovascular 10 a 20 años más tarde que el hombre (2), lo que ha llevado a sustentar por varias décadas la hipótesis que las hormonas ováricas endógenas ofrecen un efecto preventivo en el desarrollo de la enfermedad. De otra parte, estudios clínicos recientes muestran que el reemplazo con terapia hormonal no reduce el riesgo de enfermedad cerebrovascular en la mujer post-menopáusica (3, 4), lo cual sugiere que la reducción de los niveles de estrógenos no es la clave determinante del riesgo de enfermedad cerebrovascular acelerada asociado con la transición menopáusica.
Una hipótesis alternativa para la diferencia de géneros, es que la testosterona desempeña un papel adverso, lo que explica en hombres el mayor riesgo de presentar enfermedad coronaria, ya que los andrógenos en general, y la testosterona en particular se asocian con alto riesgo de enfermedad cerebrovascular en el hombre (5). Sin embargo, los niveles de testosterona no tuvieron relación con eventos cardiovasculares en hombres (6, 7) o mujeres (8), y en estudios sobre niveles endógenos de dehidroepiandrosterona y eventos cardiovasculares, mostraron resultados conflictivos (9). Estudios clínicos prospectivos (10, 11), transversales (12, 13) y experimentales (14-16) sugieren que los andrógenos tienen un efecto neutral o benéfico sobre la aterosclerosis y sus manifestaciones clínicas en el hombre.
En modelos animales, el tratamiento con testosterona tiende a inhibir el desarrollo de la aterosclerosis en conejos machos (17), mientras que en primates no-humanos hembras, induce exacerbación de la aterosclerosis (18), lo cual sugiere efectos específicos de los andrógenos según el género sobre la enfermedad cerebrovascular. Recientemente, se demostró (19) que la castración en un modelo animal de conejos causa un incremento del 100% de aterosclerosis aórtica, por lo que los autores sugieren que la testosterona endógena podría tener un fuerte efecto preventivo sobre la aterosclerosis en hombres.
Tanto para andrógenos de origen testicular como adrenal, se sugieren diferentes mecanismos de acción mediados por vías no-lipídicas (20). En términos de inhibición de la aterosclerosis, varios estudios son consistentes y proveen un soporte claro sobre el impacto benéfico de los andrógenos endógenos sobre el perfil de lípidos y lipoproteínas (21), fibrinógeno (22), agregación plaquetaria (23), efectos anti-inflamatorios, regulación de apoptosis y estabilidad de células de músculo liso vascular (24); además de propiedades vasoactivas directas de relajación vascular como un efecto no-genómico y específico estructural sobre la membrana de células de músculo liso vascular (25).
Con base en la evidencia, aún son controversiales los efectos de los andrógenos sobre la enfermedad cardiovascular. En este estudio, se describen los efectos vasculares morfológicos y funcionales de la castración en un modelo experimental en conejos hipercolesterolémicos y ateroscleróticos.
Metodología
Animales
Este estudio experimental aleatorizado y controlado fue aprobado por el Comité de Ética en Investigación Animal de la Fundación Cardioinfantil. Se emplearon, en total, 40 conejos blancos machos de la raza Nueva Zelanda (de cuatro meses de edad). Después de un período de adaptación de una semana, se sometieron 20 animales bajo anestesia general a orquidectomía (grupo 1) y 20 (20) se utilizaron como grupo control (grupo 2). Después de dos semanas en etapa de recuperación, los 40 animales se dividieron en uatro grupos y se siguieron por un período de 20 semanas.
- Grupo1: no castrados sometidos a dieta normal.
- Grupo 2: castrados sometidos a dieta normal.
- Grupo 3: no castrados sometidos a dieta aterogénica.
- Grupo 4: castrados sometidos a dieta aterogénica.
La dieta aterogénica se obtuvo con suplementos de 0,5% de colesterol (Purina S.A.), y se suministró por períodos de cuatro semanas, alternados con una dieta normal para un total de 20 semanas. Al finalizar se realizó una medición de los niveles de colesterol sérico y de testosterona en muestras plasmáticas antes de la eutanasia en los cuatro grupos.
Eutanasia y preparación del tejido vascular
La eutanasia electiva se realizó al final de un período de observación de 20 semanas usando anestesia general con ketamina (50 mg/kg IM) y una inyección letal de tiopental sódico (Pentothal® USP) 150 mg/kg IV. Inmediatamente después, se removió la aorta de cada conejo. Se aisló el segmento proximal de la aorta torácica para los estudios de relajación vascular in-vitro. El segmento de aorta torácica remanente se mantuvo y se perfundió manualmente con formaldehído en solución buffer-fosfato al 10% a 80 mm Hg por 15 minutos. La porción distal de la aorta torácica, 2 cm por encima de la arteria renal derecha, se cortó en segmentos de 4 mm para análisis histomorfométricos.
Análisis morfométricos
Procesamiento de tejidos
Después de la fijación tisular en formol-bufferado, los segmentos de tejido arterial fueron embebidos en parafina a 56-58ºC. Las secciones se realizaron a 4-µm y se tiñieron con hematoxilina y eosina y por el método de tricrómico elástica. Se hizo un análisis individual de los segmentos utilizando un microscopio de luz (Olympus BX50). Los segmentos se midieron con morfometría digital y planimetría computarizada (Media Cybernetics® Image-Pro Plus TM).
Morfometría
Cada segmento de aorta examinado se localizó sistemáticamente en el centro del campo del objetivo, usando magnificación 2X. El área del vaso corresponde al área comprendida dentro de la lámina elástica externa (mm2), el área del lumen al área dentro de la superficie endotelial (mm2) y el área de la placa aterosclerótica al área comprendida entre la lámina elástica interna y el lumen arterial, cuantificada en mm2. Se realizaron cálculos de índices área de placa aterosclerótica/área del vaso y área de placa aterosclerótica/área de la media.
Vasorreactividad arterial in-vitro
La preparación del segmento arterial para estudio de relajación vascular in-vitro, se efectuó de la manera como se describió previamente (26). Los segmentos de aorta se transportaron al laboratorio para lavarlos y someterlos a disección y limpieza del tejido conectivo exuberante. De cada vaso se obtuvieron ocho anillos. Los segmentos se ubicaron cuidadosamente en recipientes con solución de Krebs-Henseleit con la siguiente composición (en g/L): NaCl 6,9, KCl 0,35, CaCl2 0,37, MgSO4 0,14, NaHCO3 2,1; D-glucosa 2,0 y pH 7,4 ± 0,05. El tiempo que se utilizó entre la obtención del tejido y su preparación fue menor a 15 minutos.
Experimentos con anillos vasculares aislados
Los anillos se suspendieron entre dos asas de alambre en una cámara de vidrio en el equipo de baño de órganos, con 25 mL de solución de Krebs-Henseleit a 37°C y pH 7,40, aireada con O2 al 95% y CO2 al 5%. Uno de los alambres tensores estaba conectado al transductor de fuerza (Kent-Scientific Corporation, Litchfield, CT), y los cambios en fuerza isométrica se recolactaron en un sistema computarizado de registro (Power Lab/4Sp) y en un ambiente de Windows 2000. Se aplicó una tensión progresiva en reposo hasta de 3 g, la cual se definió en estudios preliminares y cada anillo vascular se dejó suspendido en dicho sistema durante aproximadamente 45 a 60 minutos.
Evaluación de la relajación vascular
La relajación independiente de endotelio se evaluó por medio de dosis acumulativas (10–8 a 10–4 M) de nitroglicerina en anillos precontraídos con norepinefrina 3,16 x 10–6 M. La relajación dependiente de endotelio se evaluó utilizando acetilcolina 3,16 x 10–6 M en anillos precontraídos con norepinefrina 3,16 x 10–6 M. En cada anillo de aorta se administró solamente un tratamiento (acetilcolina o nitroglicerina).
Análisis estadísticos
Los datos se presentan como el promedio ± la desviación estándar. Para evaluar las diferencias entre los grupos (en los niveles de colesterol sérico y testosterona, así como las diferencias en la morfometría entre los dos grupos (orquidectomizados y no orquidectomizados), se realizaron pruebas U de Mann Whitney. Se utilizó un análisis t de student para determinar las diferencias en la vasorreactividad entre los dos grupos. Se promediaron los resultados para cada animal y el nivel de significancia se estableció con un valor de p £ 0,05. Se empleó el programa estadístico SPSS 12,0.
Aspectos éticos
Se siguieron los lineamientos del Ministerio de Salud de Colombia para la investigación biomédica en animales (Resolución No 008430, octubre de 1993), así como también se acataron las normas institucionales del Comité de Ética para la Investigación Animal de la Fundación Cardioinfantil.
Resultados
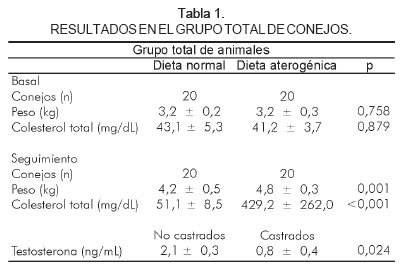
En el ingreso al estudio los animales sometidos a una dieta normal (n=20) tuvieron un peso de 3,2 ± 0,2 kg y valores de colesterol total de 43,1 ± 5,3 mg/dL. Los animales sometidos a una dieta aterogénica (n = 20) tuvieron un peso de 3,2 ± 0,3 kg (p = 0,758) y valores de colesterol total de 41,2 ± 3,7 mg/dL (p = 0,879). Todos los animales terminaron la observación por las 20 semanas, al cabo de las cuales aquellos sometidos a una dieta normal tuvieron un peso de 4,2 ± 0,5 kg y valores de colesterol total de 51,1 ± 8,5 mg/dL y los animales sometidos a dieta aterogénica tuvieron un peso de 4,8 ± 0,3 kg (p < 0,001) y valores de colesterol total de 429,2 ± 262,0 mg/dL (p < 0,001).
Los animales que fueron sometidos a castración no presentaron complicaciones locales durante el seguimiento. Los niveles de testosterona al final de las 20 semanas de seguimiento en el grupo de animales no castrados fueron de 2,1 ± 0,3 ng/mL y en el grupo de animales castrados de 0,8 ± 0,4 ng/mL (p < 0,024) (Tabla 1).
Resultados en conejos no castrados
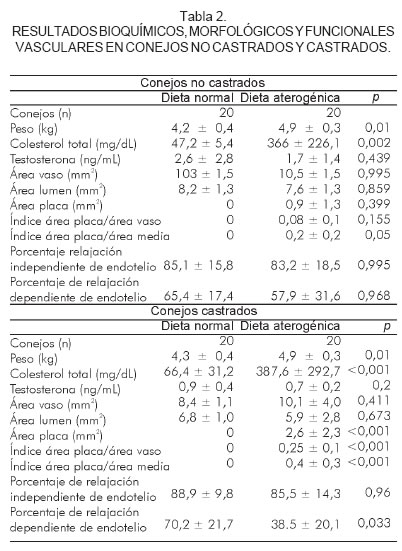
Al finalizar la observación a las 20 semanas, los conejos no castrados y alimentados con una dieta normal tuvieron un peso de 4,2 ± 0,4 kg, colesterol total 47,2 ± 5,4 mg/dL y testosterona 2,6 ± 2,8 ng/mL. La medidas histomorfométricas mostraron un área del vaso de 10,3 ± 1,5 mm2, área del lumen de 8,2 ± 1,3 mm2, y área de placa de 0,0 mm2. El porcentaje de relajación independiente de endotelio obtenido fue de 85,1 ± 15,8% y de relajación dependiente de endotelio de 65,4 ± 17,4%.
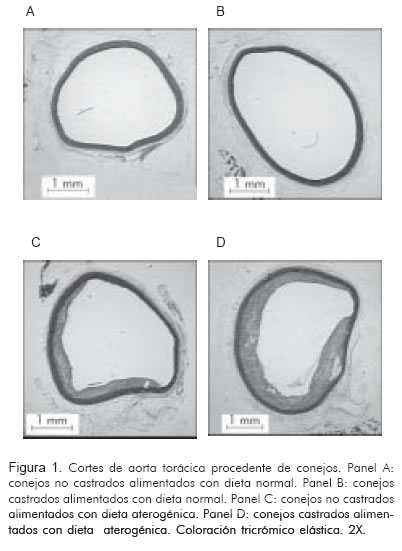
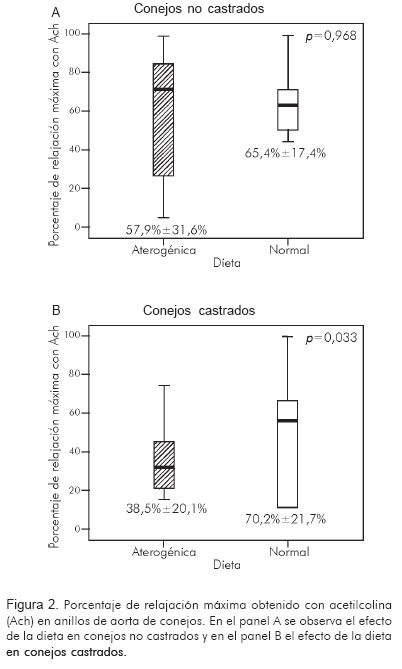
Al finalizar la observación por las 20 semanas, los conejos no castrados y alimentados con una dieta aterogénica tuvieron un peso de 4,9 ± 0,3 kg (p< 0,01), colesterol total 366 ± 226,1 mg/dL (p < 0,002) y testosterona 1,7 ± 1,4 ng/mL (p = NS). Las medidas histomorfométricas mostraron un área del vaso de 10,5 ± 1,5 mm2 (p = NS), área del lumen 7,6 ± 1,3 mm2 (p = NS) y área de placa 0,9 ± 1,3 mm2 (p = NS), índice de área de placa/área del vaso de 0,08 ± 0,01 (p = NS) e índice de área de la placa/área de la media de 0,2 ± 0,2 (p = 0,05) (Figura 1). El porcentaje de relajación independiente de endotelio obtenido fue de 83,2 ± 18,5% (p = NS) y el de relajación dependiente de endotelio fue de 57,9 ± 31,6% (p = NS) (Tabla 2).
Resultados en conejos castrados
Al finalizar la observación por las 20 semanas, los conejos castrados y alimentados con una dieta normal tuvieron un peso de 4,3 ± 0,4 kg, colesterol total 66,4 ± 31,2 mg/dL y testosterona de 0,9 ± 0,4 ng/mL. Las medidas histomorfométricas mostraron un área del vaso de 8,4 ± 1,1 mm2, área del lumen de 6,8 ± 1,0 mm2 y área de placa 0,0 mm2. El porcentaje de relajación independiente de endotelio obtenido fue de 88,9 ± 9,8% y de relajación dependiente de endotelio fue 70,2 ± 21,7%.
Al finalizar la observación por las 20 semanas, los conejos castrados y alimentados con una dieta aterogénica tuvieron un peso de 4,9 ± 0,3 kg (p < 0,01), colesterol total de 387,6 ± 292,7 mg/dL (p < 0,001) y testosterona de 0,7 ± 0,2 ng/mL (p = NS). Las medidas histomorfométricas mostraron un área del vaso de 10,1 ± 4,0 mm2 (p = NS), área del lumen 5,9 ± 2,8 mm2 (p = NS), área de placa 2,6 ± 2,3 mm2 (p < 0,001), índice de área de placa/área del vaso de 0,25 ± 0,1 (p < 0,001) e índice de área de la placa/área de la media de 0,4 ± 0,3 (p < 0,001) (Figura 1). El porcentaje de relajación independiente de endotelio obtenido fue de 85,5 ± 14,3% (p = NS) y de relajación dependiente de endotelio de 38,5 ± 20,1% (p = 0,03) (Tabla 2, figura 2).
Discusión
Los resultados del estudio en conejos con aterosclerosis, demuestran que los andrógenos endógenos circulantes se reducen de forma significativa con la castración y que esta condición en presencia de hipercolesterolemia inducida por una dieta aterogénica, favorece la mayor formación de placa aterosclerótica en la aorta torácica (290%) y una reducción severa de la vasodilatación arterial dependiente de endotelio (33,5%) en comparación con conejos no castrados y sometidos a la misma dieta, lo que sugiere que la testosterona endógena podría tener un fuerte efecto preventivo sobre la aterosclerosis. La castración no afectó los niveles de colesterol total en forma significativa ni perturbó de manera adversa la formación de placa ni la función vascular en conejos con dieta normal.
Niveles de colesterol
La influencia de andrógenos sobre lípidos séricos y lipoproteínas en hombres, permanece en controversia. Las diferencias entre especies, géneros y diseños de los estudios utilizados incluyendo dosis y ruta de administración de las hormonas, han desempeñado un papel esencial para estas discrepancias en el perfil de lípidos. Estudios experimentales (27, 28) y clínicos (29, 30) dan soporte al impacto benéfico de los andrógenos endógenos sobre los lípidos séricos y las lipoproteínas.
Formación de placa aterosclerótica
Estudios clínicos (31-33) y experimentales (34-36) sugieren que los andrógenos tienen un efecto neutral o benéfico sobre la génesis de la aterosclerosis. Aún no se ha investigado el efecto de la testosterona sobre la enfermedad cerebrovascular en hombres, en estudios clínicos, ciegos y controlados. Alexandersen y colaboradores (19), tuvieron la hipótesis que los andrógenos endógenos tienen un efecto preventivo, similar al efecto de los estrógenos. Por primera vez se demostró que la castración per se resulta en un incremento del 100% en la presencia de aterosclerosis aórtica en conejos ateroscleróticos, lo que sugirió, así como con nuestros resultados, que la testosterona endógena podría tener un efecto preventivo en la formación de aterosclerosis.
En hombres, se describe un efecto benéfico de la testosterona y la DHEA sobre los factores de riesgo cardiovascular (34, 35). Existe evidencia acerca de un papel protector de las hormonas sexuales endógenas y de la terapia estrogénica en el desarrollo de la aterosclerosis (36, 37). Van den Beld y colaboradores (38) describieron en 403 hombres (73-94 años) que los niveles de testosterona endógena, estrona y IGF-1 libre pueden tener un rol protector en el desarrollo de la aterosclerosis medida en el grosor íntima-media en arterias carótidas por ultrasonido. En un estudio poblacional (39), los niveles de testosterona sérica mostraron una relación inversa y correlación independiente con la presencia de placas aórticas calcificadas y progresión de aterosclerosis.
Se especula que la modulación de lipoproteínas probablemente es uno de los tantos mecanismos por los cuales los andrógenos endógenos en dosis farmacológicas previenen la aterosclerosis. Tanto para andrógenos de origen testicular como adrenal, se sugieren varios mecanismos de acción mediados por vías no-lipídicas (20). La conversión de testosterona a estrógenos por vía de la aromatasa, puede cumplir un papel en el efecto protector del reemplazo con andrógenos sobre la aterosclerosis (37), lo cual tiene soporte en la demostración de la actividad de la aromatasa en células de músculo liso vascular de ratas en cultivo (40). Otros posibles mecanismos de los andrógenos, podrían incluir efectos anti-inflamatorios, regulación de apoptosis y estabilidad de las células de músculo liso vascular (41).
Función endotelial in-vitro
Así como en nuestra observación, estudios previos realizados en animales demostraron que la testosterona actúa como un vasodilatador arterial directo en varias especies, incluyendo conejos, perros, cerdos y ratas; tanto en experimentos in-vivo (42, 43) como in-vitro (44-46).
La testosterona exhibe la acción vasodilatadora en arterias musculares y elásticas en diferentes especies. Otros estudios experimentales (45-47) informan que la vasodilatación inducida por testosterona, puede ocurrir dependiente e independiente de endotelio e involucrar la activación de canales de K+ en células de músculo liso vascular. Yildiz y colaboradores (48), demostraron recientemente el efecto vasodilatador de la testosterona en la arteria mamaria interna de humanos, utilizando concentraciones suprafisiológicas, lo que sugirió que la vasodilatación que se obtiene es dependiente de endotelio y mediada en parte por la activación de canales de K+ dependientes de Ca++.
Mecanismos de acción de los andrógenos
Avances en el conocimiento de la fisiología de los andrógenos, muestran luces acerca de nuevos mecanismos que podrían ser cruciales para el mejor entendimiento de la acción sobre la vasculatura. La regulación genómica, es la vía clásica de acción de los andrógenos, involucrando la unión de los esteroides a receptores de andrógenos y activando un factor de transcripción sobre el genoma (49). Los efectos no-genómicos tienen la capacidad de involucrar una inducción de señales y cascadas de transducción, incluyendo movilización de calcio citosólico, activación de proteín kinasa A, proteín kinasa C y MAPK, llevando a diversos efectos celulares incluyendo relajación de células de músculo liso vascular, transmisión neuromuscular, señales intercelulares y plasticidad neuronal (50).
La activación metabólica de los andrógenos es una de las claves en el efecto biológico de la testosterona; ésta consiste en la conversión a metabolitos bioactivos aunque solamente una pequeña fracción (<5%) de la testosterona sufre la transformación en tejidos locales (51).
De acuerdo con estudios de inmunorreactividad en tejido vascular, se ha identificado el tipo 1 y tipo 2 de la 5a reductasa (52). La conversión de testosterona a estradiol por la enzima aromatasa (CYP19) diversifica la acción de los andrógenos activando receptores de estrógenos. La expresión del gen de la aromatasa (53), actividad proteica y actividad enzimática (54) han sido detectados en tejido vascular.
Los receptores de andrógenos son expresados por las células de la vasculatura, incluyendo células endoteliales, células de músculo liso vascular, fibras del miocardio, macrófagos y plaquetas. Su contenido ha sido similar tanto en ratas machos como hembras (55) y en conejos (56). Mayores expresiones de receptores se han relacionado con mayor adhesión de monocitos circulantes al endotelio y formación de células espumosas en la estría grasa, lo cual favorece la expresión de moléculas de adhesión (VCAM-1) (57). El tratamiento con testosterona de macrófagos murinos, inhibe la liberación de nitritos por vía de la NOS inducible (iNOS), aunque el mecanismo exacto de acción se desconoce (58). Esta inhibición de la iNOS puede incrementar la agregación plaquetaria y el riesgo de trombosis asociado con el tratamiento con andrógenos por eliminación del efecto antiagregante del NO.
Conclusión
En este estudio, utilizando un modelo animal de aterosclerosis reconocido, conejos adultos castrados hipercolesterolémicos, se demuestra que la testosterona endógena podría tener un fuerte efecto preventivo sobre la aterosclerosis y favorecer la relajación vascular dependiente de endotelio. Pese a que la evidencia sugiere que los niveles normales de andrógenos podrían proteger al hombre del desarrollo de la aterosclerosis, se requieren nuevos estudios experimentales y clínicos para explorar el efecto anti-aterogénico de los andrógenos endógenos.
Agradecimientos
Los autores agradecen a Agrinal-Purina S.A. por el soporte con la dieta de los animales; a Marcela Beltrán (MSc.) por su ayuda en la recolección de resultados. Así mismo, a los Drs. Ingrid Mejía y Javier Guzmán por el cuidado diario de los animales y el soporte técnico, y al Dr. Carlos Salgar por su colaboración en el manuscrito.
Bibliografía
1. Rosamond W, Flegal K, Friday G, et al. for the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart Disease and Stroke Statistics-2007 Update A Report From the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Circulation 2007; 115 (5): e69-171. [ Links ]
2. Multiple Risk Factor Intervention Trial Research Group. Multiple Risk Factor Intervention Trial: risk factor changes in mortality results. JAMA 1982; 248: 1465-1470. [ Links ]
3. Hulley S, Grady D, Bush T, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women; Heart and Estrogen/progestin Replacement Study (HERS) Research Group. JAMA 1998; 280 (7): 605-613. [ Links ]
4. Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288: 321-333. [ Links ]
5. Kalin MF, Zumoff B. Sex hormones and coronary disease: a review of the clinical studies. Steroids 1990; 55 (8): 330-52. [ Links ]
6. Phillips GB, Yano K, Stemmermann GN. Serum sex hormone levels and myocardial infarction in the Honolulu Heart Program. Pitfalls in prospective studies on sex hormones. J Clin Epidemiol 1998; 41 (12): 1151-1156. [ Links ]
7. Yarnell JW, Beswick AD, Sweetnam PM, Riad-Fahmy D. Endogenous sex hormones and ischemic heart disease in men. The Caerphilly prospective study. Arterioscler Thromb 1993; 13 (4): 517-520. [ Links ]
8. Barrett-Connor E, Goodman-Gruen D. Prospective study of endogenous sex hormones and fatal cardiovascular disease in postmenopausal women. BMJ 1995; 311: 1193-1196. [ Links ]
9. Barrett-Connor E, Goodman-Gruen D. The epidemiology of DHEAS and cardiovascular disease. Ann N Y Acad Sci 1995; 774: 259-270. [ Links ]
10. Barrett-Connor E, Khaw KT. Endogenous sex hormones and cardiovascular disease in men: a prospective population-based study. Circulation 1988; 78 (3): 539-545. [ Links ]
11. Yarnell JWG, Beswick AD, Sweetnam PM, Riad-Fahmy D. Endogenous sex hormones and ischemic heart disease in men. The Caerphilly Prospective Study. Arterioscler Thromb 1993; 13 (4): 517-520. [ Links ]
12. Mitchell LE, Sprecher DL, Borecki IB, Rice T, Laskarzewski PM. Evidence for an association between dehydroepiandrosterone sulfate and non-fatal, premature myocardial infarction in males. Circulation 1994; 89 (1): 89-93. [ Links ]
13. Marques-Vidal P, Sie P, Cambou J-P, Chap H, Perret B. Relationships of plasminogen activator inhibitor activity and lipoprotein (a) with insulin, testosterone, 17b-estradiol, and testosterone binding globulin in myocardial infarction patients and healthy controls. J Clin Endocrinol Metab 1995; 80 (6): 1794-1798. [ Links ]
14. Larsen BA, Nordestgaard BG, Stender S, Kjeldsen K. Effect of testosterone on atherogenesis in cholesterol-fed rabbits with similar plasma cholesterol levels. Atherosclerosis 1993; 99: 79-86. [ Links ]
15. Gordon GB, Bush DE, Weisman HF. Reduction of atherosclerosis by administration of dehydroepiandrosterone: a study in the hypercholesterolemic New Zealand white rabbit with aortic intimal injury. J Clin Invest 1988; 82: 712-720. [ Links ]
16. Eich DM, Nestler JE, Johnson DE, et al. Inhibition of accelerated coronary atherosclerosis with dehydroepiandrosterone in the heterotopic rabbit model of cardiac transplantation. Circulation 1993; 8: 261-269. [ Links ]
17. Bruck B, Brehme U, Gugel N, et al. Gender-specific differences in the effects of testosterone and estrogen on the development of atherosclerosis in rabbits. Arterioscler Thromb Vasc Biol 1997; 17: 2192-2199. [ Links ]
18. Adams MR, Williams JK, Kaplan JR. Effects of androgens on coronary artery atherosclerosis and atherosclerosis-related impairment of vascular responsiveness. Arterioscler Thromb Vasc Biol 1995; 15: 562-570. [ Links ]
19. Alexandersen P, Haarbo J, Byrjalsen I, Lawaetz H, Christiansen C. Endogenous androgens inhibit male atherosclerosis. A study in castrated, cholesterol-fed rabbits. Circ Res 1999; 84 (7): 813-819. [ Links ]
20. Alexandersen P, Haarbo J, Christiansen C. The relationship of endogenous androgens to coronary heart disease in males: a review. Atherosclerosis 1996; 125 (1): 1-13. [ Links ]
21. Ben-David M, Dikstein S, Bismuth G, Sulman FG. Anti-hypercholesterolemic effect of dehydroepiandrosterone in rats. Proc Soc Exp Biol Med 1967; 125: 1136-1140. [ Links ]
22. Phillips GB, Pinkernell BH, Jing TY. The association of hyperestrogenemia with coronary heart disease in men. Arterioscler Thromb 1994; 14: 701-706. [ Links ]
23. Jesse R, Nestler J, Eich D, Hess M. Dehydroepiandrosterone in vivo and in vitro inhibits platelet aggregation. J Am Coll Cardiol 1991; 17: 376A. [ Links ]
24. Malkin CJ, Pugh PJ, Jones RD, et al. Testosterone as a protective factor against atherosclerosis-immunomodulation and influence upon plaque development and stability. J Endocrinol 2003; 178: 373-380. [ Links ]
25. Ding AQ, Stallone JN. Testosterone-induced relaxation of rat aorta is androgen structure specific and involves K+ channel activation. J Appl Physiol 2001; 91: 2742-2750. [ Links ]
26. Huraux C, Makita T, Montes F, Szlam F, Levy JH. A comparative evaluation of the effects of multiple vasodilators on human internal mammary artery. Anesthesiology 1998; 88 (6): 1654-1659. [ Links ]
27. Gordon GB, Bush DE, Weisman HF. Reduction of atherosclerosis by administration of dehydroepiandrosterone: a study in the hypercholesterolemic New Zealand white rabbit with aortic intimal injury. J Clin Invest 1988; 82: 712-720. [ Links ]
28. Ben-David M, Dikstein S, Bismuth G, Sulman FG. Anti-hypercholesterolemic effect of dehydroepiandrosterone in rats. Proc Soc Exp Biol Med 1967; 125: 1136-1140. [ Links ]
29. Ellyin FM. The long term beneficial effect of low dose testosterone in the aging male. In: The Endocrine Society 77th Annual Meeting Program and Abstracts. Washington, DC: The Endocrine Society Press; 1995: 322. Abstract P2-127. [ Links ]
30. Uyanik BS, Ari Z, Gumus B, Yigitoglu MR, Arslan T. Beneficial effects of testosterone on the lipoprotein profile in healthy elderly men: a placebo controlled study. Jpn Heart J 1997; 38: 73-82. [ Links ]
31. Yarnell JWG, Beswick AD, Sweetnam PM, Riad-Fahmy D. Endogenous sex hormones and ischemic heart disease in men. The Caerphilly Prospective Study. Arterioscler Thromb 1993; 13: 517-520. [ Links ]
32. Phillips GB, Pinkernell BH, Jing TY. The association of hypotestosteronemia with coronary artery disease in men. Arterioscler Thromb 1994; 14: 701-706. [ Links ]
33. Mitchell LE, Sprecher DL, Borecki IB, Rice T, Laskarzewski PM. Evidence for an association between dehydroepiandrosterone sulfate and non-fatal, premature myocardial infarction in males. Circulation 1994; 89: 89-93. [ Links ]
34. Barrett-Connor E, Goodman-Gruen D. The epidemiology of DHEAS and cardiovascular disease. Ann N Y Acad Sci 1995; 774: 259-270. [ Links ]
35. Herrington DM. Dehydroepiandrosterone and coronary atherosclerosis. Ann N Y Acad Sci 1995; 774: 271-280. [ Links ]
36. Grady D, Rubin SM, Petitti DB, et al. Hormone therapy to prevent disease and prolong life in postmenopausal women. Ann Intern Med 1992; 117: 1016-1037. [ Links ]
37. Van der Schouw YT, Van der Graaf Y, Steyerberg EW, et al. Age at menopause as a risk factor for cardiovascular mortality. Lancet 1996; 347: 714-718. [ Links ]
38. Van den Beld AW, Bots ML, Janssen JAMLL, Pols HAP, Lamberts SWJ, Grobbee DE. Endogenous hormones and carotid atherosclerosis in elderly men. Am J Epidemiol 2003; 157: 25-31. [ Links ]
39. Hak AE, Witteman JC, de Jong FH, et al. Low levels of endogenous androgens increase the risk of atherosclerosis in elderly men: the Rotterdam study. J Clin Endocrinol Metab 2002; 87: 3632-3639. [ Links ]
40. Simpson ER, Zhao Y, Agarwal VR, Michael MD, Bulun SE, Hinshelwood MM, Graham-Lorence S, Sun T, Fisher CR, Qin K, Mendelson CR. Aromatase expression in health and disease. Recent Prog Horm Res 1997; 52: 185-213. [ Links ]
41. Malkin CJ, Pugh PJ, Jones RD, et al. Testosterone as a protective factor against atherosclerosis-immunomodulation and influence upon plaque development and stability. J Endocrinol 2003; 178 (3): 373-380. [ Links ]
42. Chou TM, Sudhir K, Hutchison SJ, et al. Testosterone induces dilation of canine coronary conductance and resistance arteries in vivo. Circulation 1996; 94: 2614-2619. [ Links ]
43. Murphy JG, Khalil RA. Decreased [Ca(2+)](i) during inhibition of coronary smooth muscle contraction by 17beta-estradiol, progesterone, and testosterone. J Pharmacol Exp Ther 1999; 291: 44-52. [ Links ]
44. Crews JK, Khalil RA. Antagonistic effects of 17 beta-estradiol, progesterone, and testosterone on Ca2+ entry mechanisms of coronary vasoconstriction. Arterioscler Thromb Vasc Biol 1999; 19: 1034-1040. [ Links ]
45. Deenadayalu VP, White RE, Stallone JN, et al. Testosterone relaxes coronary arteries by opening the large-conductance, calcium-activated potassium channel. Am J Physiol Heart Circ Physiol 2001; 281: H1720-H1727. [ Links ]
46. English KM, Jones RD, Jones TH, et al. Testosterone acts as a coronary vasodilator by a calcium antagonistic action. J Endocrinol Invest 2002; 25: 455-458. [ Links ]
47. Tep-areenan P, Kendall DA, Randall MD. Testosterone-induced vasorelaxation in the rat mesenteric arterial bed is mediated predominantly via potassium channels. Br J Pharmacol 2002; 135: 735-740. [ Links ]
48. Yildiz O; Seyrek M, Gul H, et al. Testosterone relaxes human internal mammary artery In-Vitro. J Cardiovasc Pharmacol 2005; 45: 580-585. [ Links ]
49. Quigley CA, De Bellis A, Marschke KB, El-Awady MK, Wilson EM, French FS. Androgen receptor defects: historical, clinical and molecular perspectives. Endocr Rev 1995; 16 (3): 271-321. [ Links ]
50. Heinlein CA, Chang C. The roles of androgen receptors and androgen-binding proteins in nongenomic androgen actions. Mol Endocrinol 2002; 16 (10): 2181-2187. [ Links ]
51. Liu PY, Death AK, Handelsman DJ. Androgens and cardiovascular disease. Endocrine Reviews 2005; 24 (3): 313-340. [ Links ]
52. Eicheler W, Dreher M, Hoffmann R, Happle R, Aumuller G. Immunohistochemical evidence for differential distribution of 5a reductase isoenzymes in human skin. Br J Dermatol 1995; 133: 371-376. [ Links ]
53. Harada N, Sasano H, Murakami H, Ohkuma T, Nagura H, Takagi Y. Localized expression of aromatase in human vascular tissues. Circ Res 1999; 84: 1285-1291. [ Links ]
54. Sowers M, Derby C, Jannausch ML, Torrens JI, Pasternak R. Insulin resistance, hemostatic factors, and hormone interactions in pre and perimenopausal women: SWAN. J Clin Endocrinol Metab 2003; 88: 4904-4910. [ Links ]
55. Knauthe R, Diel P, Hegele-Hartung C, Engelhaupt A, Fritzemeier KH. Sexual dimorphism of steroid hormone receptor messenger ribonucleic acid expression and hormonal regulation in rat vascular tissue. Endocrinology 1996; 137: 3220-3227. [ Links ]
56. Tamaya T, Misao R, Nakagawa M, Itoh T, Wada K, Fujimoto J, Imai A. Estrogen and androgen receptors in aorta of the rabbit and regulation by estrogen and androgen. Res Commun Chem Pathol Pharmacol 1993; 82 (1): 3-11. [ Links ]
57. Libby P. Current concepts of the pathogenesis of the acute coronary syndromes. Circulation 2001; 104 (3): 365-372. [ Links ]
58. Friedl R, Brunner M, Moeslinger T, Spieckermann PG. Testosterone inhibits expression of inducible nitric oxide synthase in murine macrophages. Life Sci 2000; 15; 68 (4): 417-429. [ Links ]














