Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Cardiología
Print version ISSN 0120-5633
Rev. Col. Cardiol. vol.14 no.5 Bogota Sep./Oct. 2007
-Estado del arte-
Parte 1 - Aneurismas de aorta abdominal
Part 1 - Aneurysms of abdominal aorta
Departamento de Hemodinamia y Cardiología Intervencionista, Fundación Clínica Abood Shaio. Bogotá, DC., Colombia.
Correspondencia: Carlos E. Uribe, MD. Clínica Cardiovascular Santa María, Departamento de Hemodinámica y Cardiología Intervencionista, Calle 78B No. 75-21, Medellín, Colombia. Correo electrónico: uribemd72@hotmail.com
Recibido: 02/11/06. Aprobado: 14/06/07.
En la actualidad, el tratamiento endovascular de las patologías de aorta es una alternativa a la cirugía abierta. Éste ha demostrado ser seguro ya que arroja resultados iguales o superiores que el grupo quirúrgico.
En este artículo se presenta el estado actual del tratamiento con endoprótesis de las patologías de aorta, así como las indicaciones, las contraindicaciones y el futuro del tratamiento con este tipo de dispositivos.
Palabras clave: endoprótesis, estado del arte, indicaciones, contraindicaciones, evaluación, aneurismas de aorta, disección de aorta.
Endovascular treatment of aortic pathologies is actually an alternative to open surgery. It has proven to be safe, showing similar or better results to those achieved by surgery.
In this article, treatment of aortic pathologies by means of endoprosthesis is presented, as well as its indications, contraindications and future treatment with this kind of devices.
Key words: endoprosthesis, state of the art, indications, contraindications, evaluation, aortic aneurysms, aortic dissection.
Introducción
La primera cirugía abierta exitosa para el reparo de un aneurisma de aorta abdominal, fue realizada por Dubost en 1952 (1). Desde entonces, las mejorías en las técnicas quirúrgicas han reportado, en las series modernas, una mortalidad quirúrgica del 1% al 5%. No obstante, existen otros riesgos diferentes a la mortalidad cuando se realiza una laparotomía mayor; éstos incluyen complicaciones mayores (20% a 40%), hospitalización prolongada (5 a 10 días), recuperación prolongada (2 a 5 meses) y disfunción sexual (60% al 80%) (2, 3). Además, hay pacientes con comorbilidades serias que los hacen candidatos no opcionales a cirugía. Estas razones hicieron que se desarrollaran métodos alternativos para el tratamiento de los aneurismas de aorta.
Juan Parodi dio inicio al desarrollo de la técnica endovascular para el reparo de aneurismas, con el primer reporte de un implante de endoprótesis de aorta en 1991. Desde aquel momento, comenzaron a desarrollarse materiales y técnicas de manera vertiginosa (4).
De hecho, los estudios realizados a la fecha para el reparo endovascular de los aneurismas de aorta abdominal, demuestran una mortalidad menor a los 30 días y sobrevidas comparables al año contra el grupo quirúrgico, así como menores estancias hospitalarias e incidencia de complicaciones (5-10).
Hasta ahora, la Food and Drug Administration sólo ha aprobado cuatro endoprótesis comerciales para el reparo endovascular de aneurismas de aorta abdominal (2).
Se calcula que en los Estados Unidos de Norte América se han llevado a cabo aproximadamente 20.000 implantes de endoprótesis y 35.000 de ellos se han realizado en el mundo. En solo el 2004, se realizaron más de 8.000 implantes en ese país (11).
Tratamiento endovascular vs. cirugía abierta
Aneurismas de aorta abdominal
La Sociedad Americana de Cirugía Vascular recomienda el tratamiento quirúrgico cuando el aneurisma de aorta abdominal tenga un diámetro superior o igual a 5,5 cm, y hasta ahora, el tratamiento endovascular se rige por estos mismos principios (12).
El registro EUROSTAR, demostró que el tratamiento endovascular de la aorta es seguro, ya que muestra bajas tasas de complicaciones, lo cual lo convierte en una alternativa a la cirugía (14-17).
La controversia actual es saber cuál estrategia de tratamiento ofrece más ventajas para los pacientes. Recientemente, se han publicado los resultados de los estudios EVAR-1 y EVAR-2; el primero comparó la cirugía abierta con el reparo endovascular en 1.082 pacientes aleatorizados con aneurismas de más de 5,5 cm de diámetro, y los resultados mostraron menor mortalidad operatoria a los 30 días en el grupo con endoprótesis (1,7% vs. 4,7%). En el seguimiento a los 4 años este 3% de ventaja se continuó en términos de mortalidad relacionada al aneurisma (4% vs. 7%). Sin embargo, la mortalidad por todas las causas (debidas a aneurisma y por otras circunstancias patológicas de base), fue similar en los dos grupos (100 vs. 109 muertes). Las complicaciones fueron estadísticamente más significativas en el grupo de endoprótesis con 41% vs. 9% en el grupo de cirugía abierta, y la mayoría se explican por parafugas del tipo II y reintervención subsiguiente. Las complicaciones y las reintervenciones en el grupo de cirugía abierta fueron raras. El costo total de la estrategia endovascular fue mayor, debido al seguimiento con métodos de diagnóstico más costosos que el grupo quirúrgico (18-20).
El estudio danés DREAM, mostró resultados muy similares al EVAR-1 con menor mortalidad a corto plazo y estancias hospitalarias, así como menos complicaciones a los 30 días (21). Otro estudio en curso que aportará información adicional a la discusión de cuál estrategia es mejor, es el OVER (The Open versus Endovascular Repair Trial), que lo llevará a cabo el sistema Médico de Veteranos de los Estados Unidos, y esperará reclutar 1.200 pacientes. Las conclusiones de este estudio se anunciarán en el 2009.
Otro punto que ha generado controversia ha sido el resultado que arrojó el estudio EVAR-2, el cual aleatorizó a 338 pacientes de más de 60 años de edad quienes eran candidatos de alto riesgo para la cirugía abierta de aneurisma. Se escogieron dos brazos, uno al que se le implantaron endoprótesis y otro con tratamiento médico solo sin endoprótesis (únicamente observación). La mortalidad operatoria a los 30 días fue del 9% en el grupo de endoprótesis y el riesgo de ruptura sin tratamiento fue de 9 por 100 personas/año. La mortalidad global luego de 3,3 años de seguimiento fue del 64%, sin evidenciar diferencias entre los dos grupos ya fuera mortalidad relacionada al aneurisma o mortalidad por cualquier causa (incluyendo las patologías de base). Los autores concluyen que en pacientes de alto riesgo, se deben compensar las patologías de base del paciente y llevarlos al estado más óptimo posible, antes de realizar el implante de la endoprótesis (19).
Selección del paciente con aneurismas de aorta abdominal
En general, aquellos pacientes que presenten aneurisma de aorta abdominal infra-renal de más de 55 mm de diámetro, son elegibles para la colocación de endoprótesis aórtica (13).
La selección del paciente para endoprótesis se basa en sus condiciones clínicas basales así como en la complejidad técnica para llevar a cabo la implantación del dispositivo (11, 2).
Aquellos pacientes con enfermedad pulmonar obstructiva crónica severa especialmente con VEF 1 menor de 1 litro, o pacientes con enfermedad coronaria y falla renal (creatinina mayor a 1,8), se consideran como de alto riesgo quirúrgico («fisiología de alto riesgo» según el estudio EVAR-2):
1. Pacientes con bajo riesgo quirúrgico y una buena anatomía para colocar endoprótesis.
2. Pacientes con alto riesgo quirúrgico y que presenten una anatomía difícil para la colocación de la endoprótesis.
3. Pacientes con alto riesgo quirúrgico y anatomía fácil (baja complejidad técnica) para la colocación de endoprótesis.
4. En pacientes con una anatomía compleja de alto riesgo para la colocación de la endoprótesis aórtica (alta dificultad técnica) y que sean de bajo riesgo quirúrgico, se aconseja la cirugía abierta.
Según las conclusiones del estudio EVAR-2, los pacientes con alto riesgo quirúrgico deben ser llevados al procedimiento lo más compensados posible ya que estos factores son importantes en la morbilidad y mortalidad durante y después del procedimiento.
No hace falta recalcar que a aquellos pacientes seleccionados para la colocación de endoprótesis de aorta abdominal, se les deben explicar, dentro del consentimiento informado, las ventajas y desventajas de este tratamiento, así como la posibilidad remota de conversión abierta inmediata durante el procedimiento o intervenciones adicionales en un futuro para tratar las parafugas relacionadas, teniendo presente que éstas últimas constituyen la complicación más frecuente en el tratamiento con endoprótesis.
Consideraciones técnicas
Criterios de inclusión (Figura 1)
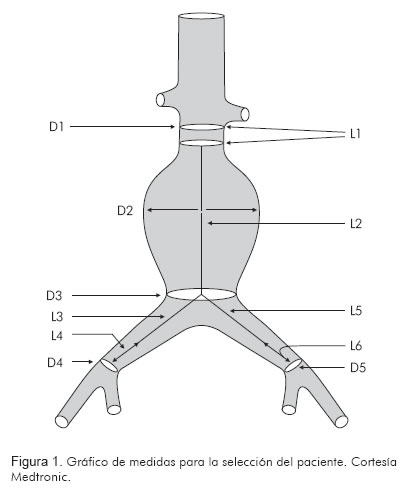
1. Tronco celíaco y arteria mesentérica superior permeables.
2. Longitud del cuello proximal de más de 10 a 15 mm.
3. Angulación del cuello menor a 60° (asociado a menos incidencia de parafugas).
4. Cuello proximal con calcificación o trombo de menor del 25% de la circunferencia.
5. La arteria ilíaca externa debe tener un diámetro mayor a 7 mm.
6. Cuello distal en las arterias ilíacas de más de 10 a 15 mm de longitud.
7. El calcio no debe ser medido o incluido en las mediciones de pared a pared.
8. Los trombos deben ser incluidos en las mediciones de pared a pared.
Evaluación inicial
Siempre se debe evaluar con dos métodos por imagen: tomografía axial computarizada y angiografía con pig tail milimetrada.
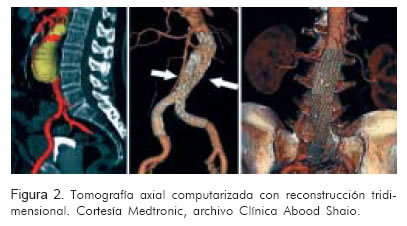
Tomografía axial computarizada abdominal simple y contrastada
Se debe realizar con extensión hasta la división de las arterias femorales, y reconstrucción tridimensional del eje aorto-ilíaco, con cortes mínimo de 2 a 3 mm.
• Desde el origen de la arteria mesentérica superior hasta el inicio de la porción aneurismática, los cortes deben de ser de 2 a 3 mm.
• Desde el aneurisma hasta la división de ambas femorales los cortes pueden ser de a 5 mm.
Ventajas
• Permite evaluar el grado de calcificación y trombosis mural.
• No es invasiva.
• Permite medir las dimensiones requeridas para el implante: ángulos, cuello, diámetro proximal y distal de implantación, y longitud; además, la reconstrucción 3D permite evaluar la relación espacial del cuello y del aneurisma. Algunos software tridimensionales permiten incluso sacar el volumen del aneurisma y hacer seguimiento posterior para ver la regresión del aneurisma (Figura 2).
Desventajas
• Algunos pacientes pueden experimentar alergia al contraste (1% a 2%).
• Existe riesgo de nefropatía por contraste.
• Hay sesgos de sobre-estimación del diámetro del cuello del aneurisma por no procesamiento axial del vaso o del cuello del aneurisma. Esto debe tenerse en cuenta para realizar las correcciones del caso y reprogramar la adquisición de los cortes axiales.
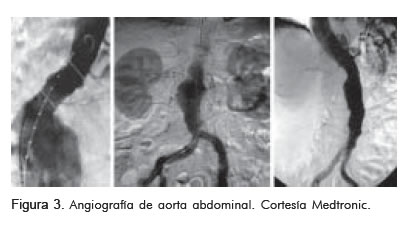
Angiografía
Se debe realizar angiografía antes de la implantación para visualizar los sitios de anclaje proximales y distales.
Su ventaja es la mejor visualización de la estenosis aorto-ilíaca y de sus ramas principales.
Su desventaja es la falta de visualización del calcio y de los trombos, lo que no permite calcular el diámetro del cuello, de manera tan precisa como lo hace la tomografía axial computarizada (Figura 3).
Resonancia magnética nuclear
Ésta es una alternativa a la tomografía axial computarizada.
Ventajas (Figura 4)
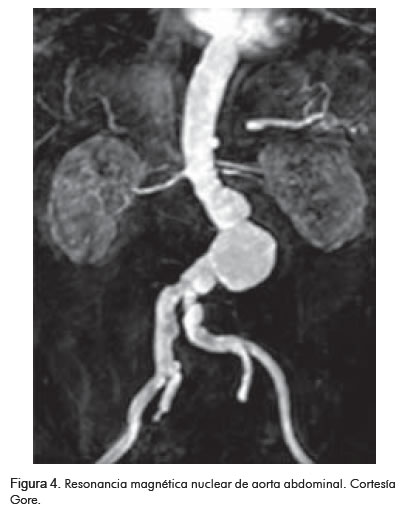
• No utiliza agentes de contraste nefrotóxicos.
• No utiliza radiación.
• No es invasiva.
• Genera reconstrucciones 3D de la aorta abdominal y sus ramas.
Desventajas
• En 10% a 15% de los pacientes, la resonancia no se puede realizar debido a implantes metálicos, artefactos o intolerancia al procedimiento mismo (claustrofobia).
• Es más costosa que la tomografía axial computarizada.
• No es adecuada para ver la calcificación de las paredes arteriales.
• Aún es dependiente del técnico encargado y su protocolo no está estandarizado para aneurismas de aorta abdominal.
Ultrasonido
Es útil únicamente como tamizaje para pacientes con sospecha de aneurismas de aorta abdominal y no permite determinar de manera exacta la longitud o los diámetros de las arterias de interés (Figura 5).
Marcas comerciales de endoprótesis de AAA
Medtronic AneuRx (Figura 6)

Está disponible en Colombia bajo el nombre de Talent, con ligeras modificaciones con respecto al AneuRx y un sistema de entrega diferente (Xcelerant), pues ésta emplea stents de nitinol en todo su recorrido como mecanismo de fijación y soporte de su estructura.
Es un dispositivo modular, compuesto por un cuerpo principal y uno menor en la rama lateral de la extremidad. Su principal ventaja es su versatilidad con múltiples tamaños proximales y distales con longitudes diferentes para acomodarse a los contornos de los diferentes cuellos. La última generación de estos dispositivos incluye dacrón de alta densidad para eliminar las parafugas tipo IV.
Gore Excluder (Figura 7)

Las endoprótesis Excluder son unas de las más utilizadas en Colombia. Emplean una estructura de nitinol y no poseen suturas de fijación al material.
Están hechas de PTFE, lo que las hace más impermeables y se evitan las parafugas tipo IV. Una ventaja de este tipo de dispositivo es su bajo perfil (20 Fr), lo que causa menor trauma en los sitios de acceso y posee mejor flexibilidad al implantarla. Lo anterior la hace de elección en aquellos pacientes con sitios de acceso difíciles o con enfermedad aterosclerótica severa.
Los estudios recientes a tres años de seguimiento con esta marca de dispositivo, mostraron que el 20% de los pacientes presentaban aumento del saco aneurismático (endotensión) al parecer por el suero acelular que se filtra a través del material. Esto ha sido confirmado en explantes de endoprótesis a pacientes y análisis microscópicos realizados por la misma planta matriz. Sin embargo, se cree que no hay ninguna secuela clínica al respecto. Debido a lo anterior, Gore, a partir de julio de 2004, modificó el diseño del material de las endoprótesis para hacerlo menos permeable. Actualmente, el fabricante lleva a cabo un estudio con el nuevo diseño para determinar el incremento del tamaño del aneurisma en 140 pacientes no aleatorizados con seguimientos a dos años y así compararlos con la cohorte histórica manufacturada con el material antiguo. Todas las endoprótesis Gore disponibles a partir de 2004, incorporan este nuevo diseño.
Cook Zenith (Figura 8)

Esta endoprótesis, disponible en Colombia, está fabricada en poliéster de tipo modular, pero a diferencia de las otras, el stent es en acero inoxidable y no en nitinol. Tiene una porción de stent descubierta proximal para ubicarla sobre el origen de las arterias renales y es particularmente útil en aquellos casos con cuellos cortos (< 1 mm). El estudio americano (US Clinical Trial) mostró excelentes resultados con 0% de migración y 98% de disminución/estabilización del diámetro del saco aneurismático a dos años (22).
Recientemente, se lanzó una versión fenestrada en su parte superior para poder colocarla en anatomías difíciles, pudiéndose implantar por encima de las renales.
Procedimientos adicionales previos a la implantación
Embolización con coils o plugs vasculares de la arteria ilíaca interna
Si las arterias ilíacas comunes están aneurismáticas y no poseen un sitio adecuado para la fijación distal de la endoprótesis, se aconseja extender el módulo a la arteria ilíaca externa y embolizar previamente las o la arteria ilíaca interna comprometida para evitar parafugas hacia el saco aneurismático. Se cree que la oclusión bilateral de las arterias ilíacas internas, presenta un riesgo de isquemia colónica y pélvica. Sin embargo, si la embolización no puede evitarse, ésta puede realizarse con tasas de complicaciones relativamente bajas, con excepción de la claudicación de las caderas, que puede ocurrir en el 30% al 40% de los pacientes (2, 11).
Se debe ocluir la arteria lo más proximal al ostium como sea posible, con el objetivo de preservar al máximo la circulación colateral de la arteria ilíaca interna y disminuir los riesgos de la claudicación de la cadera (2). Esta arteria puede canularse de forma ipsilateral o si es muy tortuosa, de forma contralateral.
No es necesario obtener un cese total del flujo de la arteria ocluida, debido a que la endoprótesis per se, excluye en gran medida el flujo de la arteria tratada.
Complicaciones
Parafugas
Las parafugas son las complicaciones a largo plazo más frecuentes en este tipo de terapia, y la tipo II es la más usual (2, 11).
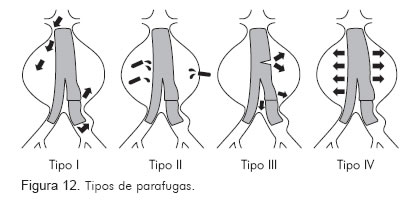
Las parafugas se clasifican en cinco tipos (Figura 12):
Parafuga tipo 1
Éstas se originan en los sitios de fijación o anclaje del dispositivo y se clasifican en proximales o distales. Las parafugas tipo I se dan por:
1. Stent pequeño para el diámetro de la arteria.
2. Anclaje deficiente de la endoprótesis.
3. Dilatación del cuello.
4. Fractura del stent o separación del mismo.
5. Mala selección del paciente (cuellos cortos, aneurismáticos con irregularidades de la pared).
En caso de una parafuga tipo I, hay consenso general de que el aneurisma se trató de forma incompleta y se debe reparar de inmediato.
Sólo hay una excepción al respecto, y es cuando la parafuga es muy pequeña y difícil de tratar técnicamente, en cuyo caso se puede dejar y realizar seguimiento con el objetivo de observar si desaparece una vez se trombose el aneurisma.
Si la parafuga tipo I se debe a implantación baja de la endoprótesis, se recomienda tratarla con una extensión o cuff ligeramente sobredimensionada.
Si la parafuga tipo I se debe a mala aposición de la endoprótesis a la pared de la arteria, a causa de un cuello angulado o aneurismático con irregularidad, se recomienda realizar impactaciones adicionales con balón. Si éstas no son exitosas, la mayoría de autores recomienda colocar un stent de Palmaz extra-grande expandible con balón.
Parafuga tipo 2
Éstas de deben al llenado del saco aneurismático de forma retrógrada en la mayoría de los casos a través de colaterales como arterias lumbares y arterias ilíacas internas. Estas parafugas se consideran más benignas que las de tipo 1 o tipo 3. La mayoría requiere seguimiento expectante con tomografía axial computarizada cada tres meses.
Su tratamiento es controversial, aunque muchos están de acuerdo en que las parafugas que causen aumento en el tamaño del saco aneurismático, deben ser tratadas.
La opción de tratamiento más aceptada es la embolización translumbar percutánea, de la cual se reportan altas tasas de éxito en la literatura. Otras opciones son la embolización transarterial o la ligadura quirúrgica abierta o laparoscópica.
La embolización translumbar se realiza con el paciente en posición prono y bajo visión fluoroscópica se marcan las estructuras sobre la piel, como la endoprótesis, el nido y la arteria responsable de la parafuga, así como las estructuras que sirven como referencia (espina ilíaca, etc.). El sitio de punción debe ser cuatro dedos laterales a la línea media y la aguja debe dirigirse medial hacia el saco aneurismático. Una vez se localiza el nido, éste se emboliza con coils. No es necesario embolizar cada vaso de manera selectiva (Figura 10).
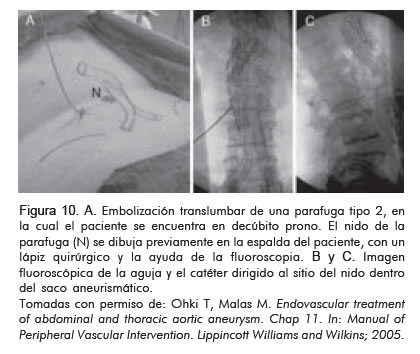
Recientemente, en el estudio presentado por Baril y colaboradores, en el congreso de la Sociedad de Cirugía Vascular en 2006 (SVCS 2006), la mayoría de las parafugas tipo 2, se cierran de manera espontánea en el tiempo siempre y cuando no haya expansión del saco aneurismático. Este estudio demuestra que la intervención selectiva y el seguimiento expectante en los casos sin expansión del saco, son una práctica segura (26) (Figura 10).
Parafuga tipo 3Ésta resulta de la separación entre los módulos de la endoprótesis o la ruptura del material de la endoprótesis. Dependiendo de la localización, se pueden emplear extensiones para sellar el defecto.
Si el defecto se localiza cerca de la carina de la endoprótesis, es más difícil tratarla con una extensión, en cuyo caso se pensaría en conversión quirúrgica o en convertir la endoprótesis en aorto uni-ilíaca y posteriormente realizar una derivación femoro-femoral quirúrgica.
Parafuga tipo 4
Ésta se debe a la porosidad del material de la endoprótesis, sobre todo en las de diseño anterior realizadas en dacrón de capas delgadas. El tratamiento de este tipo de parafugas es controversial. Muchos creen que éstas hacen trombosis de manera espontánea y no se produce ninguna secuela clínica. Si se decide tratar, una de las opciones es implantar una extensión dentro de la endoprótesis.
Parafuga tipo 5
También se conoce como endotensión y se debe a un aumento de la tensión y del diámetro del saco aneurismático sin una parafuga aparente que lo explique.
El mecanismo de por qué se produce este fenómeno aún se desconoce, pero una explicación podría ser un flujo lento de suero a través del material de la endoprótesis.
Lesión de la arteria ilíaca
Las disecciones y perforaciones de las arterias para el sitio de acceso, ahora son poco frecuentes.
Si existe disección al momento de retirar todo el sistema de la endoprótesis, se recomienda tratarlo con un stent autoexpandible. Si por el contrario existe perforación, se recomienda la oclusión temporal con un balón para evitar pérdida sanguínea y shock, y posteriormente implantar un stent cubierto.
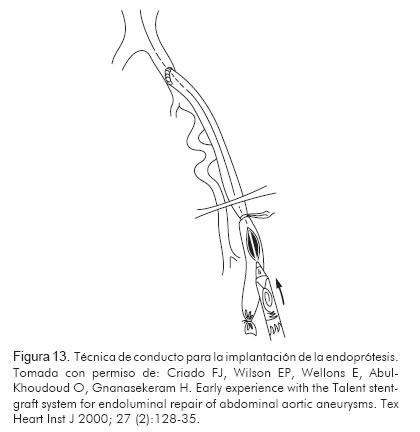
En casos de arterias femorales pequeñas, con enfermedad extensa, en las que no es posible introducir el sistema de entrega, existe una técnica llamada técnica de conducto o conduit technique, que consiste en la colocación de un injerto en la arteria ilíaca externa o común para ingresar desde allí el introductor y liberar la endoprótesis. Luego este injerto puede anastomosarse a alguna de las arterias distales como la femoral común o la femoral superficial (Figura 13).
Embolización
Puede ocurrir en cualquier momento del procedimiento. Es más común en los vasos de los miembros inferiores, pero también puede ocurrir en las arterias renales, viscerales o incluso en la arteria ilíaca interna.
Por este motivo se deben evitar los casos con trombos mayores del 25% de la circunferencia en el cuello proximal de la aorta.
Una vez identificado el sitio de embolización, se debe realizar la embolectomía quirúrgica o percutánea según sea el caso.
Seguimiento de los pacientes
El seguimiento de los pacientes con endoprótesis, es de suma importancia para la detección de parafugas, la migración del dispositivo o el incremento del diámetro del saco aneurismático (11). El estudio de Corriere y colaboradores, demostró que hasta el 24% de los pacientes presentaron parafugas, detectadas con el seguimiento mediante tomografía axial computarizada, durante un período de 18 meses. En este estudio, se detectaron tres parafugas dos años después de la implantación (23).
Se recomienda hacer seguimiento a los pacientes con tomografía axial computarizada al mes, los seis y doce meses de implantado el dispositivo. Luego de este periodo, es suficiente un control anual.
Si se encuentran parafugas, la frecuencia de los controles con la tomografía axial computarizada es cada seis meses hasta la resolución de la misma (2, 11). Para el seguimiento no se recomienda la ultrasonografía debido a su baja sensibilidad y especificidad en la detección de parafugas. La resonancia magnética nuclear, también es una excelente herramienta en el seguimiento de los pacientes, sobre todo en aquellos que presentan falla renal (2, 11).
Recientemente se desarrollaron sensores de presión del saco aneurismático que está incluido en la endoprótesis y por vía remota se puede hacer el seguimiento de estos pacientes, con lo que se ahorra tiempo y dinero. En la actualidad están en curso los estudios de esta tecnología (11).
Conclusión
El tratamiento endovascular de las patologías de aorta es ahora una realidad y una alternativa segura a la cirugía abierta; sin embargo, los altos costos de estos dispositivos y el seguimiento de estos pacientes, aún es una limitante importante en Colombia.
Bibliografía
1. Dubost D, Allary M, Oecomos NA. Preoperous du treatment des aneurismes de l´ aorta. Arch Surg 1952; 64: 405-408. [ Links ]
2. Ohki T, Malas M. Endovascular treatment of abdominal and thoracic aortic aneurysm. Chap 11. In: Manual of Peripheral Vascular Intervention, Lippincott Williams and Wilkins; 2005. p. 206-207.
3. Noel AA, Gloviczki P, Cherry KJ Jr, Bower TC, Panneton JM, Mozes GI, et al. Ruptured abdominal aortic aneurysms: the excessive mortality rate of conventional repair. J Vasc Surg 2001; 34: 41-46. [ Links ]
4. Parodi JC, Palmaz JC, Barone HD. Transfemoral intraluminal graft implantation for abdominal aortic aneurysms. Ann Vasc Surg 1991; 5: 491-499. [ Links ]
5. Criado FJ, Fairman RM, Becker GJ. Talent LPS AAA stent graft: results of a pivotal clinical trial. J Vasc Surg 2003; 37: 709-715. [ Links ]
6. Matsumura JS, Brewster DC, Makaroun MS, Naftel DC. A multicenter controlled clinical trial of open versus endovascular treatment of abdominal aortic aneurysm. J Vasc Surg 2003; 37: 262-271. [ Links ]
7. Ouriel K, Clair DG, Greenberg RK, Lyden SP, O’Hara PJ, Sarac TP, et al. Endovascular repair of abdominal aortic aneurysms: device-specific outcome. J Vasc Surg 2003; 37: 991-998. [ Links ]
8. Moore WS. The Guidant Ancure bifurcation endograft: five-year follow-up. Semin Vasc Surg 2003; 16: 139-143. [ Links ]
9. Zarins CK, White RA, Moll FL, Crabtree T, Bloch DA, Hodgson KJ, et al. The AneuRx stent graft: four-year results and worldwide experience 2000. J Vasc Surg 2001; 33: S135-S145. [ Links ]
10. Greenberg RK, Chuter TA, Sternbergh WC III, Fearnot NE. Zenith AAA endovascular graft: intermediate-term results of the US multicenter trial. J Vasc Surg 2004; 39: 1209-1218. [ Links ]
11. Katzen BT, Dake MD, MacLean AA, Wang DS. Endovascular repair of abdominal and thoracic aortic aneurysms. Circulation 2005; 112: 1663-1675. [ Links ]
12. Powell JT, Greenhalgh RM. Clinical practice: small abdominal aortic aneurysms. N Engl J Med 2003; 348: 1895-1901. [ Links ]
13. Brewster DC, Cronenwett JL, Hallett JW Jr, Johnston KW, Krupski WC, Matsumura JS. Joint Council of the American Association for Vascular Surgery and Society for Vascular Surgery. Guidelines for the treatment of abdominal aortic aneurysms: Report of a subcommittee of the Joint Council of the American Association for Vascular Surgery and Society for Vascular Surgery. J Vasc Surg 2003; 37 (5): 1106-17. [ Links ]
14. Buth J. Endovascular repair of abdominal aortic aneurysms: results from the EUROSTAR registry: EUROpean collaborators on Stent-graft Techniques for abdominal aortic Aneurysm Repair. Semin Interv Cardiol 2000; 5: 29-33. [ Links ]
15. Buth J, van Marrewijk CJ, Harris PL, Hop WC, Riambau V, Laheij RJ. Outcome of endovascular abdominal aortic aneurysm repair in patients with conditions considered unfit for an open procedure: a report on the EUROSTAR experience. J Vasc Surg 2002; 35: 211-221. [ Links ]
16. Harris PL, Buth J. An update on the important findings from the EUROSTAR EVAR registry. Vascular 2004; 12: 33-38. [ Links ]
17. Harris PL, Vallabhaneni SR, Desgranges P, Becquemin JP, van Marrewijk C, Laheij RJ. Incidence and risk factors of late rupture, conversion, and death after endovascular repair of infrarenal aortic aneurysms: the EUROSTAR experience: European Collaborators on Stent/graft techniques for aortic aneurysm repair. J Vasc Surg 2000; 32: 739-749. [ Links ]
18. Greenhalgh RM, Brown LC, Kwong GP, Powell JT, Thompson SG. EVAR trial participants. Endovascular aneurysm repair versus open repair in patients with abdominal aortic aneurysm (EVAR Trial 1): randomised controlled trial. Lancet 2005; 365 (9478): 2179-86. [ Links ]
19. Greenhalgh RM, Brown LC, Kwong GP, Powell JT, Thompson SG. EVAR trial participants. Endovascular aneurysm repair and outcome in patients unfit for open repair of abdominal aortic aneurysm (EVAR Trial 2): randomised controlled trial. Lancet 2005; 365 (9478): 2187-92. [ Links ]
20. Greenhalgh RM, Brown LC, Kwong GP, Powell JT, Thompson SG. EVAR trial participants. Comparison of endovascular aneurysm repair with open repair in patients with abdominal aortic aneurysm (EVAR trial 1), 30-day operative mortality results: randomised controlled trial. Lancet 2004; 364: 843-848. [ Links ]
21. Blankensteijn JD, de Jong SECA, Prinssen M, et al. Two-year outcomes after conventional or endovascular repair of abdominal aortic aneurysms. N Engl J Med 2005; 352: 2398-2405. [ Links ]
22. Greenberg RK, Chuter TA, Sternbergh WC , Fearnot NE; Zenith Investigators. Zenith AAA endovascular graft: intermediate-term results of the US multicenter trial. J Vasc Surg 2004; 39 (6): 1209-18. [ Links ]
23. Corriere MA, Feurer ID, Becker SY, Dattilo JB, Passman MA, Guzman RJ, et al. Endoleak following endovascular abdominal aortic aneurysm repair: implications for duration of screening. Ann Surg 2004; 239: 800-805. [ Links ]
24. Baril T, Silverberg D, Sharif H, et al. an eight-year experience with type II endoleaks: natural history suggests selective intervention is a safe approach. In: Peter D. Samuels essay award winner. Presented at the 34th. SCVS annual symposium; 2006. [ Links ]
25. Criado FJ, Wilson EP, Wellons E, Abul-Khoudoud O, Gnanasekeram H. Early experience with the Talent stent-graft system for endoluminal repair of abdominal aortic aneurysms. Tex Heart Inst J 2000; 27 (2):128-35. [ Links ]














